一种检测辣椒轻斑驳病毒和炭疽菌的引物组、试剂盒及方法
1.本发明涉及植物病毒、病菌生物检测技术领域,具体涉及一种基于重组酶介导等温核酸扩增技术(rt-raa)检测辣椒轻斑驳病毒和炭疽菌的引物组、试剂盒及方法。
背景技术:
2.辣椒轻斑驳病毒(peppermild mottlevis,pmmov)是帚状病毒科(virgaviridae)烟草花叶病毒属(tobamovirus)的无包膜正单链rna病毒,可导致辣椒果实褪绿斑驳、畸形,在世界范围内对辣椒生产造成严重的经济损失。辣椒叶片在被侵染后或表现症状不明显,或出现褪绿斑驳和花叶症状;植株生长明显变缓,发病越早,长势受影响越大;果实被侵染后的症状较为明显,表现为果小、果面有褪绿斑驳、凹凸斑点、甚至出现畸形与坏死现象。1964年在美国首次报道pmmov,随着种子贸易和种质资源交流的日益频繁,其分布范围也在逐年扩大。pmmov有很大的潜在传播性,可通过汁液摩擦传播和种子传播,随带病的辣椒进入人体,经过消化排出人体后,仍具有侵染活性。国内北京地区市售辣椒商品种子阳性检出率高达61.11%。除辣椒外,发pmmov还能自然侵染茄科的番茄,葫芦科的南瓜、黄瓜、西葫芦、甜瓜,豆科的豇豆等作物,而且在江苏葫芦科蔬菜样品中检出率为83.33%,并与其他病毒发生复合侵染的频率高且范围广,危害很大。目前对于pmmov的检测方法主要有生物学方法、电镜技术、血清学测定法(酶联免疫吸附测定)和以核酸为基础的分子生物学测定法(rt-pcr和实时荧光rt-pcr法),以酶联免疫吸附测定法(elisa)和rt-pcr法最为常用。另外还建立了通过反转录结合环介导的等温扩增(loop-mediated isothermal amplification,lamp)检测pmmov的方法。
3.辣椒炭疽病由半知菌亚门(deuteromycotina)刺盘孢属(colletotrichum)不同种引起的全球性真菌性病害。炭疽菌以菌丝体或分生孢子潜伏在种子内部或者表面上越冬,借雨水、昆虫或气流传播至寄主植物,经寄主伤口侵入,引起初次侵染,成为下季发病的初侵染源,继而长出分生孢子,可引起再次侵染。病菌侵入3~5天即可发病。高温高湿有利于病害的发生,可造成辣椒大面积减产。辣椒炭疽病主要为害叶片和果实。主要表现症状叶片染病多发生在成熟的叶片上,产生水浸状黄褐色圆形斑,果实上为褐色圆形或不规则的病斑。辣椒炭疽病在世界范围内均有发生,在中国、印度、印度尼西亚、韩国等地区常导致辣椒减产30%~40%,泰国减产最严重年份高达80%。已报道的辣椒炭疽病的病原菌主要为胶孢炭疽菌(colletotrichumgloeosporoides)、黑色炭疽菌(colletotrichum nigrum)、黑点炭疽菌(colletotrichum capsici)、尖孢炭疽菌(colletotrichum acutatum)等。对于炭疽菌的检测方法主要有生物学方法和以核酸为基础的分子生物学测定法(pcr、实时荧光pcr和lamp),以pcr和lamp法最为常用。
4.重组酶介导等温核酸扩增技术(recombinase aidedamplification)是近年开发的一种核酸扩增技术可在恒定的低温(39℃)下进行高特异性的dna扩增,并在数分钟内达到可检测的水平。rt-raa/raa产物可以通过琼脂糖凝胶电泳检测。侧向流试纸条(lateral flow strip,lfs),侧向免疫层析检测可用于检测包括抗生素、毒素、蛋白、多肽、dna等多种
生物物质,它利用纯化抗体的能力,以高度特异性结合并协同移动通过薄膜,并与薄膜上的检测区段竞争或被薄膜上的检测区段捕获。侧向流试纸条是目前常用的快速检测方法之一,其具有操作简单、样品量少、检测快速、成本低等优点,已在医学、食品和环境等多个领域广泛应用。
技术实现要素:
5.要解决的问题
6.目前对于辣椒轻斑驳病毒(peppermild mottlevis,pmmov)、辣椒炭疽病的分子生物学方法要么高度依赖训练有素的实验室技术人员,要么需要复杂且昂贵的实验室仪器或者检测操作过程繁琐,都难以脱离实验室环境,在田间条件下应用。另外,这两种病原物可感染辣椒及多种作物常见病原物,但目前的检测方法大多以其中的一种为鉴定靶标,难以在生产实践中对pmmov和炭疽菌同时进行快速准确的鉴定,亟需建立一种快速、简便、准确的双重病原物检测方法。如果能建立pmmov、炭疽菌的rt-raa/raa双重等温核酸扩增体系并与侧向层析试纸条检测相结合,既能满足农户对病毒种类确定、针对性防治病害的迫切需求,也可以为国家农技服务部门、植物保护和植物检疫部门提供新的技术支撑。
7.技术方案
8.为了解决上述的技术问题,本发明的目的在于提供一种基于rt-raa检测pmmov、炭疽菌的引物组、试剂盒及方法。
9.本发明的一个方面,本发明提供了一种检测辣椒轻斑驳病毒(pmmov)和炭疽菌的rt-raa检测引物组,所述引物组包括辣椒轻斑驳病毒检测引物、炭疽菌检测引物、辣椒
10.轻斑驳病毒检测探针pm-p3和炭疽菌检测检测探针ct-p1;其中,
11.所述辣椒轻斑驳病毒检测引物包括正向引物pm-cpf和反向引物pm-cpr,
12.正向引物pm-f2的序列为:5
′‑
ctgtgtacttcggcgttaggcaatcag-3
′
(seq id no.1);
13.反向引物pm-r2的序列为5
′‑
cattcatgaggttacttatactggccc-3
′
(seq id no.2);
14.所述炭疽菌检测引物包括正向引物ct-f1和反向引物ct-r1,
15.正向引物ct-f1的序列为:5
′‑
gtgagatccgtcgctaccagaag-3
′
(seq id no.4);
16.反向引物ct-r1的序列为:5
′‑
gcataggttggtgtcctcaaagag-3
′
(seq id no.5)。
17.作为优选,本发明所述引物组,所述辣椒轻斑驳病毒检测探针pm-p3,其序列为5
′‑
gcacttctcggagcctttgatactagghacaggataatagaagtt-3
′
(seq id no.3);所述炭疽菌检测检测探针ct-p1,其序列为5
′‑
cttcaagtccgatctccgcttccagtchtccgccatcggtgcccttc-3
′
(seq id no.6);所述pmmov的反向引物pm-r2的5
′
端修饰有fitc,所述检测探针pm-p3的5
′
端修饰有生物素,pm-p3的3
′
端磷酸化修饰,h为四氢呋喃;所述炭疽菌反向引物ct-r1的5
′
端修饰有地高辛,所述探针引物ct-p1的5
′
端修饰有罗丹明,ct-p1的3
′
端有磷酸化修饰,h为四氢呋喃。
18.本发明的一个方面,本发明提供了一种检测辣椒轻斑驳病毒(pmmov)和炭疽菌的试剂盒,所述试剂盒包括前述引物组。
19.本发明的一个方面,本发明提供的一种检测辣椒轻斑驳病毒(pmmov)和炭疽菌的rt-raa检测引物组可以用于制备判断待检测的样本中是否含有pmmov和/或炭疽菌的试剂盒。
20.本发明的一个方面,本发明试剂盒还可以含有其他试剂、包括rna提取试剂、dna提取试剂、样本裂解液、缓冲液、pcr样本扩增试剂,试剂盒说明书。
21.本发明的一个方面,本发明提供的一种检测辣椒轻斑驳病毒(pmmov)和炭疽菌的rt-raa检测引物组可以用于判断待检测的样本中是否含有pmmov和/或炭疽菌。
22.本发明的一个方面,本发明提供的试剂盒可以用于检测待测生物样本中是否含有pmmov和/或炭疽菌。
23.本发明的一个方面,本发明提供了一种利用试剂盒检测pmmov和/或炭疽菌的方法,包括以下步骤:
24.1)提取待测生物样本的总rna,或对植物样本进行裂解处理;
25.2)以步骤1)提取的总rna或植物裂解液为模板,采用引物组中的正向引物和反向引物进行rt-raa扩增,获得扩增产物;
26.3)检测扩增产物,基于扩增产物的检测结果判断是否含有pmmov和/或炭疽菌。
27.作为优选,本发明中若扩增产物中含有316bp的dna片段,则待测生物样本中含有pmmov,若扩增产物中不含有316bp的dna片段,则待测生物样本中不含有pmmov;若扩增产物中含有243bp的dna片段,则待测生物样本中含有炭疽菌,若扩增产物中不含有243bp的dna片段,则待测生物样本中不含有炭疽菌。
28.本发明的一个方面,本发明提供了一种检测待测生物样本中是否含有pmmov和/或炭疽菌的方法,包括:
29.检测待测生物样本的裂解液或总rna扩增产物中是否含有特异dna片段,若含有特异dna片段,则待测生物样本含有pmmov和/或炭疽菌,若不含有特异dna片段,则待测生物样本不含有pmmov和/或炭疽菌;其中,所述特异dna片段为本发明所述的正向引物和反向引物的靶序列。
30.本发明的一个方面,本发明提供了一种基于rt-raa扩增方式检测pmmov和/或炭疽菌的方法。
31.作为优选,所述方法包括以下步骤:
32.1)按照核酸释放剂提供的方法裂解植物样品;或者按照trizol试剂说明书操作,提取总rna,溶于te溶液或纯水中;
33.2)以步骤1)提取的总rna或植物裂解液为模板,采用引物组中的正向引物和反向引物进行rt-raa扩增,若扩增产物中含有316bp的dna片段,则待测生物样本中含有pmmov,若扩增产物中不含有316bp的dna片段,则待测生物样本中不含有pmmov;若扩增产物中含有243bp的dna片段,则待测生物样本中含有炭疽菌,若扩增产物中不含有243bp的dna片段,则待测生物样本中不含有炭疽菌。
34.正向引物pm-f2的序列为5
′‑
ctgtgtacttcggcgttaggcaatcag-3
′
(seq id no.1),
35.反向引物pm-r2的序列为5
′‑
cattcatgaggttacttatactggccc-3
′
(seq id no.2);
36.正向引物ct-f1的序列为:5
′‑
gtgagatccgtcgctaccagaag-3
′
(seq id no.4),
37.反向引物ct-r1的序列为:5
′‑
gcataggttggtgtcctcaaagag-3
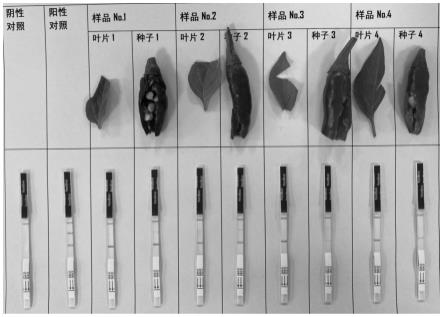
′
(seq id no.5)。
38.作为优选,所述rt-raa扩增的反应体系如下:
39.成分体积植物样品裂解液或总rna溶液2μl
基础缓冲液29.4μlpm-f2(5μm)0.29μlpm-r2(5μm)0.4μlct-f1(5μm)0.9μlct-r1(5μm)1.26μlddh2o至总体系为47.5μl
40.作为优选,所述raa扩增的反应条件设置如下:反应液配制完成后,在每个0.2ml的eppendorf管加入2.5μl 280mm的mgac2,充分混匀;将0.2ml的eppendorf管放入带有热盖功能的pcr仪上,39℃,保温25min。
41.作为优选,扩增产物可通过琼脂糖凝胶电泳进行检测,rt-raa扩增产物琼脂糖凝胶电泳检测靶序列初始扩增模板最低拷贝数为101个拷贝。
42.其中,rt-raa扩增产物的检测过程为:rt-raa反应结束后,将反应管取出。每个反应管中加入100μl酚/氯仿(1:1),充分振荡均匀,12000rpm离心10min(该步骤可使用涡旋振荡器剧烈振荡混匀)。取10μl上清液与2μl 6
×
loading buffer混合,上样于1.5%琼脂糖凝胶,200v电泳15min;待溴酚蓝移至凝胶下2/3处时结束电泳;eb染色5min,紫外灯下观察及拍照。
43.本发明的一个方面,本发明提供了一种检测待测生物样本中是否含有pmmov或/和炭疽菌的方法。
44.作为优选,所述方法包括:检测待测生物样本的裂解液或核酸样品的扩增产物中是否含有特异dna片段,若含有特异dna片段,则待测生物样本中含有pmmov或/和炭疽菌,若不含有特异dna片段,则待测生物样本中不含有pmmov或/和炭疽菌;其中,所述特异dna片段为待测生物样本的总dna中本发明所述的引物组的靶序列。
45.本发明的一个方面,本发明提供了一种基于rt-raa-侧流层析技术检测pmmov或/和炭疽菌的方法。
46.作为优选,所述方法包括以下步骤:
47.1)按照核酸释放剂提供的方法裂解植物样品;或者按照trizol试剂说明书操作,提取总rna,溶于te溶液或纯水中;
48.2)以步骤1)获得的植物裂解液或提取的总rna或为模板,采用引物组进行rt-raa扩增;
49.正向引物pm-f2的序列为5
′‑
ctgtgtacttcggcgttaggcaatcag-3
′
(seq id no.1),
50.反向引物pm-r2的序列为5
′‑
cattcatgaggttacttatactggccc-3
′
(seq id no.2);
51.辣椒轻斑驳病毒检测探针pm-p3,其序列为5
′‑
gcacttctcggagcctttgatactagghacaggataatagaagtt-3
′
(seq id no.3),
52.正向引物ct-f1的序列为:5
′‑
gtgagatccgtcgctaccagaag-3
′
(seq id no.4),
53.反向引物ct-r1的序列为:5
′‑
gcataggttggtgtcctcaaagag-3
′
(seq id no.5)。
54.疽菌检测检测探针ct-p1,
55.其序列为5
′‑
cttcaagtccgatctccgcttccagtchtccgccatcggtgcccttc-3
′
(seq id no.6);
56.作为优选,所述rt-raa扩增的反应体系如下:
57.成分体积植物样品裂解液或总rna溶液2μl基础缓冲液29.4μlpm-cpf(5μm)0.29μlpm-cpr(5μm)0.4μlpm-cpp(1μm)0.4μlct-hisf(5μm)0.9μlct-hisr(5μm)1.26μlct-hisp(1μm)1.26μlddh2o至总体系为47.5μl
58.作为优选,所述raa扩增的反应条件设置如下:反应液配制完成后,在每个0.2ml的eppendorf管加入2.5μl 280mm的mgac2,充分混匀;将0.2ml的eppendorf管放入带有热盖功能的pcr仪上,39℃,保温16min。
59.3)应用侧流层析试纸条进行扩增产物的检测,若试纸条只在质控区出现一条条带,检测区没有条带,则结果为阴性,表明样本中不含有pmmov或炭疽菌;若试纸条出现两条条带,一条位于质控区,一条位于检测区t1,则结果为阳性,表明样本中含有炭疽菌;若试纸条出现两条条带,一条位于质控区,一条位于检测区t2,则结果为阳性,表明样本中含有pmmov;若试纸条出现三条条带,一条位于质控区,一条位于检测区t1,一条位于检测区t2,则结果为阳性,表明样本中含有炭疽菌和pmmov;若试纸条质控线不显色,则检测无效,需要更换试纸条重新检测。
60.检测的具体过程可以为:将装有50μl rt-raa扩增产物的eppendorf管管盖打开,取2.5μl扩增产物至一新的1.5ml的eppendorf管,稀释20倍。将一根新的核酸侧向层析试纸条结合垫端直接插入装有稀释产物的eppendorf管管中,液面不得超过样品垫的浸没上限标记。待判读区全部浸润后,将试纸平放1分钟,观察显色结果,并在10分钟内记录。每个测试样品至少出现一条质控线,有或无检测线。若试纸条只在质控区出现一条条带,检测区没有条带,则结果为阴性,表明样本中不含有pmmov或炭疽菌;若试纸条出现两条条带,一条位于质控区,一条位于检测区t1,则结果为阳性,表明样本中含有炭疽菌;若试纸条出现两条条带,一条位于质控区,一条位于检测区t2,则结果为阳性,表明样本中含有pmmov;若试纸条出现三条条带,一条位于质控区,一条位于检测区t1,一条位于检测区t2,则结果为阳性,表明样本中含有炭疽菌和pmmov;若试纸条质控线不显色,则检测无效,需要更换试纸条重新检测。
61.本发明的一个方面,本发明提供了一种基于rt-raa-侧流层析技术检测pmmov或/和炭疽菌的试剂盒,所述试剂盒包括包括检测pmmov和炭疽菌引物组,侧流层析试纸条,所述侧流层析试纸条上检测线t1和检测线t2、质控区,所述侧流层析试纸条能够对引物组的扩增产物进行检测。优选的,所述pmmov和炭疽菌引物组序列如seq id no.1~6所示。
62.有益效果
63.本发明提供了一种用于检测pmmov、炭疽菌的特异性引物组,建立了pmmov、炭疽菌双重快速检测方法。本发明中所设计的引物可以有效扩增靶基因,具有较高的特异性和灵敏性,与其他病原菌无交叉反应,本发明的rt-raa-侧流层析技术每个反应可检测出的
pmmov初始扩增模板最低拷贝数为94个拷贝,炭疽菌靶序列初始扩增模板最低拷贝数为41个拷贝。本发明可用于pmmov、炭疽菌的现场快速检测,对于病害的有效防治具有重要意义。
附图说明
64.图1中a是使用pmmov扩增引物组1~4rtraa扩增的电泳图;
65.图1中b是使用炭疽菌扩增引物组5~8rtraa扩增的电泳图;
66.图2中a是使用pmmov扩增引物pm-f1和pm-r1扩增产物转化质粒10倍连续梯度稀释物作为rtraa模板,分析引物组1pm-f1和pm-r1的检测灵敏性,pm-f1和pm-r1rt-raa扩增可检出低至104个拷贝的pmmov cp基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
67.图2中b是使用pmmov扩增引物pm-f2和pm-r2扩增产物转化质粒10倍连续梯度稀释物作为rt raa模板,分析引物组2pm-f2和pm-r2的检测灵敏性,pm-f2和pm-r2rt-raa扩增可检出低至101个拷贝的pmmov cp基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
68.图3中a是使用炭疽菌扩增引物ct-f1和ct-r1扩增产物转化质粒10倍连续梯度稀释物作为rt raa模板,分析引物组5ct-f1和ct-r1的检测灵敏性检测结果,ct-f1和ct-r1rt-raa扩增可检出低至101个拷贝的炭疽菌his基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
69.图3中b是使用炭疽菌扩增引物ct-f2和ct-r2扩增产物转化质粒10倍连续梯度稀释物作为rt raa模板,分析引物组6ct-f2和ct-r2的检测灵敏性检测结果,ct-f2和ct-r2rt-raa扩增可检出低至102个拷贝的炭疽菌his基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
70.图3中c是使用炭疽菌扩增引物ct-f3和ct-r3扩增产物转化质粒10倍连续梯度稀释物作为rt raa模板,分析引物组7ct-f3和ct-r3的检测灵敏性检测结果,ct-f3和ct-r3rt-raa扩增可检出低至101个拷贝的炭疽菌his基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
71.图3中d是使用炭疽菌扩增引物ct-f4和ct-r4扩增产物转化质粒10倍连续梯度稀释物作为rt raa模板,分析引物组8ct-f4和ct-r4的检测灵敏性检测结果,ct-f4和ct-r4rt-raa扩增可检出低至103个拷贝的炭疽菌his基因质粒。50μl rt raa扩增初始模板拷贝数从106拷贝到100拷贝依次递减;其中,m:plus dna标记;“—”:用ddh2o替代同体积质粒的阴性对照。
72.图4单靶标一次性核酸检测试纸条(jy0201)结构及检测结果示意图;
73.图5是使用pmmov引物组a、引物组b、引物组c、引物组d对阳性质粒及阴性对照进行
rt-raa扩增及产物试纸条检测结果;
74.图6是使用炭疽菌引物组e、引物组f、引物组g、引物组h对阳性质粒及阴性对照进行rt-raa扩增及产物试纸条检测结果;
75.图7pmmov引物组a rt raa-lfs的灵敏度检测;
76.图8pmmov引物组b rt raa-lfs的灵敏度检测;
77.图9pmmov引物组d rt raa-lfs的灵敏度检测;
78.图10炭疽菌引物组e rt raa-lfs的灵敏度检测;
79.图11炭疽菌引物组h rt raa-lfs的灵敏度检测;
80.图12pmmov引物组a rt raa-lfs检测引物特异性评价;
81.图13pmmov引物组d rt raa-lfs检测引物特异性评价;
82.图14炭疽菌引物组e rt raa-lfs检测引物特异性评价;
83.图15炭疽菌引物组h rt raa-lfs检测引物特异性评价;
84.图16.双靶标一次性核酸检测试纸条(jy0209)结构及检测结果示意图;
85.图17以质粒为模板进行pmmov引物组与炭疽菌引物组双重rtraa-lfs检测结果;
86.图18pmmov引物组d(pm-f2和pm-r2,图a)、炭疽菌引物组e2(ct-f1和ct-r1,图b)qpcr熔解曲线分析;
87.图19pmmov引物组d(pm-f2和pm-r2,图a)、炭疽菌引物组e2(ct-f1和ct-r1,图b)qpcr对应梯度稀释质粒绝对定量扩增曲线分析;
88.图20pmmov引物组d与炭疽菌引物组e2、pmmov引物组d与炭疽菌引物组h2的植物叶片裂解液rtraa-lfs检测结果;
89.图21植物叶片裂解液pmmov、炭疽菌引物组d与引物组e2双重rt raa-lfs反应引物优化检测结果;
90.图22植物叶片裂解液pmmov、炭疽菌引物组d与引物组h2双重rt raa-lfs反应引物优化检测结果;
91.图23辣椒植株田间随机取样进行rtraa-lfs快速检测结果;
92.图24pmmov感染辣椒植株叶片和平头炭疽菌丝rt raa-lfs检测极限值分析(1:对应提取后总rna为浓度为100ng/μl的样品,2:对应提取后总rna为浓度为10ng/μl的样品,3:对应提取后总rna为浓度为1ng/μl的样品,4:对应提取后总rna为浓度为100pg/μl的样品,5:对应提取后总rna为浓度为10pg/μl的样品,6:对应提取后总rna为浓度为1pg/μl的样品,7:对应提取后总rna为浓度为100fg/μl的样品,“—”:用ddh2o替代同体积质粒的阴性对照)。
具体实施方式
93.下面结合附图对本发明的具体实施方式做一个详细的说明。
94.下述实施例中的实验方法,如无特殊说明,均为常规方面。下述实施例中所述的实验材料,如无特殊说明,均未自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
95.本发明所涉及的病毒样本来源:
96.本发明涉及的病毒样品,炭疽菌分离物及其相应的总rna或cdna均保存于宁波大
学植物病毒学研究所病毒与寄主互作研究室中。
97.其中,辣椒植物样本2020年采于浙江省宁波市,植株出现发育迟缓,叶片出现褪绿斑驳和花叶症状,果实出现果小、果面有褪绿斑驳、凹凸斑点及向内凹陷的黑褐色病斑,甚至出现畸形与坏死现象。样品采集后于液氮中速冻,并保存于-70℃。其中,pmmov rt-raa引物特异性筛选试验中涉及黄瓜花叶病毒(cucumber mosaic virus,cmv)、辣椒环斑病毒(chilli ringspot virus,chirsv)、蚕豆萎蔫病毒2(broadbean will virus2,bbwv2)、辣椒脉黄病毒(pepper vein yellows virus,pevyv)及与pmmov同属的烟草轻型绿花叶病毒(tobacco mild green mosaic virus,tmgmv)侵染植物的总rna作为模板作为对照模板;辣椒炭疽病由多种病原物引起,不同炭疽菌包括红色炭疽菌(colletotrichumgloeosporioides)、暹罗刺盘孢(colletotrichum siamense)、茶树炭疽菌(colletotrichum fructicola)、平头炭疽菌(colletotrichum truncatum)、斯高维尔炭疽菌(colletotrichum scovillei)、隐秘刺盘孢(colletotrichum aenigma)。
98.本发明所涉及的样品制备方法为:
99.使用trizol试剂(thermo fisher scientific)从pmmov、炭疽菌感染的辣椒叶片或果实中提取病毒或真菌的核酸。根据trizol试剂(thermo fisher scientific)说明书操作,提取辣椒叶片或种子的总rna。核酸侧向层析试纸条来源于北京宝盈同汇生物技术有限公司。
100.为了评估所使用的rt-raa-lfs体系是否可用于植物感染pmmov、炭疽菌的快速检测,以收集自宁波大学植物病毒学研究所实验基地感染pmmov和炭疽菌的辣椒植株样品为试验对象,并以健康的辣椒植株叶片作阴性对照。将新鲜辣椒叶片样品放入含100μl酷闪核酸释放(tiosbio,北京宝盈同汇生物技术有限公司)的1.5ml eppendorf管中用枪头轻捣数下,得到对应的植物样品裂解液。以1μl植物样品裂解液或其稀释液作为rt-raa的扩增模板。植物样品裂解液可立即试验,或于-70℃储存3个月以上。
101.实验例1:pmmov和炭疽菌检测的引物设计及筛选
102.本发明小组经过大量序列分析,以pmmov coat protein(cp)基因与炭疽菌的组蛋白h3(his)基因为靶基因,分析靶基因序列特点后,应用primer premier 5.0软件设计种属特异性扩增引物。引物设计遵循以下原则。
103.①
扩增引物长度约20~30bp,不同引物的退火温度尽可能一致或相似;
②
扩增产物长度约200~500bp,具物种特异性。
104.使用美国国家生物技术信息中心(ncbi)的blast功能对引物扩增区段序列进行比对,完成引物扩增特异性的初步鉴定。通过鉴定的引物交由通用生物系统(安徽)有限公司合成,纯度级别为hplc。引物具体序列如下表1所示:
[0105][0106][0107]
表1设计的pmmov和炭疽菌检测的引物
[0108]
使用rt raa核酸扩增试剂盒(基础款jy0203),以植物总rna或感染pmmov、炭疽菌的辣椒植株叶片样品裂解液作为模板,分别进行组1-~2、组5-~8的正向引物和反向引物的rt-raa扩增,扩增体系(单个样品/反应)如下:
[0109]
成分体积植物样品裂解液或总rna溶液2μl基础缓冲液29.4μl正向引物(5μm)2.1μl反向引物(5μm)2.1μlddh2o至总体系为47.5μl
[0110]
反应液配制完成后,在每个0.2ml的eppendorf管加入2.5μl 280mm的mgac2,充分混匀;将0.2ml的eppendorf管放入带有热盖功能的pcr仪上,39℃,保温30min。
[0111]
rt-raa反应结束后,将反应管取出。每个反应管中加入100μl酚/氯仿(1:1),充分振荡均匀,12000rpm离心10min(该步骤可使用涡旋振荡器剧烈振荡混匀)。取10μl上清液与2μl 6
×
loading buffer混合,上样于1.5%琼脂糖凝胶,200v电泳15min;待溴酚蓝移至凝胶下2/3处时结束电泳;eb染色5min,紫外灯下观察及拍照。
[0112]
如图1所示,添加2μl植物总rna溶液或样品裂解液的前提下,pmmov扩增引物组1(pm-f1和pm-r1)、pmmov扩增引物组2(pm-f2和pm-r2)的rt-raa扩增产物电泳条带清晰、明亮,无杂带,扩增条带大小与预期一致;pmmov扩增引物组3(pm-f3和pm-r3)、pmmov扩增引物组4(pm-f4和pm-r4)扩增产物的电泳条带微弱,扩增效率较差,不能作为检测pmmov的引物;炭疽菌扩增引物组5~引物组8均可用于检测炭疽菌,扩增产物电泳条带清晰、特异,无杂带,扩增条带大小与预期一致。各引物对扩增产物克隆至t载体,经测序后,确定为目的序列。
[0113]
实验例2:pmmov与炭疽检验样品比对盘制备和组成
[0114]
pmmov扩增引物组1(pm-f1和pm-r1)、pmmov扩增引物组2(pm-f2和pm-r2)cp基因扩增产物和炭疽菌扩增引物组5~引物组8his基因扩增产物克隆、测序正确的质粒,分别转化摇菌过夜后进行质粒抽提,以紫外分光光度计测量重组质粒od260、od280及od260/od280值,并重复3次,确定质粒dna浓度和纯度。
[0115]
按照下面的公式获得质粒的拷贝数:
[0116]
拷贝数=质粒浓度
×
6.02
×
10
23
/(660
×
质粒总长度)
[0117]
计算拷贝数并稀释至1
×
108拷贝/μl,
–
20℃保存备用。将已定值的重组质粒稀释至1
×
106拷贝/μl,再10倍系列稀释,获得1
×
100拷贝/μl、1
×
101拷贝/μl、1
×
102拷贝/μl、1
×
103拷贝/μl、1
×
104拷贝/μl、1
×
105拷贝/μl和1
×
106拷贝/μl质粒稀释液为后续扩增模板。
[0118]
实验例3:用于pmmov、炭疽菌检测的引物灵敏度的检测
[0119]
为了进一步检测pmmov扩增引物组1(pm-f1和pm-r1)、pmmov扩增引物组2(pm-f2和pm-r2),和炭疽菌扩增引物组5(ct-f1和ct-r1)、引物组6(ct-f2和ct-r2)、引物组7(ct-f3和ct-r3)、引物组8(ct-f4和ct-r4)的灵敏性,将各自对应扩增产物质粒dna的10倍系列稀释液(每微升106、105、104、103、102、101、100拷贝)用作rt-raa的模板,使用ddh2o用作阴性对照模板。通过1.5%琼脂糖凝胶电泳比较同一模板分别进行不同引物rt-raa的扩增情况。
[0120]
pmmov扩增引物组rt-raa扩增实验结果如图2所示,从实验结果可以看出,引物组1(pm-f1和pm-r1)rt-raa扩增可检出低至104个拷贝的pmmov cp基因质粒;引物组2(pm-f2和pm-r2)rt-raa扩增可检出低至101个拷贝的pmmov cp基因基因质粒。
[0121]
炭疽菌扩增引物组5~8rt-raa扩增实验结果如图3所示,从实验结果可以看出,引物组5(ct-f1和ct-r1)rt-raa扩增可检出低至101个拷贝的炭疽菌his基因质粒,引物组6(ct-f2和ct-r2)rt-raa扩增可检出低至102个拷贝的炭疽菌his基因质粒;引物组7(ct-f3和ct-r3)rt-raa扩增可检出低至101个拷贝的炭疽菌his基因质粒;引物组8(ct-f4和ct-r4)rt-raa扩增可检出低至103个拷贝的炭疽菌his基因基因质粒。
[0122]
实验例4:pmmov、炭疽菌rt-raa-lfs检测
[0123]
针对实施例1中的引物组1~8扩增区段,应用primer premier 5.0软件设计种属特异性的探针序列,探针序列位于扩增引物中间区段,经四氢呋喃修饰。引物设计遵循以下原则。
[0124]
①
探针长度约为30~45bp;
②
探针序列具有物种特异性。
[0125]
使用美国国家生物技术信息中心(ncbi)的blast功能对引物扩增区段序列进行比对,完成引物扩增特异性的初步鉴定。通过鉴定的引物交由通用生物系统(安徽)有限公司合成,纯度级别为hplc。引物具体序列、探针及扩增下游引物标记情况如下表2所示:
[0126]
[0127][0128]
表2设计的pmmov、炭疽菌、探针引物
[0129]
以各引物组上、下游引物对应扩增产物1
×
106拷贝/μl重组质粒溶液为模板,使用rt raa核酸扩增试剂盒(试纸条法)(jy0204)进行引物组a~引物组h的raa反应体系的配制(单个样品/反应),体系如下:
[0130][0131]
加样顺序为阴性质控样本(1
×
106拷贝/μl重组质粒溶液替换为同体积的超纯水)、1
×
106拷贝/μl重组质粒溶液,每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。将上述反应体系混匀,加入基础反应单元。使冻干粉充分溶解,注意,该步骤不能使用涡旋振荡器剧烈振荡混匀。打开反应单元,在每个0.2ml的eppendorf管加入2.5μl280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。
[0132]
将反应管放置在39℃条件下反应16min。raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释20~50倍。
[0133]
将单靶标一次性核酸检测试纸条(jy0201)结构示意图如图4所示,将试纸条的浸液区端(标示蓝色箭头向上)插入eppendorf管,液面不得超过浸液区的max指示线,待判读区全部浸润(约需30~60sec),将试纸平放1min,等待红色条带出现。根据试纸条显色情况直接读取检测结果。10min内观察结果,10min后判读无效。
[0134]
如图5所示,pmmov引物组c阴性对照rt raa扩增产物稀释20倍后的试纸条检测结果为阳性,不可用于后续rtraa核酸扩增试纸条灵敏度检测;引物组a、引物组b、引物组d在阴性对照rt raa扩增产物稀释20倍后的试纸条检测结果为阴性,1
×
106拷贝/μl重组质粒溶液rtraa检测结果为阳性,可用于后续rt raa核酸扩增试纸条灵敏度检测。
[0135]
如图6所示,炭疽菌引物组f、引物组g阴性对照rt raa扩增产物稀释20倍后的试纸条检测结果为阳性,不可用于后续rt raa核酸扩增试纸条灵敏度检测;引物组合e、引物组合h在阴性对照rt raa扩增产物稀释20倍后的试纸条检测结果为阴性,1
×
106拷贝/μl重组质粒溶液rtraa检测结果为阳性,可用于后续rt raa核酸扩增试纸条灵敏度检测。
[0136]
实验例5:pmmov、炭疽菌不同引物组rt-raa-lfs检测灵敏度的对比
raa-lfs引物特异性评价结果如图15所示,可以看出,炭疽菌两组引物扩增产物的lfs检测结果在所检测的致病炭疽菌中感染植物的总rna中均显示阳性,表明该引物适于进行多种致病炭疽菌的rtraa-lfs检测。
[0149]
实验例7:pmmov、炭疽菌不同引物组双重rt-raa-lfs检测体系的建立
[0150]
实验例7使用的引物交由通用生物系统(安徽)有限公司合成,纯度级别为hplc。引物具体序列、探针及扩增下游引物标记情况如下表3所示:
[0151][0152][0153]
表3双重rt-raa-lfs检测体系中的引物序列
[0154]
分别进行引物组a和引物组e2,引物组a和引物组h2,引物组d和引物组e2,引物组d和引物组h2的双重rt raa扩增,以各引物组上、下游引物对应扩增产物1
×
106拷贝/μl质粒稀释液为模板,使用rt raa核酸扩增试剂盒(试纸条法)(jy0204)进行pmmov和炭疽菌双重rt raa反应体系的配制(单个样品/反应),体系如下:
[0155][0156]
加样顺序为阴性质控样本(1
×
106拷贝/μl重组质粒溶液替换为同体积的超纯水)、1
×
106拷贝/μl重组质粒溶液,每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。将上述反应体系混匀,加入基础反应单元。使冻干粉充分溶解,注意,该步骤不能使用涡旋振荡器剧烈振荡混匀。打开反应单元,在每个0.2ml的eppendorf管加入2.5μl280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。
[0157]
将反应管放置在39℃条件下反应16min。raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释20~50倍。
[0158]
将双靶标一次性核酸检测试纸条(jy0209)结构示意图如图16所示,将试纸条的浸液区端(标示蓝色箭头向上)插入eppendorf管,液面不得超过浸液区的max指示线,待判读区全部浸润(约需30~60sec),将试纸平放1min,等待红色条带出现。根据试纸条显色情况直接读取检测结果。10min内观察结果,10min后判读无效。
[0159]
不同引物质粒及阴性对照双重rt raa-lfs检测情况结果如图17所示,其中引物组a和引物组e2、引物组a和引物组h2阴性对照扩增产物稀释20倍后的试纸条检测结果为阳性,不能用于后续双重rt raa-lfs对叶片裂解液的检测;引物组d和引物组e2、引物组d和引物组h2阴性对照扩增产物稀释20倍后的试纸条检测结果为阴性,质粒扩增产物稀释20倍后的试纸条检测结果为阳性,可用于后续双重rtraa-lfs对叶片裂解液的检测。
[0160]
实验例8:pmmov、炭疽菌引物组d与引物组e2绝对定量标准曲线绘制
[0161]
利用实施例2中的比对盘进行实时qpcr,使用pmmov引物组d与炭疽菌引物组e2中的正向引物和反向引物验证引物的敏感性,并对拷贝数进行绝对定量。
[0162]
从图18可以看出,qpcr之后,pmmov引物组d(pm-f2和pm-r2,图18a)、炭疽菌引物组e2(ct-f1和ct-r1,图18b)熔解曲线分析均为尖锐单峰,说明本实施例筛选的pmmov引物组d(pm-f2和pm-r2)和炭疽菌引物组e2(ct-f1和ct-r1)扩增特异性和扩增效率均较高。
[0163]
图19显示,上述引物pmmov引物组d(pm-f2和pm-r2,图19a)和炭疽菌引物组e2(ct-f1和ct-r1,图19b)可以成功检测101~106拷贝的初始模板,跨越6个对数值的动态检测范
围,每个模板浓度梯度之间的cq相差相似,这表明每个模板稀释梯度差异为10倍。
[0164]
pmmov引物组d(pm-f2和pm-r2)cq值和对数转换后的拷贝数(y=-4.3491x+37.412,r2》0.998),炭疽菌引物组e2(ct-f1和ct-r1)cq值和对数转换后的拷贝数(y=-4.5169x+39.047,r2》0.973)之间均具有良好的线性关系,说明本实施例所设计的引物具有较好的扩增特异性和灵敏度,可以用于pmmov和炭疽菌rt-pcr和rt-raa分析。
[0165]
实验例9:pmmov、炭疽菌不同引物组植物材料裂解物双重rt raa-lfs检测体系的建立
[0166]
经rt-qpcr鉴定为pmmov阳性(约4.8
×
106个病毒拷贝/mg叶片)、炭疽菌阳性(约4.8
×
106个病毒拷贝/mg叶片)的植物叶片样本,取20mg植物叶片样品和100μl的酷闪核酸释放剂(bt0068),以枪头碾压待检材料数次,离心,取2μl叶片裂解液上清液待检。
[0167]
使用实验例7中的引物进行引物组d和引物组e2,引物组d和引物组h2的双重rt raa扩增,以植物叶片裂解液上清液为模板,使用rt raa核酸扩增试剂盒(试纸条法)(jy0204)进行pmmov和炭疽菌双重rt raa反应体系的配制(单个样品/反应),体系如下:
[0168][0169]
加样顺序为阴性质控样本(植物叶片裂解液上清液替换为同体积的超纯水)、植物叶片裂解液上清液,每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。将上述反应体系混匀,加入基础反应单元。使冻干粉充分溶解,注意,该步骤不能使用涡旋振荡器剧烈振荡混匀。打开反应单元,在每个0.2ml的eppendorf管加入2.5μl280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。
[0170]
将反应管放置在39℃条件下反应16min。raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释20~50倍。
[0171]
不同引物质粒及阴性对照双重rt raa-lfs检测情况结果如图20所示,其中引物组d和引物组e2阴性对照扩增产物稀释20倍后的试纸条,pmmov检测结果为阳性;引物组d和引物组h2阴性对照扩增产物稀释20倍后的试纸条pmmov、炭疽菌检测结果均为阳性。因此需要对引物组d和e2、引物组d和引物组h2引物添加量进行优化,降低阴性对照扩增结果中因引物二聚体导致的检测假阳性,以用于植物叶片裂解液的rtraa双重扩增。
[0172]
实验例10:pmmov、炭疽菌植物材料裂解物双重rt-raa-lfs检测体系的优化
[0173]
将实施例7中的pmmov引物组d、炭疽菌引物组e2、炭疽菌引物组h2配置为mix,以利于rtraa双重扩增系内的引物添加量优化,引物mix各组分如下:
[0174][0175][0176]
经rt-pcr鉴定为pmmov、炭疽菌阳性的植物叶片样本,取100μl的酷闪核酸释放剂(bt0068),以枪头碾压待检材料数次,离心,取上清液待检。
[0177]
使用实验例7中的引物进行引物组d和引物组e2、引物组d和引物组h2的双重rt raa扩增,以约4.8
×
106个病毒拷贝/mg叶片的植物叶片为检测样本,取20mg植物叶片样品和100μl的酷闪核酸释放剂(bt0068),以枪头碾压待检材料数次,离心,取2μl叶片裂解液上清液待检。使用rt raa核酸扩增试剂盒(试纸条法)(jy0204)进行pmmov和炭疽菌双重rt raa反应体系的配制(单个样品/反应),体系如下:
[0178][0179]
加样顺序为阴性质控样本(植物叶片裂解液上清液替换为同体积的超纯水)、植物叶片裂解液上清液,每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。将上述反应体系混匀,加入基础反应单元。使冻干粉充分溶解,注意,该步骤不能使用涡旋振荡器剧烈
振荡混匀。打开反应单元,在每个0.2ml的eppendorf管加入2.5μl280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。
[0180]
将反应管放置在39℃条件下反应16min。rt raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释20~50倍。
[0181]
如图21所示,检测结果显示,引物组d与引物组e2的raa扩增引物组合,50μl rt raa扩增体系中引物组mix添加量为mix 5时,检测体系中的阴性对照(模板替换为等体积的裂解液)扩增产物稀释20倍后的试纸条检测结果为阴性,植物叶片裂解液上清液对pmmov和炭疽菌的检测结果均为阳性。
[0182]
如图22所示,引物组d与引物组h2的raa扩增引物组合,50μl rt raa扩增体系中引物组mix添加量为mix 4时,检测体系中的阴性对照(模板替换为等体积的裂解液)扩增产物稀释20倍后的试纸条检测结果为阴性,植物叶片裂解液上清液对pmmov的检测结果为阳性,对炭疽菌的检测结果为阴性;50μl rt raa扩增体系中引物组mix添加量为mix 5时,检测体系中的阴性对照(模板替换为等体积的裂解液)扩增产物稀释20倍后的试纸条检测结果为阴性,植物叶片裂解液上清液对pmmov和炭疽菌的检测结果均为阴性。
[0183]
因此,选用引物组d与引物组e2的rt raa双重扩增引物组合,设置引物组mix添加量为mix 5,进行后续的植物裂解液上清液灵敏度试验及田间样品检测。
[0184]
实验例10:辣椒植株pmmov、炭疽菌双重rt raa-lfs田间快速检测
[0185]
使用实验例8确定的引物组d与引物组e2序列及标记方式进行rtraa双重扩增,降低引物浓度,以增加引物添加体积,避免因引物浓度高,添加体积小,影响检测效果。在田间随机取样进行辣椒植株的田间检测,取每份样品选取40mg,其中的20mg样品提取总rna,进行rt qpcr分析,测定ct值,并计算样品拷贝数;另外20mg样品按照酷闪核酸释放剂提供的方法完成辣椒的叶片、果实及种子样品的裂解,进行rt-raa扩增反应,体系如下:
[0186]
成分体积植物样品裂解液或总rna溶液2μl基础缓冲液29.4μlpm-f2(5μm)0.29μlpm-r2(5μm)0.4μlpm-p3(1μm)0.4μlct-f1(5μm)0.9μlct-r1(5μm)1.26μlct-p1(1μm)1.26μlddh2o至总体系为47.5μl
[0187]
所述raa扩增的反应条件设置如下:反应液配制完成后,在每个0.2ml的eppendorf管加入2.5μl 280mm的mgac2,充分混匀;将0.2ml的eppendorf管放入带有热盖功能的pcr仪上,39℃,保温16min。rtraa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释20倍。
[0188]
对田间获取的4个样品的不同取材位置rt raa-lfs检测与rt-qpcr结果如下表4所示:
[0189][0190][0191]
各样品的rtraa-lfs检测结果图如图23所示,显示该体系可借助样品的快速裂解,实现pmmov、炭疽菌的田间快速检测。
[0192]
实验例11:pmmov、炭疽菌引物组d与引物组e2绝对定量实测样品的拷贝数和检测极限分析
[0193]
根据比对盘获得的质粒绝对定量标准曲线,将有pmmov感染症状的辣椒植株叶片50mg等分为两份,其中一份辣椒植株叶片提取总rna,转录后,进行梯度稀释,完成qpcr分析,计算样品拷贝数;另一份等量样品按照酷闪核酸释放剂提供的方法完成辣椒的叶片及种子样品的裂解,与平头炭疽菌样品裂解液合并后,按照实验例10所示体系,完成rt-raa双重扩增反应。
[0194]
分离接种盘上刮取20mg平头炭疽菌菌丝样品,其中10mg提取总rna,转录后,进行梯度稀释,完成qpcr分析,计算样品拷贝数;另一份等量样品按照酷闪核酸释放剂提供的方法完成菌丝样品的裂解,与被pmmov感染的辣椒样品裂解液合并后,按照实验例10所示体系,完成rt raa双重扩增反应。待反应完成后,将反应液稀释20倍,进行lfs检测,检测结果如图24所示,rt qpcr检测结果如下表5所示,显示所建立的rt-raa反应体系,每个50μl反应体系,最低可检出94拷贝的pmmov和41拷贝的炭疽菌。
[0195][0196][0197]
表5本发明rt raa-lfs检测pmmov和炭疽菌的检测极限
[0198]
综上所述,本技术通过一系列验证筛选出了能够同时检测pmmov和炭疽菌的引物组,该引物组可以有效扩增靶基因,具有较高的特异性和灵敏性,与其他病毒无交叉反应,可用于植物pmmov和炭疽菌的现场快速检测,对于有效防治这些病害具有重要意义。
[0199]
在缺少本文中所具体公开的任何元件、限制的情况下,可以实现本文所示和所述的发明。所采用的术语和表达法被用作说明的术语而非限制,并且不希望在这些术语和表达法的使用中排除所示和所述的特征或其部分的任何等同物,而且应该认识到各种改型在本发明的范围内都是可行的。因此应该理解,尽管通过各种实施例和可选的特征具体公开了本发明,但是本文所述的概念的修改和变型可以被本领域普通技术人员所采用,并且认为这些修改和变型落入所附权利要求书限定的本发明的范围之内。
[0200]
本文中所述或记载的文章、专利、专利申请以及所有其他文献和以电子方式可得的信息的内容在某种程度上全文包括在此以作参考,就如同每个单独的出版物被具体和单独指出以作参考一样。申请人保留把来自任何这种文章、专利、专利申请或其他文献的任何及所有材料和信息结合入本技术中的权利。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1