一种检测KRAS、NRAS、BRAF和PIK3CA基因突变的引物探针组合及其应用
一种检测kras、nras、braf和pik3ca基因突变的引物探针组合及其应用
技术领域
1.本发明属于生物检测技术领域,涉及一种检测kras、nras、braf和pik3ca基因突变的引物探针组合及其应用。
背景技术:
2.kras、nras、braf和pik3ca基因在egfr信号传导通路下游ras-raf-mek-erk途径和pi3k-akt-mtor途径中起到分子关卡的作用,与肿瘤的发生发展息息相关。kras、nras、braf和pik3ca基因的突变会直接影响针对egfr基因的抗肿瘤药物的疗效,进行癌症患者基因突变状态的检测与分析,对临床用药及治疗方案指导具有重要意义。
3.目前检测kras、nras、braf和pik3ca基因突变的方法主要有2种:荧光定量pcr法和测序法。直接测序法存在检测灵敏度不足、操作繁琐、无法进行多突变同时检测等缺点。大部分商用的试剂盒依赖于arms-qpcr技术,在针对多点突变联合检测时,但只能进行定性分析,并且在单管体系内无法区分突变亚型,如cn106636442a公开了一种人类肿瘤基因变异联合检测试剂盒,包括以下部分:egfr基因引物组、kras基因引物组、braf基因引物组、nras基因引物组、pik3ca基因引物组、hifi酶、pcr反应液、消化酶、连接酶、连接缓冲液、连接接头、荧光探针、qpcr反应的taq酶、qpcr引物和qpcr反应液,能同时检测人类肿瘤的多种驱动基因的突变位点,包括egfr、nras、kras、pik3ca和braf中一个或多个基因突变位点。商用的基于数字pcr技术的基因突变检测试剂盒同样无法在多位点突变检测中区分突变亚型,而只针对两三个热点突变的检测方案虽然能够确定突变亚型,但却无法满足临床对多突变检测实际需求。
4.综上所述,提供一种检测kras、nras、braf和pik3ca基因中多个突变热点试剂盒,对于肿瘤基因检测领域具有重要意义。
技术实现要素:
5.针对现有技术的不足和实际需求,本发明提供一种检测kras、nras、braf和pik3ca基因突变的引物探针组合及其应用,设计特定序列的引物探针组合,协同配合,可基于数字pcr,能够同时检测kras、nras、braf和pik3ca基因的14种热点突变,具备良好特异性和灵敏度,且操作简便、成本低。
6.为达上述目的,本发明采用以下技术方案:
7.第一方面,本发明提供一种检测kras、nras、braf和pik3ca基因突变的引物探针组合,所述引物探针组合包括检测kras、nras、braf和pik3ca基因的引物和探针;所述kras基因的引物包括3对引物,核酸序列包括seq id no.1~seq id no.6所示的序列;所述kras基因的野生型探针的核酸序列包括seq id no.7~seq id no.9所示的序列;所述kras基因的参考探针的核酸序列包括seq id no.10~seq id no.11所示的序列;所述nras基因的引物包括2对引物,核酸序列包括seq id no.12~seq id no.15所示的序列;所述nras基因的野
生型探针的核酸序列包括seq id no.16和seq id no.17所示的序列;所述nras基因的参考探针的核酸序列包括seq id no.18和seq id no.19所示的序列;所述braf基因的引物包括1对引物,核酸序列包括seq id no.20和seq id no.21所示的序列;所述braf基因的野生型探针的核酸序列包括seq id no.22;所述braf基因的参考探针的核酸序列包括seq id no.23;所述pik3ca基因的引物包括1对引物,核酸序列包括seq id no.24和seq id no.25所示的序列;所述pik3ca基因的野生型探针的核酸序列包括seq id no.26;所述pik3ca基因的参考探针的核酸序列包括seq id no.27。
8.本发明中,针对kras基因不同的外显子(exon2、exon3、exon4),nras基因两个外显子(exon2、exon3)、braf基因以及pik3ca基因设计引物、野生型探针及参考探针,协同配合并能够基于数字pcr同时检测kras、nras、braf和pik3ca基因的14种热点突变,包括kras突变基因p.g12s、p.g12d、p.g12c、p.g12v、p.g12a、p.g13d、p.q61h、p.k117n(19940)、p.k117n(28519);nras突变基因p.g12d、p.q61r、p.q61k;braf突变基因p.v600e;pik3ca突变基因p.h1047r,不同外显子的靶标分别记为kras-e2、kras-e3、kras-e4、nras-e2和nras-e3。
9.kras-e2正向引物(seq id no.1):5
’‑
aaggcctgctgaaaatgact-3’。
10.kras-e2反向引物(seq id no.2):5
’‑
gtcctgcaccagtaatatgc-3’。
11.kras-e3正向引物(seq id no.3):5
’‑
tctcccttctcaggattcct-3’。
12.kras-e3反向引物(seq id no.4):5
’‑
tacacaaagaaagccctccc-3’。
13.kras-e4正向引物(seq id no.5):
[0014]5’‑
ggactctgaagatgtacctatgg-3’。
[0015]
kras-e4反向引物(seq id no.6):
[0016]5’‑
tcagtgttacttacctgtcttgt-3’。
[0017]
nras-e2正向引物(seq id no.12):5
’‑
ggtttccaacaggttcttgc-3’。
[0018]
nras-e2反向引物(seq id no.13):5
’‑
actgggcctcacctctatg-3’。
[0019]
nras-e3正向引物(seq id no.14):5
’‑
cacacccccaggattcttac-3’。
[0020]
nras-e3反向引物(seq id no.15):5
’‑
attggtctctcatggcactg-3’。
[0021]
braf正向引物(seq id no.20):
[0022]5’‑
tcttcatgaagacctcacagtaaa-3’。
[0023]
braf反向引物(seq id no.21):5
’‑
agcctcaattcttaccatcca-3’。
[0024]
pik3ca正向引物(seq id no.24):
[0025]5’‑
agaggctttggagtatttcatga-3’。
[0026]
pik3ca反向引物(seq id no.25):5
’‑
gtggaatccagagtgagctt-3’。
[0027]
kras-e2野生型探针(seq id no.7):
[0028]5’‑
tggagctggtggcgt-3’。
[0029]
kras-e3野生型探针(seq id no.8):
[0030]5’‑
cacagcaggtcaagagga-3’。
[0031]
kras-e3参考探针(seq id no.10):
[0032]5’‑
cctcatgtactggtccctcattgcactg-3’。
[0033]
kras-e4野生型探针(seq id no.9):
[0034]5’‑
aggaaataaatgtgatttgccttc-3’。
[0035]
kras-e4参考探针(seq id no.11):
[0036]5’‑
tgctaagtcctgagcctgttttgtgtct-3’。
[0037]
nras-e2野生型探针(seq id no.16):
[0038]5’‑
tggttggagcaggtgg-3’。
[0039]
nras-e2参考探针(seq id no.18):
[0040]5’‑
ctggattagctggattgtcagtgcgct-3’。
[0041]
nras-e3野生型探针(seq id no.17):
[0042]5’‑
atacagctggacaagaagagt-3’。
[0043]
nras-e3参考探针(seq id no.19):
[0044]5’‑
ccagtatgtccaacaaacaggtttcacca-3’。
[0045]
braf野生型探针(seq id no.22):
[0046]5’‑
agctacagtgaaatctcgatgg-3’。
[0047]
braf参考探针(seq id no.23):
[0048]5’‑
actgttcaaactgatgggacccactcca-3’。
[0049]
pik3ca野生型探针(seq id no.26):
[0050]5’‑
tgcacatcatggtggct-3’。
[0051]
pik3ca参考探针(seq id no.27):
[0052]5’‑
tgcatgctgtttaattgtgtggaagatcca-3’。
[0053]
优选地,所述探针的5’端标记有荧光基团,3’端标记有淬灭基团。
[0054]
优选地,所述荧光基团包括fam、vic、tet、joe、hex、tamra、rox、cy5或texas red。
[0055]
优选地,所述淬灭基团包括mgb、tamra、dabcyl、bhq-1、bhq-2、bhq-3或eclipse。
[0056]
第二方面,本发明提供第一方面所述的检测kras、nras、braf和pik3ca基因突变的引物探针组合在制备检测kras、nras、braf和pik3ca基因的产品中的应用。
[0057]
第三方面,本发明提供一种检测kras、nras、braf和pik3ca基因突变的试剂盒,所述试剂盒包括第一方面所述的检测kras、nras、braf和pik3ca基因突变的引物探针组合。
[0058]
优选地,所述试剂盒还包括pcr反应液。
[0059]
优选地,所述pcr反应液包括dna聚合酶、mg
2+
、dntps和水。
[0060]
第四方面,本发明提供一种以非疾病诊断和/或治疗为目的的检测kras、nras、braf和pik3ca基因突变的方法,所述方法包括:
[0061]
以待测样本中的基因组为模板,利用第一方面所述的检测kras、nras、braf和pik3ca基因突变的引物探针组合进行数字pcr,进行荧光信号检测,根据数字pcr结果进行结果判读。
[0062]
本发明中,利用数字pcr(digital pcr,dpcr)对肿瘤中kras、nras、braf和pik3ca基因的14种热点突变,包括kras突变基因p.g12s、p.g12d、p.g12c、p.g12v、p.g12a、p.g13d、p.q61h、p.k117n(19940)、p.k117n(28519);nras突变基因p.g12d、p.q61r、p.q61k;braf突变基因p.v600e;pik3ca突变基因p.h1047r进行定性检测,可应用与kras、nras、braf和pik3ca基因功能机制的基础研究中。
[0063]
优选地,所述数字pcr的反应条件为:
[0064]
93~98℃预变性10min;
[0065]
93~96℃、25~35sec,55~65℃、25~35sec,共45~55个循环。
[0066]
优选地,所述数字pcr的反应体系包括kn多重数字pcr体系与nbp多重数字pcr体系;
[0067]
优选地,所述kn多重数字pcr反应体系包括:pcr反应液、kras、nras基因的引物、kras-e2野生型探针、kras-e3野生型探针、kras-e3参考探针、kras-e4野生型探针、kras-e4参考探针、nras-e2野生型探针、nras-e2参考探针和待测样本。
[0068]
优选地,所述nbp多重数字pcr反应体系包括:pcr反应液、nras、braf和pik3ca基因的引物、nras-e3野生型探针、nras-e3参考探针、braf野生型探针、braf参考探针、pik3ca野生型探针、pik3ca参考探针和待测样本。
[0069]
优选地,所述pcr反应液为ddpcr supermix for probes(no dutp)(bio-rad)。
[0070]
优选地,所述结果判读包括对微滴进行分类,判读是否产生突变。
[0071]
优选地,所述数字pcr可选择多重液滴数字pcr(ddpcr)。
[0072]
本发明中,根据设计的探针浓度,野生型靶标在数字pcr二维荧光结果上呈现不同的野生型液滴团簇,能够明显区分开,当靶标发生突变时,二维荧光结果会在野生型结果的基础上增加突变型液滴团簇,且突变型团簇会位于对应野生型团簇的正下方。
[0073]
优选地,所述以非疾病诊断和/或治疗为目的的检测kras、nras、braf和pik3ca基因突变的方法包括以下步骤:
[0074]
(1)配制所述kn多重数字pcr体系和nbp多重数字pcr体系;
[0075]
(2)将配制好的扩增体系混匀,加入液滴发生器样品孔中,在油孔中加入微滴生成油,制备微滴;
[0076]
(3)转移微滴至pcr板,进行扩增,pcr反应条件为:95℃预变性10min;94℃、30sec,60℃、30sec,共50个循环;
[0077]
(4)扩增完成后,进行微滴计数及荧光信号检测,对液滴进行分类,判读是否产生突变。
[0078]
第五方面,本发明提供一种检测kras、nras、braf和pik3ca基因突变的装置,所述装置包括检测单元和分析单元;
[0079]
所述检测单元用于执行包括:
[0080]
以待测样本中的基因组为模板,利用第一方面所述的检测kras、nras、braf和pik3ca基因突变的引物探针组合进行数字pcr,进行荧光信号检测;
[0081]
所述分析单元用于执行包括:
[0082]
根据数字pcr结果进行结果判读。
[0083]
优选地,所述数字pcr的反应条件为:
[0084]
93~98℃预变性10min;
[0085]
93~96℃、25~35sec,55~65℃、25~35sec,共45~55个循环。
[0086]
优选地,所述结果判读包括对微滴进行分类,判读是否产生突变。
[0087]
优选地,所述检测单元用于执行包括以下步骤:
[0088]
(1’)配制所述kn多重数字pcr体系和nbp多重数字pcr体系;
[0089]
(2’)将配制好的扩增体系混匀,加入液滴发生器样品孔中,在油孔中加入微滴生成油,制备微滴;
[0090]
(3’)转移微滴至pcr板,进行扩增,pcr反应条件为:95℃预变性10min;94℃、30sec,60℃、30sec,共50个循环;
[0091]
(4’)扩增完成后,进行荧光信号检测。
[0092]
与现有技术相比,本发明具有以下有益效果:
[0093]
本发明中,针对kras基因不同的外显子(exon2、exon3、exon4),nras基因两个外显子(exon2、exon3),braf基因以及pik3ca基因设计引物、野生型探针及参考探针,协同配合并能够基于数字pcr同时检测kras、nras、braf和pik3ca基因的14种热点突变,包括kras突变基因p.g12s、p.g12d、p.g12c、p.g12v、p.g12a、p.g13d、p.q61h、p.k117n(19940)、p.k117n(28519);nras突变基因p.g12d、p.q61r、p.q61k;braf突变基因p.v600e;pik3ca突变基因p.h1047r。
附图说明
[0094]
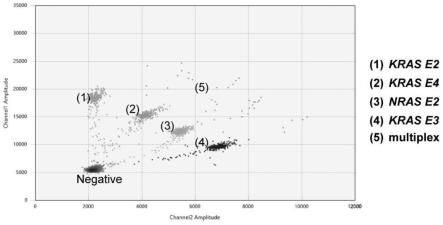
图1a为以kras-e2、kras-e3、kras-e4、nras-e2野生型质粒混合物为靶标进行ddpcr检测结果图;
[0095]
图1b为以kras-e2、kras-e3、kras-e4、nras-e2野生型质粒及其各自对应的一种突变型质粒(p.g12d、p.q61h、p.k117n(28519)、p.g12d(564))混合物进行ddpcr检测结果图;
[0096]
图2a为以nras-e3、braf、pik3ca野生型质粒混合物为靶标进行ddpcr检测结果图;
[0097]
图2b为以nras-e3、braf、pik3ca野生型质粒及其对应的一种突变型质粒(p.q61r、p.v600h、p.h1047r)混合物进行ddpcr检测结果图;
[0098]
图3为野生型样本kn体系ddpcr检测结果图,其中(1)为kras-e2野生型液滴团簇,(2)为kras-e4野生型液滴团簇,(3)为nras-e2野生型液滴团簇,(4)为kras-e3野生型液滴团簇,(5)为双阳性液滴团簇;
[0099]
图4为kras-e3突变样本kn体系ddpcr检测结果图;
[0100]
图5为kras-e2突变样本kn体系ddpcr检测结果图;
[0101]
图6为nras-e2突变样本kn体系ddpcr检测结果图;
[0102]
图7为野生型样本nbp体系ddpcr检测结果图,其中(1)为pik3ca野生型液滴团簇,(2)为nras-e3野生型液滴团簇,(3)为braf野生型液滴团簇,(4)为双阳性液滴团簇;
[0103]
图8为pik3ca突变样本nbp体系ddpcr检测结果图;
[0104]
图9为braf突变样本nbp体系ddpcr检测结果图。
具体实施方式
[0105]
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
[0106]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
[0107]
实施例1
[0108]
本实施例设计检测kras、nras、braf和pik3ca基因的引物探针组合。
[0109]
引物的序列和浓度如下所示:
[0110]
kras-e2正向引物(900nm):5
’‑
aaggcctgctgaaaatgact-3’;
[0111]
kras-e2反向引物(900nm):5
’‑
gtcctgcaccagtaatatgc-3’;
[0112]
kras-e3正向引物(900nm):5
’‑
tctcccttctcaggattcct-3’;
[0113]
kras-e3反向引物(900nm):5
’‑
tacacaaagaaagccctccc-3’;
[0114]
kras-e4正向引物(900nm):5
’‑
ggactctgaagatgtacctatgg-3’;
[0115]
kras-e4反向引物(900nm):5
’‑
tcagtgttacttacctgtcttgt-3’;
[0116]
nras-e2正向引物(900nm):5
’‑
ggtttccaacaggttcttgc-3’;
[0117]
nras-e2反向引物(900nm):5
’‑
actgggcctcacctctatg-3’;
[0118]
nras-e3正向引物(900nm):5
’‑
cacacccccaggattcttac-3’;
[0119]
nras-e3反向引物(900nm):5
’‑
attggtctctcatggcactg-3’;
[0120]
braf正向引物(900nm):5
’‑
tcttcatgaagacctcacagtaaa-3’;
[0121]
braf反向引物(900nm):5
’‑
agcctcaattcttaccatcca-3’;
[0122]
pik3ca正向引物(900nm):5
’‑
agaggctttggagtatttcatga-3’;
[0123]
pik3ca反向引物(900nm):5
’‑
gtggaatccagagtgagctt-3’。
[0124]
探针的序列和浓度如下:
[0125]
(1)kn多重ddpcr体系:
[0126]
kras-e2野生型探针(250nm):
[0127]5’‑
fam-tggagctggtggcgt-mgb-3’;
[0128]
kras-e3野生型探针(100nm):
[0129]5’‑
fam-cacagcaggtcaagagga-mgb-3’;
[0130]
kras-e3参考探针(200nm):
[0131]5’‑
hex-cctcatgtactggtccctcattgcactg-blackhole quencher 1-3’;
[0132]
kras-e4野生型探针(80nm):
[0133]5’‑
fam-aggaaataaatgtgatttgccttc-mgb-3’;
[0134]
kras-e4参考探针(150nm):
[0135]5’‑
hex-tgctaagtcct/ibhq1dt/gagcctgttttgtgtct-blackhole quencher 1-3’(此为双淬灭探针,/ibhq1dt/表示在序列中间碱基t上标记了淬灭基团bhq1);
[0136]
nras-e2野生型探针(150nm):
[0137]5’‑
fam-tggttggagcaggtgg-mgb-3’;
[0138]
nras-e2参考探针(120nm):
[0139]5’‑
hex-ctggattagctggattgtcagtgcgct-blackhole quencher 1-3’;
[0140]
(2)nbp多重ddpcr体系:
[0141]
nras-e3野生型探针(100nm):
[0142]5’‑
fam-atacagctggacaagaagagt-mgb-3’;
[0143]
nras-e3参考探针(100nm):
[0144]5’‑
hex-ccagtatgtccaacaaacaggtttcacca-blackhole quencher 1-3’;
[0145]
braf野生型探针(80nm):
[0146]5’‑
fam-agctacagtgaaatctcgatgg-mgb-3’;
[0147]
braf参考探针(200nm):
[0148]5’‑
hex-actgttcaaactgatgggacccactcca-blackhole quencher 1-3’;
[0149]
pik3ca野生型探针(250nm):
[0150]5’‑
fam-tgcacatcatggtggct-mgb-3’;
[0151]
pik3ca参考探针(80nm):
[0152]5’‑
hex-tgcatgctgtttaattgtgtggaagatcca-blackhole quencher 1-3’。
[0153]
实施例2
[0154]
利用kn多重ddpcr体系对kras-e2、kras-e3、kras-e4、nras-e2野生型质粒混合物及四种野生型质粒与对应的突变型质粒混合物进行检测。
[0155]
针对kras-e2、kras-e3、kras-e4、nras-e2基因设计引物,再利用引物对临床gdna扩增得到对应的基因片段,利用peasy-blunt cloning kit完成克隆、转化;利用takara minibest plasmid purification kit ver.4.0(takara)从e.coli中提取质粒。制备完野生型质粒定点突变后得到突变型质粒,将kras-e2、kras-e3、kras-e4、nras-e2四种野生型质粒混合得到野生型混合样本,将四种野生型质粒与其对应的四种突变型质粒混合得到突变型混合样本。ddpcr的20μl反应体系为:10μl的ddpcr supermix for probes(no dutp)(bio-rad),1.8μl的引物混合物、0.5μl的kras-e2野生型探针、0.2μl的kras-e3野生型探针、0.4μl的kras-e3参考探针、0.3μl的kras-e4野生型探针、0.16μl的kras-e4参考探针、0.3μl的nras-e2野生型探针、0.24μl的nras-e2参考探针、2μl待测样本,4.2μl无菌水。
[0156]
配制好的pcr扩增体系经混匀后,加入液滴发生器样品孔中,在油孔中加入70μl微滴生成油,覆盖垫圈,放入bio-rad ddpcr系统配套的qx200 droplet generator中制备微滴。转移40μl微滴至96孔pcr板,封膜后于bio-rad t100 pcr仪进行扩增(pcr反应条件为95℃预变性10min;94℃30sec,60℃30sec共50个循环)。扩增完成后,将pcr反应板转移至bio-rad ddpcr系统配套qx200 droplet reader,按仪器和软件操作说明,进行微滴计数及荧光信号检测;利用quantasoft analysis pro version 1.0.596软件对液滴进行分类,实现突变型的检测,ddpcr结果如图1a和图1b所示。当体系检测四种野生型质粒时,结果如图1a所示,不同靶标的单阳性液滴(序号1-4)与双阳性液滴(序号5-10)在散点图中呈现不同团簇,能够明显区分开。(11)为包含了三种靶标的液滴散点。当体系检测四种野生型质粒与对应的四种突变型质粒时,结果如图1b所示,四种野生型液滴团簇(序号1-4)与四种突变型液滴团簇(序号5-8)能够明显区分开,且突变型团簇位于野生型团簇正下方(序号1和5、2和6、3和7、4和8),序号(9)为液滴包含了两种或以上靶标的液滴散点。
[0157]
实施例3
[0158]
利用nbp多重ddpcr体系对nras-e3、braf、pik3ca野生型质粒混合物及三种野生型质粒与对应的突变型质粒混合物进行检测。
[0159]
针对nras-e3、braf、pik3ca基因设计引物,再利用引物对临床gdna扩增得到对应的基因片段,利用peasy-blunt cloning kit完成克隆、转化;利用takara minibest plasmid purification kit ver.4.0(takara)从e.coli中提取质粒,制备完野生型质粒定点突变后得到突变型质粒,将nras-e3、braf、pik3ca三种野生型质粒混合得到野生型混合样本。将三种野生型质粒与其对应的三种突变型质粒混合得到突变型混合样本。ddpcr的20μl反应体系为:10μl的ddpcr supermix for probes(no dutp)(bio-rad),1.8μl的引物混
合物、各0.2μl的nras-e3野生型和nras-e3参考探针、0.16μl的braf野生型探针、0.4μl的braf参考探针、0.5μl的pik3ca野生型探针、0.16μl的pik3ca参考探针、2μl待测样本,4.58μl无菌水。
[0160]
配制好的pcr扩增体系经混匀后,加入液滴发生器样品孔中,在油孔中加入70μl微滴生成油,覆盖垫圈,放入bio-rad ddpcr系统配套的qx200 droplet generator中制备微滴。转移40μl微滴至96孔pcr板,封膜后于bio-rad t100 pcr仪进行扩增(pcr反应条件为95℃预变性10min;94℃、30sec,60℃、30sec共50个循环)。扩增完成后,将pcr反应板转移至bio-rad ddpcr系统配套qx200 droplet reader,按仪器和软件操作说明,进行微滴计数及荧光信号检测;利用quantasoft analysis pro version 1.0.596软件对液滴进行分类,实现突变型的检测。ddpcr结果如图2a和图2b所示。当体系检测nras-e3、braf、pik3ca野生型质粒时,结果如图2a所示,不同靶标的单阳性液滴(序号1-3)与双阳性液滴(序号4-6)在散点图中呈现不同团簇,能够明显区分开。(7)为包含了三种靶标的液滴散点。当体系检测三种野生型质粒与对应的三种突变型质粒时,结果如图2b所示,三种野生型液滴团簇(序号1-3)与三种突变型液滴团簇(序号4-6)能够明显区分开,且突变型团簇位于野生型团簇正下方(序号1和4、2和5、3和6),序号(7-18)为包含了两种靶标的双阳性液滴团簇,(19)为包含了三种靶标的液滴散点。
[0161]
实施例4
[0162]
本实施例对临床肿瘤ffpe样本进行多位点突变检测。
[0163]
收集肿瘤ffpe样本,根据he染色结果,划分肿瘤区域,使用切片机切取4片厚度为10μm、肿瘤面积大于60%的样本,利用dnaffpe tissue kit(qiagen)提取gdna,最终用50μlbufferae洗脱。利用kn多重ddpcr体系与nbp多重ddpcr体系对临床样本gdna进行ddpcr扩增与检测,反应过程参照实施例2和实施例3,最终利用quantasoft analysis pro version 1.0.596软件对液滴进行分类,并判读是否产生突变,ddpcr结果如图3~图9所示,在kn体系中,野生型样本检测结果如图3所示,(1)为kras-e2野生型液滴团簇,(2)为kras-e4野生型液滴团簇,(3)为nras-e2野生型液滴团簇,(4)为kras-e3野生型液滴团簇,(5)为双阳性液滴团簇。突变型样本检测结果如图4~图6所示,图4为kras-e3突变样本,图5为kras-e2突变样本,图6为nras-e2突变样本,序号(1-4)为四种野生型液滴团簇,(5)为突变型液滴团簇,(6)为双阳性液滴团簇。在nbp体系中,野生型样本检测结果如图7所示,(1)为pik3ca野生型液滴团簇,(2)为nras-e3野生型液滴团簇,(3)为braf野生型液滴团簇,(4)为双阳性液滴团簇。图8展示braf突变型样本结果,序号(1-3)为三种野生型液滴团簇,(4)为突变型液滴团簇,(5)为双阳性液滴团簇。图9展示pik3ca突变型样本结果,序号(1-3)为三种野生型液滴团簇,(4)为突变型液滴团簇,(5)为双阳性液滴团簇。
[0164]
综上所述,本发明设计检测kras、nras、braf和pik3ca基因的引物探针组合,利用数字pcr对肿瘤中kras、nras、braf和pik3ca基因的14种热点突变进行定性检测,包括kras突变基因p.g12s、p.g12d、p.g12c、p.g12v、p.g12a、p.g13d、p.q61h、p.k117n(19940)、p.k117n(28519);nras突变基因p.g12d、p.q61r、p.q61k;braf突变基因p.v600e;pik3ca突变基因p.h1047r,具备良好特异性和灵敏度,且操作简便、成本低。
[0165]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的
技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1