一种喹喔啉酮和醛腙的二氟烷基化方法
1.本发明涉及有机合成技术领域,尤其涉及一种喹喔啉酮和醛腙的二氟烷基化方法。
背景技术:
2.二氟烷基是一类十分重要的含氟基团,存在于许多具有生物活性的化合物和功能性材料中,它被认为是氧原子和羰基的生物电子等排体,并且能够调节邻位官能团的pka值。
3.可见光诱导的c
sp3-x键均裂,尤其是c
sp3-i键,已成为在无金属或无光催化剂条件下获得多种c
sp3
自由基的可持续且强大的工具,从而实现了许多与c
sp3
自由基相关的转化。然而,通过c
sp3-br键均裂进行的转化相对不发达,因为它们的键解离能比c
sp3-i键强。c
sp3-x键均裂的独特之处在于它主要依赖于c
sp3
自由基的高反应性,而x自由基(例如溴自由基)的活性尚未见报道。溴自由基作为“底物活化的先驱”可以激活有机合成中的各种分子,所得中间体可以反过来淬灭另一种反应性底物或中间体,从而实现各种关键的化学转化。溴自由基激活底物的主要方式是作为亲电子氢原子转移(hat)试剂,从si-h键或c-h键中提取氢原子以提供亲核硅或碳自由基。利用这一特性,设想了一种涉及溴自由基的自由基交叉偶联策略,用于可见光驱动的c
sp3-br键均裂。然而实现这一策略的直接挑战是需要通过c
sp3-br键的光解和选择性可靠和可控地生成溴自由基基础上,溴自由基通过三种方式获得,包括(i)通过单电子转移(set)将溴阴离子氧化为溴自由基,主要借助光催化剂、自由基引发剂和其他set氧化方法,例如o2、光电氧化和电子供体受体复合物(edac),(ii)光敏引发的肉桂基溴能量转移,需要光催化剂,以及(iii)溴化物如分子溴的直接光解(br2,bde=46.4kcal/mol)或n-溴代琥珀酰亚胺(nbs,bde=58.0kcal/mol),这两种溴化物虽然容易光解形成溴自由基,但也存在nbs等固有缺陷,分子量较大的琥珀酰亚胺基团被直接丢弃,br2是一种剧毒、腐蚀性、挥发性的液体,限制了其官能团耐受性及其在有机合成中的应用。
4.喹喔啉酮和腙的c-h官能化是一种典型的自由基加成/set-氧化/去质子化中继转化,已通过经典的set催化和过氧化物介导的自由基反应得到证实。然而,这些反应受到一个或多个限制,例如需要过渡金属催化剂、配体、高温、化学计量氧化剂、有机染料、uva光照射,这对实用性产生了负面影响。
技术实现要素:
5.有鉴于此,本发明的目的是提供一种喹喔啉酮和醛腙的二氟烷基化方法,该方法反应条件温和、简单、高效,且不需光催化剂和任何金属试剂,仅在可见光作用下即可合成出具有重要药物活性的二氟烷基化的喹喔啉酮和醛腙衍生物,该方法在药物合成中可避免重金属残留,敏感官能团的不耐受以及环境污染。
6.本发明通过以下技术手段解决上述技术问题:
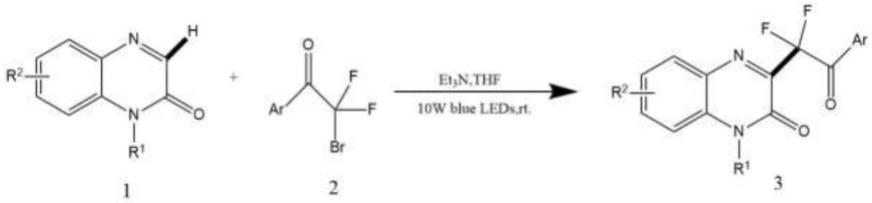
7.一种喹喔啉酮和醛腙的二氟烷基化方法,所述方法为在蓝色led的照射下,以α-溴
二氟代芳烃作为二氟烷基和溴自由基前体,在三乙胺存在下,和喹喔啉酮进行反应生成二氟烷基化喹喔啉酮衍生物,或者在1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)存在下和醛腙进行反应生成二氟烷基化醛腙衍生物。
[0008]
作为优选的,所述蓝色led的功率为10w,波长λ
max
=454nm。
[0009]
作为优选的,所述二氟烷基化喹喔啉酮衍生物的合成路线如下:
[0010][0011]
其中,r1为烷基、芳基、卤代苄基或氢,r2为氢、烷基、芳基或卤素,ar为芳基或杂芳基。
[0012]
作为优选的,所述二氟烷基化喹喔啉酮衍生物的合成方法如下:
[0013]
将三乙胺、喹喔啉酮和α-溴二氟芳烃加入到干燥的且装有搅拌器的容器中,抽空容器内的空气并用n2回填3次进行氮气保护,在无光条件下,加入0.2m无水四氢呋喃,并将容器密封;然后在10w蓝色led的照射下搅拌容器内的混合物,48小时后,得到的粗产物通过硅胶柱色谱纯化,使用正己烷/乙酸乙酯=4/1作为洗脱剂,得到二氟烷基化喹喔啉酮衍生物;所述三乙胺、喹喔啉酮和α-溴二氟芳烃的摩尔比为4:2:3。
[0014]
作为优选的,所述二氟烷基化醛腙衍生物的合成路线如下:
[0015][0016]
其中,r为芳基、杂芳基、烷基、烯基、炔基、酯基,ar’为芳基或杂芳基。
[0017]
作为优选的,所述二氟烷基化醛腙衍生物的合成路线如下:
[0018]
将1,8-二氮杂双环[5.4.0]十一碳-7-烯、醛腙和α-溴二氟代芳烃加入到干燥的且装有搅拌器的容器中,抽空容器内的空气并用n2回填3次进行氮气保护,在无光条件下,加入无水n,n-二甲基乙酰胺,并将容器密封;然后在10w蓝色led的照射下搅拌容器内的混合物,48小时后,得到的粗品用乙酸乙酯和水萃取3次,萃取液用无水na
2 so4干燥,除去溶剂,并通过硅胶柱色谱纯化,使用正己烷/乙酸乙酯=10/1作为洗脱剂,得到二氟烷基化醛腙衍生物;所述1,8-二氮杂双环[5.4.0]十一碳-7-烯、醛腙和α-溴二氟代芳烃的摩尔比为4:1.5:3。
[0019]
本发明的喹喔啉酮和醛腙的二氟烷基化方法,使用易于合成的α-溴二氟代芳烃作为二氟烷基和溴自由基前体,通过可见光蓝光诱导促进的c
sp3-br键均裂,得到亲电性的二氟烷基自由基和溴自由基,溴自由基可对喹喔啉酮或醛腙中的n=c-h进行氢原子转移得到
亲核性的n=c
·
自由基,进而淬灭原位生成的二氟烷基自由基,得到目标产物。
[0020]
本发明的合成路线不需要过渡金属或化学计量氧化剂参与,操作工艺简单,通过可见光作用即可得到二氟烷基化的喹喔啉酮和醛腙衍生物,原料简单易得,操作简单,反应条件温和、绿色、简单、高效,用于药物合成中,可避免重金属残留,敏感官能团的不耐受以及环境污染。
具体实施方式
[0021]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0022]
本发明的一种喹喔啉酮和醛腙的二氟烷基化方法,为在蓝色led的照射下,以α-溴二氟代芳烃作为二氟烷基和溴自由基前体,在三乙胺存在下,和喹喔啉酮进行反应生成二氟烷基化喹喔啉酮衍生物,或者在1,8-二氮杂双环[5.4.0]十一碳-7-烯存在下和醛腙进行反应生成二氟烷基化醛腙衍生物。其中的蓝色led的功率为10w,波长λ
max
=454nm。
[0023]
具体的,二氟烷基化喹喔啉酮衍生物的合成路线如下:
[0024][0025]
其中,r1为烷基、芳基、卤代苄基或氢,r2为氢、烷基、芳基或卤素,ar为芳基或杂芳基。实施例1-10中的二氟烷基化喹喔啉酮衍生物的合成方法均参照以下具体方法进行合成:
[0026]
将摩尔比为4:2:3的三乙胺、喹喔啉酮和α-溴二氟芳烃加入到干燥的且装有搅拌器的容器中,抽空容器内的空气并用n2回填3次进行氮气保护,在无光条件下,加入0.2m无水四氢呋喃,并将容器密封;然后在波长λ
max
=454nm、10w蓝色led的照射下搅拌容器内的混合物,48小时后,得到的粗产物通过硅胶柱色谱纯化,使用正己烷/乙酸乙酯=4/1作为洗脱剂,得到二氟烷基化喹喔啉酮衍生物。
[0027]
具体的,二氟烷基化醛腙衍生物的合成路线如下:
[0028][0029]
其中,r为芳基、杂芳基、烷基、烯基、炔基、酯基,ar’为芳基或杂芳基。实施例11-21
中的二氟烷基化醛腙衍生物的合成方法均参照以下具体方法进行合成:
[0030]
将摩尔比为4:1.5:3的1,8-二氮杂双环[5.4.0]十一碳-7-烯、醛腙和α-溴二氟代芳烃加入到干燥的且装有搅拌器的容器中,抽空容器内的空气并用n2回填3次进行氮气保护,在无光条件下,加入无水n,n-二甲基乙酰胺,并将容器密封;然后在波长λ
max
=454nm、10w蓝色led的照射下搅拌容器内的混合物,48小时后,得到的粗品用乙酸乙酯和水萃取3次,萃取液用无水na
2 so4干燥,除去溶剂,并通过硅胶柱色谱纯化,使用正己烷/乙酸乙酯=10/1作为洗脱剂,得到二氟烷基化醛腙衍生物。
[0031]
实施例1
[0032]
本实施例公开了化合物3aa及其合成路线,化合物3aa的结构式如下:
[0033][0034]
化合物3aa的合成路线如下:
[0035][0036]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3aa为黄色油状物,产率为87%。1h nmr(400mhz,cdcl3)δ8.08(dd,j=13.7,8.9hz,3h),7.58(t,j=7.9hz,1h),7.51(d,j=8.5hz,2h),7.42(t,j=7.6hz,1h),7.27(d,j=6.4hz,2h),6.95(d,j=7.4hz,2h),6.85(d,j=9.4hz,1h),5.44(s,2h),1.34(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.2(t,j=28.1hz),164.3,161.9,158.2,152.8,149.8(t,j=24.0hz),137.0(d,j=7.3hz),133.3,132.6,132.1,131.8,130.7(d,j=8.4hz),129.9(t,j=2.6hz),125.7,124.6,122.5(d,j=3.0hz),115.1,114.9,114.5,114.1,113.9,113.2(t,j=258.3hz),45.3,35.3,31.0ppm;
19
f nmr(376mhz,cdcl3)δ-105.31(s),-111.48
–‑
111.64(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
27h24
f3n2o
2+
465.1784;found 465.1780.
[0037]
实施例2
[0038]
本实施例公开了化合物3ba及其合成路线,化合物3ba的结构式如下:
[0039][0040]
化合物3ba的合成路线如下:
[0041][0042]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ba为无色油状物,产率为62%。1h nmr(400mhz,cdcl3)δ8.10(d,j=8.3hz,2h),8.05(d,j=8.0hz,1h),7.70(t,j=7.8hz,1h),7.51(d,j=8.5hz,2h),7.45(t,j=7.6hz,1h),7.39(d,j=8.4hz,1h),3.68(s,3h),1.34(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.36(t,j=28.2hz),158.1,152.8,149.7(t,j=23.9hz),134.2,132.6,131.9,131.5,130.0,125.7,124.4,114.0,113.3(t,j=259.1hz),35.3,31.0,29.0ppm;
19
f nmr(376mhz,cdcl3)-105.48(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
21h21
f2n2o
2+
371.1566;found 371.1564.
[0043]
实施例3
[0044]
本实施例公开了化合物3ca及其合成路线,化合物3ca的结构式如下:
[0045][0046]
化合物3ca的合成路线如下:
[0047][0048]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ca为无色油状物,产率为71%。1h nmr(400mhz,cdcl3)δ8.02-7.99(m,3h),7.52-7.45(m,3h),7.41-7.38(m,3h),7.35-7.31(m,1h),7.21-7.18(m,2h),6.70(dd,j=8.4,0.9hz,1h),1.25(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.6(t,j=27.7hz),158.0,152.5,150.4(t,j=24.0hz),135.0,134.6,132.2,131.7,131.1,130.4,130.1,130.1,130.1,130.0,129.8,129.6,128.2,126.0,125.6,124.5,115.8,113.4(t,j=256.9hz),35.3,31.0ppm;
19
f nmr(376mhz,cdcl3)δ-105.09(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
26h23
f2n2o
2+
433.1722;found 433.1719.
[0049]
实施例4
[0050]
本实施例公开了化合物3ma及其合成路线,化合物3ma的结构式如下:
[0051][0052]
化合物3ma的合成路线如下:
[0053][0054]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ma为淡黄色油状物,产率为77%。1h nmr(400mhz,cdcl3)δ8.07(d,j=8.3hz,2h),7.81(s,1h),7.49(d,j=8.5hz,2h),7.26
–
7.21(m,1h),7.01(s,1h),6.94(dd,j=10.9,5.1hz,2h),6.81(d,j=9.5hz,1h),5.40(s,2h),2.34(s,6h),1.33(s,9h)ppm;
13
c{1h}
nmr(100mhz,cdcl3)δ187.2(t,j=29.0hz),164.3,161.9,158.0,152.9,148.4(t,j=23.5hz),143.2,137.2(d,j=7.2hz),133.8,131.6,131.4,130.6(d,j=7.8hz),130.1,129.8,125.7,122.4(d,j=2.8hz),115.0,114.8,114.0,113.8,113.3(t,j=257.5hz),45.1,35.2,31.0,20.9,19.2ppm;
19
f nmr(376mhz,cdcl3)δ-105.24(s),-111.70
–‑
111.75(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
29h28
f3n2o
2+
493.2097;found 493.2099.
[0055]
实施例5
[0056]
本实施例公开了化合物3ra及其合成路线,化合物3ra的结构式如下:
[0057][0058]
化合物3ra的合成路线如下:
[0059][0060]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ra为无色油状物,产率为73%。1h nmr(400mhz,cdcl3)δ8.13(d,j=2.3hz,1h),8.02(d,j=8.4hz,2h),7.57(dd,j=9.0,2.3hz,1h),7.46
–
7.44(m,2h),7.20
–
7.16(m,1h),7.06(d,j=9.0hz,1h),6.90
–
6.84(m,2h),6.76(d,j=9.3hz,1h),5.33(s,2h),1.27(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.0(t,j=28.1hz),164.3,161.9,158.4,152.5,151.0(t,j=24.0hz),136.5(d,j=7.3hz),135.4,134.0,132.8,132.3,130.8(d,j=8.4hz),130.0,129.6,125.8,122.4(d,j=2.9hz),117.3,116.0,115.3,115.1,114.1,113.8,113.1(t,j=257.7hz),45.4,35.3,31.0ppm;
19
f nmr(376mhz,cdcl3)δ-105.36(s),-111.27
–
111.31(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
27h23
brf3n2o
2+
543.0890;found 543.0892.
[0061]
实施例6
[0062]
本实施例公开了化合物3ua及其合成路线,化合物3ua的结构式如下:
[0063][0064]
化合物3ua的合成路线如下:
[0065][0066]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ua为浅黄色固体,产率为38%。1h nmr(400mhz,cdcl3)δ12.79(s,1h),8.09(d,j=6.6hz,2h),7.83(d,j=7.6hz,1h),7.55(d,j=6.7hz,2h),7.05(d,j=6.6hz,1h),1.36(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.2(t,j=28.4hz),158.8,157.6,154.7(d,j=15.0hz),154.4,152.1(d,j=15.0hz),150.1(t,j=23.3hz),149.2(d,j=14.2hz),146.8(d,j=14.2hz),130.0,129.5,129.4(d,j=10.2hz),128.1(d,j=9.8hz),125.9,125.5,117.9,113.2(t,j=259.2hz),104.3,104.1,35.4,31.0ppm;
19
f nmr(376mhz,cdcl3)δ-105.01(s),-125.37
–‑
125.61(m),-137.86
–‑
137.96(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
20h17
f4n2o
2+
393.1221;found 393.1220.
[0067]
实施例7
[0068]
本实施例公开了化合物3af及其合成路线,化合物3af的结构式如下:
[0069][0070]
化合物3af的合成路线如下:
[0071][0072]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3af为浅黄色固体,产率为68%。1h nmr(400mhz,cdcl3)δ8.05(d,j=8.4hz,3h),7.57(t,j=7.9hz,1h),7.41(t,j=7.6hz,1h),7.29
–
7.22(m,4h),6.97
–
6.88(m,2h),6.85(d,j=9.4hz,1h),5.43(s,2h),2.51(s,3h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ186.4(t,j=28.1hz),164.3,161.8,152.8,149.6(t,j=24.2hz),147.9,137.0(d,j=7.1hz),133.2,132.7,132.1,131.7,130.7(d,j=8.3hz),130.2,128.6,124.9,124.6,123.8,122.4(d,j=2.7hz),115.1,114.9,114.5,114.1,113.9,113.2(t,j=258.1hz),45.2,14.6ppm;
19
f nmr(376mhz,cdcl3)δ-105.28(s),-111.58
–‑
111.68(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
24h18
f3n2o2s
+
455.1036;found455.1031.
[0073]
实施例8
[0074]
本实施例公开了化合物3ag及其合成路线,化合物3ag的结构式如下:
[0075][0076]
化合物3ag的合成路线如下:
[0077]
[0078]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ag为淡黄色油状物,产率为80%。1h nmr(400mhz,cdcl3)δ8.05(t,j=8.4hz,3h),7.57(t,j=7.9hz,1h),7.41(t,j=7.6hz,1h),7.29
–
7.25(m,2h),7.14(d,j=8.4hz,2h),6.97
–
6.82(m,3h),5.43(s,2h),1.98
–
1.92(m,1h),1.11
–
1.06(m,2h),0.82
–
0.78(m,2h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ186.8(t,j=28.0hz),164.3,161.9,152.8,151.9,149.8(t,j=24.0hz),137.0(d,j=7.3hz),133.2,132.6,132.1,131.7,130.7(d,j=8.3hz),130.1(t,j=2.6hz),129.7,125.6,124.6,122.4(d,j=3.0hz),115.1,114.9,114.5,114.1,113.9,113.2(t,j=258.2hz),45.2,15.9,10.6ppm;
19
f nmr(376mhz,cdcl3)δ-105.36(s),-111.64
–‑
111.66(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
26h20
f3n2o
2+
449.1471;found 449.1469.
[0079]
实施例9
[0080]
本实施例公开了化合物3ai及其合成路线,化合物3ai的结构式如下:
[0081][0082]
化合物3ai的合成路线如下:
[0083][0084]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ai为淡黄色油状物,产率为78%。1h nmr(400mhz,cdcl3)δ8.06(d,j=8.0hz,1h),7.81(d,j=8.3hz,1h),7.61
–
7.56(m,2h),7.42(t,j=7.7hz,1h),7.29(d,j=7.3hz,1h),7.25(d,j=7.4hz,1h),6.97
–
6.93(m,2h),6.88(d,j=8.3hz,1h),6.82(d,j=9.4hz,1h),6.06(s,2h),5.44(s,2h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ185.5(t,j=28.1hz),164.3,161.9,152.9,152.8,149.75(t,j=24.0hz),148.2,137.0(d,j=7.3hz),133.2,132.7,132.1,131.7,130.7(d,j=8.3hz),126.9(t,j=3.6hz),124.6,122.5(d,j=3.0hz),115.1,114.9,114.5,114.1,113.8,113.2(t,j=258.6hz),109.6,108.3,102.1,45.2ppm;
19
f nmr(376mhz,cdcl3)δ-104.77(s),-111.66
–‑
111.81(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
24h16
f3n2o
4+
453.1057;found453.10450.
[0085]
实施例10
[0086]
本实施例公开了化合物3ak及其合成路线,化合物3ak的结构式如下:
[0087][0088]
化合物3ak的合成路线如下:
[0089][0090]
具体的合成方法和工艺条件参照上述二氟烷基化喹喔啉酮衍生物的合成方法,合成的化合物3ak为无色油状物,产率为84%。1h nmr(400mhz,cdcl3)δ8.16(d,j=2.9hz,1h),8.07(d,j=8.0hz,1h),7.82(d,j=4.9hz,1h),7.58(t,j=7.8hz,1h),7.42(t,j=7.6hz,1h),7.29(d,j=7.7hz,1h),7.26(d,j=5.0hz,1h),7.22(t,j=4.4hz,1h),6.98
–
6.93(m,2h),6.88(d,j=9.4hz,1h),5.45(s,2h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ180.7(t,j=29.5hz),164.3,161.9,152.8,149.2(t,j=24.0hz),138.0(t,j=2.2hz),136.9(d,j=7.3hz),136.3,135.8(t,j=4.8hz),133.3,132.8,132.1,131.8,130.7(d,j=8.3hz),128.7,124.6,122.4(d,j=2.6hz),115.2,114.9,114.5,114.1,113.9,112.9(t,j=258.2hz),45.3ppm;
19
f nmr(376mhz,cdcl3)δ-106.29(s),-111.61
–‑
111.67(m)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
21h14
f3n2o2s
+
415.0723;found415.0720.
[0091]
实施例11
[0092]
本实施例公开了化合物5fa及其合成路线,化合物5fa的结构式如下:
[0093][0094]
化合物5fa的合成路线如下:
1.27(m,9h);
13
c{1h}nmr(100mhz,cdcl3)δ186.7(t,j=27.0hz),153.4,152.9,143.9(t,j=30.8hz),132.5,128.6,128.1,125.6,125.6,121.0,116.1(t,j=250.0hz),110.4,65.9,64.7,54.6,54.1,40.0,34.9,31.2,31.2;
19
f nmr(376mhz,cdcl3)δ-96.36(s),-98.06(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
25h32
f2n3o
2+
444.2457;found 444.2459.
[0103]
实施例13
[0104]
本实施例公开了化合物5ak及其合成路线,化合物5ak的结构式如下:
[0105][0106]
化合物5ak的合成路线如下:
[0107][0108]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5ak为无色油状物,产率为93%。1h nmr(400mhz,cdcl3)δ7.77
–
7.73(m,0.81h),7.69
–
7.59(m,1.50h),7.48
–
7.35(m,3.71h),7.10
–
7.04(m,1h),3.56
–
3.36(m,4h),2.85
–
2.68(m,3.35h),2.55(s,0.64h),1.28-1.27(m,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ182.2(t,j=29.5hz),154.6,153.1,142.1(t,j=31.4hz),139.9,134.7,134.7,134.6,134.5,128.3,128.3,128.2,125.7,125.6,115.8(t,j=250.5hz),65.9,64.7,54.2,54.1,34.9,31.2,31.2;
19
f nmr(376mhz,cdcl3)δ-97.73(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
21h25
f2n2o2s
+
407.1599;found 407.1603.
[0109]
实施例14
[0110]
本实施例公开了化合物5na及其合成路线,化合物5na的结构式如下:
[0111][0112]
化合物5na的合成路线如下:
[0113][0114]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5na为无色油状物,产率为89%。1h nmr(400mhz,cdcl3)δ8.02(d,j=8.1hz,2h),7.40(d,j=8.6hz,2h),7.01(s,1h),6.89(d,j=1.5hz,1h),5.99(dd,j=5.7,1.2hz,2h),3.49(t,j=4.8hz,4h),3.01
–
2.88(m,2h),2.87
–
2.73(m,2h),1.28(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ189.7
–
188.8(m),157.1,149.7,147.4,133.9(dd,j=35.0,30.6hz),131.1,130.3,126.1,125.1,115.7(dd,j=455.0,207.3hz),115.6,114.2,112.8,110.9,102.4,66.3,53.2,35.2,31.1;
19
f nmr(376mhz,cdcl3)δ-96.45(q,j=270.8hz),-104.07(dd,j=293.9,234.7hz)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
24h26
brf2n2o
4+
523.1039;found523.1041.
[0115]
实施例15
[0116]
本实施例公开了化合物5pa及其合成路线,化合物5pa的结构式如下:
[0117]
[0118]
化合物5pa的合成路线如下:
[0119][0120]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5pa为无色油状物,产率为96%。1h nmr(400mhz,cdcl3)δ7.89(d,j=8.3hz,3.86h),7.74(t,j=7.1hz,0.57h),7.69(s,0.8h),7.54(dt,j=8.7,7.1hz,2.84h),7.42(dd,j=10.3,8.1hz,4h),3.58
–
3.31(m,8h),2.95
–
2.68(m,7.39h),12.9(s,18h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ188.5(t,j=27.7hz),157.5,140.2(t,j=31.4hz),132.4,130.8,130.0,129.7,129.5,129.0,125.4,115.9(t,j=250.0hz),65.8,54.2,35.3,31.1;
19
f nmr(376mhz,cdcl3)δ-96.86(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
40h47
f4n4o
4+
723.3528;found 723.3530.
[0121]
实施例16
[0122]
本实施例公开了化合物5ra及其合成路线,化合物5ra的结构式如下:
[0123][0124]
化合物5ra的合成路线如下:
[0125][0126]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5ra为无色油状物,产率为67%。1h nmr(400mhz,cdcl3)δ8.78(s,1h),8.68
–
8.61(m,1h),7.97(d,j=8.4hz,1h),7.87(d,j=8.2hz,2h),7.44
–
7.41(m,2h),7.38(dd,j=7.9,5.0hz,1h),3.51
–
3.34(m,4h),2.86
–
2.69(m,3.59h),1.29(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ188.1(t,j=27.5hz),170.4,157.5,157.1,150.6,149.2,139.0(t,j=31.9hz),136.2,130.6,130.0,130.0,128.1,127.0,125.5,125.4,123.8,115.7(t,j=250.4hz),65.8,54.2,35.3,31.1,31.0;
19
f nmr(376mhz,cdcl3)δ-96.81(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
22h26
f2n3o
2+
402.1988;found 402.1987.
[0127]
实施例17
[0128]
本实施例公开了化合物5sa及其合成路线,化合物5sa的结构式如下:
[0129][0130]
化合物5sa的合成路线如下:
[0131][0132]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5sa为无色油状物,产率为72%。1h nmr(400mhz,cdcl3)δ8.51(d,j=7.9hz,1h),8.07(s,1h),7.95(d,j=8.3hz,2h),7.90(d,j=8.4hz,1h),7.42(d,j=8.5hz,2h),7.32(t,j=
7.8hz,1h),7.24(t,j=7.5hz,1h),3.89
–
3.78(m,4h),3.20
–
3.10(m,4h),1.49(s,9h),1.28(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ186.5(t,j=30.7hz),157.2,149.8,136.1,131.2(t,j=7.2hz),130.3,129.7,127.3(t,j=29.7hz),126.8,126.5,125.6,124.5,123.7,121.8,116.6(t,j=252.8hz),115.1,85.7,66.5,51.6,35.2,31.1,28.1;
19
f nmr(376mhz,cdcl3)δ-88.91(s),-97.89(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
30h36
f2n3o
4+
540.2668;found 540.2679.
[0133]
实施例18
[0134]
本实施例公开了化合物5ta及其合成路线,化合物5ta的结构式如下:
[0135][0136]
化合物5ta的合成路线如下:
[0137][0138]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5ta为无色油状物,产率为85%。1h nmr(400mhz,cdcl3)δ7.81(d,j=8.4hz,2h),7.37(d,j=8.6hz,2h),5.83(s,1h),3.64
–
3.44(m,4h),3.07
–
2.73(m,4h),1.85(s,3h),1.63(s,3h),1.27(s,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ188.7(t,j=27.8hz),157.1,146.0,143.0(t,j=31.1hz),130.8,130.0,129.0,125.2,115.9(t,j=250.6hz),113.4,66.4,53.4,35.2,31.0,25.8,21.7;
19
f nmr(376mhz,cdcl3)δ-99.09ppm;hrms(esi)m/z:[m+h]
+
calcd for c
21h29
f2n2o
2+
379.2192;found 379.2200.
[0139]
实施例19
[0140]
本实施例公开了化合物5xa及其合成路线,化合物5xa的结构式如下:
[0141][0142]
化合物5xa的合成路线如下:
[0143][0144]
具体的合成方法和工艺条件参照上述二氟烷基化醛腙衍生物的合成方法,合成的化合物5xa为无色油状物,产率为79%。1h nmr(400mhz,cdcl3)δ7.88(d,j=8.5hz,1.62h),7.76
–
7.66(m,0.29h),7.45
–
7.37(m,3.75h),7.35
–
7.22(m,3.32h),3.86
–
3.74(m,0.39h),3.62(dd,j=5.7,3.4hz,3.27h),3.58
–
3.51(m,3.58h),3.15
–
3.07(m,0.35h),1.27-1.20(m,9h)ppm;
13
c{1h}nmr(100mhz,cdcl3)δ187.8(t,j=27.8hz),157.4,131.5,130.4(t,j=13.5hz),130.1,129.7,128.6,125.4,121.5,119.7(t,j=33.3hz),117.9,114.9(t,j=251.3hz),101.3,79.2,66.1,53.4,35.2,31.0;
19
f nmr(376mhz,cdcl3)δ-98.28(s)ppm;hrms(esi)m/z:[m+h]
+
calcd for c
25h27
f2n2o
2+
425.2035;found 425.2033.
[0145]
实施例20
[0146]
本实施例公开了化合物5ya及其合成路线,化合物5ya的结构式如下:
[0147][0148]
化合物5ya的合成路线如下:
367.2199.
[0157]
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。本发明未详细描述的技术、形状、构造部分均为公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1