一种通过C端添加融合肽段提高木聚糖酶和植酸酶热稳定性的方法
一种通过c端添加融合肽段提高木聚糖酶和植酸酶热稳定性的方法
技术领域
1.本技术涉及基因工程领域,具体涉及一种通过c端添加融合肽段提高木聚糖酶和植酸酶热稳定性的方法。
背景技术:
2.木聚糖是生物圈中含量仅次于纤维素的第二大类多糖,其结构复杂,完全降解需要多种木聚糖酶的协同作用。β-1,4-内切木聚糖酶是木聚糖主链水解过程中最关键的酶,已广泛应用于饲料、造纸、能源、食品和医药等行业。但在实际应用中,由于真菌来源木聚糖酶的热稳定性较差,限制了其在工业中的应用。
3.植 酸 酶 (phytase) 又 称 肌 醇 六 磷 酸 水 解 酶,是催化肌醇六磷酸逐步去除磷酸盐的磷酸酶,广泛存在于植物、动物及微生物中。植酸酶在饲料行业具有重要的应用价值,在单胃动物的饲料中添加适量的植酸酶可以提高磷的利用率,通过减少对无机磷补充的需求和由含磷粪便排泄引起的环境污染可以降低饲养成本。大肠杆菌来源植酸酶是已知分解植酸能力最强的植酸酶之一,其作用ph范围与曲霉属来源植酸酶相比,更适于在动物的胃肠道内发挥作用,且有着更好的抗蛋白酶降解能力,但其热稳定性较差,限制了其在颗粒饲料中的应用。
4.通过基因工程技术对酶蛋白进行分子改良是提高木聚糖酶和植酸酶的热稳定性的有效方法,如增加氢键和盐桥数量、增强疏水相互作用、引入二硫键、增加某些特殊氨基酸等都是提高木聚糖酶热稳定性的有效策略。de souza等将来源于thermoascus aurantiacus cbmai756 的木聚糖酶xyna 的第209 位的氨基酸his突变为asn,增加了短螺旋和盐桥的数量,木聚糖酶的热稳定性得到了显著提升(de souza et al., 2016)。tang等在trichoderma ressei的木聚糖酶xyn2 中分别引入了cys14-cys52 和cys59-cys149 两对二硫键,使突变酶在60℃下的半衰期分别提高了2.5 倍和1.8 倍(tang et al., 2017)。denisenko等将来源于penicillium canescens的木聚糖酶pcxyla的第18位氨基酸leu突变为phe,增加了蛋白质三维结构中的疏水作用力,使突变酶在50℃~60℃下的半衰期提高了2~2.5 倍(denisenko et al., 2017)。然而,通过分子改良提升蛋白热稳定性的效果是不可必然事先预期的,需要进行大量的突变和筛选工作,耗时耗力成本较高。
技术实现要素:
5.本技术的目的是提供一种提高木聚糖酶的热稳定性的方法。
6.本发明的再一目的是提供一种提高植酸酶热稳定性的方法。
7.根据本发明的提高木聚糖酶的热稳定性的方法,包括以下步骤:在木聚糖酶的c端融合氨基酸序列如seq id no:1所示的融合肽段。
8.根据本发明的提高木聚糖酶的热稳定性的方法,其中,所述木聚糖酶为新美鞭菌属真菌n. patriciarum来源的木聚糖酶。
9.根据本发明的提高木聚糖酶的热稳定性的方法,其中,所述n. patriciarum来源的木聚糖酶的氨基酸序列如seq id no:2所示。
10.根据本发明的提高植酸酶的热稳定性的方法,包括以下步骤:在植酸酶的c端融合氨基酸序列如seq id no:1所示的融合肽段。
11.根据本发明的提高植酸酶的热稳定性的方法,其中,所述植酸酶为大肠杆菌来源的植酸酶。
12.根据本发明的提高植酸酶的热稳定性的方法,其中,所述大肠杆菌来源的植酸酶的氨基酸序列如seq id no.3所示。
13.本发明首次发现,通过在gh11家族木聚糖酶和植酸酶c端添加特定融合肽段的方法,可显著提高木聚糖酶和植酸酶的热稳定性,对于其他类型木聚糖酶、植酸酶及其他工业酶类的热稳定性分子改造具有重要的指导意义。
附图说明
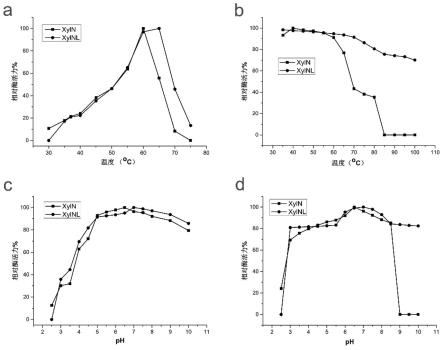
14.图1显示重组xyln和xylnl的酶学性质,其中,a:温度对酶活力的影响,b:不同温度下的热稳定性,c:ph对酶活力的影响,d:ph稳定性。
具体实施方式
15.在以下实施例中,在n. patriciarum来源β-1,4-内切木聚糖酶npxyln、大肠杆菌来源植酸酶appa的c端融合49个氨基酸组成的融合肽段(seq id no:1),其中,所述n. patriciarum来源β-1,4-内切木聚糖酶npxyln由225 个氨基酸组成(seq id no:2),属于糖苷水解酶gh11 家族;所述大肠杆菌来源植酸酶appa由410 个氨基酸组成(seq id no.3)。
16.在以下实施例中,木聚糖酶、植酸酶酶活力测定方法分别如下。
17.木聚糖酶酶活力测定:称取1 g榉木木聚糖于90 ml 0.1 m ph 6.0柠檬酸-磷酸氢二钠缓冲液中,在沸水中加热5 min,12,000 rpm离心5 min,取上清。再加缓冲液定容至100 ml,置于4oc环境中备用。木聚糖酶酶活性的测定采用3,5-二硝基水杨酸(dns)法(miller, g. l. (1959). "use of dinitrosalicylic acid reagent for determination of reducing sugar." anal. chem. 31( 3): 426
–
428.)。测定酶活时,设置为两组,一为实验组,二为对照组,两者均含有900 μl榉木木聚糖底物,置于60oc恒温水域锅内进行预热,测定时,实验组加入用0.1 m、ph 6.0柠檬酸-磷酸氢二钠缓冲液适当稀释的酶液,对照组则不加,反应10 min后加入1.5 ml dns终止液,在对照组中添加相等体积的稀释酶液。沸水煮5 min后,将其置于冰水混合物中冷却至室温,在540 nm波长处测定其od值,根据木糖的标准曲线来计算酶活。在60
°
c、ph 6.0的条件下,每分钟生成1 μmol还原糖所需要的酶量定义为一个酶活力单位(u)。
18.植酸酶活力测定方法如下:植酸酶活力的测定采用钼蓝法,酶活力单位定义:在37oc、ph 5.0条件下,每分钟从5.0 mmol
·
l-1
植酸钠溶液中释放出1μmol的无机磷所需的酶含量。
19.实施例1 在毕赤酵母中表达重组木聚糖酶和重组植酸酶及活力测定合成以下序列:
c端融合肽段的编码序列(seq id no. 4);neocallimastix patriciarum来源木聚糖酶xyln的编码序列(如seq id no. 5所示);大肠杆菌来源植酸酶appa的编码序列(seq id no. 6)。
20.通过重叠pcr将所述c端融合肽段的编码序列分别与上述木聚糖酶和植酸酶的编码序列连接。
21.将上述dna片段构建至表达载体ppic9k,分别构建得到表达质粒ppic9k-xyln,ppic9k
‑ꢀ
xyln-l; ppic9k-appa和ppic9k
‑ꢀ
appa-l,并转化毕赤酵母。
22.借助灭菌过后的牙签在md平板上选取单克隆,依据早晚顺序标号,点到对应标号的md板上;将md板放在30
°
c培育箱里培育48 h。依据标号选择正常成长的转化子接种于含有600 μl bmgy培养基的离心管中,带有bmgy培养基的离心管必须经过严格灭菌并被八层纱布包绕,把它放在28
°
c、200 rpm摇床上培育48 h;把摇床培育48 h的菌液放在3000 rpm离心10 min,除去上清液,向离心管里添加600 μl bmmy培养基,放置在28
°
c、200 rpm诱导培育。每隔12 h后补加一次甲醇(补加量为体系中甲醇终浓度为0.5%),诱导培育48 h后,把得到的菌液放置在8000 rpm离心3 min,选择上清液检查测定酶活性,从中筛选出具有木聚糖酶/植酸酶活性的转化子。
23.把最初筛选的有木聚糖酶/植酸酶活性的转化子,再次进行筛选。把上述转化子接种于含有10 ml bmgy培养基中,28
°
c,200 rpm培育48 h,4000 rpm离心5 min,除去上清,添加5 ml bmmy甲醇诱导培养基重新悬浮后,28
°
c,200 rpm培养,每隔12 h补加一次甲醇(补加量为体系中甲醇终浓度为0.5%),诱导48 h后取样检测木聚糖酶/植酸酶活。
24.实施例2 c端融合肽段的木聚糖酶的热稳定性及ph特性2.1 c端融合肽段的添加可改善neocallimastix patriciarum来源木聚糖酶xyln的热稳定性和ph特性将表达质粒ppic9k-xyln和ppic9k
‑ꢀ
xyln-l线性化后转化毕赤酵母gs115感受态细胞,使其整合至毕赤酵母染色体上,筛选得到具有木聚糖酶活力的转化子,进行摇瓶发酵诱导表达xyln和xyln-l蛋白。xyln和xyln-l蛋白在毕赤酵母中均成功实现了高效表达。
25.重组木聚糖酶xyln和xyln-l的最适温度的测定为在柠檬酸-磷酸氢二钠缓冲液(ph6.5)缓冲液体系及不同温度下进行酶促反应。耐温性测定为重组木聚糖酶xyln和xyln-l在不同温度下处理5 分钟,再在55oc、ph 4.0下进行酶活性测定。酶反应最适温度测定结果(图1,a图)表明xyln的最适温度为60oc,融合蛋白xyln-l的最适温度为65oc。
26.酶的热稳定性试验表明(图1, b图),重组木聚糖酶xyln在65oc处理5分钟后具有约76.9%的残余活性,在80oc处理5分钟后仅具有约35.3%的残余活性;而融合蛋白xyln-l在65oc处理5分钟后仍具有约93.6%的残余活性,在80oc处理5分钟后仍具有80%以上的残余活性。这表明,c端融合肽段的添加明显提升了重组木聚糖酶xyln的热稳定性。
27.将纯化的重组木聚糖酶xyln在不同的ph下进行酶促反应以测定其最适ph。在不同ph的缓冲液中60oc下进行重组木聚糖酶xyln活力测定。结果(图1, c图)表明,重组木聚糖酶xyln的最适ph为6.5,融合酶xyln-l的最适ph为7.0。将重组木聚糖酶xyln和xyln-l于上述各种不同ph的缓冲液中室温放置24小时,再在其最适ph缓冲液体系中于60oc下测定酶活性,以研究酶的ph耐受性。结果(图1, d图)表明重组木聚糖酶xyln在ph 3.0-8.5之间稳定,
在此ph范围内处理24小时后剩余酶活性在69%以上;重组木聚糖酶xyln-l在ph3.0-10.0之间均很稳定,在此ph范围内处理24小时后剩余酶活性在80%以上。这说明c端添加融合肽段的xyln-l蛋白比xyln具有更好的ph稳定性。
28.2.2c端融合肽段的添加可改善植酸酶appa的热稳定性将表达质粒ppic9k-appa和ppic9k-appa-l线性化后转化毕赤酵母gs115感受态细胞,使其整合至毕赤酵母染色体上。筛选得到具有植酸酶活力的转化子,进行摇瓶发酵诱导表达appa和appa-l蛋白。appa和appa-l蛋白在毕赤酵母中均成功实现了高效表达。
29.酶反应最适温度测定结果表明appa最适温度为80oc,酶的热稳定性试验表明,重组植酸酶appa在85oc处理5分钟后具有约59%的残余活性,在100oc处理5分钟后无残余活性;而appa-l在100oc处理5分钟后仍具有65%以上的残余活性。这表明,c端融合肽段的添加明显提升了重组植酸酶appa的热稳定性。
30.以上实施例仅用于理解本技术的技术方案,不限定本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1