同时检测四种致病菌的多重荧光定量PCR引物探针组、方法及应用与流程
同时检测四种致病菌的多重荧光定量pcr引物探针组、方法及应用
技术领域
1.本发明涉及分子生物学领域,具体涉及一种同时检测四种致病菌的多重荧光定量 pcr引物探针组、方法及应用。
背景技术:
2.金黄色葡萄球菌(staphylococcus aureus)、沙门氏菌(salmonella)、单核增生李斯特菌 (listeria monocytogenes)、大肠杆菌o157:h7(enterohemorrhagic e.coli o157∶h7)是四种常见的食源性致病菌,也是我国食品安全卫生标准中重点检测的4种致病菌。金黄色葡萄球菌是一种常见的革兰氏阳性菌,广泛分布于自然界中,作为常见的食源性致病菌可产生肠毒素,引起食物中毒、毒素休克综合征、骨髓炎、坏死性肺炎和心内膜炎等严重疾病。沙门氏菌属革兰氏阴性肠道杆菌,其感染症为人畜共患感染性疾病,主要由食用遭受污染的食物导致,蛋、家禽和肉类产品是沙门氏菌病的主要传播媒介,感染主要取决于沙门氏菌的血清型和食用者的身体状况,受威胁最大的是小孩、老年人及免疫缺陷个体。单核增生李斯特菌是一种兼性厌氧革兰氏阳性菌,为李斯特菌症的病原体,主要以食物为传染媒介,该菌在4℃的环境仍可以生长繁殖,是最致命的食源性病原体之一,造成二至三成的感染者死亡。大肠杆菌o157:h7属于肠杆菌科埃希氏菌属革兰氏阴性菌,大肠杆菌o157:h7的感染剂量极低。伏期为3-10天,病程2-9天。通常是突然发生剧烈腹痛和水样腹泻,数天后出现出血性腹泻,可发热或不发热。部分患者可发展为hus、ttp 等,严重者可导致死亡。
3.在食源性致病菌检测中,长久以来都是以传统的分离培养技术作为微生物鉴定和检测的主要方法技术,通常要经过分离培养,染色镜检,生化反应,溶血实验等,确定为某种病原菌后再进一步进行血清分析达到鉴定目的,传统的分离培养鉴定步骤复杂,周期较长,无法满足大规模快速检测的需求。随着分子生物学的发展,实时荧光定量pcr尤其是基于 taqman探针的荧光定量pcr技术逐渐应用于食源性致病菌的检测中,与传统的微生物分离培养鉴定相比,荧光定量pcr技术具有灵敏度高、检测周期短、特异性强等优点,由于多对引物和探针组合交叉影响和添加量不同,目前大多使用单重实时荧光定量进行致病菌检测,可同时检测多个目的基因的检测体系较少。无论是在常规食品抽检,还是在应对突发和重大食品安全事故中,都需要进行大规模快速的病原菌检测,因此建立一种同时检测金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌o157:h7的荧光定量pcr体系具有非常重要的实践意义。
技术实现要素:
4.针对上述问题,本发明的目的一在于提供一种同时检测四种致病菌的多重荧光定量 pcr引物探针组,目的二在于提供一种检测方法,目的三在于提供所述引物探针组的应用。本发明结合实时荧光定量pcr以及多重荧光定量pcr技术,提供的可以同时检测金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌o157:h7四种致病菌的方法,极大地提升
检测效率,节约检测成本,满足大规模快速检测的需要。
5.本发明采用的具体方案为:同时检测四种致病菌的多重荧光定量pcr引物探针组,包含分别针对金黄色葡萄球菌nuc 基因、沙门氏菌inva基因、单核增生李斯特菌hly基因和大肠杆菌o157:h7rfbe基因的引物对与探针;其中,针对金黄色葡萄球菌nuc基因的上游引物为序列如seq id no:1所示的nuc-f,下游引物为序列如seq id no:2所示的nuc-r,探针为序列如seq id no:3所示的nuc-p;针对沙门氏菌inva基因的上游引物为序列如seq id no:4所示的inva-f,下游引物为序列如seq id no:5所示的inva-r,探针为序列如seq id no:6所示的inva-p;针对单核增生李斯特菌hly基因的上游引物为序列如seq id no:7所示的hly-f,下游引物为序列如seq id no:8所示的hly-r,探针为序列如seq id no:9所示的hly-p;针对大肠杆菌o157:h7rfbe基因的上游引物为序列如seq id no:10所示的rfbe-f,下游引物为序列如seq id no:11所示的rfbe-r,探针为序列如seq id no:12所示的rfbe-p。
6.作为对上述方案的进一步优化,所述金黄色葡萄球菌nuc基因的探针序列5’端修饰有texred,所述沙门氏菌inva基因的探针序列5’端修饰有cy5,所述单核增生李斯特菌 hly基因的探针序列5’端修饰有hex,所述大肠杆菌o157:h7rfbe基因的探针序列5’端修饰有fam;所有探针的3’端均修饰有bhq1。
7.本发明还提供一种同时检测四种致病菌的多重实时荧光定量pcr方法,包括以下步骤:步骤一、提取待测样本的基因组dna备用;步骤二、将待测样本的基因组dna作为模板加入到多重荧光定量pcr反应体系中,所述体系包含上述的引物探针组;步骤三、将步骤二所述反应体系放置于荧光定量pcr仪中进行扩增,收集pcr扩增过程中的荧光信号,通过荧光信号分析判断是否存在致病菌。
8.本发明另外提供一种同时检测四种致病菌的多重实时荧光定量pcr试剂盒,所述试剂盒包括pcr反应液,所述反应液中含有上述的引物探针组。
9.作为对上述试剂盒的进一步优化,所述反应液包含反应液a和反应液b;所述反应液a为2
×
pcr mix,包含的组分为:taq酶4-8u、dntp 500nm、ph8.3的tris-hcl 200mm、 kcl 800mm和mg
2+
10mm;所述反应液b的组分为:四种致病菌的引物nuc-f、nuc-r、 inva-f、inva-r、hly-f、hly-r、rfbe-f、rfbe-r各500nm与探针nuc-p、inva-p、hly-p、rfbe-p各400nm。
10.作为对上述试剂盒的进一步优化,所述试剂盒还包括阴性质控品和阳性质控品;所述阴性质控品为depc水,所述阳性质控品为根据金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌o157:h7目的基因构建的质粒按照1:1:1:1比例的混合物。
11.作为对上述试剂盒的更进一步优化,其使用方法为:反应液a10ul,反应液b1.8ul,加入50-100ng模板,补水至20ul组成反应体系,按照95℃5min-10min,95℃变性20s-30s, 60℃退火/延伸30s-35s,40个循环程序进行荧光定量pcr反应。
12.更进一步地,收集pcr扩增过程中的荧光信号,通过待测样本中某一通道基因的 ct值及s型扩增曲线进行阳性判断:a).若待测样本某基因通道扩增有s型扩增曲线,且 ct
≦35,则判断待测样本含有致病菌;b).若待测样本某基因通道没有s型扩增曲线,且 ct≧35,则判断待测样本不含有致病菌;c).若待测样本某基因通道有s型扩增曲线,且 35≦ct《40,则判断为不确定样本,重新提取核酸复检。
13.本发明最后提供上述引物探针组、检测方法或试剂盒在以下任意一种中的应用:(a)检测金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌和大肠杆菌o157:h7中至少一种致病菌;(b)制备用于(a)检测的药物或产品。
14.有益效果:本发明的优点在于基于taqman探针多重实时荧光定量pcr检测技术,实现了同时检测金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌o157:h7致病菌的目的,具有特异性强、灵敏度高、简便快捷的特点,简化了实验过程,能够极大地提高检测效率,同时节约检测成本,能够满足现代大规模快速检测致病菌的需求,具有很高的实际应用价值。
附图说明
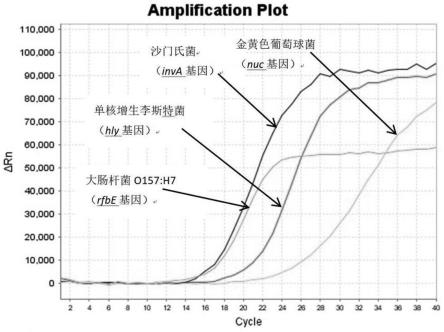
15.图1为四种致病菌同时阳性扩增曲线;图2为金黄色葡萄球菌阳性扩增曲线;图3为沙门氏菌阳性扩增曲线;图4为单核增生李斯特菌阳性扩增曲线;图5为大肠杆菌o157:h7阳性扩增曲线;图6为阴性对照扩增曲线;图7四种致病菌多重荧光定量pcr标准曲线;图8四种致病菌多重荧光定量pcr灵敏度试验。
具体实施方式
16.本发明提供同时检测致病菌多重荧光定量pcr试剂盒,包含pcr反应液a,反应液b,阳性质控,阴性对照。
17.所述反应液a为2
×
pcr mix,包含组分为:taq酶4-8u、dntp 500nm、ph8.3的 tris-hcl 200mm、kcl 800mm、mg
2+
10mm。
18.所述反应液b中包含针对金黄色葡萄球菌nuc基因、沙门氏菌inva基因、单核增生李斯特菌hly基因和大肠杆菌o157:h7rfbe基因的引物与探针,所述引物与探针序列如表 1所示的seq id no.1-12,其中seq id no.1、2、4、5、7、8、10、11分别为引物序列nuc-f、 nuc-r、inva-f、inva-r、hly-f、hly-r、rfbe-f、rfbe-r,seq id no.3、6、9、12分别为探针序列nuc-p、inva-p、hly-p、rfbe-p,所述各探针序列5’端均修饰有报告集团分别为 texred、cy5、hex、fam,3’端均修饰有淬灭集团为bhq1,同时反应液b中四种致病菌的引物nuc-f、nuc-r、inva-f、inva-r、hly-f、hly-r、rfbe-f、rfbe-r各500nm,探针 nuc-p、inva-p、hly-p、rfbe-p各400nm。
19.表1本发明同时检测四种致病菌的探针引物组合。
20.所述阴性质控品为depc水,所属阳性质控品为根据金黄色葡萄球菌nuc、沙门氏菌inva、单核增生李斯特菌hly、大肠杆菌o157:h7rfbe目的基因构建的质粒按照1:1:1:1 比例的混合物。
21.本发明的另一目的是提供一种同时检测四种致病菌的多重实时荧光定量pcr方法,包括以下步骤:(1).提取待测样本的基因组dna备用;(2).待测样本的基因组dna作为模板加入到四重实时荧光定量pcr反应体系中,所述反应体系为:反应液a10ul,反应液b1.8ul,模板dna50-100ng,补水至20ul;(3).将反应体系放置于荧光定量pcr仪中,选择texred通道用于检测金黄色葡萄球菌 nuc基因,cy5用于检测沙门氏菌inva基因,fam通道用于检测大肠杆菌o157:h7rfbe基因,hex/vic通道用于检测单核增生李斯特菌hly基因,选择参比荧光(passive reference) 为none,设置sample volume为20;(4).结果分析,阴性对照无ct值且没有典型的s型扩增曲线,阳性对照检测的fam、cy5、 texred和hex/vic通道均有明显的s型扩增曲线且ct值在20-25之间,通过待测样本中某一通道基因的ct值及s型扩增曲线进行阳性判断。a).若待检测样本某基因通道扩增有 s型扩增曲线,且ct≦35,则判断待检测样本为该致病菌;b).若待检测样本某基因通道没有s型扩增曲线,且ct≧35,则判断该样本不含有该致病菌;c).若待检测样本某基因通道有s型扩增曲线,且35≦ct《40,则判断为不确定样本,需要重新提取核酸复检。
22.下面通过具体实施例和相关附图对本发明进行更加详细的阐述。如无特殊说明,本发明中涉及的实验试剂和实验仪器均为常规市场销售产品。
23.实施例1制备同时检测金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌 o157的试剂盒。
24.1、配置反应液a:按照taq酶4-8u、dntp 500nm、ph8.3的tris-hcl 200mm、 kcl 800mm、mg
2+
10mm的含量比例制备反应液a。
25.2、配置反应液b:四种致病菌的上下游引物各500nm,探针各400nm震荡混匀避光保
存。
26.3、阳性质控品:金黄色葡萄球菌nuc、沙门氏菌inva、单核增生李斯特菌hly、大肠杆菌o157:h7rfbe目的基因构建的质粒按照1:1:1:1体积比例的混合物。
27.4、阴性质控品:depc水
28.实施例2样本处理
29.目标致病菌的基因组dna使用洛阳吉恩特生物科技有限公司的gnt
tm
细菌dna 提取试剂盒(磁珠法)进行提取,操作参照说明书。各阳性质控品质粒使用天根生化科技(北京)有限公司的质粒小提试剂盒(dp103)进行提取,操作参照说明书,按照1:1:1:1体积比进行混合备用。
30.实施例3实时荧光定量pcr检测四种致病菌
31.pcr反应体系为20ul,其中反应液a为10ul,反应液b为1.8ul,待测模板(阳性质粒)4ul,加水补齐至20ul。实时荧光定量pcr仪为abi7500,反应程序为95℃5min, 95℃20s,60℃30s,40个循环。
32.四种致病菌同时阳性扩增的曲线如图1所示,四种致病菌与阳性对照扩增曲线如图2-5所示,阴性对照如图6所示。正如附图所示,阳性、阴性对照可控,四种致病菌不存在非特异性扩增,证明本试剂盒可以同时检测这四种致病菌。
33.结果显示:本发明的试剂盒可以在2个小时内同时检测出金黄色葡萄球菌、沙门氏菌、单核增生李斯特菌、大肠杆菌o157这四种常见致病菌,极大地提高了检测效率,缩短了检测周期,并且具有操作简便、实用性强等特点,能够满足现代大规模快速检测致病菌的需求,能够产生良好的经济和社会效益。
34.实施例4四种致病菌多重实时荧光定量pcr的特异性和灵敏度
35.(1)探针及引物的特异性试验:将25种已知菌株快速扩增后,提取基因组dna,使用实施例3确定的pcr体系及反应条件对这25种已知菌株进行多重qpcr扩增检测,检测结果与预期设计完全相符:四种目标致病菌均有扩增曲线,而其他非目标菌没有出现扩增情况。通过特异性检测的实验结果可以看出本实验设计的探针及引物具有很高的物种特异性。
36.表2:多重实时荧光定量pcr特异性试验结果。
37.(2)多重实时荧光定量pcr标准曲线的建立及灵敏度试验:同上述实施例2提取各目标菌的dna模板并测定浓度和纯度(a260/a280),金黄色葡萄球菌:136.47ng/ul和1.832、沙门氏菌:205.38ng/ul和1.896、单核增生李斯特氏菌:75.61ng/ul 和1.923、大肠杆菌o157:h7:175.82ng/ul和1.786。各模板dna从50ng/ul开始使用ddh2o 按照10倍梯度稀释至0.005ng/ul,按照优化好的反应体系和程序进行多重qpcr扩增,建立标准曲线并且确定其灵敏度,每个稀释梯度做3个重复。四种致病菌的标准曲线如图7所示,金黄色葡萄球菌的标准曲线线性方程为:y=5.0091x+6.6386,r2=0.9988;沙门氏菌的标准曲线线性方程为:y=5.3573x+1.4095,r2=0.9996;单核增生李斯特菌的标准曲线线性方程为:y=4.0238x+4.8358,r2=0.9992;大肠杆菌o157:h7的标准曲线线性方程为:y= 5.4304x+1.6392,r2=0.9996。结果表明r2均大于0.99,模板dna浓度的对数(x轴)与 ct值(y轴)具有良好的线性关系。多重荧光定量pcr灵敏度如图8所示,以ct值小于等于35为阳性判定结果,四种致病菌的最低检测浓度为0.005ng/ul。
38.实施例5人工污染样品的检测
39.由于食品的多样性和食品基质的复杂性,其中可能存在多种抑制pcr反应的物质,所以为了检验本方法的广泛适用性,使用本方法建立的多重荧光定量pcr体系来检验人工污染食品中的四种致病菌。根据国家标准(gb 29921-2021《食品安全国家标准预包装食品
中致病菌限量》、gb 31607-2021《食品安全国家标准散装即食食品中致病菌限量》)购买相应类别的食品,基本涵盖预包装及散装食品种类。按照每25g/25ml样本加入100ul菌悬液,对食品样本使用四种致病菌进行人工污染,tsb培养基进行6-8小时增菌,按照实施例 2中的样本处理方法提取细菌基因dna,实施例3中的反应体系与反应程序进行多重荧光定量pcr检测,结果如表3所示,本检测体系可以检测到国家标准中规定食物类别中的四种致病菌。
40.表3:人工污染样品的检测结果。
41.需要说明的是,以上所述的实施方案应理解为说明性的,而非限制本发明的保护范围,本发明的保护范围以权利要求书为准。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1