一种低压制备甲酰胺的方法
1.本发明涉及一种低压制备甲酰胺的制备方法,具体地来说,利用简单的胺和一氧化碳为原料,通过碱促进剂在低压条件下发生羰基化反应,得到甲酰胺类化合物。属于有机学合成技术领域。
背景技术:
2.甲酰胺化合物是一类重要的化合物,因其结构中含有酰胺官能团,可作为合成咪唑、四氮唑、喹唑啉酮、喹啉、喹诺酮以及其他杂环化合物的重要的中间体。广泛存在于各种天然产物和医农药化学品中,通常表现出特殊价值的理化性质和重要的生物学活性。因此,关于该类化合物的合成,特别是发展一种简单的环境友好的合成路径,显得尤为重要。
3.甲酰胺化合物的合成方法有很多种,早期的制备方法一般是在高温高压下实现甲酰胺的制备,反应效率低,产率较低,且会产生大量的副产物。为了解决此类反应带来的弊端,科学工作者们在反应体系中引入了过度金属催化剂,一步催化胺制备甲酰胺化合物,虽然实现了良好的催化性能以及底物适应性,同时还需要加入复杂的原料以及活性试剂,不仅要求苛刻的反应条件,一氧化碳的压力一般超过50压力,反应温度基本上在130℃以上。反应的效率大大降低,且会产生大量的副产物,不符合绿色合成化学的基本要求。
4.为了解决此类问题,需要开发一种新的合成方法:不加采用金属催化剂、配体或高危活性的添加剂的情况下,使用绿色的碱来促进廉价易得胺类化合物直接反应制备甲酰胺化合物。目前,有几类利用促进实现了胺类的羰基化反应制备甲酰胺化合物,但是一氧化碳的压力仍不低于10个压力,而且温度基本上都在110℃以上。因此,在1-2个大气压的低压条件下实现碱促进的此类反应,至目前为止还没有相关报道。
5.因此,发展一类绿色、快速、实用和方便的甲酰胺合成方法成为了亟待解决的问题,直接利用胺的羰基化反应,低压条件下高原子经济性制备底物适用性范围广泛的甲酰胺具有要的理论意义和广泛的应用前景。
技术实现要素:
6.针对传统甲酰胺化合物的合成方法是在高压高温条件下完成反应,反应效率低,产率较低,且会产生大量的副产物等问题,本发明提供了一种低压制备甲酰胺的方法。
7.本方法在不采用金属催化剂、配体或高危活性添加剂的情况下,使用绿色的碱来促进廉价易得胺类化合物直接反应制备甲酰胺化合物。在1-2个大气压的低压条件下实现碱促进的此类反应,至目前为止还没有相关报道。
8.为了达到上述目的,本发明采用了下列技术方案:
9.一种低压制备甲酰胺的方法,以芳基胺为原料,增加碱促进剂和溶剂在低压条件下发生插羰反应,反应结束后抽干溶剂,通过柱层析得到甲酰胺化合物。
10.所述低压条件下发生插羰反应是在手套箱里往带有磁力搅拌子的干燥反应小瓶里加入芳基胺原料、碱促进剂和溶剂,将反应小瓶放置于高压釜中,于高压釜中置换co气体
三次后,充入1-2巴co;在室温下搅拌均匀后,最后在油浴中加热搅拌反应。
11.所述插羰反应是在油浴中加热至40-140℃,反应时间为3-15h。
12.所述芳基胺:碱促进剂的摩尔比是1:1。
13.进一步,所述芳基胺中的芳基r基团(其结构式如图2所示)选自:脂肪类取代基团(如对甲基、间甲基、邻甲基、对叔丁基、邻叔丁基、邻苯基、对甲氧基、间甲氧基、邻甲氧基,对三氟甲基、对腈基、邻腈基、对羟基),卤素类取代基团(对氟基、邻氯基、间氯基、对氯基、邻溴基、对溴基、邻碘基、对碘基),杂环及稠环类取代基团(乙缩醛基、2-呋喃基、α-萘基、β-萘基)。
14.进一步,所述碱促进剂为叔丁醇钾(t-buok)、叔丁醇钠(t-buona),优选的碱促进剂为叔丁醇钠(t-buona)。
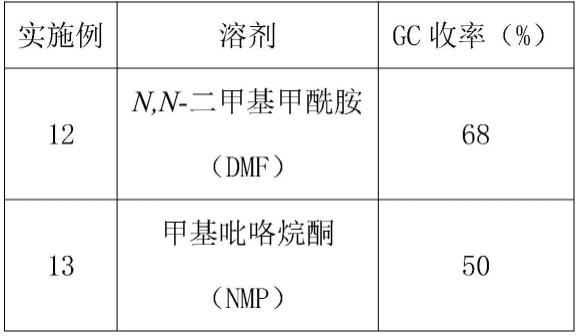
15.进一步,所述溶剂为:二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)、甲基吡咯烷酮(nmp),优选的溶剂为n,n-二甲基乙酰胺(dmac)。
16.与现有技术相比本发明具有以下优点:
17.本发明在工业上廉价易得的碱促进剂的催化下,由简单的芳基胺化合物通过插羰反应,仅一步低压即可高效的制备甲酰胺化合物,该反应中原料及和促进剂在工业上廉价易得,合成工艺简单,大大降低了合成成本;本发明可以低压高效合成甲酰胺化合物,反应条件温和,产率高,底物适用性范围宽,经济价值和实用价值较高;反应原料及促进剂清洁无毒,对环境污染小,反应过程清洁,操作简单,更符合绿色化学的要求;该反应转化效率较高,可以实现克级放大实验,易于实现工业化。
附图说明
18.图1为本发明甲酰胺的合成路线示意图;
19.图2为甲芳基胺衍生物结构式示意图;
20.图3为本实施例1甲酰苯胺b1的合成路线示意图;
21.图4为本实施例22甲酰基对甲苯胺b2的合成路线示意图;
22.图5为本实施例23甲酰基对甲苯胺b2的合成路线示意图;
23.图6为本实施例24间甲基甲酰苯胺b3的合成路线示意图;
24.图7为本实施例25邻甲基甲酰苯胺b4的合成路线示意图;
25.图8为本实施例26对叔丁基甲酰苯胺b5的合成路线示意图;
26.图9为本实施例27对叔丁基甲酰苯胺b5的合成路线示意图;
27.图10为本实施例28邻苄基甲酰苯胺b6的合成路线示意图;
28.图11为本实施例292-甲酰胺基联苯b7的合成路线示意图;
29.图12为本实施例30对甲氧基甲酰苯胺b8的合成路线示意图;
30.图13为本实施例31对甲氧基甲酰苯胺b8的合成路线示意图;
31.图14为本实施例32间甲氧基甲酰苯胺b9的合成路线示意图;
32.图15为本实施例33邻甲氧基甲酰苯胺b10的合成路线示意图;
33.图16为本实施例34甲酰基对氟苯胺b11的合成路线示意图;
34.图17为本实施例35甲酰基对氟苯胺b11的合成路线示意图;
35.图18为本实施例36对氯甲酰苯胺b12的合成路线示意图;
36.图19为本实施例37间氯甲酰苯胺b13的合成路线示意图;
37.图20为本实施例38邻氯甲酰苯胺b14的合成路线示意图;
38.图21为本实施例39对溴甲酰苯胺b15的合成路线示意图;
39.图22为本实施例40对溴甲酰苯胺b15的合成路线示意图;
40.图23为本实施例41间溴甲酰苯胺b16的合成路线示意图;
41.图24为本实施例42对碘甲酰苯胺b17的合成路线示意图;
42.图25为本实施例43对碘甲酰苯胺b17的合成路线示意图;
43.图26为本实施例44间碘甲酰苯胺b18的合成路线示意图;
44.图27为本实施例45对三氟甲基甲酰苯胺b19的合成路线示意图;
45.图28为本实施例46对三氟甲基甲酰苯胺b19的合成路线示意图;
46.图29为本实施例47对氰基甲酰苯胺b20的合成路线示意图;
47.图30为本实施例48间氰基甲酰苯胺b21的合成路线示意图;
48.图31为本实施例49对羟基甲酰苯胺b22的合成路线示意图;
49.图32为本实施例50胡椒醛b23的合成路线示意图;
50.图33为本实施例51胡椒醛b23的合成路线示意图;
51.图34为本实施例52甲酰基对甲酸甲酯苯胺b24的合成路线示意图;
52.图35为本实施例53甲酰基1-萘基胺b25的合成路线示意图;
53.图36为本实施例54甲酰基2-萘基胺b26的合成路线示意图;
54.图37为本实施例55甲酰基2-萘基胺b26的合成路线示意图;
55.图38为本实施例564-吡啶甲酰胺b27的合成路线示意图;
56.图39为本实施例57n-苄基甲酰胺b28的合成路线示意图;
57.图40为本实施例58对氟基n-苄基甲酰胺b29的合成路线示意图;
58.图41为本实施例59对氯基n-苄基甲酰胺b30的合成路线示意图;
59.图42为本实施例60对氯基n-苄基甲酰胺b30的合成路线示意图;
60.图43为本实施例61对溴基n-苄基甲酰胺b31的合成路线示意图;
61.图44为本实施例62n-环己基甲酰胺b32的合成路线示意图;
62.图45为本实施例63n-甲酰胺吗啉b33的合成路线示意图;
63.图46为本实施例64n-甲酰胺吗啉b33的合成路线示意图;
64.图47为本实施例65对苯二甲酰胺b34的合成路线示意图;
65.图48为本实施例661,8-二甲酰胺基萘b35的合成路线示意图;
66.图49为本实施例67n-(4-甲酰胺基)苄基甲酰胺b36的合成路线示意图。
具体实施方式
67.实施例1
68.甲酰苯胺b1的制备,其合成路线示意图1所示。
69.在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,加入正十六烷作为内标,gc收率为94%。
[0070]1h nmr(400mhz,cdcl3)δ9.04(br,0.5h),8.70(d,j=11.2hz,0.5h),8.33(s,0.5h),8.22(br,0.5h),7.56(d,j=7.6hz,1h),7.36
–
7.29(m,2h),7.23
–
6.98(m,2h).
[0071]
13
c nmr(101mhz,cdcl3)δ162.10,158.60,135.99,135.79,128.67,128.00,124.20,123.71,119.12,119.10,117.72.
[0072]
hrms(esi)calcd.for c7h8no[m+h]:122.0606,found:122.0607.
[0073]
对比例1
[0074]
甲酰苯胺b1的制备,其合成路线示意图3所示。
[0075]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(1.0mmol)、
t
buok(1.0mmol)和dmac(2.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,60℃下反应6h。停止反应,加入正十六烷作为内标,gc收率为67%。
[0076]
实施例2~11
[0077]
甲酰苯胺b1的制备:在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(1.0mmol)、一定量的
t
buona和dmac(2.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,60℃下反应6h。停止反应,加入正十六烷作为内标。
[0078]
表1不同的摩尔质量的碱促进剂对插羰反应的影响
[0079]
实施例碱促进剂用量(mmol)gc收率(%)20.85630.96341.16351.26861.36871.46781.56892.065102.56011353
[0080]
实施例12~13
[0081]
甲酰苯胺b1的制备:在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(1.0mmol)、buona(1.0mmol)和溶剂(2.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,60℃下反应6h。停止反应,加入正十六烷作为内标。
[0082]
表2不同的溶剂对插羰反应的影响
[0083][0084]
实施例14~17
[0085]
甲酰苯胺b1的制备:在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(1.0mmol)、buona(1.0mmol)和dmac(2.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,一定温度下反应6h。停止反应,加入正十六烷作为内标。
[0086]
表3不同的反应温度对插羰反应的影响
[0087]
实施例反应温度(℃)gc收率(%)148081151008916120811714080
[0088]
实施例18~21
[0089]
甲酰苯胺b1的制备:在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入苯胺(1.0mmol)、buona(1.0mmol)和dmac(1.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,60℃下反应一段时间。停止反应,加入正十六烷作为内标。
[0090]
表4不同的反应时间对插羰反应的影响
[0091]
实施例反应时间(h)gc收率(%)1868919995201299211598
[0092]
实施例22
[0093]
甲酰基对甲苯胺b2的制备,其合成路线示意图4所示。
[0094]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对甲苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0095]1h nmr(400mhz,cdcl3)δ8.85(d,j=9.4hz,1h),8.62(d,j=11.4hz,1h),8.31(d,j
=1.9hz,1h),7.92(s,1h),7.50
–
7.35(m,1h),7.13(dd,j=13.0,8.2hz,2h),7.01
–
6.97(m,1h),2.31(d,j=8.8hz,3h).
[0096]
13
c nmr(101mhz,cdcl3)δ163.27,159.39,135.14,134.45,134.18,130.23,129.56,120.15,119.10,20.90,20.82.
[0097]
hrms(esi)calcd.for c8h
10
no[m+h]:136.0762,found:136.0764.
[0098]
实施例23
[0099]
甲酰基对甲苯胺b2的制备,其合成路线示意图5所示。
[0100]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对甲苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为81%。
[0101]1h nmr(400mhz,cdcl3)δ8.85(d,j=9.4hz,1h),8.62(d,j=11.4hz,1h),8.31(d,j=1.9hz,1h),7.92(s,1h),7.50
–
7.35(m,1h),7.13(dd,j=13.0,8.2hz,2h),7.01
–
6.97(m,1h),2.31(d,j=8.8hz,3h).
[0102]
13
c nmr(101mhz,cdcl3)δ163.27,159.39,135.14,134.45,134.18,130.23,129.56,120.15,119.10,20.90,20.82.
[0103]
hrms(esi)calcd.for c8h
10
no[m+h]:136.0762,found:136.0764.
[0104]
表5不同的反应压力和反应时间对插羰反应的影响
[0105][0106]
实施例24
[0107]
间甲基甲酰苯胺b3的制备,其合成路线示意图6所示。
[0108]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间甲苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为93%。
[0109]1h nmr(400mhz,cdcl3)δ8.96
–
8.76(m,1h),8.69(d,j=11.3hz,1h),8.33(d,j=2.0hz,1h),7.88(s,1h),7.40(t,j=1.8hz,1h),7.36
–
7.28(m,1h),7.29
–
7.14(m,2h),6.99
–
6.89(m,4h),2.33(d,j=9.8hz,6h).
[0110]
13
c nmr(101mhz,cdcl3)δ163.09,159.42,139.84,139.04,136.93,136.76,129.53,128.89,126.04,125.58,120.72,119.48,117.16,115.72,21.46,21.40.
[0111]
hrms(esi)calcd.for c8h
10
no[m+h]:136.0762,found:136.07625.
[0112]
实施例25
[0113]
邻甲基甲酰苯胺b4的制备,其合成路线示意图7所示。
[0114]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入邻甲苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为90%。
[0115]1h nmr(400mhz,cdcl3)δ8.46(d,j=11.2hz,1h),8.36(d,j=1.8hz,1h),8.09
–
7.87(m,1h),7.85
–
7.78(m,1h),7.21
–
6.95(m,4h),2.22(d,j=11.8hz,2h).
[0116]
13
c nmr(101mhz,cdcl3)δ162.40,158.15,134.00,133.59,130.21,129.54,128.71,127.57,126.09,125.81,125.01,124.49,122.01,119.65,16.69.
[0117]
hrms(esi)calcd.for c8h
10
no[m+h]:136.0762,found:136.0761.
[0118]
实施例26
[0119]
对叔丁基甲酰苯胺b5的制备,其合成路线示意图8所示。
[0120]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对叔丁基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为98%。
[0121]1h nmr(400mhz,dmso-d6)δ10.24
–
9.84(m,1h),8.72(d,j=11.0hz,1h),8.24(d,j=1.9hz,1h),7.54
–
7.45(m,1h),7.37
–
7.28(m,1h),7.15
–
7.07(m,1h),1.25(s,7h).
[0122]
13
c nmr(101mhz,dmso-d6)δ162.94,159.80,146.54,146.37,136.16,136.13,126.49,125.90,119.36,117.91,40.60,40.39,40.18,34.48,34.44,31.63.
[0123]
hrms(esi)calcd.for c
11h16
no[m+h]:178.1232,found:178.1231.
[0124]
实施例27
[0125]
对叔丁基甲酰苯胺b5的制备,其合成路线示意图9所示。
[0126]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对叔丁基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为82%。
[0127]1h nmr(400mhz,dmso-d6)δ10.24
–
9.84(m,1h),8.72(d,j=11.0hz,1h),8.24(d,j=1.9hz,1h),7.54
–
7.45(m,1h),7.37
–
7.28(m,1h),7.15
–
7.07(m,1h),1.25(s,7h).
[0128]
13
c nmr(101mhz,dmso-d6)δ162.94,159.80,146.54,146.37,136.16,136.13,126.49,125.90,119.36,117.91,40.60,40.39,40.18,34.48,34.44,31.63.
[0129]
hrms(esi)calcd.for c
11h16
no[m+h]:178.1232,found:178.1231.
[0130]
表6不同的反应压力和反应时间对插羰反应的影响
[0131][0132]
实施例28
[0133]
邻苄基甲酰苯胺b6的制备,其合成路线示意图10所示。
[0134]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入邻苄基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为91%。
[0135]1h nmr(400mhz,cdcl3)δ8.40(d,j=11.3hz,1h),8.22(d,j=1.7hz,1h),7.88(d,j=8.0hz,1h),7.71(d,j=10.6hz,1h),7.33
–
7.25(m,1h),7.25
–
7.15(m,3h),7.15
–
7.08(m,3h),3.99(d,j=3.8hz,2h).
[0136]
13
c nmr(101mhz,cdcl3)δ163.21,159.31,138.83,138.61,135.09,134.68,132.94,131.44,131.31,131.00,128.96,128.52,128.43,127.90,127.61,126.77,126.47,125.81,124.12,122.00,38.01,37.82.
[0137]
hrms(esi)calcd.for c
14h14
no[m+h]:212.1075,found:212.1078.
[0138]
实施例29
[0139]
2-甲酰胺基联苯b7的制备,其合成路线示意图11所示。
[0140]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入邻甲苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为91%。
[0141]1h nmr(400mhz,cdcl3)δ8.64(d,j=11.3hz,1h),8.36(d,j=8.2hz,1h),8.25(d,j=1.5hz,1h),7.71
–
6.93(m,8h).
[0142]
13
c nmr(101mhz,cdcl3)δ162.02,158.99,137.82,137.36,133.84,133.78,133.01,132.01,131.20,130.18,129.34,129.20,129.18,128.75,128.52,128.16,128.12,125.37,124.65,121.57,118.34.
[0143]
hrms(esi)calcd.for c
13h12
no[m+h]:198.0919,found:198.0918.
[0144]
实施例30
[0145]
对甲氧基甲酰苯胺b8的制备,其合成路线示意图12所示。
[0146]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对甲氧基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为98%。
[0147]1h nmr(400mhz,cdcl3)δ8.50(d,j=11.0hz,1h),8.28(s,1h),7.84(s,1h),7.45(s,1h),7.03(d,j=8.6hz,1h),6.85(dd,j=14.0,8.7hz,2h),3.78(d,j=7.4hz,3h).
[0148]
13
c nmr(101mhz,cdcl3)δ162.32,158.19,156.54,155.64,129.02,128.63,120.84,120.49,113.85,113.16,54.52,54.45.
[0149]
hrms(esi)calcd.for c8h
10
no2[m+h]:152.0712,found:152.0715.
[0150]
实施例31
[0151]
对甲氧基甲酰苯胺b8的制备,其合成路线示意图13所示。
[0152]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对甲氧基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,80℃下反应12h。停止反应,柱层析分离收率为78%。
[0153]1h nmr(400mhz,cdcl3)δ8.50(d,j=11.0hz,1h),8.28(s,1h),7.84(s,1h),7.45(s,1h),7.03(d,j=8.6hz,1h),6.85(dd,j=14.0,8.7hz,2h),3.78(d,j=7.4hz,3h).
[0154]
13
c nmr(101mhz,cdcl3)δ162.32,158.19,156.54,155.64,129.02,128.63,120.84,120.49,113.85,113.16,54.52,54.45.
[0155]
hrms(esi)calcd.for c8h
10
no2[m+h]:152.0712,found:152.0715.
[0156]
表7不同的反应温度对插羰反应的影响
[0157]
实施例反应温度(℃)gc收率(%)3010098318078
[0158]
实施例32
[0159]
间甲氧基甲酰苯胺b9的制备,其合成路线示意图14所示。
[0160]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间甲氧基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0161]1h nmr(400mhz,dmso-d6)δ10.17(s,1h),8.82(d,j=10.8hz,1h),8.28(d,j=1.7hz,1h),7.31(t,j=2.2hz,1h),7.26
–
7.17(m,1h),7.14
–
7.12(m,1h),6.81
–
6.75(m,1h),6.66
–
6.64(m,1h),3.73(s,2h).
[0162]
13
c nmr(101mhz,dmso-d6)δ163.02,160.57,160.09,160.01,140.05,139.82,130.69,130.12,111.90,110.10,109.43,105.55,103.79,55.51,55.39.
[0163]
hrms(esi)calcd.for c8h
10
no2[m+h]:152.0712,found:152.0714.
[0164]
实施例33
[0165]
邻甲氧基甲酰苯胺b10的制备,其合成路线示意图15所示。
[0166]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间甲氧基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0167]1h nmr(400mhz,cdcl3)δ8.73(d,j=11.6hz,1h),8.45(d,j=1.9hz,1h),8.36(dd,
j=8.0,1.7hz,1h),8.03
–
7.53(m,1h),7.19(dd,j=7.7,1.6hz,1h),7.16
–
7.00(m,1h),7.00
–
6.86(m,2h),3.94
–
3.75(m,3h).
[0168]
13
c nmr(101mhz,cdcl3)δ168.24,161.53,158.85,148.75,147.82,127.69,126.75,126.17,125.25,124.29,123.62,121.06,120.45,119.79,116.69,111.29,110.07,109.89,55.72,55.64.
[0169]
hrms(esi)calcd.for c8h
10
no2[m+h]:152.0712,found:152.0710.
[0170]
实施例34
[0171]
甲酰基对氟苯胺b11的制备,其合成路线示意图16所示。
[0172]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氟苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为97%。
[0173]1h nmr(400mhz,dmso-d6)δ10.42
–
10.20(m,1h),10.15(d,j=10.8hz,1h),8.83
–
8.62(m,1h),8.29
–
8.26(m,1h),7.66
–
7.59(m,1h),7.25
–
7.19(m,1h),7.19
–
7.10(m,2h).
[0174]
13
c nmr(101mhz,dmso-d6)δ163.11,160.42,159.90,159.78,158.03,157.40,135.18,135.15,135.10,135.08,121.39,121.31,120.00,119.92,116.52,116.29,115.94,115.72.
[0175]
19
f nmr(376mhz,dmso)δ-118.84,-119.76.
[0176]
hrms(esi)calcd.for c7h7fno[m+h]:140.0512,found:140.0511.
[0177]
实施例35
[0178]
甲酰基对氟苯胺b11的制备,其合成路线示意图17所示。
[0179]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氟苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为80%。
[0180]1h nmr(400mhz,dmso-d6)δ10.42
–
10.20(m,1h),10.15(d,j=10.8hz,1h),8.83
–
8.62(m,1h),8.29
–
8.26(m,1h),7.66
–
7.59(m,1h),7.25
–
7.19(m,1h),7.19
–
7.10(m,2h).
[0181]
13
c nmr(101mhz,dmso-d6)δ163.11,160.42,159.90,159.78,158.03,157.40,135.18,135.15,135.10,135.08,121.39,121.31,120.00,119.92,116.52,116.29,115.94,115.72.
[0182]
19
f nmr(376mhz,dmso)δ-118.84,-119.76.
[0183]
hrms(esi)calcd.for c7h7fno[m+h]:140.0512,found:140.0511.
[0184]
表8不同的反应压力和反应时间对插羰反应的影响
[0185]
[0186][0187]
实施例36
[0188]
对氯甲酰苯胺b12的制备,其合成路线示意图18所示。
[0189]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氯苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为99%。
[0190]1h nmr(400mhz,dmso-d6)δ10.33(s,1h),8.79(d,j=8.1hz,1h),8.29(s,1h),7.66
–
7.59(m,1h),7.41
–
7.33(m,2h),7.26
–
7.19(m,1h).
[0191]
13
c nmr(101mhz,dmso-d6)δ162.99,160.18,137.86,137.61,129.69,129.22,127.93,127.62,121.17,119.44.
[0192]
hrms(esi)calcd.for c7h7clno[m+h]:156.0216,found:156.0217.
[0193]
实施例37
[0194]
间氯甲酰苯胺b13的制备,其合成路线示意图19所示。
[0195]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间氯苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为94%。
[0196]1h nmr(400mhz,cdcl3)δ8.71(d,j=11.1hz,1h),8.64(s,1h),8.38(d,j=1.4hz,1h),7.66(t,j=1.9hz,1h),7.39(dd,j=8.1,1.0hz,1h),7.30
–
7.22(m,1h),7.20
–
7.14(m,1h),7.14
–
7.08(m,1h),7.00(dd,j=8.0,1.3hz,1h).
[0197]
13
c nmr(101mhz,cdcl3)δ162.54,159.23,138.00,137.97,135.46,134.74,130.85,130.14,125.35,124.93,120.14,118.77,117.96,116.70.
[0198]
hrms(esi)calcd.for c7h7clno[m+h]:156.0216,found:156.0212.
[0199]
实施例38
[0200]
邻氯甲酰苯胺b14的制备,其合成路线示意图20所示。
[0201]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入邻氯苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为90%。
[0202]1h nmr(400mhz,cdcl3)δ8.72(d,j=11.2hz,1h),8.51(d,j=1.0hz,1h),8.41(dd,j=8.3,1.2hz,1h),7.76(s,1h),7.44(d,j=8.0hz,1h),7.39(dd,j=8.0,1.3hz,1h),7.33
–
7.22(m,1h),7.16
–
7.12(m,1h),7.10
–
7.06(m,1h).
[0203]
13
c nmr(101mhz,cdcl3)δ161.55,159.01,158.93,133.70,130.32,129.21,129.13,128.03,127.89,127.81,125.96,125.23,125.15,122.58,122.09,122.01,118.78,
118.70.
[0204]
hrms(esi)calcd.for c7h7clno[m+h]:156.0216,found:156.0218.
[0205]
实施例39
[0206]
对溴甲酰苯胺b15的制备,其合成路线示意图21所示。
[0207]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对溴苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0208]1h nmr(400mhz,cdcl3)δ8.66(d,j=11.3hz,1h),8.39(d,j=1.4hz,1h),7.99(s,1h),7.54
–
7.39(m,2h),7.29(s,1h),6.98(d,j=8.7hz,1h).
[0209]
13
c nmr(101mhz,cdcl3)δ162.07,158.79,135.83,135.69,132.81,132.10,121.44,120.36,118.29,117.48.
[0210]
hrms(esi)calcd.for c7h7brno[m+h]:199.9711,found:199.9715.
[0211]
实施例40
[0212]
对溴甲酰苯胺b15的制备,其合成路线示意图22所示。
[0213]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对溴苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,80℃下反应12h。停止反应,柱层析分离收率为77%。
[0214]1h nmr(400mhz,cdcl3)δ8.66(d,j=11.3hz,1h),8.39(d,j=1.4hz,1h),7.99(s,1h),7.54
–
7.39(m,2h),7.29(s,1h),6.98(d,j=8.7hz,1h).
[0215]
13
c nmr(101mhz,cdcl3)δ162.07,158.79,135.83,135.69,132.81,132.10,121.44,120.36,118.29,117.48.
[0216]
hrms(esi)calcd.for c7h7brno[m+h]:199.9711,found:199.9715.
[0217]
ms(70ev):m/z(%)=232[m]
+
(100),201,183,124.
[0218]
表9不同的反应温度对插羰反应的影响
[0219]
实施例反应温度(℃)gc收率(%)3910096408077
[0220]
实施例41
[0221]
间溴甲酰苯胺b16的制备,其合成路线示意图23所示。
[0222]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间溴苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为89%。
[0223]1h nmr(400mhz,cdcl3)δ8.71(d,j=11.1hz,1h),8.50(d,j=1.8hz,1h),8.39(dd,j=8.3,1.6hz,1h),7.87
–
7.50(m,1h),7.36
–
7.24(m,1h),7.12
–
6.96(m,1h).
[0224]
13
c nmr(101mhz,cdcl3)δ161.54,158.85,135.03,134.79,133.52,132.37,128.72,128.49,126.39,125.67,122.24,118.93,114.45,113.00.
[0225]
hrms(esi)calcd.for c7h7brno[m+h]:199.9711,found:199.9714.
[0226]
实施例42
[0227]
对碘甲酰苯胺b17的制备,其合成路线示意图24所示。
[0228]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对碘苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为93%。
[0229]1h nmr(400mhz,cdcl3)δ8.67(d,j=11.3hz,1h),8.39(d,j=1.7hz,1h),8.19(d,j=11.2hz,1h),7.70
–
7.55(m,1h),7.43
–
7.29(m,1h),6.92
–
6.70(m,1h).
[0230]
13
c nmr(101mhz,cdcl3)δ162.13,158.90,138.74,138.07,136.56,136.46,121.75,120.51,88.71,88.16.
[0231]
hrms(esi)calcd.for c7h7ino[m+h]:247.9572,found:247.9574.
[0232]
实施例43
[0233]
对碘甲酰苯胺b17的制备,其合成路线示意图25所示。
[0234]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对碘苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为76%。
[0235]1h nmr(400mhz,cdcl3)δ8.67(d,j=11.3hz,1h),8.39(d,j=1.7hz,1h),8.19(d,j=11.2hz,1h),7.70
–
7.55(m,1h),7.43
–
7.29(m,1h),6.92
–
6.70(m,1h).
[0236]
13
c nmr(101mhz,cdcl3)δ162.13,158.90,138.74,138.07,136.56,136.46,121.75,120.51,88.71,88.16.
[0237]
hrms(esi)calcd.for c7h7ino[m+h]:247.9572,found:247.9574.
[0238]
表10不同的反应压力和反应时间对插羰反应的影响
[0239][0240]
实施例44
[0241]
间碘甲酰苯胺b18的制备,其合成路线示意图26所示。
[0242]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间碘苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为85%。
[0243]1h nmr(400mhz,dmso-d6)δ9.57(s,1h),8.35(s,1h),7.88(dd,j=7.9,1.1hz,1h),
7.79(dd,j=8.1,1.2hz,1h),7.45
–
7.31(m,1h),7.16
–
6.80(m,1h).
[0244]
13
c nmr(101mhz,dmso-d6)δ164.16,160.78,139.96,139.62,138.94,129.86,129.16,128.27,127.41,125.08,95.54,93.16.
[0245]
hrms(esi)calcd.for c7h7ino[m+h]:247.9572,found:247.9575.
[0246]
实施例45
[0247]
对三氟甲基甲酰苯胺b19的制备,其合成路线示意图27所示。
[0248]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对三氟甲基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0249]1h nmr(400mhz,dmso-d6)δ10.49
–
10.06(m,1h),8.81(s,1h),8.31(s,1h),7.74
–
7.67(m,2h),7.31(t,j=4.2hz,2h).
[0250]
13
c nmr(101mhz,dmso-d6)δ168.96,163.10,160.21,144.64,144.22,144.20,138.95,138.16,137.85,124.37,122.73,122.14,121.92,121.83,120.96,120.67,119.29,119.19,116.75.
[0251]
19
f nmr(376mhz,dmso)δ-57.29,-57.37.
[0252]
hrms(esi)calcd.for c8h7f3no[m+h]:190.0480,found:190.0478.
[0253]
实施例46
[0254]
对三氟甲基甲酰苯胺b19的制备,其合成路线示意图28所示。
[0255]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对三氟甲基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,80℃下反应12h。停止反应,柱层析分离收率为74%。
[0256]1h nmr(400mhz,dmso-d6)δ10.49
–
10.06(m,1h),8.81(s,1h),8.31(s,1h),7.74
–
7.67(m,2h),7.31(t,j=4.2hz,2h).
[0257]
13
c nmr(101mhz,dmso-d6)δ168.96,163.10,160.21,144.64,144.22,144.20,138.95,138.16,137.85,124.37,122.73,122.14,121.92,121.83,120.96,120.67,119.29,119.19,116.75.
[0258]
19
f nmr(376mhz,dmso)δ-57.29,-57.37.
[0259]
hrms(esi)calcd.for c8h7f3no[m+h]:190.0480,found:190.0478.
[0260]
表11不同的反应温度对插羰反应的影响
[0261]
实施例反应温度(℃)gc收率(%)4510096468074
[0262]
实施例47
[0263]
对氰基甲酰苯胺b20的制备,其合成路线示意图29所示。
[0264]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氰基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,
100℃下反应12h。停止反应,柱层析分离收率为94%。
[0265]1h nmr(400mhz,dmso-d6)δ10.64(s,1h),8.99(s,1h),8.37(s,1h),7.84
–
7.70(m,2h),7.38(d,j=8.4hz,1h).
[0266]
13
c nmr(101mhz,dmso-d6)δ163.14,160.88,143.36,142.75,134.25,133.88,119.76,119.40,117.52,105.90,105.68.
[0267]
hrms(esi)calcd.for c8h7n2o[m+h]:147.0558,found:147.0556.
[0268]
实施例48
[0269]
间氰基甲酰苯胺b21的制备,其合成路线示意图30所示。
[0270]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入间氰基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为86%。
[0271]1h nmr(400mhz,cdcl3)δ10.40(s,1h),8.49(d,j=90.8hz,1h),7.94(d,j=8.4hz,1h),7.83(dd,j=7.9,1.5hz,1h),7.72
–
7.68(m,1h),7.44(d,j=15.8hz,1h),7.34(t,j=7.7hz,1h).
[0272]
13
c nmr(101mhz,cdcl3)δ161.56,158.87,135.05,134.80,133.54,132.39,128.73,128.51,126.40,125.68,122.25,118.94,114.46,113.01.
[0273]
hrms(esi)calcd.for c8h7n2o[m+h]:147.0558,found:147.0559.
[0274]
实施例49
[0275]
对羟基甲酰苯胺b22的制备,其合成路线示意图31所示。
[0276]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对羟基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为75%。
[0277]1h nmr(400mhz,dmso-d6)δ9.99
–
9.84(m,1h),9.30(s,1h),8.56(d,j=11.2hz,1h),8.21(t,j=3.0hz,1h),7.52
–
7.31(m,1h),7.13
–
6.91(m,1h),6.84
–
6.66(m,2h).
[0278]
13
c nmr(101mhz,dmso-d6)δ163.01,159.27,154.64,153.97,130.43,130.10,121.23,120.63,116.24,115.62.
[0279]
hrms(esi)calcd.for c7h8no2[m+h]:138.0555,found:138.0558.
[0280]
实施例50
[0281]
胡椒醛b23的制备,其合成路线示意图32所示。
[0282]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入1,3-苯并二恶茂(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为94%。
[0283]1h nmr(400mhz,dmso-d6)δ10.16
–
9.93(m,1h),8.61(d,j=10.9hz,1h),8.20(d,j=1.8hz,1h),7.30(d,j=2.1hz,1h),6.97(dd,j=8.4,2.1hz,1h),6.87(dd,j=9.9,5.3hz,1h),6.61(dd,j=8.3,2.2hz,1h),5.99(d,j=2.1hz,1h).
[0284]
13
c nmr(101mhz,dmso-d6)δ163.08,159.64,148.31,147.54,144.16,143.57,
133.11,133.08,112.36,111.34,108.97,108.58,101.73,101.62,101.47,100.60.
[0285]
hrms(esi)calcd.for c8h8no3[m+h]:166.0505,found:166.0509.
[0286]
实施例51
[0287]
胡椒醛b23的制备,其合成路线示意图33所示。
[0288]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入1,3-苯并二恶茂(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,80℃下反应12h。停止反应,柱层析分离收率为73%。
[0289]1h nmr(400mhz,dmso-d6)δ10.16
–
9.93(m,1h),8.61(d,j=10.9hz,1h),8.20(d,j=1.8hz,1h),7.30(d,j=2.1hz,1h),6.97(dd,j=8.4,2.1hz,1h),6.87(dd,j=9.9,5.3hz,1h),6.61(dd,j=8.3,2.2hz,1h),5.99(d,j=2.1hz,1h).
[0290]
13
c nmr(101mhz,dmso-d6)δ163.08,159.64,148.31,147.54,144.16,143.57,133.11,133.08,112.36,111.34,108.97,108.58,101.73,101.62,101.47,100.60.
[0291]
hrms(esi)calcd.for c8h8no3[m+h]:166.0505,found:166.0509.
[0292]
表12不同的反应温度对插羰反应的影响
[0293]
实施例反应温度(℃)gc收率(%)5010094518073
[0294]
实施例52
[0295]
甲酰基对甲酸甲酯苯胺b24的制备,其合成路线示意图34所示。
[0296]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对甲醇甲酯基苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0297]1h nmr(400mhz,dmso-d6)δ10.71
–
10.42(m,1h),8.97(d,j=10.5hz,1h),8.35(s,1h),8.06
–
7.86(m,2h),7.72(d,j=8.7hz,2h),7.32(d,j=8.6hz,1h),3.82(s,3h).
[0298]
13
c nmr(101mhz,dmso-d6)δ166.20,163.04,160.63,143.44,142.95,131.26,130.87,124.81,119.11,116.90,52.38.
[0299]
hrms(esi)calcd.for c9h
10
no3[m+h]:180.0661,found:180.0663.
[0300]
实施例53
[0301]
甲酰基1-萘基胺b25的制备,其合成路线示意图35所示。
[0302]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入1-萘基胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为96%。
[0303]1h nmr(400mhz,dmso-d6)δ8.67(d,j=10.9hz,1h),8.37(d,j=1.1hz,1h),7.90(s,1h),7.52
–
7.38(m,5h),7.00(t,j=5.7hz,1h).
[0304]
13
c nmr(101mhz,dmso-d6)δ162.83,160.56,144.22,142.52,125.43,125.10,119.02,116.58.
[0305]
hrms(esi)calcd.for c
11h10
no[m+h]:172.0762,found:172.0765.
[0306]
实施例54
[0307]
甲酰基2-萘基胺b26的制备,其合成路线示意图36所示。
[0308]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入2-萘基胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为97%。
[0309]1h nmr(400mhz,cdcl3)δ8.77(d,j=11.3hz,1h),8.46(s,1h),8.38(d,j=1.8hz,1h),8.15(d,j=2.0hz,1h),7.80
–
7.66(m,3h),7.52(s,1h),7.47
–
7.30(m,3h),7.18(d,j=1.5hz,1h).
[0310]
13
c nmr(101mhz,cdcl3)δ161.80,158.18,133.23,133.16,132.74,132.68,130.06,129.79,128.92,127.90,126.77,126.65,126.55,126.20,126.10,125.64,124.48,124.26,118.57,117.72,116.06,114.15.
[0311]
hrms(esi)calcd.for c
11h10
no[m+h]:172.0762,found:172.0766.
[0312]
实施例55
[0313]
甲酰基2-萘基胺b26的制备,其合成路线示意图37所示。
[0314]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入2-萘基胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为80%。
[0315]1h nmr(400mhz,cdcl3)δ8.77(d,j=11.3hz,1h),8.46(s,1h),8.38(d,j=1.8hz,1h),8.15(d,j=2.0hz,1h),7.80
–
7.66(m,3h),7.52(s,1h),7.47
–
7.30(m,3h),7.18(d,j=1.5hz,1h).
[0316]
13
c nmr(101mhz,cdcl3)δ161.80,158.18,133.23,133.16,132.74,132.68,130.06,129.79,128.92,127.90,126.77,126.65,126.55,126.20,126.10,125.64,124.48,124.26,118.57,117.72,116.06,114.15.
[0317]
hrms(esi)calcd.for c
11h10
no[m+h]:172.0762,found:172.0766.
[0318]
表13不同的反应压力和反应时间对插羰反应的影响
[0319][0320][0321]
实施例56
[0322]
4-吡啶甲酰胺b27的制备,其合成路线示意图38所示。
[0323]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入4-胺基吡啶(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为89%。
[0324]1h nmr(400mhz,dmso-d6)δ10.59(s,1h),10.46(d,j=9.5hz,1h),9.06(d,j=10.5hz,1h),8.50
–
8.32(m,3h),7.54(d,j=6.2hz,2h),7.20(d,j=5.8hz,1h).
[0325]
13
c nmr(101mhz,dmso-d6)δ163.00,161.33,151.05,151.00,146.03,145.07,113.82,111.62.
[0326]
hrms(esi)calcd.for c6h7n2o[m+h]:123.0558,found:123.0555.
[0327]
实施例57
[0328]
n-苄基甲酰胺b28的制备,其合成路线示意图39所示。
[0329]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入n-苄基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为82%。
[0330]1h nmr(400mhz,cdcl3)δ8.33
–
8.02(m,1h),7.45
–
7.13(m,4h),6.22(s,1h),4.41(dd,j=28.1,6.2hz,2h).
[0331]
13
c nmr(101mhz,cdcl3)δ164.82,161.26,137.67,128.74,127.74,126.99,45.67,42.10.
[0332]
hrms(esi)calcd.for c8h
10
no[m+h]:136.0762,found:136.0760.
[0333]
实施例58
[0334]
对氟基n-苄基甲酰胺b29的制备,其合成路线示意图40所示。
[0335]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氟基n-苄基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为82%。
[0336]1h nmr(400mhz,dmso-d6)δ8.54(s,1h),8.14(d,j=1.8hz,1h),7.31(dd,j=8.6,5.6hz,1h),7.23
–
7.04(m,2h),4.29(d,j=6.1hz,1h).
[0337]
13
c nmr(101mhz,dmso-d6)δ169.62,165.34,162.86,161.52,160.45,136.29,135.70,135.67,129.78,129.70,115.73,115.60,115.52,115.39,44.29,41.84.
[0338]
19
f nmr(376mhz,dmso-d6)δ-115.83,-116.06.
[0339]
hrms(esi)calcd.for c8h9fno[m+h]:154.0668,found:154.0664.
[0340]
实施例59
[0341]
对氯基n-苄基甲酰胺b30的制备,其合成路线示意图41所示。
[0342]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氯基n-苄基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为86%。
[0343]1h nmr(400mhz,dmso-d6)δ8.56(s,1h),8.15(d,j=1.7hz,1h),7.45
–
7.35(m,1h),
7.29(dd,j=11.3,5.2hz,2h),4.30(d,j=6.2hz,1h).
[0344]
13
c nmr(101mhz,dmso-d6)δ169.71,165.40,161.61,139.16,138.54,131.90,129.60,128.72,44.32,41.90.
[0345]
hrms(esi)calcd.for c8h9clno[m+h]:170.0373,found:170.0370.
[0346]
实施例60
[0347]
对氯基n-苄基甲酰胺b30的制备,其合成路线示意图42所示。
[0348]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氯基n-苄基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为70%。
[0349]1h nmr(400mhz,dmso-d6)δ8.56(s,1h),8.15(d,j=1.7hz,1h),7.45
–
7.35(m,1h),7.29(dd,j=11.3,5.2hz,2h),4.30(d,j=6.2hz,1h).
[0350]
13
c nmr(101mhz,dmso-d6)δ169.71,165.40,161.61,139.16,138.54,131.90,129.60,128.72,44.32,41.90.
[0351]
hrms(esi)calcd.for c8h9clno[m+h]:170.0373,found:170.0370.
[0352]
表14不同的反应压力和反应时间对插羰反应的影响
[0353]
实施例反应压力(bar)反应时间(h)gc收率(%)59212866012470
[0354]
实施例61
[0355]
对溴基n-苄基甲酰胺b31的制备,其合成路线示意图43所示。
[0356]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对氯基n-苄基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为80%。
[0357]1h nmr(400mhz,dmso-d6)δ8.50(t,j=33.1hz,1h),8.26
–
8.07(m,1h),7.57
–
7.48(m,1h),7.22(t,j=8.2hz,2h),4.28(d,j=6.2hz,1h).
[0358]
13
c nmr(101mhz,dmso-d6)δ169.71,165.41,161.62,139.58,138.97,131.64,129.97,120.36,44.38,41.96.
[0359]
hrms(esi)calcd.for c8h9brno[m+h]:213.9868,found:213.9864.
[0360]
实施例62
[0361]
n-环己基甲酰胺b32的制备,其合成路线示意图44所示。
[0362]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入n-环己基甲胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为81%。
[0363]1h nmr(400mhz,cdcl3)δ8.11(t,j=7.4hz,1h),6.06(d,j=78.7hz,1h),4.01
–
3.75(m,1h),3.42
–
3.18(m,1h),2.08
–
1.83(m,2h),1.75
–
1.69(m,1h),1.67
–
1.56(m,1h),1.39
–
1.31(m,2h),1.22
–
1.16(m,2h).
[0364]
13
c nmr(101mhz,cdcl3)δ163.68,160.42,77.42,77.10,76.78,51.04,47.06,34.64,32.98,25.40,25.00,24.74,24.71.
[0365]
hrms(esi)calcd.for c7h
14
no[m+h]:128.1075,found:128.1077.
[0366]
实施例63
[0367]
n-甲酰胺吗啉b33的制备,其合成路线示意图45所示。
[0368]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入吗啉(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(2bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应12h。停止反应,柱层析分离收率为82%。
[0369]1h nmr(400mhz,cdcl3)δ8.07(s,1h),3.81
–
3.63(m,4h),3.63
–
3.51(m,2h),3.47
–
3.33(m,2h).
[0370]
13
c nmr(101mhz,cdcl3)δ160.84,67.23,66.43,45.79,40.59.
[0371]
hrms(esi)calcd.for c5h
10
no2[m+h]:116.0712,found:116.0717.
[0372]
实施例64
[0373]
n-甲酰胺吗啉b33的制备,其合成路线示意图46所示。
[0374]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入吗啉(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为71%。
[0375]1h nmr(400mhz,cdcl3)δ8.07(s,1h),3.81
–
3.63(m,4h),3.63
–
3.51(m,2h),3.47
–
3.33(m,2h).
[0376]
13
c nmr(101mhz,cdcl3)δ160.84,67.23,66.43,45.79,40.59.
[0377]
hrms(esi)calcd.for c5h
10
no2[m+h]:116.0712,found:116.0717.
[0378]
表15不同的反应压力和反应时间对插羰反应的影响
[0379]
实施例反应压力(bar)反应时间(h)gc收率(%)63212826412471
[0380]
实施例65
[0381]
对苯二甲酰胺b34的制备,其合成路线示意图47所示。
[0382]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对二苯胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为82%。
[0383]1h nmr(400mhz,dmso-d6)δ10.14(s,1h),10.08(d,j=11.3hz,1h),8.69(dd,j=11.1,2.0hz,1h),8.23(d,j=2.0hz,1h),7.59
–
7.46(m,2h),7.15(t,j=4.4hz,1h).
[0384]
13
c nmr(101mhz,dmso-d6)δ162.90,159.74,134.82,134.45,120.64,120.06,119.32,118.72,40.60,40.40,40.19,39.98,39.77,39.56,39.35.
[0385]
hrms(esi)calcd.for c8h9n2o2[m+h]:165.0664,found:165.0666.
[0386]
实施例66
[0387]
1,8-二甲酰胺基萘b35的制备,其合成路线示意图48所示。
[0388]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对1,8-萘二胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为73%。
[0389]1h nmr(400mhz,cdcl3)δ8.73
–
8.53(m,2h),8.02(d,j=7.8hz,1h),7.91
–
7.85(m,1h),7.79(d,j=8.3hz,1h),7.72(d,j=8.2hz,1h),7.62
–
7.44(m,3h),7.32(d,j=7.3hz,1h),7.26(s,1h).
[0390]
13
c nmr(101mhz,cdcl3)δ164.11,159.65,134.29,134.08,132.13,131.00,128.85,128.55,127.77,127.04,126.81,126.52,126.23,126.14,125.71,125.52,121.32,120.90,120.38,119.07.
[0391]
hrms(esi)calcd.for c
12h11
n2o2[m+h]:215.0821,found:215.0823.
[0392]
实施例67
[0393]
n-(4-甲酰胺基)苄基甲酰胺b36的制备,其合成路线示意图49所示。
[0394]
在手套箱里,往带有磁力搅拌子的干燥反应小瓶里加入对对甲胺苄胺(10.0mmol)、
t
buona(10.0mmol)和dmac(10.0ml),将反应小瓶放置于高压釜中,于高压釜中置换co气体三次后,充入co(1bar)。反应在室温下搅拌均匀后,把高压釜放置于预先升温的油浴锅中,100℃下反应24h。停止反应,柱层析分离收率为76%。
[0395]1h nmr(400mhz,dmso-d6)δ10.30
–
10.01(m,1h),8.75(d,j=11.0hz,1h),8.47(s,1h),8.26(t,j=2.0hz,1h),8.11(t,j=7.5hz,1h),7.62
–
7.48(m,2h),7.26
–
7.10(m,3h),4.22(dd,j=23.0,6.0hz,2h).
[0396]
13
c nmr(101 mhz,dmso-d6)δ165.30,162.97,161.44,159.96,137.49,134.62,128.90,128.33,119.55,117.99,40.78,40.69.
[0397]
hrms(esi)calcd.for c9h
11
n2o2[m+h]:179.0821,found:179.0824.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1