一种毛白杨PtYABBY7基因及其应用
一种毛白杨ptyabby7基因及其应用
技术领域
1.本发明属于植物基因工程领域,涉及一种影响植物开花时间的基因,一种影响植物叶片形态的基因,涉及该基因编码的蛋白质,涉及含有该基因的表达载体和宿主细胞,涉及从植物dna中克隆该基因引物组,以及该基因的用途。
背景技术:
2.毛白杨(populus tomentosa)属杨柳科(salicaceae)树种,树干通直,材质优良,为我国特有乡土树种,在用材林建设、生态防护以及城乡绿化等方面具有重要的经济价值和生态价值。
3.作为典型的多年生木本植物,前人对其开花分子调节机制已经研究非常广泛。
4.杨树ft(floweringlocust)亚类基因ft1、ft2在拟南芥中过表达能够诱导开花时间提前,与ft过表达转基因表型相似。毛果杨ft1过表达转基因幼树能够产生花序,但较大植株更容易开花,幼小树木往往导致不完整的花器官,该基因的表达水平对杨树的开花时间有决定性作用,达到一定的临界水平才能完成开花过程。
5.lfy(leafy)、ap1(apetala1)在杨树腋生分生组织中高度表达,lfy被抑制会产生不育植株,不育rnai
–
ptlfy转基因植株的花芽中palfy表达减少,花序发育不完全。
6.杨树花器官发育阶段,a类基因ptap1-1和ptap1-2在雌雄花芽中季节表达模式相似,ptap1-1转录水平相对高于ptap1-2,参与杨树花器官的形成与性别分化。b类基因pdpi(pistillata)在美洲黑杨根系、叶片、雌雄花序中均有表达,在花被和花药中表达水平较高,而花梗和成熟花粉中表达微弱。chen等研究表明ap3和pi在毛白杨花芽发育后期高表达,可能在花粉发育过程中发挥重要作用。
7.c类基因ag(agamous)同源基因(ag1、ag2)均在毛果杨雌、雄花的花分生组织内轮(雌蕊和雄蕊)发育过程中表达,与花器官发育abcde模型一致。
8.毛白杨雄株散粉雌株飞絮造成环境影响,并且具有较长童期,阻碍遗传育种研究。在杨树中开展花发育的研究,构建完整的开花分子调控网络,对于加速育种周期、提高木质生物量积累、解决飞絮污染问题具有十分重要的意义。
技术实现要素:
9.鉴于此,本发明目的在于提供一种能够影响植物开花时间和叶片形态的基因。
10.本发明的目的之二在于提供一种由毛白杨ptyabby7基因编码的蛋白质。
11.本发明的目的之三在于提供一种用于克隆毛白杨ptyabby7基因的引物对。
12.本发明的目的之四在于提供一种毛白杨ptyabby7基因的荧光定量引物对。
13.本发明的目的之五在于提供一种含有ptyabby7基因的表达载体。
14.本发明的目的之六在于提供一种ptyabby7基因的宿主细胞。
15.本发明的目的之七在于提供一种ptyabby7基因的用途。
16.发明人通过长期的探索和尝试,以及多次的实验和努力,不断的改革创新,为解决
以上技术问题,本发明提供的技术方案是,提供一种毛白杨ptyabby7基因,在植物中进行表达,以调控植物开花时间和/或叶片形态,所述ptyabby7基因包含选自下组的核苷酸序列:
17.a、序列表seq id no.1所示核苷酸序列;
18.b、与a所述序列互补的核苷酸序列,或具有70%以上同源性的核苷酸序列;
19.c、编码序列表seq id no.2所示的氨基酸序列的核苷酸序列。
20.进一步地,所述植物为木本植物。
21.优选地,所述植物为毛白杨。
22.本发明还提供了一种毛白杨ptyabby7基因编码的蛋白质,所述蛋白质的氨基酸序列选自序列表seqidno.2所示的氨基酸序列。
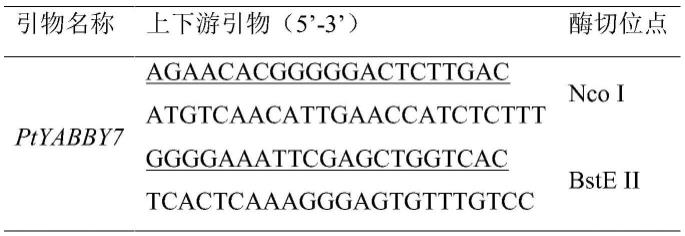
23.本发明还提供了一种用于克隆毛白杨ptyabby7基因的引物对,所述引物对的碱基序列如下:
24.第一上游引物f:5
’‑
atgtcaacattgaaccatctcttt-3’;
25.第一下游引物r:5
’‑
tcactcaaagggagtgtttgtcc-3’。
26.进一步地,所述引物对的碱基序列还包括酶切位点,包括酶切位点的引物对的碱基序列如下:
27.第二上游引物f:
[0028]5’‑
agaacacgggggactcttgacatgtcaacattgaaccatctcttt-3’;
[0029]
第二下游引物r:
[0030]5’‑
ggggaaattcgagctggtcactcactcaaagggagtgtttgtcc-3’。
[0031]
本发明还提供了一种毛白杨ptyabby7基因的荧光定量引物对,所述荧光定量引物对的碱基序列如下:
[0032]
第三上游引物f:5
’‑
acggtggtgactgtgata-3’;
[0033]
第三下游引物f:5
’‑
gctgagaggagttgaaagatt-3’。
[0034]
本发明还提供了一种含有ptyabby7基因的表达载体,利用限制性内切酶bsteii-hf和ncol-hf将pcambia1301载体质粒进行双酶切,使用ⅱone step cloning kit进行载体连接,获得过表达载体pcambia1301-ptyabby7。
[0035]
本发明还提供了一种含有前述过表达载体的宿主细胞,将所述过表达载体pcambia1301-ptyabby7装入农杆菌gv3101,获得宿主细胞。
[0036]
本发明还提供了一种所述毛白杨ptyabby7基因的用途,用于培育不同开花时间和/或叶片形态的毛白杨新品种。
[0037]
与现有技术相比,上述技术方案中的一个技术方案具有如下优点:
[0038]
a)通过对野生型拟南芥和转基因植株的对比观察发现,ptyabby7基因过表达影响拟南芥的开花时间和叶片形态。转基因植株开花时间出现不同程度的延迟,其中四个株系的开花时间与野生型植株差异显著。
[0039]
b)拟南芥转基因植株叶片颜色加深、变皱,叶片较窄并且向下卷曲。对莲座叶和茎生叶数量统计分析,部分植株莲座叶数量与开花时间成正相关,开花越晚,莲座叶数量有所增加。
[0040]
c)拟南芥转基因植株的花序与野生型一致,均为无限花序。花器官发育正常,雄蕊、雌蕊和花被的数量和表型均无明显变化,同时长角果表型与野生型一致,果荚饱满,结
实率无明显差异。
[0041]
d)本发明ptyabby7基因在调控杨树开花以及侧生器官生长发育中的重要作用,为解决杨树春季飞絮问题和积累木质生物量带来可能,并为其他多年生木本植物的相关研究提供了参考。
[0042]
e)ptyabby7基因在毛白杨营养组织和雌雄花芽发育的8个时期中出现差异表达。主要在雌花芽发育过程中表达,且基因表达变化明显;在雄花芽和营养组织中表达极低。
附图说明
[0043]
为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0044]
图1是使用毛白杨cdna为模板克隆ptyabby7基因的克隆电泳图。
[0045]
图2是ptyabby7与atyabby蛋白多序列比对图。
[0046]
图3是yabby蛋白系统进化分析结果。
[0047]
图4是雌雄花芽和营养器官中ptyabby7的表达模式分析结果。
[0048]
图5是拟南芥野生型与转基因株系的dna扩增电泳图。
[0049]
图6是拟南芥野生型与转基因株系的表型观察结果。
[0050]
图7是拟南芥野生型与转基因株系的统计分析结果。
[0051]
图8是与叶片极性和开花时间相关的基因进行实时荧光定量分析结果。
具体实施方式
[0052]
下面结合附图与一个具体实施例进行说明。
[0053]
为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
[0054]
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中可以不对其进行进一步定义和解释。
[0055]
实施例1
[0056]
为了清楚说明本发明所述的ptyabby7基因、ptyabby7基因编码的蛋白质、克隆毛白杨ptyabby7基因的引物对、ptyabby7基因的荧光定量引物对、含有ptyabby7基因的表达载体和包括所述过表达载体的宿主细胞,以及毛白杨ptyabby7基因在培育不同开花时间和/或叶片形态的毛白杨新品种的应用,以下通过具体试验手段、过程进行说明。
[0057]
本发明是基于申请人对毛白杨植物的持续性研究成果,课题组持续研究过程中证实杨树中yabby家族成员在毛白杨中存在组织特异性表达,并在雌雄花芽发育过程中表达变化明显,进而推测yab3亚类成员ptyabby7可能在毛白杨雌雄花发育过程中发挥重要作
用。为了进一步探究ptyabby7在杨树花发育过程中的调控作用,课题组针对“花特征基因”ino亚类成员ptyabby7开展分析,初步阐释该基因功能。本发明能够为构建完整的开花分子调控网络提供参考,并为其他多年生木本植物的相关研究提供借鉴。
[0058]
本实施例具体试验方案如下。
[0059]
1试验材料
[0060]
1.1植物材料
[0061]
本实施例所用试验材料毛白杨雌株定植于北京市海淀区中科院半导体研究所,雄株定植于北京市海淀区小月河流域,毛白杨无菌组培苗(tc1521)取自北京林业大学林木育种国家工程实验室。毛白杨花芽发育过程分为8个时期:时期1.成花诱导期;时期2.花原基形成期;时期3.器官发生期;时期4.伸长期;时期5.孢子形成期;时期6、7.休眠期;时期8.小孢子发生期。分别取毛白杨成熟叶片、八个发育关键时期的雌雄花芽及毛白杨无菌组培苗的根、茎、叶为组织定量材料,迅速放入液氮中,存于-80℃超低温冰箱用于后续rna提取。
[0062]
拟南芥(a.thaliana(col))种子(本实验室保存)。
[0063]
1.2引物
[0064]
ptyabby7克隆引物序列经primer3web(4.1.0)(https://bioinfo.ut.ee/primer3/)设计好后送于北京睿博兴科生物技术有限公司合成。克隆引物目的基因序列见seq id no.3和seq id no.4,含酶切位点的克隆引物基因序列见seq id no.5和seq id no.6,如下表1所示。
[0065]
另内源基因荧光定量引物详见表2;序列依次见seq id no.7和seq id no.22。
[0066]
表1杨树ptyabby7基因克隆引物
[0067][0068]
注a:划线部分为酶切位点。
[0069]
表2yabby基因家族荧光定量引物
[0070][0071]
2试验方法
[0072]
2.1毛白杨ptyabby7基因的扩增和序列分析
[0073]
以2.6中所提取的毛白杨叶片的第一链cdna稀释产物为dna模板进行pcr扩增。扩增引物见表1,克隆反应体系为20μl,包含10μl taq酶(takara rr02mq),0.5μl上、下游引物,2μl dna模板和7μl ddh2o。反应条件为98℃预变性3min,98℃变性30s,57℃退火30s,72℃延伸40s,共进行34个循环,最后在72℃延伸5min,4℃保存。pcr产物经1.2%的琼脂糖凝胶电泳分离后,用干净刀片切下目的片段,用dna凝胶回收试剂盒(浙江易思得dr0101050)纯化,将纯化产物与-t easy载体连接,4℃过夜。选取单菌落进行pcr分子检测,大肠杆菌阳性克隆委托北京睿博兴科生物技术有限公司进行测定。
[0074]
2.2杨树ptyabby蛋白多序列比对和系统进化分析
[0075]
从phytozome v13公共数据平台中获取拟南芥、番茄、葡萄和水稻等物种中已鉴定出的yabby家族蛋白序列。利用mega(v10.2.2)对多个物种的yabby蛋白序列进行muscle比对,并构建无根系统发育树探究其亲缘关系(系统发育树参数设置:neighbor-joining(nj)算法,poisson模型,complete deletion模式,bootstrap值取1000)。
[0076]
2.3杨树ptyabby家族基因结构与保守基序分析
[0077]
使用tbtools(v1.082)对杨树全基因组数据和相关注释信息进行分析绘制基因结构图;通过在线网站meme(http://meme-suite.org/tools/meme)分析ptyabby蛋白的氨基酸序列预测其motif数量及分布。
[0078]
2.4蛋白结构预测分析
[0079]
通过在线软件sopma(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构;swiss-model(http://swissmodel.expasy.org/)预测氨基酸序列的三级结构。
[0080]
2.5基因表达模式分析
[0081]
用液氮研磨1.1所述植物材料,采用改良的ctab法提取毛白杨器官的总rna(chang et al.,1993),利用nanodrop 2000分光光度计(thermo scientific,usa)测定所提取的
rna浓度,通过琼脂糖凝胶电泳检测rna完整性。利用transscript all-in-one first-strand cdna synthesis supermix for qpcr试剂盒将待测rna逆转录成cdna。逆转录完毕后加入90μl无核酸酶水储存在-20℃冰箱备用。对ptyabbys基因在毛白杨雌雄花芽和根茎叶等组织部位进行荧光定量pcr检测。pcr反应程序设置为:94℃30s;94℃5s,60℃30s,45个循环。循环结束后利用熔解曲线检测产物特异性:从60℃缓慢升温至97℃,每1℃采集5次荧光信号。以毛白杨ptactin基因作为内参进行检测,设置三次生物学重复、技术重复,采用2-δct
法计算表达量。
[0082]
2.6基因的过表达载体构建
[0083]
使用高纯度质粒dna小提试剂盒提取测定序列无误的ptyabby7菌液质粒,利用限制性内切酶bsteii-hf和ncol-hf将pcambia1301(本实验室保存)载体质粒进行双酶切。酶切体系设置详见表3,反应条件为37℃,30min,反应结束后用dna凝胶回收试剂盒回收载体,并通过凝胶电泳进行检测。使用ⅱone step cloning kit进行载体连接,获得pcambia1301-ptyabby7过表达载体,将重组体导入农杆菌gv3101中用于后续侵染。
[0084]
表3酶切体系
[0085][0086]
2.7野生型拟南芥培养与侵染
[0087]
选取适量拟南芥种子去除杂物置于干净离心管中,在无菌环境下加入无菌蒸馏水,加入1/50体积的次氯酸钠溶液混匀,上下反复摇晃10-15min,种子消毒后用无菌蒸馏水清洗4-5次;而后将种子平铺于1/2ms固体培养基上,置于冰箱中4℃低温培养3天后转移到光照培养箱中培养大约一周左右,将幼苗完整移栽到培养土(灭菌后的基质土、蛭石混合物)中,置于光照培养箱中生长。培养箱设置:长日照(16/8h)22℃,相对含水量70%。采用浸花法转化拟南芥植株,拟南芥抽薹后长出3-4片茎生叶时,所有植株同步去除顶端,解除顶端优势促使侧枝生长,待植株生长至含有大量未开放的花芽时进行农杆菌侵染。用侵染液浸泡未开放花芽15s左右,侵染后将植株置于暗环境中3天左右,提高转化效率。
[0088]
2.8转基因拟南芥的筛选和鉴定
[0089]
t0代种子用上述方法消毒后平铺至包含30mg/l潮霉素的1/2ms固态培养基上,能够正常生长的植株即视为筛选出的转基因植株,抗性植株通过提取dna作为模板进行pcr扩增完成分子验证,凝胶电泳检测是否产生目的条带。t2代转基因株系用于后续表型观察和功能分析。
[0090]
2.9拟南芥内源基因表达分析
[0091]
用液氮研磨转基因和野生型拟南芥叶片,通过试剂盒提取总rna,反转录后使用荧光定量试剂盒steponeplus real-time pcr system测定表达水平。pcr反应程序设置为:94
℃30s;94℃5s,60℃30s,45个循环。循环结束后利用熔解曲线检测产物特异性:从60℃缓慢升温至97℃,每1℃采集5次荧光信号。以拟南芥atactin基因作为内参进行检测,设置三次技术重复,采用2-δct
法计算表达量。
[0092]
2.10转基因拟南芥的表型观察
[0093]
在野生型和转基因拟南芥生长过程中实时记录对比观察植株露白时间和叶片数量等,并采集叶片用于后续定量表达分析,荧光定量引物详见(表2)。利用游标卡尺对转基因和野生型拟南芥30日龄幼苗的叶片长度和叶片宽度进行测量。使用spss(20.0.0)软件进行anova分析,并获得均值、标准差等数值。采用originpro 2021b(9.8.5.212)绘制图表。
[0094]
3试验结果
[0095]
3.1ptyabby7基因的克隆和序列分析
[0096]
经电泳检测,所提取的rna条带清晰完整,没有发生降解,质量符合实验要求。使用毛白杨cdna为模板克隆ptyabby7基因,其克隆电泳图如图1所示,图1中,m代表dl2000marker;1代表ptyabby7。目的片段测序后获得654bp的编码序列,如序列表seq id no.1所示;编码216个氨基酸,如序列表seq id no.2所示。序列比对结果(图2)表明克隆所得序列在n端存在完整的c2c2锌指结构,c端存在yabby结构域,属于yabby家族(cl04677)。此外,系统进化分析表明ptyabby7与拟南芥atino处于同一分支,属于ino亚家族成员(图3)。
[0097]
3.2ptyabby7基因表达模式分析
[0098]
3.1杨树yabby转录因子在雌雄花芽和营养器官中表达模式分析
[0099]
课题组分析了ptyabby7在杨树根、茎、幼叶、成熟叶片等营养器官以及雌雄花芽发育的8个时期中的表达模式,具体结果如图4所示。图4中,s1:成花诱导期;s2:花原基形成期;s3:器官发生期;s4:伸长期;s5:孢子形成期;s6&s7:休眠期;s8:小孢子发生期;root:根系;stem:茎;yl:幼叶;ml:成熟叶片。ino亚类基因ptyabby7在营养组织中表达极低,在毛白杨花芽发育过程中特异表达,ptyabby7主要在雌花芽发育过程中表达,且表达变化明显,具体如下:表达水平在s4-5和s7-8下调,在s2-4和s5-7上调;在雄花芽发育过程中,ptyabby7几乎不表达,表达水平极低。试验表明,花器官发育基因ptyabby7在雌花芽发育s4(伸长期)和s7(休眠期)表达水平较高,在雄花芽中表达较低。为了验证杨树中ino亚类基因的功能,课题组克隆了ptyabby7基因,并构建表达载体,转入拟南芥中以观察后代表型。
[0100]
3.3ptyabby7基因功能验证
[0101]
3.3.1转基因拟南芥的鉴定
[0102]
分别采集野生型和转基因35s::ptyabby7拟南芥叶片,提取dna作为模板进行pcr检测,检测结果如图5所示,图5中,m代表dl2000 marker;wt代表野生型拟南芥;oe代表35s::ptyabby7植株。野生型植株无目的条带,成功转入外源基因的转基因株系有目的条带。
[0103]
3.3.2转基因拟南芥整体植株观察及叶片差异分析
[0104]
通过对野生型拟南芥和35s::ptyabby7植株的对比观察发现(图6),ptyabby7过表达影响拟南芥的开花时间和叶片形态。图6中a为野生型拟南芥与35s::ptyabby7拟南芥整株对比图(花期),左侧为野生型植株,右侧为转基因植株;b为野生型拟南芥与35s::ptyabby7拟南芥花序对比图,左侧为野生型植株,右侧为转基因植株;c、d均为野生型拟南芥与35s::ptyabby7拟南芥长角果对比图,左侧为野生型植株,右侧为转基因植株;e为野生
型拟南芥与35s::ptyabby7拟南芥花器官对比图,左侧为野生型植株,右侧为转基因植株;f、g均为野生型拟南芥与35s::ptyabby7拟南芥整株对比图(莲座叶),左侧为野生型植株,右侧为转基因植株;h开花时间统计分析;i莲座叶数量统计分析;j茎生叶数量统计分析。35s::ptyabby7植株开花时间出现不同程度的延迟,其中四个株系的开花时间与野生型植株差异显著(图6h),具体如下:野生型拟南芥开花时间为30.10
±
1.37;转基因株系的开花时间分别为33.91
±
2.36、34.1832
±
2.47、33.57
±
1.96、31.53
±
2.57和33.04
±
2.68。此外,转基因植株叶片颜色加深、变皱,叶片较窄并且向下卷曲(图6f和图6g)。另外,图6i和图6j分别为莲座叶和茎生叶数量统计分析,部分植株莲座叶数量与开花时间成正相关,开花越晚,莲座叶数量有所增加。由图6a和图6b可知,35s::ptyabby7植株的花序与野生型一致,均为无限花序。花器官发育正常,雄蕊、雌蕊和花被的数量和表型均无明显变化(图6e),同时长角果表型与野生型一致,果荚饱满,结实率无明显差异(图6c和图6d)。
[0105]
图7是拟南芥野生型与转基因株系的统计分析,其中,a野生型和转基因拟南芥的叶片正面对比;b叶片长度统计分析;c野生型和转基因拟南芥的叶片背面对比;d叶片宽度统计分析。ptyabby7对拟南芥叶片产生不同程度的影响,如图7a和图7c中株系oe9-2叶片较株系oe8-5叶片颜色深、卷曲程度更严重。另外,为了进一步对转基因植株的叶片形态进行分析(图7),课题组测定了拟南芥叶片的长度和宽度(图7b和图7d),结果表明转基因植株的叶片较野生型小,其长度和宽度均小于野生型。具体表现为:转基因植株叶片长度平均值为20.74
±
0.69mm,宽度平均值为4.65
±
0.18mm,野生型植株叶片长度平均值为30.57
±
0.80mm,宽度平均值为9.52
±
0.27mm。
[0106]
3.3.3转基因拟南芥中与开花时间和叶片形态相关基因的表达分析
[0107]
通过3.3.2对ptyabby7转基因拟南芥植株的对比观察发现,ptyabby7基因过表达导致拟南芥在多方面产生不同于野生型的表型:开花时间延迟,叶片较小且向下卷曲。为了进一步研究这些表型产生的原因,在分子水平上探究ptyabby7基因的潜在功能,课题组以拟南芥野生型和过表达植株的叶片为试验材料,提取rna,反转录后获得dna模板,探究拟南芥部分内源基因的表达模式。分别选取与叶片极性和开花时间相关的基因进行实时荧光定量分析(图8)。结果表明ptyabby7仅在转基因植株中表达。另35s::ptyabby7植株中控制叶片远轴特征形成的atfil(filamentous flower)和atkan(kanadi)基因表达上调,参与控制叶片近轴生长发育的基因atrev(revoluta)和atphv(phavoluta)表达下调,与叶片背面轴化,向下卷曲的现象一致。此外,atft基因极显著下调,抑制植株开花,与开花延迟一致,因而ptyabby7基因可通过调控以上基因表达,影响植株表型变化,在植株生长发育过程中扮演重要角色。
[0108]
本发明进行关键基因ptyabby7功能验证,研究结果反映了ptyabby7基因对毛白杨花、叶等侧生器官发育过程的具有明显的调控作用,并为其他木本植物的相关研究提供参考,同时为解决杨树春季飞絮散粉问题提供重要候选基因。
[0109]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1