一种吡咯酯类化合物的制备方法
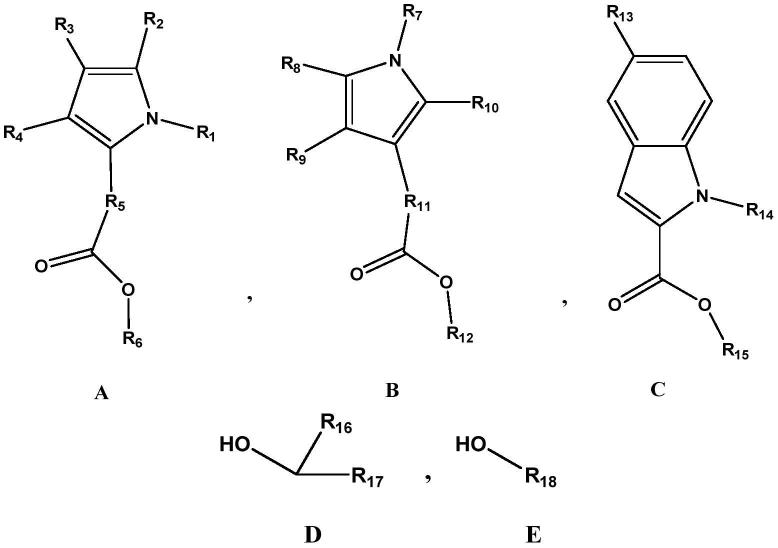
cl或-br;r5为单键或亚甲基;r6为甲基或乙基;
8.式b中,r7为氢、c
1-c
10
烷基、苄基或吡啶基;r8、r9、r
10
独立地选自氢、c
1-c3烷基、-f、-cl或-br;r
11
为单键或亚甲基;r
12
为甲基或乙基;
9.式c中,r
13
为-f、-cl或-br;r
14
为氢、甲基或乙基;r
15
为甲基或乙基;
10.式d中,r
16
为甲基、乙基、丙基或苯基;r
17
为苯基;
11.式e中,r
18
为c
1-c
10
烷基、c
1-c
10
烯基、c
1-c5羟烷基、c
3-c6环烷基、c
3-c6环烷基甲基、被1~2个c
1-c3烷基取代的c
3-c6环烷基、被萘基取代的c
1-c3烷基、被吡嗪基取代的c
1-c3烷基、被吡啶基取代的c
1-c3烷基、被噻吩基取代的c
1-c3烷基、被呋喃基取代的c
1-c3烷基、被3,4-亚甲二氧基苯基取代的c
1-c3烷基或式f所示的基团;
[0012][0013]
式f中,r
19
为亚甲基、亚乙基或亚丙烯基;r
20
为氢、-f、-cl、-br、c
1-c5烷基、c
1-c5烷氧基、苯基或c
1-c5氟代烷基。
[0014]
本发明的吡咯酯类化合物的制备方法,将吡咯甲酯或乙酯类化合物与醇类化合物进行酯交换反应,得到吡咯酯类化合物。本发明的吡咯酯类化合物的制备方法不需要惰性气体保护,可避免使用复杂催化剂,操作方便,条件温和,成本低廉,简洁绿色高效,适合推广应用,并且制备的吡咯酯类化合物具有较高的收率。
[0015]
本发明中,“烷基”是指衍生自饱和烷烃的具有一个键合位点的基团;“烯基”是指衍生自烯烃的具有一个键合位点的基团;“羟烷基”是指基团ho-烷基-;“烷氧基”是指基团r-o-烷基-;“环烷基”是指衍生自以下化合物的具有一个键合位点的基团:环丙烷、环丁烷、环己烷、环戊烷。
[0016]
本发明中,基团结构式中的波浪线表示连接位置,例如,式e中,当r
18
为被吡嗪基取代的c
1-c3烷基基团时,基团中的波浪线表示被吡嗪基取代的c
1-c3烷基通过波浪线所在的碳原子与羟基连接。
[0017]
优选地,式a中,所述c
1-c
10
烷基为甲基、正丙基、正丁基、正戊基或异戊基。例如,式a所示的化合物为1-甲基-2-吡咯甲酸甲酯、1-丙基-2-吡咯甲酸甲酯、1-丁基-2-吡咯甲酸甲酯、1-丁基-2-吡咯甲酸乙酯、1-戊基-2-吡咯甲酸甲酯或1-异戊基-2-吡咯甲酸甲酯。
[0018]
优选地,式a中,r2、r3和r4均为氢或者r2、r3和r4中有两个为氢,一个为甲基、-f、-cl或-br。
[0019]
优选地,式a中,所述吡啶基为
[0020]
优选地,式a中,r2和r4均为氢,r3为-br;或者r2和r3均为氢,r4为-f;或者r2为甲基,r3和r4均为氢;或者r2和r4均为甲基,r3为氢;或者r2、r3和r4均为氢。例如,式a所示的化合物为4-溴-1-甲基-2-吡咯甲酸甲酯、3-氟-吡咯甲酸乙酯、5-甲基-2-吡咯甲酸乙酯、3,5-二甲基-2-甲酸甲酯吡咯、1-甲基-2-吡咯甲酸甲酯、1-甲基-2-吡咯乙酸甲酯、2-吡咯甲酸甲酯、
2-吡咯甲酸乙酯、2-吡咯乙酸甲酯或2-吡咯乙酸乙酯。
[0021]
优选地,式b中,r7、r8、r9和r
10
均为氢。优选地,式b中,r
11
为单键。优选地,式b中,r
12
为甲基。例如,式b所述的化合物为3-吡咯甲酸甲酯。
[0022]
优选地,式e中,所述被1~2个c
1-c3烷基取代的c
3-c6环烷基为被1~2个c
1-c3烷基取代的环己基;所述被萘基取代的c
1-c3烷基为被萘基取代的甲基;所述被吡嗪基取代的c
1-c3烷基为被吡嗪基取代的甲基;所述被吡啶基取代的c
1-c3烷基为被吡啶基取代的甲基;所述被噻吩基取代的c
1-c3烷基为被噻吩基取代的甲基;所述被呋喃基取代的c
1-c3烷基为被呋喃基取代的甲基;所述被3,4-亚甲二氧基苯基取代的c
1-c3烷基为被3,4-亚甲二氧基苯基取代的甲基。优选地,式e中,所述1~2个c
1-c3烷基选自甲基、异丙基。优选地,被1~2个c
1-c3烷基取代的环己基中,c
1-c3烷基位于环己基的邻位和/或间位。例如,式e所示的化合物为薄荷醇。
[0023]
优选地,式e中,所述c
1-c
10
烷基为甲基、丙基、异丙基、正丁基、异丁基、正戊基或正辛基;所述c
1-c
10
烯基为异丁烯基或3,7-二甲基-6-辛烯基;所述c
1-c5羟烷基为羟丙基;所述c
3-c6环烷基为环己基;所述c
3-c6环烷基甲基为环己基甲基或环丙基甲基;
[0024]
所述被1~2个c
1-c3烷基取代的c
3-c6环烷基为所述被萘基取代的c
1-c3烷基为所述被吡嗪基取代的c
1-c3烷基为所述被吡啶基取代的c
1-c3烷基为所述被噻吩基取代的c
1-c3烷基为所述被呋喃基取代的c
1-c3烷基为所述被3,4-亚甲二氧基苯基取代的c
1-c3烷基为式f中,所述c
1-c5烷氧基为甲氧基;所述c
1-c5氟代烷基为三氟甲基。例如,式e所示的化合物为正丁醇、异丁醇、正戊醇、正辛醇、甲代烯丙基醇、香茅醇、1,3-丙二醇、环己醇、环己基甲醇、环丙甲醇、薄荷醇、2-萘甲醇、糠醇、2-噻吩甲醇、3-吡啶甲醇、2-羟甲基吡嗪、苯甲醇、苯乙醇、肉桂醇、4-甲基苄醇、3-氯苄醇、3-氟苄醇、3-溴苄醇、4-溴苄醇、4-联苯甲醇、邻甲基苄醇、对氟苄醇、4-异丙基苄醇、4-氯苄醇、4-乙基苄醇或3-甲基苄醇。
[0025]
优选地,所述式a、式b或式c所示的化合物与醇类化合物的摩尔比为(2~3):(1~2)。
[0026]
优选地,r1为氢或r1为甲基且r6为甲基,所述式a所示的化合物与醇类化合物的摩尔比为2:1;
[0027]
或者r1为甲基,r6为乙基,所述式a所示的化合物与醇类化合物的摩尔比为3:2;
[0028]
或者r1为甲基,r2和r4均为氢,r3为-br,所述式a所示的化合物与醇类化合物的摩尔比为3:2;
[0029]
或者r1为正丙基、正丁基、正戊基、异戊基、苄基或吡啶基,所述式a所示的化合物与醇类化合物的摩尔比为3:2。
[0030]
优选地,所述式b所示的化合物与醇类化合物的摩尔比为2:1。优选地,r
14
为氢,所
述式c所示的化合物与醇类化合物的摩尔比为2:1;或者r
14
为甲基,所述式c所示的化合物与醇类化合物的摩尔比为3:2。
[0031]
优选地,所述醇类化合物和催化剂的摩尔比为1:(0.5~2)。例如,所述醇类化合物和催化剂的摩尔比为1:1。优选地,所述酯交换反应的温度为120~150℃,酯交换反应的时间为24h。例如,所述酯交换反应的温度为140℃,酯交换反应的时间为24h。优选地,所述酯交换反应采用的溶剂为甲苯或1,4-二氧六环。优选地,所述酯交换反应在schlenk管中进行。
[0032]
优选地,所述酯交换反应的方法包括以下步骤:将式a、式b或式c所示的化合物、醇类化合物、溶剂和催化剂组成的混合物加热至酯交换反应所需温度,至反应完全。
[0033]
进一步优选地,所述酯交换反应的方法包括以下步骤:将式a、式b或式c所示的化合物、醇类化合物、溶剂和催化剂组成的混合物在空气气氛下加热至酯交换反应所需温度,至反应完全。
[0034]
优选地,酯交换反应结束后,将酯交换反应后的体系进行浓缩,得到浓缩物,然后采用柱色谱分离对浓缩物提纯,得到吡咯酯类化合物。优选地,柱色谱分离采用的流动相由二氯甲烷和石油醚组成,所述二氯甲烷和石油醚的体积比为(3~8):1。例如,所述二氯甲烷和石油醚的体积比为7:1或5:1。
具体实施方式
[0035]
本发明实现了在无过渡金属、无配体、无复杂催化剂的空气条件下制备吡咯酯类化合物的简便有效方法,以经济易得的吡咯羧酸甲/乙酯类化合物和醇为原料,在碱的作用下,于有机溶剂中混合发生酯交换反应生成相应的吡咯酯类化合物,产物吡咯酯类化合物具有较高的应用价值,可用于香料、药物和农药等领域。
[0036]
吡咯羧酸甲/乙酯化合物的结构式可选自:
[0037][0038]
醇原料可选自:苄醇、2-甲基苄醇、3-甲基苄醇、3-氟苄醇、3-氯苄醇、3-溴苄醇、4-甲基苄醇、4-氟苄醇、4-氯苄醇、4-溴苄醇、4-异丙基苄醇、4-乙基苄醇、3,4-二甲氧基苄醇、4-甲氧基苄醇、4-联苯甲醇、3-(三氟甲基)苄醇、2-萘甲醇、3-吡啶甲醇、2-噻吩甲醇、2-呋喃甲醇、2-羟甲基吡嗪、环丙甲醇、环己甲醇、正丁醇、正戊醇、正辛醇、异丁醇、环己醇、1,3-丙二醇、r-(+)-1-苯乙醇、苯乙醇、甲代烯丙基醇、香茅醇、胡椒醇、薄荷醇、肉桂醇、二苯基甲醇、叶醇、香叶醇、橙花醇。
[0039]
该方法适用的底物范围广、适应性好,部分底物、催化剂等配合体系的反应收率接
近100%,具有非常卓越的应用效果。利用本方法可以简洁绿色高效的合成系列吡咯酯类化合物,从而有利于该类化合物的工业化生产。
[0040]
下面结合具体实施例对本发明的技术方案进行进一步说明。
[0041]
实施例1
[0042]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0043]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0044]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得39.8mg吡咯酯类化合物,收率为99%。
[0045]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸苄酯,结构式如式1所示:
[0046][0047]
对式1所示的化合物进行核磁分析,表征数据如下:
[0048]1h nmr(400mhz,cdcl3)δ9.29(s,1h),7.47
–
7.40(m,2h),7.40
–
7.35(m,2h),7.33(ddd,j=7.0,3.4,1.5hz,1h),7.00
–
6.95(m,1h),6.95
–
6.91(m,1h),6.26(dt,j=3.6,2.6hz,1h),5.31(s,2h);
13
c nmr(100mhz,cdcl3)δ161.01,136.18,128.59,128.23,128.18,123.11,122.59,115.67,110.54,66.01。
[0049]
实施例2
[0050]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0051]
(1)将0.4mmol 1-甲基-2-吡咯乙酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0052]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得32mg吡咯酯类化合物,收率为70%。
[0053]
本实施例制备得到的吡咯酯类化合物的化学名称为2-(1-甲基-1h-吡咯-2-基)乙酸苄酯,结构式如式2所示:
[0054][0055]
对式2所示的化合物进行核磁分析,表征数据如下:
[0056]1h nmr(400mhz,cdcl3)δ7.33(d,j=5.2hz,5h),6.58(s,1h),6.16
–
5.96(m,2h),
5.14(s,2h),3.66(s,2h),3.53(s,3h);
13
c nmr(100mhz,cdcl3)δ170.42,135.77,128.59,128.31,128.21,124.71,122.59,108.86,107.05,66.74,33.93,32.66。
[0057]
实施例3
[0058]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0059]
(1)将0.4mmol 1-甲基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0060]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得37mg吡咯酯类化合物,收率为86%。
[0061]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-甲基-1h-吡咯-2-基)甲酸苄酯,结构式如式3所示:
[0062][0063]
对式3所示的化合物进行核磁分析,表征数据如下:
[0064]1h nmr(400mhz,cdcl3)δ7.41(d,j=7.0hz,2h),7.39
–
7.34(m,2h),7.34
–
7.28(m,1h),7.00(dd,j=3.9,1.8hz,1h),6.78(t,j=1.9hz,1h),6.11(dd,j=3.9,2.5hz,1h),5.27(s,2h),3.92(s,3h);
13
c nmr(100mhz,cdcl3)δ161.06,136.58,129.69,128.53,128.02,127.93,122.34,118.15,107.92,65.42,36.86。
[0065]
实施例4
[0066]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0067]
(1)将0.3mmol 1-丙基-2-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0068]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得24mg吡咯酯类化合物,收率为49%。
[0069]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-丙基-1h-吡咯-2-基)甲酸苄酯,结构式如式4所示:
[0070][0071]
对式4所示的化合物进行核磁分析,表征数据如下:
[0072]1h nmr(400mhz,cdcl3)δ7.41(d,j=7.1hz,2h),7.37(t,j=7.2hz,2h),7.34
–
7.28(m,1h),7.02(d,j=2.2hz,1h),6.84(s,1h),6.14
–
6.08(m,1h),5.27(s,2h),4.26(t,j=
7.2hz,2h),1.87
–
1.68(m,2h),0.88(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ160.81,136.58,128.96,128.52,127.99,127.91,121.48,118.51,107.81,65.38,50.83,24.85,11.09。
[0073]
实施例5
[0074]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0075]
(1)将0.4mmol 2-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0076]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得20mg吡咯酯类化合物,收率为50%。
[0077]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸苄酯,结构式如式5所示:
[0078][0079]
对式5所示的化合物进行核磁分析,表征数据如下:
[0080]1h nmr(400mhz,cdcl3)δ9.29(s,1h),7.47
–
7.40(m,2h),7.40
–
7.35(m,2h),7.33(ddd,j=7.0,3.4,1.5hz,1h),7.00
–
6.95(m,1h),6.95
–
6.91(m,1h),6.26(dt,j=3.6,2.6hz,1h),5.31(s,2h);
13
c nmr(100mhz,cdcl3)δ161.01,136.18,128.59,128.23,128.18,123.11,122.59,115.67,110.54,66.01。
[0081]
实施例6
[0082]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0083]
(1)将0.4mmol 1-甲基-2-吡咯甲酸甲酯、0.2mmol 4-甲氧基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0084]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得34.3mg吡咯酯类化合物,收率为70%。
[0085]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-甲基-1h-吡咯-2-基)甲酸对甲氧基苄酯,结构式如式6所示:
[0086]
[0087]
对式6所示的化合物进行核磁分析,表征数据如下:
[0088]1h nmr(400mhz,cdcl3)δ7.35(d,j=8.5hz,2h),6.96(dd,j=3.6,1.4hz,1h),6.89(d,j=8.5hz,2h),6.77(s,1h),6.15
–
6.04(m,1h),5.20(s,2h),3.91(s,3h),3.80(s,3h);
13
c nmr(100mhz,cdcl3)δ161.16,159.49,129.82,129.58,128.66,122.46,118.06,113.91,107.86,65.28,55.29,36.85。
[0089]
实施例7
[0090]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0091]
(1)将0.4mmol 3,5-二甲基-2-甲酸甲酯吡咯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0092]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得42mg吡咯酯类化合物,收率为92%。
[0093]
本实施例制备得到的吡咯酯类化合物的化学名称为(3,5-二甲基-1h-吡咯-2-基)甲酸苄酯,结构式如式7所示:
[0094][0095]
对式7所示的化合物进行核磁分析,表征数据如下:
[0096]1h nmr(400mhz,cdcl3)δ8.89(s,1h),7.41(d,j=7.0hz,2h),7.37(dd,j=11.2,4.4hz,2h),7.34
–
7.28(m,1h),5.80(d,j=2.6hz,1h),5.29(s,2h),2.32(s,3h),2.22(s,3h);
13
c nmr(100mhz,cdcl3)δ161.46,136.62,132.95,129.65,128.56,128.04,128.03,117.41,111.53,65.51,13.08,13.00。
[0097]
实施例8
[0098]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0099]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-甲基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0100]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得34.3mg吡咯酯类化合物,收率为80%。
[0101]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对甲基苄酯,结构式如式8所示:
[0102][0103]
对式8所示的化合物进行核磁分析,表征数据如下:
[0104]1h nmr(400mhz,cdcl3)δ9.36(s,1h),7.31(d,j=8.0hz,2h),7.17(d,j=7.9hz,2h),6.95(ddd,j=3.8,2.4,1.5hz,1h),6.93
–
6.89(m,1h),6.24(dt,j=3.7,2.6hz,1h),5.26(s,2h),2.35(s,3h);
13
c nmr(100mhz,cdcl3)δ161.15,138.10,133.16,129.27,128.39,123.12,122.65,115.64,110.47,66.02,21.24。
[0105]
实施例9
[0106]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0107]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-氯苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0108]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得33mg吡咯酯类化合物,收率为70%。
[0109]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸间氯苄酯,结构式如式9所示:
[0110][0111]
对式9所示的化合物进行核磁分析,表征数据如下:
[0112]1h nmr(400mhz,cdcl3)δ9.42(s,1h),7.41(s,1h),7.34
–
7.26(m,3h),7.03
–
6.97(m,1h),6.97
–
6.85(m,1h),6.27(dt,j=3.6,2.6hz,1h),5.27(s,2h);
13
c nmr(100mhz,cdcl3)δ160.92,138.20,134.46,129.89,128.37,128.11,126.11,123.50,122.24,115.94,110.63,65.09。
[0113]
实施例10
[0114]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0115]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-氟苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0116]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得26.7mg吡咯酯类化合物,收率为61%。
[0117]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸间氟苄酯,结构式如式10所示:
[0118][0119]
对式10所示的化合物进行核磁分析,表征数据如下:
[0120]1h nmr(400mhz,cdcl3)δ7.57(dd,j=8.1,1.0hz,2h),7.54
–
7.49(m,2h),7.42(t,j=7.6hz,2h),7.32(dd,j=7.6,5.6hz,3h),6.96(dd,j=4.1,1.6hz,1h),6.82
–
6.76(m,1h),6.11(dd,j=4.1,2.5hz,1h),3.95(s,3h),3.14(ddd,j=6.6,5.8,1.8hz,2h),3.09
–
3.02(m,2h);
13
c nmr(100mhz,cdcl3)δ164.10,161.23(d,j=82.2hz),138.68(d,j=8.0hz),130.15(d,j=7.0hz),123.45(d,j=2.0hz),122.30,119.60(d,j=750.6hz),115.20,114.99,114.85(d,j=21.7hz),110.64,65.09(d,j=2.0hz)。
[0121]
实施例11
[0122]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0123]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-溴苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0124]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得33.3mg吡咯酯类化合物,收率为60%。
[0125]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸间溴苄酯,结构式如式11所示:
[0126][0127][0128]
对式11所示的化合物进行核磁分析,表征数据如下:
[0129]1h nmr(400mhz,cdcl3)δ9.32(s,1h),7.57(s,1h),7.46(d,j=7.9hz,1h),7.34(d,j=7.7hz,1h),7.25(d,j=8.3hz,1h),6.98(ddt,j=4.2,2.7,1.4hz,2h),6.28(dt,j=3.6,2.6hz,1h),5.26(s,2h),1.57(d,j=6.6hz,1h);
13
c nmr(100mhz,cdcl3)δ160.78,143.44,143.12,142.43,138.46,131.30,131.04,130.16,126.61,123.37,122.61,122.27,115.90,110.64,64.99.。
[0130]
实施例12
[0131]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0132]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-溴苄醇、0.2mmol叔丁醇钾和1ml甲苯
混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0133]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得36mg吡咯酯类化合物,收率为65%。
[0134]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对溴苄酯,结构式如式12所示:
[0135][0136]
对式12所示的化合物进行核磁分析,表征数据如下:
[0137]1h nmr(400mhz,cdcl3)δ9.33(s,1h),7.53
–
7.44(m,2h),7.29(d,j=8.4hz,2h),6.96(dd,j=3.2,2.0hz,2h),6.27(dd,j=6.2,2.7hz,1h),5.25(s,2h);
13
c nmr(100mhz,cdcl3)δ160.89,135.21,131.73,129.82,123.35,122.32,122.25,115.82,110.62,65.20。
[0138]
实施例13
[0139]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0140]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-联苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0141]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得33mg吡咯酯类化合物,收率为60%。
[0142]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-4-联苯苄酯,结构式如式13所示:
[0143][0144]
对式13所示的化合物进行核磁分析,表征数据如下:
[0145]1h nmr(400mhz,cdcl3)δ9.37(s,1h),7.64
–
7.53(m,4h),7.48(d,j=8.2hz,2h),7.44(dd,j=10.3,4.8hz,2h),7.39
–
7.30(m,1h),6.99(ddd,j=3.8,2.4,1.5hz,1h),6.96
–
6.90(m,1h),6.26(dt,j=3.7,2.6hz,1h),5.34(s,2h);
13
c nmr(100mhz,cdcl3)δ161.10,141.24,140.72,135.20,128.85,128.70,127.48,127.37,127.17,123.23,122.58,115.77,110.57,65.80。
[0146]
实施例14
[0147]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0148]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-(三氟甲基)苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0149]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得43mg吡咯酯类化合物,收率为80%。
[0150]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-3-三氟甲基苄酯,结构式如式14所示:
[0151][0152]
对式14所示的化合物进行核磁分析,表征数据如下:
[0153]1h nmr(400mhz,cdcl3)δ7.20
–
7.13(m,4h),6.94(dd,j=4.1,1.6hz,1h),6.81
–
6.77(m,1h),6.10(dd,j=4.1,2.5hz,1h),3.95(s,3h),3.13
–
3.06(m,2h),3.02
–
2.93(m,2h),2.88(dt,j=13.8,6.9hz,1h),1.24(d,j=6.9hz,6h);
13
c nmr(101mhz,cdcl3)δ160.83,137.20,131.36,130.00(dd,j=32.1,64.4hz),129.11,125.03(dd,j=37.6,75.0hz),124.79(dd,j=36.6,73.7hz),123.98(dd,j=270.57,541.33hz),123.49,122.18,115.95,110.67,65.10。
[0154]
实施例15
[0155]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0156]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol邻甲基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0157]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得41mg吡咯酯类化合物,收率为95%。
[0158]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸邻甲基苄酯,结构式如式15所示:
[0159][0160]
对式15所示的化合物进行核磁分析,表征数据如下:
[0161]1h nmr(400mhz,cdcl3)δ9.31(s,1h),7.43
–
7.33(m,1h),7.30
–
7.23(m,1h),7.23
–
7.17(m,2h),6.94(ddt,j=6.8,2.7,1.4hz,2h),6.25(dt,j=3.7,2.6hz,1h),5.31(s,2h),
2.39(s,3h);
13
c nmr(100mhz,cdcl3)δ161.09,137.09,134.08,130.41,129.25,128.55,126.04,123.13,122.58,115.62,110.51,64.57,19.00。
[0162]
实施例16
[0163]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0164]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol对氟苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0165]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得33mg吡咯酯类化合物,收率为75%。
[0166]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对氟苄酯,结构式如式16所示:
[0167][0168]
对式16所示的化合物进行核磁分析,表征数据如下:
[0169]1h nmr(400mhz,cdcl3)δ7.21
–
7.15(m,2h),7.13(d,j=8.2hz,2h),6.94(dd,j=4.1,1.7hz,1h),6.79(t,j=1.9hz,1h),6.11(dd,j=4.1,2.5hz,1h),3.95(s,3h),3.12
–
3.06(m,2h),3.03
–
2.93(m,2h),2.62(q,j=7.6hz,2h),1.22(t,j=7.6hz,3h);
13
c nmr(100mhz,cdcl3)δ163.88,161.43,161.02,130.22,130.14,127.24(d,j=956.2hz),123.70(d,j=1660.5hz).123.30,115.75,115.61,110.57,65.31。
[0170]
实施例17
[0171]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0172]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-异丙基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0173]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得34mg吡咯酯类化合物,收率为70%。
[0174]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对异丙基苄酯,结构式如式17所示:
[0175]
[0176]
对式17所示的化合物进行核磁分析,表征数据如下:
[0177]1h nmr(400mhz,cdcl3)δ9.34(s,1h),7.35(d,j=8.1hz,2h),7.23(d,j=8.1hz,2h),6.96(ddd,j=3.8,2.4,1.5hz,1h),6.92(td,j=2.7,1.5hz,1h),6.25(dt,j=3.7,2.6hz,1h),5.27(s,2h),2.91(dt,j=13.8,6.9hz,1h),1.25(d,j=6.9hz,6h);
13
c nmr(100mhz,cdcl3)δ161.13,149.06,133.54,128.43,126.66,123.07,122.67,115.64,110.47,66.00,33.92,23.98。
[0178]
实施例18
[0179]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0180]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-氯苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0181]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得34mg吡咯酯类化合物,收率为72%。
[0182]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对氯苄酯,结构式如式18所示:
[0183][0184]
对式18所示的化合物进行核磁分析,表征数据如下:
[0185]1h nmr(400mhz,cdcl3)δ9.41(s,1h),7.44
–
7.28(m,4h),6.96(dtd,j=6.9,2.5,1.4hz,2h),6.26(dt,j=3.7,2.6hz,1h),5.26(s,2h);
13
c nmr(100mhz,cdcl3)δ161.01,134.70,134.11,129.54,128.77,123.45,122.32,115.86,110.60,65.20。
[0186]
实施例19
[0187]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0188]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-乙基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0189]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得32.5mg吡咯酯类化合物,收率为71%。
[0190]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对乙基苄酯,结构式如式19所示:
[0191][0192]
对式19所示的化合物进行核磁分析,表征数据如下:
[0193]1h nmr(400mhz,cdcl3)δ9.28(s,1h),7.34(d,j=8.1hz,2h),7.20(d,j=8.1hz,2h),6.96(ddd,j=3.8,2.4,1.5hz,1h),6.93(td,j=2.7,1.5hz,1h),6.25(dt,j=3.7,2.6hz,1h),5.27(s,2h),2.65(q,j=7.6hz,2h),1.23(t,j=7.6hz,3h);
13
c nmr(100mhz,cdcl3)δ161.10,144.45,133.40,128.45,128.09,123.05,122.68,115.62,110.48,66.02,28.64,15.59。
[0194]
实施例20
[0195]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0196]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-甲基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0197]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得42.5mg吡咯酯类化合物,收率为99%。
[0198]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸间甲基苄酯,结构式如式20所示:
[0199][0200]
对式20所示的化合物进行核磁分析,表征数据如下:
[0201]1h nmr(400mhz,cdcl3)δ9.35(s,1h),7.30
–
7.23(m,1h),7.21(d,j=7.7hz,2h),7.14(d,j=7.3hz,1h),6.99
–
6.95(m,1h),6.95
–
6.91(m,1h),6.26(dt,j=3.6,2.6hz,1h),5.27(s,2h),2.36(s,3h);
13
c nmr(100mhz,cdcl3)δ161.11,138.29,136.10,129.00,128.94,128.50,125.28,123.14,122.62,115.68,110.49,66.09,21.40。
[0202]
实施例21
[0203]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0204]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 4-甲氧基苄醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0205]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得20.3mg吡咯酯类化合物,
收率为44%。
[0206]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸对甲氧基苄酯,结构式如式21所示:
[0207][0208]
对式21所示的化合物进行核磁分析,表征数据如下:
[0209]1h nmr(400mhz,cdcl3)δ9.17(s,1h),7.36(d,j=8.7hz,2h),6.99
–
6.92(m,2h),6.92
–
6.86(m,2h),6.25(dd,j=6.2,2.6hz,1h),5.24(s,2h),3.81(s,3h);
13
c nmr(100mhz,cdcl3)δ161.02,159.65,130.10,128.26,122.90,122.73,115.53,113.96,110.50,65.86,55.31。
[0210]
实施例22
[0211]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0212]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 2-萘甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0213]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得39mg吡咯酯类化合物,收率为78%。
[0214]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-2-萘甲酯,结构式如式22所示:
[0215][0216]
对式22所示的化合物进行核磁分析,表征数据如下:
[0217]1h nmr(400mhz,cdcl3)δ9.37(s,1h),7.92
–
7.76(m,4h),7.49(ddd,j=11.8,7.4,2.5hz,3h),7.03
–
6.96(m,1h),6.92(dd,j=4.0,2.6hz,1h),6.25(dt,j=3.6,2.5hz,1h),5.46(s,2h);
13
c nmr(100mhz,cdcl3)δ161.14,133.62,133.24,133.15,128.42,128.03,127.76,127.29,126.35,126.30,125.90,123.27,122.57,115.79,110.56,66.20。
[0218]
实施例23
[0219]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0220]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol二苯基甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0221]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得31mg吡咯酯类化合物,收率为56%。
[0222]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸二苯基甲酯,结构式如式23所示:
[0223][0224]
对式23所示的化合物进行核磁分析,表征数据如下:
[0225]1h nmr(400mhz,cdcl3)δ9.34(s,1h),7.44
–
7.38(m,4h),7.34(ddd,j=7.5,5.5,2.6hz,4h),7.31-7.25(m,2h),7.06(dd,j=3.1,2.1hz,2h),6.90(td,j=2.7,1.5hz,1h),6.27(dt,j=3.7,2.5hz,1h);
13
c nmr(100mhz,cdcl3)δ160.39,140.33,128.55,127.95,127.18,126.57,123.40,122.63,115.79,110.53,76.80。
[0226]
实施例24
[0227]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0228]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol环丙甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0229]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得30mg吡咯酯类化合物,收率为91%。
[0230]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸环丙基甲酯,结构式如式24所示:
[0231][0232]
对式24所示的化合物进行核磁分析,表征数据如下:
[0233]1h nmr(400mhz,cdcl3)δ9.46(s,1h),6.95(t,j=2.9hz,2h),6.27(dd,j=5.8,3.0hz,1h),4.10(d,j=7.2hz,2h),1.28
–
1.16(m,1h),0.64
–
0.54(m,2h),0.40
–
0.28(m,2h);
13
c nmr(100mhz,cdcl3)δ161.49,122.94,122.90,115.29,110.36,69.09,10.02,3.34。
[0234]
实施例25
[0235]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0236]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol肉桂醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应12h,反应结束后,冷却至室温,得到反应液。
[0237]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚
组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38mg吡咯酯类化合物,收率为84%。
[0238]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸肉桂酯,结构式如式25所示:
[0239][0240]
对式25所示的化合物进行核磁分析,表征数据如下:
[0241]1h nmr(400mhz,cdcl3)δ9.40(s,1h),7.45
–
7.37(m,2h),7.36
–
7.29(m,2h),7.25(ddd,j=7.2,3.5,1.5hz,1h),6.97(dtd,j=8.4,2.5,1.4hz,2h),6.70(d,j=15.9hz,1h),6.36(dt,j=15.9,6.4hz,1h),6.27(dt,j=3.6,2.6hz,1h),4.92(dd,j=6.4,1.2hz,2h);
13
c nmr(100mhz,cdcl3)δ161.09,136.26,134.17,128.65,128.10,126.67,123.43,123.20,122.62,115.61,110.52,64.91。
[0242]
实施例26
[0243]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0244]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol环己甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0245]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38mg吡咯酯类化合物,收率为92%。
[0246]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸环己甲酯,结构式如式26所示:
[0247][0248]
对式26所示的化合物进行核磁分析,表征数据如下:
[0249]1h nmr(400mhz,cdcl3)δ9.32(s,1h),6.95(td,j=2.7,1.5hz,1h),6.92(ddd,j=3.8,2.4,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),4.08(d,j=6.5hz,2h),1.87
–
1.63(m,6h),1.35
–
1.12(m,3h),1.11
–
0.95(m,2h);
13
c nmr(100mhz,cdcl3)δ161.43,123.00,122.77,115.08,110.36,69.40,37.34,29.72,26.39,25.70。
[0250]
实施例27
[0251]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0252]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol胡椒醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体
系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0253]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得24.5mg吡咯酯类化合物,收率为50%。
[0254]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸胡椒酯,结构式如式27所示:
[0255][0256]
对式27所示的化合物进行核磁分析,表征数据如下:
[0257]1h nmr(400mhz,cdcl3)δ9.18(s,1h),6.95(t,j=2.9hz,2h),6.91(t,j=2.3hz,1h),6.88(d,j=1.6hz,1h),6.79(d,j=7.8hz,1h),6.26(dd,j=5.8,3.0hz,1h),5.96(s,2h),5.20(s,2h);
13
c nmr(100mhz,cdcl3)δ160.93,147.81,147.63,129.91,123.02,122.61,122.23,115.62,110.55,109.04,108.25,101.17,65.99。
[0258]
实施例28
[0259]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0260]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol香茅醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0261]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得40mg吡咯酯类化合物,收率为80%。
[0262]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸香茅酯,结构式如式28所示:
[0263][0264]
对式28所示的化合物进行核磁分析,表征数据如下:
[0265]1h nmr(400mhz,cdcl3)δ9.22(s,1h),6.95(td,j=2.7,1.5hz,1h),6.91(ddd,j=3.8,2.4,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),5.14
–
5.05(m,1h),4.38
–
4.22(m,2h),2.10
–
1.89(m,2h),1.85
–
1.71(m,1h),1.68(s,3h),1.65
–
1.57(m,4h),1.57
–
1.48(m,1h),1.47
–
1.33(m,1h),1.31
–
1.15(m,1h),0.95(d,j=6.5hz,3h);
13
c nmr(100mhz,cdcl3)δ161.33,131.39,124.58,123.02,122.72,115.09,110.39,62.88,36.99,35.60,29.55,
25.71,25.39,19.49,17.66。
[0266]
实施例29
[0267]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0268]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol糠醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0269]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得28mg吡咯酯类化合物,收率为73%。
[0270]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-2-呋喃甲酯,结构式如式29所示:
[0271][0272]
对式29所示的化合物进行核磁分析,表征数据如下:
[0273]1h nmr(400mhz,cdcl3)δ9.23(s,1h),7.43(dd,j=1.8,0.8hz,1h),6.99
–
6.91(m,2h),6.46(d,j=3.2hz,1h),6.37(dd,j=3.2,1.9hz,1h),6.25(dt,j=3.6,2.6hz,1h),5.25(s,2h);
13
c nmr(100mhz,cdcl3)δ160.66,149.64,143.26,123.14,122.31,115.92,110.75,110.60,110.56,57.79。
[0274]
实施例30
[0275]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0276]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 2-噻吩甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0277]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得28mg吡咯酯类化合物,收率为68%。
[0278]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-2-噻吩甲酯,结构式如式30所示:
[0279][0280]
对式30所示的化合物进行核磁分析,表征数据如下:
[0281]1h nmr(400mhz,cdcl3)δ9.37(s,1h),7.32(dd,j=5.1,1.2hz,1h),7.17
–
7.12(m,1h),6.99(dd,j=5.1,3.5hz,1h),6.96(dq,j=3.4,1.3hz,2h),6.25(dt,j=3.6,2.6hz,1h),5.45(s,2h);
13
c nmr(100mhz,cdcl3)δ160.83,138.15,128.26,126.89,126.84,
123.35,122.34,115.96,110.56,60.34。
[0282]
实施例31
[0283]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0284]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 3-吡啶甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0285]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38mg吡咯酯类化合物,收率为94%。
[0286]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-3-吡啶甲酯,结构式如式31所示:
[0287][0288]
对式31所示的化合物进行核磁分析,表征数据如下:
[0289]1h nmr(400mhz,cdcl3)δ9.95(s,1h),8.68(d,j=1.8hz,1h),8.58(dd,j=4.8,1.5hz,1h),7.75(dt,j=7.8,1.9hz,1h),7.35
–
7.27(m,1h),6.98(t,j=2.9hz,2h),6.27(dd,j=5.7,3.1hz,1h),5.31(s,2h);
13
c nmr(100mhz,cdcl3)δ160.85,149.53,149.46,136.12,131.94,123.67,123.54,122.12,116.05,110.55,63.36。
[0290]
实施例32
[0291]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0292]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 2-羟甲基吡嗪、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0293]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得28.4mg吡咯酯类化合物,收率为70%。
[0294]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸吡嗪甲酯,结构式如式32所示:
[0295][0296]
对式32所示的化合物进行核磁分析,表征数据如下:
[0297]1h nmr(400mhz,cdcl3)δ9.70(s,1h),8.75(d,j=0.8hz,1h),8.63
–
8.57(m,1h),8.55(d,j=2.5hz,1h),7.03(ddd,j=3.8,2.4,1.5hz,1h),7.00(td,j=2.7,1.5hz,1h),6.29(dt,j=3.7,2.5hz,1h),5.47(s,2h);
13
c nmr(100mhz,cdcl3)δ160.59,151.76,
144.10,144.07,143.73,123.86,121.80,116.34,110.70,64.38。
[0298]
实施例33
[0299]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0300]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol正丁醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应12h,反应结束后,冷却至室温,得到反应液。
[0301]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得33mg吡咯酯类化合物,收率为99%。
[0302]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸丁酯,结构式如式33所示:
[0303][0304]
对式33所示的化合物进行核磁分析,表征数据如下:
[0305]1h nmr(400mhz,cdcl3)δ9.28(s,1h),6.95(dd,j=4.0,2.6hz,1h),6.94
–
6.87(m,1h),6.26(dd,j=6.2,2.6hz,1h),4.27(t,j=6.7hz,2h),1.71(dt,j=14.6,6.8hz,2h),1.51
–
1.39(m,2h),0.96(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ161.40,122.99,122.76,115.09,110.36,64.21,30.88,19.21,13.75。
[0306]
实施例34
[0307]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0308]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol正辛醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0309]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得26.7mg吡咯酯类化合物,收率为60%。
[0310]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸辛酯,结构式如式34所示:
[0311][0312]
对式34所示的化合物进行核磁分析,表征数据如下:
[0313]1h nmr(400mhz,cdcl3)δ9.36(s,1h),6.95(td,j=2.7,1.5hz,1h),6.92(ddd,j=3.8,2.4,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),4.26(t,j=6.7hz,2h),1.77
–
1.67(m,2h),1.48
–
1.21(m,11h),0.89(dd,j=9.2,4.5hz,3h);
13
c nmr(100mhz,cdcl3)δ161.45,
122.99,122.81,115.11,110.34,64.53,31.80,29.25,29.20,28.83,25.99,22.65,14.09。
[0314]
实施例35
[0315]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0316]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol异丁醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0317]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得30mg吡咯酯类化合物,收率为90%。
[0318]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸异丁酯,结构式如式35所示:
[0319][0320]
对式35所示的化合物进行核磁分析,表征数据如下:
[0321]1h nmr(400mhz,cdcl3)δ9.46(s,1h),6.96(td,j=2.7,1.5hz,1h),6.93(ddd,j=3.8,2.4,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),4.05(d,j=6.7hz,2h),2.04(dp,j=13.4,6.7hz,1h),0.99(d,j=6.7hz,6h);
13
c nmr(100mhz,cdcl3)δ161.51,122.94,115.13,110.32,70.37,27.96,19.15。
[0322]
实施例36
[0323]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0324]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol正戊醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0325]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得35mg吡咯酯类化合物,收率为97%。
[0326]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸戊酯,结构式如式36所示:
[0327][0328]
对式36所示的化合物进行核磁分析,表征数据如下:
[0329]1h nmr(400mhz,cdcl3)δ9.38(s,1h),6.95(td,j=2.7,1.5hz,1h),6.92(ddd,j=3.8,2.4,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),4.26(t,j=6.7hz,2h),1.79
–
1.67(m,2h),1.47
–
1.31(m,4h),0.92(t,j=7.1hz,3h);
13
c nmr(100mhz,cdcl3)δ161.45,122.99,122.82,115.11,110.34,64.50,28.53,28.14,22.36,13.98。
[0330]
实施例37
[0331]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0332]
(1)将0.2mmol 2-吡咯甲酸甲酯、0.4mmol r-(+)-1-苯乙醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0333]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得30mg吡咯酯类化合物,收率为70%。
[0334]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-1-苯乙酯,结构式如式37所示:
[0335][0336]
对式37所示的化合物进行核磁分析,表征数据如下:
[0337]1h nmr(400mhz,cdcl3)δ9.18(s,1h),7.42(dd,j=5.2,3.5hz,2h),7.39
–
7.32(m,2h),7.32
–
7.26(m,1h),6.98(ddd,j=3.8,2.4,1.5hz,1h),6.92(td,j=2.7,1.5hz,1h),6.26(dt,j=3.7,2.6hz,1h),6.07(q,j=6.6hz,1h),1.64(d,j=6.6hz,3h);
13
c nmr(100mhz,cdcl3)δ160.50,141.87,128.52,127.84,126.02,123.01,122.88,115.34,110.43,72.23,22.39。
[0338]
实施例38
[0339]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0340]
(1)将0.2mmol 2-吡咯甲酸甲酯、0.4mmol薄荷醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0341]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得22mg吡咯酯类化合物,收率为45%。
[0342]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸薄荷酯,结构式如式38所示:
[0343][0344]
对式38所示的化合物进行核磁分析,表征数据如下:
[0345]1h nmr(400mhz,cdcl3)δ9.22(s,1h),6.95(dt,j=4.1,2.1hz,1h),6.93
–
6.87(m,1h),6.29
–
6.23(m,1h),4.87(td,j=10.9,4.4hz,1h),2.09(ddd,j=10.1,5.0,2.5hz,1h),1.94(dtd,j=13.9,7.0,2.7hz,1h),1.79
–
1.69(m,2h),1.61
–
1.43(m,2h),1.19
–
1.03(m,
2h),0.91(t,j=6.8hz,7h),0.79(d,j=7.0hz,3h);
13
c nmr(100mhz,cdcl3)δ160.90,123.35,122.56,114.92,110.32,74.18,47.28,41.13,34.31,31.45,26.49,23.73,22.05,20.70,16.60。
[0346]
实施例39
[0347]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0348]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol甲代烯丙基醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0349]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得23.4mg吡咯酯类化合物,收率为71%。
[0350]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-2-甲基-丙烯甲酯,结构式如式39所示:
[0351][0352]
对式39所示的化合物进行核磁分析,表征数据如下:
[0353]1h nmr(400mhz,cdcl3)δ9.40(s,1h),6.97(t,j=2.5hz,2h),6.27(dd,j=6.1,2.6hz,1h),5.05(s,1h),4.96(s,1h),4.70(s,2h),1.81(s,3h);
13
c nmr(100mhz,cdcl3)δ160.97,140.13,123.12,122.61,115.46,112.82,110.47,67.41,19.52。
[0354]
实施例40
[0355]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0356]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol苯乙醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0357]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得35mg吡咯酯类化合物,收率为81%。
[0358]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸苯乙酯,结构式如式40所示:
[0359][0360]
对式40所示的化合物进行核磁分析,表征数据如下:
[0361]1h nmr(400mhz,cdcl3)δ9.18(s,1h),7.37
–
7.29(m,2h),7.29
–
7.25(m,2h),7.23(dt,j=2.9,1.8hz,1h),6.94(dt,j=4.1,2.1hz,1h),6.93
–
6.89(m,1h),6.26(dt,j=3.6,2.6hz,1h),4.47(t,j=7.1hz,2h),3.04(t,j=7.1hz,2h);
13
c nmr(100mhz,cdcl3)δ
161.07,137.90,128.98,128.54,126.59,122.91,122.78,115.35,110.47,64.81,35.36。
[0362]
实施例41
[0363]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0364]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol环己醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0365]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38.2mg吡咯酯类化合物,收率为99%。
[0366]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸环己酯,结构式如式41所示:
[0367][0368]
对式41所示的化合物进行核磁分析,表征数据如下:
[0369]1h nmr(400mhz,cdcl3)δ9.22(s,1h),6.94(td,j=2.7,1.6hz,1h),6.93
–
6.89(m,1h),6.26(dt,j=3.6,2.6hz,1h),5.00
–
4.92(m,1h),1.98
–
1.87(m,2h),1.84
–
1.72(m,2h),1.62
–
1.47(m,3h),1.47
–
1.36(m,2h),1.36
–
1.27(m,1h);
13
c nmr(100mhz,cdcl3)δ160.73,123.46,122.51,114.93,110.30,72.56,31.80,25.45,23.77。
[0370]
实施例42
[0371]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0372]
(1)将0.4mmol 2-吡咯甲酸甲酯、0.2mmol 1,3-丙二醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0373]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得23.6mg吡咯酯类化合物,收率为70%。
[0374]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吡咯-2-基)甲酸-3-羟基丙酯,结构式如式42所示:
[0375][0376]
对式42所示的化合物进行核磁分析,表征数据如下:
[0377]1h nmr(400mhz,cdcl3)δ9.55(s,1h),7.01
–
6.95(m,1h),6.93(d,j=3.6hz,1h),6.26(dd,j=6.1,2.5hz,1h),4.43(t,j=6.1hz,2h),3.75(t,j=6.0hz,2h),2.43(s,1h),1.97(p,j=6.0hz,2h);
13
c nmr(100mhz,cdcl3)δ161.74,123.32,122.46,115.61,110.46,61.17,59.06,31.91。
[0378]
实施例43
[0379]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0380]
(1)将0.3mmol 1-丙基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0381]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得22mg吡咯酯类化合物,收率为45%。
[0382]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-丙基-吡咯-2-基)甲酸苄酯,结构式如式43所示:
[0383][0384]
对式43所示的化合物进行核磁分析,表征数据如下:
[0385]1h nmr(400mhz,cdcl3)δ7.41(d,j=6.9hz,2h),7.39
–
7.34(m,2h),7.34
–
7.27(m,1h),7.02(dd,j=3.9,1.8hz,1h),6.86
–
6.82(m,1h),6.11(dd,j=3.9,2.6hz,1h),5.27(s,2h),4.30
–
4.22(m,2h),1.84
–
1.71(m,2h),0.88(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ160.81,136.57,128.98,128.51,127.99,127.91,118.52,107.81,65.38,50.83,24.85,11.08。
[0386]
实施例44
[0387]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0388]
(1)将0.3mmol 1-丁基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0389]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得28.2mg吡咯酯类化合物,收率为55%。
[0390]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-丁基-吡咯-2-基)甲酸苄酯,结构式如式44所示:
[0391][0392]
对式44所示的化合物进行核磁分析,表征数据如下:
[0393]1h nmr(400mhz,cdcl3)δ7.45
–
7.39(m,2h),7.39
–
7.34(m,2h),7.34
–
7.29(m,1h),7.01(dd,j=3.9,1.8hz,1h),6.87
–
6.80(m,1h),6.11(dd,j=3.9,2.5hz,1h),5.27(s,2h),
4.30(t,j=7.3hz,2h),1.80
–
1.66(m,2h),1.37
–
1.24(m,3h),0.91(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ160.80,136.58,128.87,128.51,127.99,127.91,121.47,118.49,107.85,65.38,49.02,33.72,19.84,13.72。
[0394]
实施例45
[0395]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0396]
(1)将0.3mmol 1-戊基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0397]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得39.6mg吡咯酯类化合物,收率为73%。
[0398]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-戊基-吡咯-2-基)甲酸苄酯,结构式如式45所示:
[0399][0400]
对式45所示的化合物进行核磁分析,表征数据如下:
[0401]1h nmr(400mhz,cdcl3)δ7.41(d,j=7.0hz,2h),7.36(t,j=7.2hz,2h),7.33
–
7.28(m,1h),7.01(dd,j=3.9,1.7hz,1h),6.84(t,j=2.0hz,1h),6.11(dd,j=3.8,2.6hz,1h),5.27(s,2h),4.29(t,j=7.3hz,2h),1.76(dd,j=14.8,7.5hz,2h),1.37
–
1.28(m,2h),1.28
–
1.19(m,3h),0.87(t,j=7.1hz,3h);
13
c nmr(100mhz,cdcl3)δ171.19,160.79,136.57,128.86,128.51,127.98,127.91,121.46,118.49,107.85,65.38,60.41,49.26,31.38,28.80,22.34,21.05,14.20,13.98。
[0402]
实施例46
[0403]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0404]
(1)将0.3mmol 1-异戊基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0405]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得41mg吡咯酯类化合物,收率为76%。
[0406]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-异戊基-吡咯-2-基)甲酸苄酯,结构式如式46所示:
[0407][0408]
对式46所示的化合物进行核磁分析,表征数据如下:
[0409]1h nmr(400mhz,cdcl3)δ7.45
–
7.39(m,2h),7.39
–
7.34(m,2h),7.34
–
7.28(m,1h),7.01(dd,j=3.9,1.8hz,1h),6.85(t,j=2.1hz,1h),6.11(dd,j=3.9,2.6hz,1h),5.27(s,2h),4.36
–
4.28(m,2h),1.64(dt,j=7.4,6.3hz,2h),1.56(td,j=13.1,6.5hz,1h),0.93(d,j=6.5hz,7h);
13
c nmr(100mhz,cdcl3)δ160.76,136.57,128.67,128.51,127.98,127.91,121.47,118.49,107.94,65.37,47.62,40.58,25.76,22.46。
[0410]
实施例47
[0411]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0412]
(1)将0.3mmol 1-苄基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0413]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得46mg吡咯酯类化合物,收率为79%。
[0414]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-苄基-吡咯-2-基)甲酸苄酯,结构式如式47所示:
[0415][0416]
对式47所示的化合物进行核磁分析,表征数据如下:
[0417]1h nmr(400mhz,cdcl3)δ7.34(d,j=4.2hz,4h),7.32
–
7.27(m,2h),7.27
–
7.21(m,1h),7.12
–
7.04(m,3h),6.18(dd,j=3.9,2.6hz,1h),5.55(s,2h),5.22(s,2h);
13
c nmr(100mhz,cdcl3)δ160.85,138.24,136.44,129.27,128.65,128.51,128.00,127.92,127.45,126.87,122.01,118.81,108.59,65.50,52.12。
[0418]
实施例48
[0419]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0420]
(1)将0.3mmol 1-丁基-2-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0421]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得30.3mg吡咯酯类化合物,收率为59%。
[0422]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-丁基-吡咯-2-基)甲酸苄酯,结构式如式48所示:
[0423][0424]
对式48所示的化合物进行核磁分析,表征数据如下:
[0425]1h nmr(400mhz,cdcl3)δ7.45
–
7.39(m,2h),7.39
–
7.34(m,2h),7.34
–
7.29(m,1h),7.01(dd,j=3.9,1.8hz,1h),6.87
–
6.80(m,1h),6.11(dd,j=3.9,2.5hz,1h),5.27(s,2h),4.30(t,j=7.3hz,2h),1.80
–
1.66(m,2h),1.37
–
1.24(m,3h),0.91(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ160.80,136.58,128.87,128.51,127.99,127.91,121.47,118.49,107.85,65.38,49.02,33.72,19.84,13.72。
[0426]
实施例49
[0427]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0428]
(1)将0.4mmol吲哚-2-甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0429]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得22mg吡咯酯类化合物,收率为44%。
[0430]
本实施例制备得到的吡咯酯类化合物的化学名称为(1h-吲哚-2-基)甲酸苄酯,结构式如式49所示:
[0431][0432]
对式49所示的化合物进行核磁分析,表征数据如下:
[0433]1h nmr(400mhz,cdcl3)δ8.95(s,1h),7.68(d,j=8.1hz,1h),7.46(d,j=6.7hz,2h),7.40(dd,j=7.9,6.0hz,3h),7.36(dd,j=9.5,2.6hz,1h),7.34
–
7.29(m,1h),7.28(d,j=1.1hz,1h),7.15(t,j=7.5hz,1h),5.39(s,2h);
13
c nmr(100mhz,cdcl3)δ171.22,161.80,136.94,135.76,128.67,128.42,128.29,127.45,127.08,125.51,122.63,120.86,111.90,109.19,66.66,60.42,31.59,22.66,21.05,18.38,14.19,14.12。
[0434]
实施例50
[0435]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0436]
(1)将0.4mmol 3-氟-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0437]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得30.3mg吡咯酯类化合物,收率为69%。
[0438]
本实施例制备得到的吡咯酯类化合物的化学名称为(3-氟-1h-吡咯-2-基)甲酸苄酯,结构式如式50所示:
[0439][0440]
对式50所示的化合物进行核磁分析,表征数据如下:
[0441]1h nmr(400mhz,cdcl3)δ9.08(s,1h),7.43(d,j=6.8hz,2h),7.40
–
7.34(m,2h),7.34
–
7.30(m,1h),6.69(dd,j=7.4,3.6hz,1h),5.98(t,j=3.0hz,1h),5.34(s,2h);
13
c nmr(100mhz,cdcl3)δ160.17,136.02,109.75(dd,j=69.2,2206.3hz),107.32(t,j=4871.9hz),107.12(t,j=4623.2hz),96.98(dd,j=4312.9,10529.5hz),128.58,127.93,31.60,21.05,14.19,14.13。
[0442]
实施例51
[0443]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0444]
(1)将0.4mmol 5-甲基-2-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0445]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得42.5mg吡咯酯类化合物,收率为99%。
[0446]
本实施例制备得到的吡咯酯类化合物的化学名称为(5-甲基-1h-吡咯-2-基)甲酸苄酯,结构式如式51所示:
[0447][0448]
对式51所示的化合物进行核磁分析,表征数据如下:
[0449]1h nmr(400mhz,cdcl3)δ9.43(s,1h),7.45
–
7.38(m,2h),7.38
–
7.33(m,2h),7.31(ddd,j=7.0,3.4,1.5hz,1h),6.90
–
6.85(m,1h),5.94(t,j=2.8hz,1h),5.29(s,2h),2.27(s,3h);
13
c nmr(100mhz,cdcl3)δ161.21,136.42,134.48,128.56,128.13,128.03,120.89,116.77,109.06,65.74,13.15。
[0450]
实施例52
[0451]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0452]
(1)将0.3mmol 6-溴-1-甲基-2-吲哚甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾
和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0453]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得29mg吡咯酯类化合物,收率为42%。
[0454]
本实施例制备得到的吡咯酯类化合物的化学名称为(6-溴-1-甲基-吲哚-2-基)甲酸苄酯,结构式如式52所示:
[0455][0456]
对式52所示的化合物进行核磁分析,表征数据如下:
[0457]1h nmr(400mhz,cdcl3)δ7.54(s,1h),7.50(d,j=8.5hz,1h),7.45(d,j=7.1hz,2h),7.39(t,j=7.2hz,2h),7.37
–
7.32(m,1h),7.29(s,1h),7.23(dd,j=8.5,1.4hz,1h),5.35(s,2h),4.02(s,3h);
13
c nmr(100mhz,cdcl3)δ171.18,161.66,140.35,135.91,128.66,128.33,128.23,128.14,124.60,124.14,123.80,119.02,113.32,110.58,66.35,60.41,31.80,31.60,22.67,21.06,18.45,14.21,14.14。
[0458]
实施例53
[0459]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0460]
(1)将0.3mmol 1-甲基-2-吡咯甲酸乙酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0461]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得25.4mg吡咯酯类化合物,收率为59%。
[0462]
本实施例制备得到的吡咯酯类化合物的化学名称为(1-甲基-吡咯-2-基)甲酸苄酯,结构式如式53所示:
[0463][0464]
对式53所示的化合物进行核磁分析,表征数据如下:
[0465]1h nmr(400mhz,cdcl3)δ7.41(d,j=7.0hz,2h),7.36(t,j=7.2hz,2h),7.31(dd,j=8.5,5.5hz,1h),7.00(dd,j=3.9,1.7hz,1h),6.78(d,j=1.8hz,1h),6.11(dd,j=3.9,2.6hz,1h),5.27(s,2h),3.92(s,3h);
13
c nmr(100mhz,cdcl3)δ161.07,136.56,129.70,128.53,128.01,127.92,122.33,118.16,107.92,65.43,60.42,36.85,31.60,22.67,14.21,14.14。
[0466]
实施例54
[0467]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0468]
(1)将0.3mmol 4-溴-1-甲基-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0469]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38.7mg吡咯酯类化合物,收率为66%。
[0470]
本实施例制备得到的吡咯酯类化合物的化学名称为(4-溴-1-甲基-吡咯-2-基)甲酸苄酯,结构式如式54所示:
[0471][0472]
对式54所示的化合物进行核磁分析,表征数据如下:
[0473]1h nmr(400mhz,cdcl3)δ7.42
–
7.35(m,4h),7.35
–
7.30(m,1h),6.96(d,j=1.9hz,1h),6.76(d,j=1.8hz,1h),5.26(s,2h),3.89(s,3h);
13
c nmr(100mhz,cdcl3)δ160.13,136.12,128.97,128.59,128.20,127.99,122.82,119.50,95.13,65.81,60.42,36.96,31.60,22.67,21.06,14.21,14.14。
[0474]
实施例55
[0475]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0476]
(1)将0.3mmol 1-吡啶-2-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0477]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38mg吡咯酯类化合物,收率为68%。
[0478]
本实施例制备得到的吡咯酯类化合物的化学名称为1-(吡啶-3-基)-1h-吡咯-2-甲酸苄酯,结构式如式55所示:
[0479][0480]
对式55所示的化合物进行核磁分析,表征数据如下:
[0481]1h nmr(400mhz,cdcl3)δ8.60(dd,j=6.8,1.9hz,2h),7.65(ddd,j=8.1,2.5,1.5hz,1h),7.37
–
7.26(m,6h),7.21(dd,j=3.9,1.8hz,1h),6.94(dd,j=2.6,1.8hz,1h),6.34(dd,j=3.9,2.7hz,1h),5.16(s,2h);
13
c nmr(100mhz,cdcl3)δ160.09,148.92,147.11,137.00,135.96,133.96,129.85,128.51,128.14,128.08,123.52,123.09,120.02,110.10,65.85。
[0482]
实施例56
[0483]
本实施例的吡咯酯类化合物的制备方法,包括以下步骤:
[0484]
(1)将0.4mmol 3-吡咯甲酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0485]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为7:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得31mg吡咯酯类化合物,收率为77%。
[0486]
本实施例制备得到的吡咯酯类化合物的化学名称为1h-吡咯-3-甲酸苄酯,结构式如式56所示:
[0487][0488]
对式56所示的化合物进行核磁分析,表征数据如下:
[0489]1h nmr(400mhz,cdcl3)δ8.80(s,1h),7.46
–
7.39(m,3h),7.36(ddd,j=7.4,4.6,1.4hz,2h),7.33
–
7.26(m,1h),6.72(dd,j=5.0,2.4hz,1h),6.67(td,j=2.7,1.5hz,1h),5.28(s,2h);
13
c nmr(100mhz,cdcl3)δ165.02,136.74,128.51,127.99,127.97,123.85,118.94,116.15,109.89,65.54。
[0490]
实施例57
[0491]
本实施例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为六甲基二硅基氨基钾,其他条件不变。本实施例所得吡咯酯类化合物的收率为90%。
[0492]
实施例58
[0493]
本实施例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为碳酸铯,其他条件不变。本实施例所得吡咯酯类化合物的收率为88%。
[0494]
实施例59
[0495]
本实施例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为叔丁醇钠,其他条件不变。本实施例所得吡咯酯类化合物的收率为88%。
[0496]
对比例1
[0497]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中2-吡咯甲酸甲酯的物质的量为0.3mmol。本对比例所得吡咯酯类化合物的收率为71%。
[0498]
对比例2
[0499]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中的反应时间为12h。本对比例所得吡咯酯类化合物的收率为82%。
[0500]
对比例3
[0501]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中的反应时间为6h。本对比例所得吡咯酯类化合物的收率为67%。
[0502]
对比例4
[0503]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中的反应温度为120℃。本对比例所得吡咯酯类化合物的收率为80%。
[0504]
对比例5
[0505]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为氢氧化钾,其他条件不变。本对比例所得吡咯酯类化合物的收率为67%。
[0506]
对比例6
[0507]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为碳酸钾,其他条件不变。本对比例所得吡咯酯类化合物的收率为60%。
[0508]
对比例7
[0509]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为乙酸钾,其他条件不变。本对比例所得吡咯酯类化合物的收率为0。
[0510]
对比例8
[0511]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将叔丁醇钾替换为叔丁醇锂,其他条件不变。本对比例所得吡咯酯类化合物的收率为40%。
[0512]
对比例9
[0513]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为乙酸乙酯,其他条件不变。本对比例所得吡咯酯类化合物的收率为20%。
[0514]
对比例10
[0515]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为正己烷,其他条件不变。本对比例所得吡咯酯类化合物的收率为40%。
[0516]
对比例11
[0517]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为二氯乙烷,其他条件不变。本对比例所得吡咯酯类化合物的收率为30%。
[0518]
对比例12
[0519]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为乙腈,
其他条件不变。本对比例所得吡咯酯类化合物的收率为70%。
[0520]
对比例13
[0521]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为dmf,其他条件不变。本对比例所得吡咯酯类化合物的收率为43%。
[0522]
对比例14
[0523]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中将甲苯替换为1,4-二氧六环,其他条件不变。本对比例所得吡咯酯类化合物的收率为95%。
[0524]
对比例15
[0525]
本对比例的吡咯酯类化合物的制备方法与实施例1的吡咯酯类化合物的制备方法的区别仅在于,本对比例的吡咯酯类化合物的制备方法中,步骤(1)中叔丁醇钾用量为0,其他条件不变。本对比例所得吡咯酯类化合物的收率为0。
[0526]
对比例16
[0527]
本对比例的呋喃酯类化合物的制备方法,包括以下步骤:
[0528]
(1)将0.4mmol糠酸甲酯、0.2mmol苯甲醇、0.2mmol叔丁醇钾和1ml甲苯混匀,得到混合物,然后将混合物置于体积为5ml的schlenk管内,再将schlenk管内的反应体系在140℃反应24h,反应结束后,冷却至室温,得到反应液。
[0529]
(2)将反应液进行浓缩得浓缩物,再将浓缩物以体积比为5:1的二氯甲烷和石油醚组成的混合溶剂为展开剂,以硅胶为吸附剂,进行柱色谱分离,得38.3mg呋喃酯类化合物,收率为95%。
[0530]
本对比例制备得到的呋喃酯类化合物的化学名称为2-呋喃甲酸苄酯,结构式如式57所示:
[0531][0532]
对式57所示的化合物进行核磁分析,表征数据如下:
[0533]1h nmr(400mhz,cdcl3)δ7.58(dd,j=1.6,0.8hz,1h),7.44(dd,j=7.9,1.4hz,2h),7.42
–
7.36(m,2h),7.36
–
7.30(m,1h),7.20(dd,j=3.5,0.7hz,1h),6.50(dd,j=3.5,1.7hz,1h),5.34(s,2h);
13
c nmr(100mhz,cdcl3)δ158.56,146.45,144.60,135.64,128.63,128.40,128.38,118.20,111.87,66.54。
[0534]
对比例17
[0535]
本对比例的噻吩酯类化合物的制备方法与对比例16的呋喃酯类化合物的制备方法的区别仅在于,将对比例16的呋喃酯类化合物的制备方法的步骤(1)中的糠酸甲酯替换为2-噻吩甲酸甲酯,将步骤(2)中的展开剂替换为由体积比为7:1的二氯甲烷和石油醚组成的混合溶剂;本对比例的噻吩酯类化合物的制备方法制备得到的噻吩酯类化合物的质量为0,收率为0。
[0536]
对比例18
[0537]
本对比例的吡啶酯类化合物的制备方法与对比例16的呋喃酯类化合物的制备方
法的区别仅在于,将对比例16的呋喃酯类化合物的制备方法的步骤(1)中的糠酸甲酯替换为2-吡啶甲酸甲酯;本对比例的吡啶酯类化合物的制备方法制备得到的吡啶酯类化合物的质量为0,收率为0。
[0538]
对比例19
[0539]
本对比例的苯甲酸酯类化合物的制备方法与对比例16的呋喃酯类化合物的制备方法的区别仅在于,将对比例16的呋喃酯类化合物的制备方法的步骤(1)中的糠酸甲酯替换为3-甲基苯甲酸甲酯;本对比例的苯甲酸酯类化合物的制备方法制备得到的苯甲酸酯类化合物的质量为23mg,收率为51%。
[0540]
本对比例制备得到的苯甲酸酯类化合物的化学名称为3-甲基苯甲酸苄酯,结构式如式58所示:
[0541][0542]
对式58所示的化合物进行核磁分析,表征数据如下:
[0543]1h nmr(400mhz,cdcl3)δ7.88(t,j=4.0hz,2h),7.49
–
7.43(m,2h),7.43
–
7.37(m,2h),7.35(dd,j=8.9,4.7hz,2h),7.31(d,j=7.9hz,1h),5.36(s,2h),2.39(s,3h);
13
c nmr(100mhz,cdcl3)δ166.65,138.19,136.16,133.81,130.23,130.08,128.61,128.29,128.23,128.19,126.88,66.64,21.27。
[0544]
对比例20
[0545]
本对比例的吡嗪酯类化合物的制备方法与对比例16的呋喃酯类化合物的制备方法的区别仅在于,将对比例16的呋喃酯类化合物的制备方法的步骤(1)中的糠酸甲酯替换为2-吡嗪甲酸甲酯;本对比例的吡嗪酯类化合物的制备方法制备得到的吡嗪酯类化合物的质量为0,收率为0。
[0546]
对比例21
[0547]
本对比例的丙酸酯类化合物的制备方法与对比例16的呋喃酯类化合物的制备方法的区别仅在于,将对比例16的呋喃酯类化合物的制备方法的步骤(1)中的糠酸甲酯替换为丙酸甲酯;本对比例的丙酸酯类化合物的制备方法制备得到的丙酸酯类化合物的质量为0,收率为0。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1