一种仲胺与邻二碘苯的反应方法
1.本发明属于有机合成,具体涉及一种仲胺与邻二碘苯的反应方法。
背景技术:
2.氢化钠是碱金属氢化物的典型代表,它是由na
+
和h-组成。2004年,su等发现在氢化钠可以促进酯交换反应,将化合物与氢化钠在四氢呋喃中回流,经分子内酯交换可得到大环内酯类化合物㈠-apicularen a。2003年,blacklock等发现使用催化量的水可以使nah反应生成高活性的氢氧化钠,可以快速对化合物进行n-甲基化,可有效实现氨基酸及其类似物的甲基化。芳胺类化合物是一种重要的分子骨架,经常被应用于农业、医药、染料、颜料、电子工业等各个领域内。很多生物活性分子都是n-取代芳烃类化合物,如中枢降压药盐酸可乐定、可逆胆碱酯酶抑制剂溴新斯的明、α受体阻断剂酚妥拉明、ca
2+
通道拮抗剂苄普地尔等(图 1)。传统n-芳基化一般是由芳基卤代物和胺经ullmann反应构建[(a) jourdan f. ber. dtsch. friedrich jourdan: xeue syntheeen von derivaten dee hydroacridins und aoridins. chem. ges., 1885, 18: 1444.(b) ullmann f, wenner p. ber. dtsch. chem. ges, 1900, 33: 2476],合成方法一般需要金属铜或铜盐或钯催化、高温高压等条件,反应时间长,制备成本高,环境污染严重。后来芳基硼酸作为芳基受体参与n-芳基化反应,也需要过渡金属催化[patrick y. s. lam, et al. new aryl/heteroaryl c-n bond cross-coupling reactions via arylboronic acid/cupric acetate arylation. tetrahedron letters39 (1998) 2941-2944]。因此寻找绿色高效的c-n键构建方法尤为重要。
技术实现要素:
[0003]
本发明中公开了邻二碘苯在氢化钠作用下与仲胺快速制备芳胺类化合物,这类反应快速、简捷而且温和,是一种快速实现n-芳基化的新颖方法,反应主产物为2-碘代芳胺类化合物,易于转化,具有更大的应用价值,尤其是解决了现有技术n-芳基化方法需要用到高温、金属催化等条件,具有反应时间长、制备成本高、环境污染严重等缺点。
[0004]
本发明采用如下技术方案:一种仲胺与邻二碘苯的反应方法,在碱金属氢化物或者格式试剂存在下,将仲胺与邻二碘苯反应,完成仲胺与邻二碘苯的反应。
[0005]
一种邻碘代产物的制备方法,在碱金属氢化物或者格式试剂存在下,将仲胺与邻二碘苯反应,得到邻碘代产物。
[0006]
本发明中,碱金属氢化物为nah、kh、cah2、lih中的一种或几种,格式试剂为i-prmgbr。
[0007]
本发明中,反应在溶剂中进行,溶剂优选为dma、thf、甲苯、ch3cn中的一种或几种;优选为thf、dma混合溶剂;进一步优选的,thf、dma的体积比为(3~5)∶1。
[0008]
本发明中,反应的温度为室温~50℃,优选室温~40℃。
[0009]
本发明中,仲胺、邻二碘苯、碱金属氢化物的摩尔量比为1∶(1~3)∶(2~5),优选为1∶2∶3。
[0010]
本发明中,仲胺的化学结构式如下:邻二碘苯的化学结构式如下:邻碘代产物的化学结构式如下:r1、r2独立的选择烷基、取代烷基、芳基、取代芳基、杂环基中的一种;优选的,取代烷基为卤素取代烷基,其中碳原子数为1~10,优选1~5。r1、r2也可以与n组成含氮杂环基团,比如吲哚、吲唑、吡唑、四氮唑、吡啶、咔唑、吖啶类、吩噻嗪等。
[0011]
r3选自烷基、取代烷基、芳基、取代芳基、杂环基中的一种;优选的,取代烷基为卤素取代烷基,其中碳原子数为1~10,优选1~5;杂环基比如吩噻嗪、咔唑、苯胺基嘧啶、吲哚、吖啶酮、吡唑等基团。
[0012]
本发明发现,邻二碘苯在碱金属氢化物氢化钠的作用下,能够与胺反应,用于c-n的非金属催化构建。这类反应绿色高效、原子转化率高,不需要过渡金属催化,没有过度偶联的副产物,原料邻二碘苯廉价易得;实验操作简单,放大至克级仍能得到较高的收率;反应主产物为2-碘代化合物,用其他方法难以一步获得;产物易于转化,对复杂药物分子的合成和修饰具有重要意义。
附图说明
[0013]
图1为现有n-取代芳烃类化合物的化学结构。
[0014]
图2为二苯胺与邻二碘苯在不同条件下的反应结果。
[0015]
图3为不同胺化合物与邻二碘苯的反应结果。
[0016]
图4为吩噻嗪化合物与邻二碘苯的反应结果。
[0017]
图5为二苯胺与二碘苯衍生物的反应结果。
[0018]
图6为放大条件下的反应结果。
[0019]
图7为二碘苯原料制备示意。
具体实施方式
[0020]
本发明在碱金属氢化物或者格式试剂存在下,将仲胺与邻二碘苯在溶剂中室温反应,得到邻碘代产物。所有原料都为市售产品,具体制备操作以及测试方法为常规技术。
[0021]
核磁谱图1h nmr、
19
f nmr和
13
c nmr均使用agilent 400 mhz和bruker 400 mhz仪
器测定,样品溶剂均为cdcl3(7.26 ppm)。核磁数据报告包括:化学位移,峰面积积分,偶合常数,峰型等。lr-ms质谱仪为esi源。tlc薄层色谱板为烟台黄海化工厂生产,在254 nm或365 nm波长下可视化监测,显色剂有kmno4、碘、磷钼酸和二硝基苯肼,快速柱层析所用硅胶目数为200-300目。所用试剂都为市售分析纯或化学纯,无特殊说明,直接使用。无水溶剂均为重蒸溶剂或市售干燥溶剂(百灵威)。
[0022]
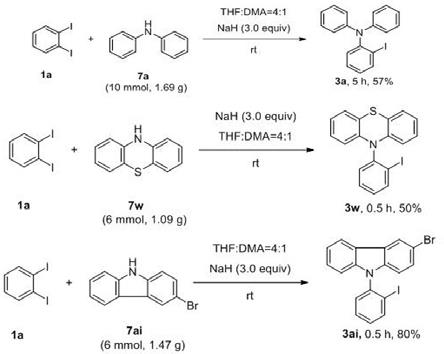
实施例一参见图2,改变反应条件(单因素变化),得到不同结果,以第11组为例:室温下,将nah(1.8 mmol, 3.0 equiv)称量于反应瓶中,悬于无水thf(1.0 ml)中常规搅拌,在搅拌过程中加入二苯胺2a(0.6 mmol, 1.0 equiv,溶于0.5 ml dma),加完后在室温下搅拌5 min,然后加入邻二碘苯1a(1.2 mmol, 2.0 equiv,溶于1.0 ml thf),室温下搅拌1小时。反应完成后,将反应液加到冰水中淬灭反应,乙酸乙酯萃取3次,合并有机层,饱和nacl溶液洗涤,无水硫酸钠干燥,过滤,旋干溶剂,加入硅胶粉拌样,快速柱层析分离,得到邻碘芳胺产物3a,收率为72%。
[0023]
实施例二室温下,将nah(1.8 mmol, 3.0 equiv)称量于反应瓶中,悬于无水thf(1.0 ml)中常规搅拌,在搅拌过程中加入仲胺2(0.6 mmol, 1.0 equiv,溶于0.5 ml dma),加完后在室温下搅拌5 min,然后加入邻二碘苯1(1.2 mmol, 2.0 equiv,溶于1.0 ml thf),常规搅拌反应。反应完成后,将反应液加到冰水中淬灭反应,乙酸乙酯萃取3次,合并有机层,饱和nacl溶液洗涤,无水硫酸钠干燥,过滤,旋干溶剂,加入硅胶粉拌样,快速柱层析分离,得到邻碘芳胺产品3。
[0024]
本发明对各类底物具有普适性,参见图3至图5,图中时间为反应时间,收率为分离收率,如无特殊说明,则为常规反应条件;化合物1、化合物2中的取代基与产物3中的取代基一致。参见图3,对于二苯胺、苯萘胺、二苄胺均可取得较高收率(3a-3c);对于苯氨基吡啶、苯胺基嘧啶、甲基苯胺、甲氨基吡啶类可以取得中等及以上收率(3d-3i);对于烷基胺类,如二烯丙基胺、哌嗪、氢化异喹啉,可以取得中等收率(3d-3i);对于氮杂环,如吲哚、吲唑、吡唑、四氮唑、吡啶、咔唑、吖啶类、吩噻嗪等可以取得中等及以上收率(3m-3x)。参见图4,对于吩噻嗪,有强吸电子基氰基存在时可以取得较高收率(3z),-cf3、-cl 可以取得中等收率(3y、3aa);对于二苯胺,有吸电子基存在时可以取得较高收率,给电子基存在时收率较低(3ab-3ac);对于吲哚,甲基、甲氧基、卤素取代时产率相差不大(3ae-3ag),邻位大位阻苯环取代时产率较低(3ah);对于咔唑类,卤素取代均可得到较高收率(3ai-3aj)。参见图5,吩噻嗪、咔唑、苯胺基嘧啶类、吲哚、吖啶酮、吡唑类与对称性二碘苯反应均可得到中等及以上收率的单一产物(3ak-3ap、3ar-3at、3av、3aw、3bd),与不对称二碘苯反应,得到中等收率的混合产物(3aq、3ax、3ay、3az、3bc),值得注意的是1,2-二碘萘可获得中等的收率(3bb)。
[0025]
实施例三进行了放大试验,将投料量放大至克级,该反应为实现工业化生产奠定了基础,参见图6,反应过程与实施例二一致,原料用量放大。
[0026]
合成例本发明的原料为市售产品,也可根据常规技术制备,以下给出部分原料的制备方法。
lr-ms (esi): m/z 412.1 [m+h]
+
.10-(2-iodophenyl)-10h-phenothiazine (3w). white solid, yield 43%. 1
h nmr (400 mhz, cdcl3) δ 8.14 (dd, j = 8.0, 1.3 hz, 1h), 7.61 (td, j = 7.6, 1.4 hz, 1h), 7.49 (dd, j = 7.8, 1.5 hz, 1h), 7.21 (td, j = 7.8, 1.6 hz, 1h), 7.05
ꢀ–ꢀ
6.96 (m, 2h), 6.87
ꢀ–ꢀ
6.77 (m, 4h), 6.13
ꢀ–ꢀ
5.96 (m, 2h). 13
c nmr (101 mhz, cdcl3) δ 142.6, 142.0, 141.7, 133.2, 130.5, 130.1, 126.9, 126.7, 122.7, 119.5, 115.37, 102.7. lr-ms (esi): m/z 402.0 [m+h]
+
.10-(2-iodophenyl)-10h-benzo[b]pyrido[2,3-e][1,4]thiazine (3x). white solid, yield 56%. 1
h nmr (400 mhz, cdcl3) δ 8.06 (dd, j = 8.0, 1.3 hz, 1h), 7.75 (dd, j = 4.9, 1.6 hz, 1h), 7.57 (td, j = 7.6, 1.4 hz, 1h), 7.47 (dd, j = 7.8, 1.6 hz, 1h), 7.24
ꢀ–ꢀ
7.11 (m, 2h), 7.02
ꢀ–ꢀ
6.94 (m, 1h), 6.91
ꢀ–ꢀ
6.78 (m, 2h), 6.68 (dd, j = 7.5, 4.9 hz, 1h), 6.04
ꢀ–ꢀ
5.89 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 152.7, 145.0, 142.30, 141.7, 140.7, 133.9, 133.2, 129.8, 129.7, 127.3, 126.5, 123.3, 118.7, 118.4, 116.4, 115.3, 102.1. lr-ms (esi): m/z 403.0 [m+h]
+
10-(2-iodophenyl)-3-(trifluoromethyl)-10h-phenothiazine (3y). white solid, yield 67%. 1
h nmr (400 mhz, cdcl3) δ 8.13 (d, j = 8.0 hz, 1h), 7.61 (t, j = 7.6 hz, 1h), 7.46 (d, j = 7.7 hz, 1h), 7.24
ꢀ–ꢀ
7.19 (m, 1h), 7.07
ꢀ–ꢀ
6.98 (m, 2h), 6.95 (dd, j = 5.8, 3.3 hz, 1h), 6.86
ꢀ–ꢀ
6.77 (m, 2h), 6.14 (s, 1h), 6.03
ꢀ–ꢀ
5.91 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 142.5, 142.0, 141.9, 141.4, 132.9, 130.9, 130.7, 129.3 (q,j = 272 hz), 127.45, 126.79 (d, j = 5.0 hz), 125.25, 124.60 (d, j = 1.2 hz), 123.41, 122.55, 119.35 (q, j = 3.9 hz), 118.69, 115.81, 111.43 (q, j = 4.1 hz), 102.14. 19
f nmr (377 mhz, cdcl3) δ
ꢀ‑
63.06. lr-ms (esi): m/z 470.0 [m+h]
+
.10-(2-iodophenyl)-10h-phenothiazine-4-carbonitrile (3z). white solid, yield 93%. 1
h nmr (400 mhz, cdcl3) δ 8.15 (dd, j = 8.0, 1.4 hz, 1h), 7.64 (td, j = 7.7, 1.4 hz, 1h), 7.43 (dd, j = 7.8, 1.5 hz, 1h), 7.29
ꢀ–ꢀ
7.26 (m, 1h), 7.01 (dt, j = 16.8, 4.7 hz, 2h), 6.96
ꢀ–ꢀ
6.90 (m, 1h), 6.87
ꢀ–ꢀ
6.80 (m, 2h), 6.08 (d, j = 1.4 hz, 1h), 5.99
ꢀ–ꢀ
5.92 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 142.5, 142.1, 141.4, 140.8, 132.6, 131.1, 130.8, 127.6, 126.9, 126.7, 126.1, 123.6, 118.9, 117.9, 117.2, 115.8, 110.2, 101.9. lr-ms (esi): m/z 427.0 [m+h]
+
.3-chloro-10-(2-iodophenyl)-10h-phenothiazine (3aa). white solid, yield 39%. 1
h nmr (400 mhz, cdcl3) δ 8.14 (d, j = 7.9 hz, 1h), 7.62 (t, j = 7.6 hz, 1h), 7.46 (d, j = 7.7 hz, 1h), 7.23 (t, j = 7.7 hz, 1h), 6.99 (dd, j = 5.8, 3.3 hz, 1h), 6.90 (d, j = 8.2 hz, 1h), 6.83 (dd, j = 5.6, 3.8 hz, 2h), 6.78 (dd, j = 8.2, 1.8 hz, 1h), 6.08
ꢀ–ꢀ
5.91 (m, 2h). 13
c nmr (101 mhz, cdcl3) δ 143.2, 142.0,141. 9, 141.5, 132.9, 132.7, 130.7, 130.5, 127.3, 127.2, 126.8, 123.2, 122.5, 119.4, 118.2, 115.7, 115.6, 102.2. lr-ms (esi): m/z 435.9 [m+h]
+
.
2,6-dichloro-n-(2-iodophenyl)-n-phenylaniline (3ab). white solid,yield 68%. 1
h nmr (400 mhz, cdcl3) δ 7.91 (d, j = 7.9 hz, 1h), 7.38 (d, j = 8.0 hz, 2h), 7.29 (s, 1h), 7.23 (d, j = 8.0 hz, 2h), 7.17 (t, j = 8.0 hz, 1h), 7.00 (dd, j = 8.0, 1.0 hz, 1h), 6.96 (t, j = 7.3 hz, 1h), 6.83 (t, j = 7.6 hz, 1h), 6.68 (d, j = 8.0 hz, 2h). 13
c nmr (101 mhz, cdcl3) δ 146.5, 145.7, 141.8, 141.3, 136.5, 129.9, 129.13, 129.08, 127.9, 127.7, 126.1, 121.7, 120.6, 95.3. lr-ms (esi): m/z 439.9 [m+h]
+
.2-iodo-n, n-di-p-tolylaniline (3ac). white solid, yield 38%. 1
h nmr (400 mhz, cdcl3) δ 7.92 (d, j = 7.9 hz, 1h), 7.35 (m, 1h), 7.20 (dd, j = 7.9, 1.1 hz, 1h), 7.05 (d, j = 8.3 hz, 4h), 6.94 (m, 1h), 6.87 (d, j = 8.4 hz, 4h), 2.31 (s, 6h).
13
c nmr (101 mhz, cdcl3) δ 149.4, 145.0, 141.0, 131.4, 131.2, 129.8, 129.7, 127.3, 122.3, 100.2, 20.9. lr-ms (esi): m/z 400.1 [m+h]
+
.n-(2-iodophenyl)-3,4-dimethyl-n-phenylaniline (3ad). white solid, yield 33%. 1
h nmr (400 mhz, cdcl3) δ 7.93 (dd, j = 7.9, 1.4 hz, 1h), 7.37 (td, j = 7.7, 1.4 hz, 1h), 7.25
ꢀ–ꢀ
7.20 (m, 3h), 7.02 (d, j = 8.1 hz, 1h), 6.97
ꢀ–ꢀ
6.89 (m, 4h), 6.87
ꢀ–ꢀ
6.76 (m, 2h), 2.23 (s, 3h), 2.19 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 149.3, 147.5, 144.8, 141.0, 137.40, 131.40, 130.90, 130.3, 129.8, 129.1, 127.5, 124.4, 121.4, 121.3, 120.7, 100.3, 20.1, 19.2.1-(2-iodophenyl)-7-methyl-1h-indole (3ae). colorless oil, yield 36%. 1
h nmr (400 mhz, cdcl3) δ 7.97 (d, j = 7.9 hz, 1h), 7.57 (d, j = 7.8 hz, 1h), 7.45 (d, j = 3.9 hz, 2h), 7.20 (dt, j = 8.3, 4.4 hz, 1h), 7.09 (t, j = 7.4 hz, 1h), 7.02 (d, j = 2.6 hz, 1h), 6.94 (d, j = 6.9 hz, 1h), 6.69 (d, j = 2.6 hz, 1h), 1.95 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 144.4, 139.1, 135.4, 130.3, 130.2, 129.4, 129.2, 128.6, 124.8, 121.7, 120.6, 119.22, 103.4, 100.4, 18.8. lr-ms (esi): m/z 334.0 [m+h]
+
.1-(2-iodophenyl)-5-methoxy-1h-indole (3af). colorless oil, yield 27%. 1
h nmr (400 mhz, cdcl3) δ 8.02 (d, j = 7.9 hz, 1h), 7.48 (t, j = 7.5 hz, 1h), 7.38 (d, j = 7.5 hz, 1h), 7.17 (d, j = 7.3 hz, 3h), 6.95 (d, j = 8.8 hz, 1h), 6.89
ꢀ–ꢀ
6.78 (m, 1h), 6.63 (s, 1h), 3.88 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 154.7, 142.3, 140.3, 132.1, 129.9, 129.5, 129.3, 129.2, 129.0, 112.6, 111.6, 102.9, 102.7, 97.7, 56.0. lr-ms (esi): m/z 350.0 [m+h]
+
.5-fluoro-1-(2-iodophenyl)-1h-indole (3ag). colorless oil, yield 38%. 1
h nmr (400 mhz, cdcl3) δ 8.04 (d, j = 8.0 hz, 1h), 7.62 (dd, j = 8.6, 5.3 hz, 1h), 7.51 (t, j = 7.6 hz, 1h), 7.39 (d, j = 7.6 hz, 1h), 7.20 (dd, j = 12.7, 5.5 hz, 2h), 6.96 (td, j = 9.2, 2.2 hz, 1h), 6.75 (dd, j = 9.7, 1.9 hz, 1h), 6.69 (s, 1h). 13
c nmr (101 mhz, cdcl3) δ 160.3(d, j = 240 hz), 141.8, 140.4, 136.9 (d, j = 12.1 hz), 130.3, 129.3 (dd, j = 27.0, 8.1 hz), 124.9, 121.8 (d, j = 10.0 hz), 109.3, 109.0, 103.3, 97.6, 97.4, 97.1. 19
f nmr (377 mhz, cdcl3) δ
ꢀ‑
120.12. lr-ms (esi): m/z 338.0 [m+h]
+
.
1-(2-iodophenyl)-2-phenyl-1h-indole(3ah). colorless oil, yield 20%. 1
h nmr (400 mhz, cdcl3) δ 7.95 (dd, j = 8.0, 1.3 hz, 1h), 7.70 (ddd, j = 4.5, 2.2, 0.5 hz, 1h), 7.38 (td, j = 7.7, 1.4 hz, 1h), 7.31 (ddd, j = 8.4, 3.5, 2.3 hz, 2h), 7.26
ꢀ–ꢀ
7.23 (m, 2h), 7.21 (dt, j = 5.9, 1.7 hz, 2h), 7.17 (dt, j = 10.7, 3.4 hz, 2h), 7.14
ꢀ–ꢀ
7.08 (m, 1h), 6.97
ꢀ–ꢀ
6.90 (m, 1h), 6.83 (s, 1h). 13
c nmr (101 mhz, cdcl3) δ 141.7, 141.0, 140.2, 138.7, 132.5, 131.0, 130.0, 129.4, 128.9, 128.40, 128.35, 127.6, 122.5, 120.9, 120.7, 111.3, 103.6, 100.0. lr-ms (esi): m/z 396.0 [m+h]
+
.3-bromo-9-(2-iodophenyl)-9h-carbazole (3ai). white solid, yield 55%. 1
h nmr (400 mhz, dmso) δ 8.27 (s, 1h), 8.11 (d, j = 7.8 hz, 2h), 7.58 (t, j = 7.5 hz, 1h), 7.48 (d, j = 8.6 hz, 1h), 7.43 (t, j = 7.5 hz, 2h), 7.31 (dd, j = 13.2, 6.8 hz, 2h), 7.02 (d, j = 8.1 hz, 1h), 6.91 (d, j = 8.6 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 141.1, 140.6, 139.9, 139.4, 130.7, 130.6, 129.9, 128.7, 126.8, 125.1, 123.3, 122.2, 120.7, 120.6, 113.0, 111.7, 110.4, 99.1. lr-ms (esi): m/z 447.9 [m+h]
+
.3-iodo-9-(2-iodophenyl)-9h-carbazole(3aj). white solid, yield 91%. 1
h nmr (400 mhz, cdcl3) δ 8.47 (s, 1h), 8.16
ꢀ–ꢀ
8.06 (m, 2h), 7.65 (dd, j = 8.5, 1.6 hz, 1h), 7.57 (td, j = 7.6, 1.3 hz, 1h), 7.46
ꢀ–ꢀ
7.38 (m, 2h), 7.36
ꢀ–ꢀ
7.27 (m, 2h), 7.02 (d, j = 8.2 hz, 1h), 6.82(d, j = 4 hz,1h). 13
c nmr (101 mhz, cdcl3) δ 140.9, 140.7, 139.99, 139.96, 134.4, 130.8, 130.7, 130.0, 129.4, 126.9, 125.9, 122.1, 120.7, 120.6, 112.4, 110.4, 99.2, 82.9. lr-ms (esi): m/z 495.9 [m+h]
+
.10-(2-iodo-3,4,5,6-tetramethylphenyl)-10h-phenothiazine-1-carbonitrile(3ak). white solid,yield 43%. 1
h nmr (400 mhz, cdcl3) δ 6.94 (dd, j = 7.9, 1.6 hz, 1h), 6.88 (d, j = 7.9 hz, 1h), 6.86
ꢀ–ꢀ
6.79 (m, 1h), 6.80
ꢀ–ꢀ
6.72 (m, 2h), 5.89 (d, j = 1.5 hz, 1h), 5.84
ꢀ–ꢀ
5.77 (m, 1h), 2.61 (s, 3h), 2.42 (s, 3h), 2.30 (s, 3h), 2.20 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 141.4, 140.9, 139.5, 138.1, 137.3, 136.9, 135.7, 127.8, 126.6, 126.42, 126.39, 125.8, 123.2, 119.6, 117.3, 116.6, 115.2, 110.3, 107.0, 27.8, 18.7, 17.2, 17.1. lr-ms (esi): m/z 483.0 [m+h]
+
.10-(2-iodo-4,5-dimethylphenyl)-10h-phenothiazine-1-carbonitrile (3al). white solid,yield 47%. 1
h nmr (400 mhz, cdcl3) δ 7.87 (s, 1h), 7.16 (s, 1h), 6.99 (dd, j = 7.9, 1.5 hz, 1h), 6.94 (d, j = 7.9 hz, 1h), 6.91
ꢀ–ꢀ
6.87 (m, 1h), 6.85
ꢀ–ꢀ
6.77 (m, 2h), 6.10 (d, j = 1.5 hz, 1h), 6.02
ꢀ–ꢀ
5.97 (m, 1h), 2.35 (s, 3h), 2.31 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 142.8, 142.3, 141.0, 140.5, 140.3, 139.0, 132.9, 127.3, 126.8, 126.7, 126.6, 126.0, 123.4, 119.1, 117.7, 117.4, 116.0, 110.2, 97.6, 19.9, 19.3. lr-ms (esi): m/z 455.0 [m+h]
+
.10-(6-iodobenzo[d] [1,3] dioxol-5-yl)-10h-phenothiazine-1-carbonitrile (3am). white solid, yield 55%. 1
h nmr (400 mhz, cdcl3) δ 7.06
ꢀ–ꢀ
with 1-(5-(tert-butyl)-2-iodophenyl)-3,5-diphenyl-1h-pyrazole (2:1) (3bb). white solid, yield 46%.1h nmr (400 mhz, cdcl3) δ 7.94 (dd, j = 10.7, 3.6 hz, 2.7h), 7.87 (d, j = 2.0 hz, 0.5h), 7.77 (d, j = 8.4 hz, 1h), 7.45
ꢀ–ꢀ
7.36 (m, 3.5h), 7.36
ꢀ–ꢀ
7.31 (m, 2.5h), 7.24 (dt, j = 10.1, 3.6 hz, 7h), 7.11 (dd, j = 8.4, 2.4 hz, 1.5h), 6.87 (d, j = 6.6 hz, 1.5h), 1.30 (s, 4.5h), 1.20 (s, 9h). 13
c nmr (101 mhz, cdcl3) δ 154.2, 152.8, 152.02, 151.97, 145.6, 142.6, 140.6, 139.5, 137.0, 133.2, 130.14, 130.08, 129.0, 128.70, 128.68, 128.5, 128.4, 128.3, 128.0, 127.7, 127.3, 126.3, 126.02, 125.98, 103.8, 97.9, 93.6, 34.8, 34.7, 31.2, 31.0. lr-ms (esi): m/z 479.1 [m+h]
+
.1-(6-iodobenzo[d] [1,3] dioxol-5-yl)-3,5-diphenyl-1h-pyrazole (3bc). white solid, yield 31%.1h nmr (400 mhz, cdcl3) δ 7.98
ꢀ–ꢀ
7.90 (m, 2h), 7.44 (t, j = 7.5 hz, 2h), 7.38
ꢀ–ꢀ
7.29 (m, 6h), 6.94 (s, 1h), 6.86 (s, 1h), 6.05 (s, 2h). 13
c nmr (101 mhz, cdcl3) δ 152.1, 149.1, 148.7, 145.7, 137.0, 133.1, 130.1, 128.8, 128.6, 128.5, 128.4, 128.2, 126.0, 118.3, 110.2, 103.9, 102.7, 87.4. lr-ms (esi): m/z 467.0 [m+h]
+
.本发明公开了邻二碘苯在氢化钠作用下,与仲胺反应生成邻碘芳胺化合物。这类反应更加快速、简捷而且温和,不需要过渡金属催化,没有过度偶联的副产物,官能团耐受性好,原料邻二碘苯廉价易得,是一种快速实现n-芳基化的新颖方法。此类反应主产物为2-碘代芳胺类化合物,用其他方法难以一步获得,产物易于转化,具有重要的应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1