一种邻碘苯基化合物的制备方法
1.本发明属于有机合成技术,具体涉及一种邻碘苯基化合物的制备方法。
背景技术:
2.含有酰胺以及胺类的结构是有机化学、材料化学等学科中及其重要的合成中间体或者目标产物,在药物合成领域和功能材料制造领域广泛应用,扮演着不可或缺的作用。一般来说,酰胺以及胺类化合物的c-n偶联芳基化反应是在金属催化下完成的。但是近些年来,常用的一些金属催化剂价格水涨船高,使得药物研发与制造成本大大增加,且使用金属催化剂后的金属残留问题也比较突出,这对药物合成工艺的研究是一个巨大的考验;且所用的重金属以及配体也会对环境造成严重污染,这是必须考虑的问题。
技术实现要素:
3.现有上市的药物中,含有c-n键的药物分子不计其数。因此,发展一种高效、便捷、经济、环保的c-n偶联方法具有重大的意义。本发明介绍了一种以邻二碘苯为前体,不需要金属催化剂和及其昂贵特殊的配体以及高温、高压等条件,高效构建c-n键的新方法。
4.本发明采用如下技术方案:一种邻碘苯基化合物的制备方法,以碘苯化合物、酰胺化合物为原料,在氢化钠、氢化钾或者正丁基锂,溶剂存在下,反应得到邻碘苯基化合物。优选的,反应的温度为室温~50℃。
5.本发明中,溶剂为四氢呋喃、二甲基乙酰胺、1,4-二氧六环、乙二醇二甲醚中的一种或几种。
6.本发明中,碘苯化合物、酰胺化合物、氢化钠或者氢化钾的摩尔比为(2~3)∶1∶(2~3);碘苯化合物、酰胺化合物、正丁基锂的摩尔比为(2~3)∶1∶(1.5~2.5)。
7.本发明中,碘苯化合物为如下化学结构:酰胺化合物为如下化学结构:邻碘苯基化合物为如下化学结构:g1、g2独立的选择烷基或者芳基、杂环基,r为氢、烷基或者芳基、杂环基,x为碘、溴、氯或者三氟甲磺酸基;优选的,芳基含有一个或者多个苯环,含有或者不含有取代基;烷基为直连烷基或者环烷基、支链烷基。
8.本发明公开了一种具有重要意义的c-n偶联新方法,此方法无需金属催化剂,无需高温、高压,条件温和,并能得到独特的邻碘苯基产物,由于碘原子在有机合成转化中是万能官能团,便于产物的衍生化,所以具有重要意义。
附图说明
9.图1为本发明部分原料及制备示意图。
10.图2为本发明部分原料及制备示意图。
11.图3为本发明部分原料及制备示意图。
12.图4为本发明n-苄基苯甲酰胺与邻二碘苯在不同条件下的反应结果示意图。
13.图5为芳香酰胺底物拓展示意图。
14.图6为脂肪族酰胺拓展示意图。
15.图7为被boc或者cbz保护后的伯胺化合物拓展示意图。
16.图8为芳胺底物拓展示意图。
17.图9为邻碘苯化合物拓展示意图。
18.图10为放大实验示意图。
具体实施方式
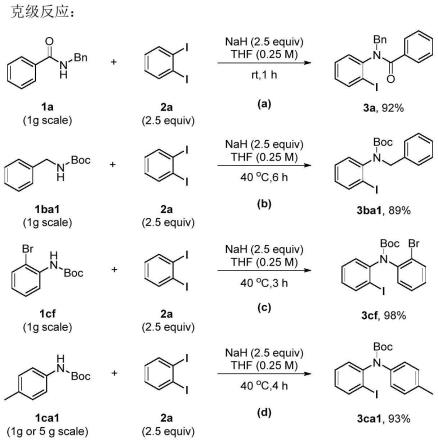
19.本发明公开了一种非金属催化进行c-n偶联的的新方法,进行了底物拓展以及一定规模的放大实验,证明了此方法无需金属催化剂,无需高温、高压,条件温和,可以方便快捷的高效构建c-n键,并能得到独特的邻碘芳基化产物,具有非常高的实用价值,并且有大规模制备的工业前景。之后,将得到的产物作为合成中间体进一步衍生化,制备了多种多样具有重要价值的化合物,证明了其同样具有非常高的应用价值。因此,本论文发展的新方法具有重要的意义。
20.安捷伦400 mhz (1h nmr)和布鲁克400 mhz (1h nmr和
13
c nmr)核磁仪器(苏州大学分析测试中心提供测试服务,1h nmr谱参考tms (0.00 ppm)及
13
c nmr谱参考cdcl3溶剂中心峰(77.10 ppm)进行定标,化学位移以ppm为单位,核磁数据报告包括:化学位移,峰型,氢个数峰面积积分,偶合常数等。);安捷伦lc-ms液质联用仪(苏州大学药学院公共实验仪器平台);85-1型磁力搅拌器(郑州科泰);df-101s集热式恒温加热磁力搅拌器(郑州科泰);旋转蒸发仪(eyela);bsa224s分析天平(sartorius);玻璃仪器(欣维尔);zf-7型254 nm或365 nm手提式紫外检测灯(上海光豪);200-300目快速柱层析硅胶(青岛海洋化工);含有tms内标的cdcl3或d6-dmso(百灵威);常用显色剂(碘缸、kmno4、磷钼酸以及2,4-二硝基苯肼);其余试剂及溶剂(均为市售分析纯或化学纯)。
21.本发明涉及的底物可市购,也可以根据以下方法合成,具体制备操作以及测试方法都为常规技术。
22.合成例图1、图2、图3为部分原料及制备示意。底物合成的一般步骤(1c-1n, 1p-1ae):将苯甲酸衍生物(10 mmol, 1.0 equiv)溶解在二氯甲烷(20 ml, 0.5 m)溶液中,加入1滴dmf和草酰氯(15 mmol, 1.5 equiv);将反应混合物搅拌成为均相溶液后,在减压蒸馏下除去溶剂。生成的粗酰氯被重新溶解在二氯甲烷(20 ml, 0.5 m)中,在冰水浴下将甲胺盐酸盐
或乙胺盐酸盐(15 mmol, 1.5 equiv)和三乙胺(30 mmol, 3.0 equiv)依次滴加到反应混合物中,室温搅拌过夜。将水加入反应后的溶液中,用乙酸乙酯(3 x 100 ml)萃取。得到的有机相用无水na2so4干燥、过滤、减压蒸馏。用乙酸乙酯与石油醚对混合物进行打浆或者快速柱层析纯化,得到纯产品(1c-1n, 1p-1ae),产率80-99%。将溴代芳酰胺1k (10 mmol, 1.0 equiv),pdcl2(dppf) (0.3 mmol, 3 mol%),koac (30 mmol, 3.0 equiv)和联硼酸频那醇酯(15 mmol, 1.5 equiv)的混合物溶解在1,4-二氧六烷中,在80
ꢀ°
c下搅拌过夜。待反应冷却至室温后,用水稀释,乙酸乙酯萃取。得到的有机相用水和饱和nacl洗涤,无水na2so4干燥、过滤、减压蒸馏。用乙酸乙酯、石油醚为洗脱剂,快速柱层析对粗产物进行分离纯化,得到纯产品1o,产率92%。底物合成的一般步骤(1af-1am):在圆底烧瓶中,依次加入羧酸(10 mmol, 1.0 equiv)、edci (15 mmol, 1.5 equiv)、dmap (5 mmol, 0.5 equiv)、dcm (20 ml),混合物搅拌20 min。随后,在上述混合液中加入乙胺盐酸盐(10 mmol, 1.0 equiv)和三乙胺(20 mmol, 2.0 equiv)。将反应液在室温下搅拌12 h,用1 n hcl溶液淬灭反应,分离有机相,用饱和nahco3溶液洗涤有机相,无水na2so4干燥、过滤、减压蒸馏。快速柱层析对粗产物进行分离纯化(通常用石油醚和乙酸乙酯的混合物作为洗脱剂),得到纯产品1af-1am,产率80-99%。将苯丙炔酸 (11 mmol, 1.1 equiv)溶解在dcm (20 ml, 0.5 m)溶液中,加入dmap (1.0 mmol, 0.1 equiv)和dcc (11 mmol, 1.1 equiv) ,然后搅拌约10 min。随后,在0
ꢀ°
c下将溶于dcm (10 ml, 1.0 m)的苄胺(10 mmol, 1.0 equiv)滴入混合液中,所得混合物在室温下搅拌16 h。通过减压蒸馏除去一部分溶剂,将粗混合物溶液通过硅藻土过滤,用乙醚洗脱。通过在硅胶上预吸附,快速柱层析对粗产物进行分离纯化(通常用石油醚和乙酸乙酯的混合物作为洗脱剂),得到纯产品1an,产率82%。底物合成的一般步骤(1ba1, 1bb1, 1bc-1bw, 1ca1, 1cb-1co1, 1cp-1cs):将胺类化合物(10 mmol, 1.0 equiv)溶解在乙醇(20 ml, 0.5 m)溶液中(制备1cm时使用叔丁醇, 1cd, 1cg, 1ck使用甲醇),加入(boc)2o (12 mmol, 1.2 equiv) (制备1cq-1cs时为2.4 equiv)。在30-100
ꢀ°
c(根据溶剂选择)下将反应,tlc测反应进度。反应完成后,将溶剂减压除去,用乙酸乙酯与石油醚对混合物进行打浆,或者快速柱层析对粗产物进行分离纯化(通常用石油醚和乙酸乙酯的混合物作为洗脱剂),得到纯产品(1ba1, 1bb1, 1bc-1bw, 1ca1, 1cb-1co1, 1cp-1cs),产率70-99%。将肼基甲酸叔丁酯(10 mmol, 1.0 equiv)和对甲基苯甲醛(10 mmol, 1.0 equiv)溶解在etoh (0.25 m)溶液中,在80
ꢀ°
c下搅拌回流6 h。反应完成后,通过减压蒸馏除去溶剂,将粗产品重结晶,得到纯产品1baa,产率94%。将四氢吡咯(10 mmol, 1.0 equiv)和间氯苯异氰酸酯(10 mmol, 1.0 equiv)溶解在dcm (0.25 m)溶液中,在室温下搅拌1 h。反应完成后,通过减压蒸馏除去溶剂,将粗产品重结晶,得到纯产品1cw,产率93%。邻碘苯酚(10 mmol, 1.0 equiv)溶解在dcm (0.33 m)的溶液中,在-78
ꢀ°
c下将无水dipea (12.5 mmol, 1.25 equiv)和三氟甲磺酸酐(12.5 mmol, 1.25 equiv)依次滴加到反应液中。10 min后,移开冷却装置,反应混合物逐渐恢复至室温反应。1-2 h后,加入水淬灭反应,用乙酸乙酯萃取,之后合并有机相并用饱和nacl洗涤,无水na2so4干燥、过滤、减压蒸馏。快速柱层析对粗产物进行分离纯化(石油醚作为洗脱剂),得到纯产品2d,产率89%。在水(15 ml)和甲苯(15 ml)的混合物中加入氢氧化钠(3.05 g, 76.2 mmol, 3.8 equiv),然后依次加入四丁基溴化铵(0.65 g, 2.0 mmol, 2.0 equiv)、2-羟基苯并咪唑( 2.68 g, 20.0 mmol, 1.0 equiv)和苄溴(8.20 g, 48.0 mol, 2.4 equiv)。60
ꢀ°
c下反应12 h后,冷却至
室温,用分液漏斗直接分离有机层,用水洗涤3次,饱和食盐水洗涤1次,无水na2so4干燥,过滤,减压去除溶剂后,快速柱层析(石油醚:乙酸乙酯= 10:1)进行纯化,得到化合物10a (5.53 g),产率88%;将dcm (20 ml)、乙酸(17.6 ml)、质量分数为20 %的硫酸水溶液(10.6 ml)加入100 ml两口瓶中,依次将化合物10a (5.53 g, 17.6 mmol, 1.0 equiv)、碘酸(1.55 g, 8.8 mmol, 0.5 equiv)、i
2 (4.52 g, 17.6 mmol, 1.0 equiv)加入两口瓶中,60
ꢀ°
c回流搅拌反应12 h,待反应体系温度降至室温,边搅拌边将反应液倒入水中,用dcm萃取两遍(3 x 30 ml),随后分离有机相并用水将有机相洗至中性,无水na2so4干燥,过滤,减压浓缩,将粗产物固体用石油醚重结晶,得到白色固体化合物2g,收率63%。在n2保护条件下,依次将hio
4 (8.0 mmol, 0.4 equiv),i
2 (16.0 mmol, 0.8 equiv)加入meoh (30 ml, 0.66 m)溶液中搅拌溶解,随后将邻二甲氧基苯(20 mmol, 1.0 equiv)加入混合液中,并将混合液移至70
ꢀ°
c条件下搅拌21 h。待反应完成后,将反应体系冷却至室温,加入适量饱和nahso3溶液还原过量的碘单质,处理后的反应液变为白色混悬液,减压抽滤,收集滤饼,烘箱55
ꢀ°
c干燥,得到白色固体产品2i,产率86%。在氮气保护下,将相应的炔醇(10 mmol, 1.0 equiv)溶解在无水的dmf (10 ml, 1.0 m)中,室温下依次加入k2co
3 (1.93 g, 14 mmol, 1.4 equiv)、四丁基溴化铵(483 mg, 1.5 mmol, 0.15 equiv)和cui (96 mg, 0.5 mmol, 0.05 equiv)。混合物搅拌15 min后,加入3-氯-2-甲基丙烯(1.36 g, 15 mmol, 1.5 equiv),继续将反应混合物搅拌24 h。待反应完成后,将反应液倒入水(20 ml)中,用乙酸乙酯(3 x 30 ml)萃取,合并有机相后再用水(3 x 30 ml)反萃洗掉dmf。有机相用饱和nacl水溶液洗涤一次,无水na2so4干燥、过滤、减压蒸馏。粗产品经快速柱层析(石油醚:乙酸乙酯=10:1)纯化,得到相应的纯产品10c或10d,产率均为80%,为淡黄色油状液体;将10c或10d (8 mmol, 1.0 equiv)溶解在ch3no
3 (115 ml, 0.07 m)中,在室温下加入i
2 (3.66 g, 14.4 mmol, 1.8 equiv)并搅拌2 h。tlc检测反应完全后,加入nahso3水溶液还原过量的碘,随后用乙酸乙酯(3 x 50 ml)萃取,合并有机相并用饱和nacl水溶液洗涤一次,无水na2so4干燥、过滤、减压蒸馏。粗产品在室温下无需纯化直接加入dcm (160 ml, 0.05 m)溶液,然后加入ddq (3.63 g, 16 mmol, 2.0 equiv)。tlc检测反应完全后,先过滤除去固体残渣,滤液加入硅胶拌样。经快速柱层析(石油醚作为洗脱剂)纯化得到相应二碘苯衍生物2m or 2o。在室温下,将3-苯-1-丙炔(6.0 mmol, 1.2 equiv)溶解在thf (5 ml, 1.0 m)中,加入乙基溴化镁(5.5 ml, 1.0 m in thf, 1.1 equiv),反应混合物在50
ꢀ°
c下搅拌1 h。撤去加热仪器,将溶解在少量thf中的4-溴苯甲醛(5.0 mmol, 1.0 equiv)缓慢滴加到上述反应液中,室温下搅拌3 h。反应完成后加入饱和nh4cl溶液淬灭反应,用乙酸乙酯(2 x 40 ml)萃取。常规处理后,用快速柱层析法对粗产品进行纯化,得到纯的1-(4-溴苯基)-4-苯基-2-炔-1-醇10e,收率为80%;在室温下,将化合物10e (4.0 mmol, 1.0 equiv)溶解在ch3no
3 (60 ml, 0.07 m)溶液中,加入i
2 (2.03 g, 8.0 mmol, 2.0 equiv)并搅拌2 h。tlc检测反应完全后,加入适量nahso3水溶液还原过量的碘,随后用乙酸乙酯(3 x 30 ml)萃取,合并有机相并用饱和nacl水溶液洗涤一次,无水na2so4干燥、过滤、减压蒸馏。粗产品在室温下无需纯化直接加入dcm (80 ml, 0.05 m)溶液,然后加入ddq (2.72 g, 12 mmol, 3.0 equiv)。tlc检测反应完全后,先过滤除去固体残渣,滤液加入硅胶拌样。经快速柱层析(石油醚作为洗脱剂)纯化得到相应二碘苯衍生物2n,收率为63%,黄色固体化合物。
实施例
23.胺类化合物与邻碘苯化合物的通用的反应步骤:将溶解在thf (2.0 ml) 溶液中的化合物1 (0.6 mmol, 1.0 equiv)加入氢化钠 (60% in oil, 60 mg, 1.5 mmol, 2.5 equiv)中,室温下常规搅拌2min,然后加入溶解在thf (0.4 ml) 溶液中的化合物2 (1.5 mmol, 2.5 equiv),特定温度下反应1-15 h;然后将反应液加入水(5.0 ml)中,用乙酸乙酯(3
×
3.0 ml)萃取,合并有机层,用无水na2so4干燥,过滤,蒸干,快速柱层析纯化,得到产物邻碘苯基化合物3,产率20-98%。
24.n-苄基苯甲酰胺1a与邻二碘苯2a在nah作用下制备3a的反应参见图4,标准反应条件为将氢化钠 (60% in oil, 60 mg, 1.5 mmol, 2.5 equiv) 称量至反应瓶中,常规磁力搅拌下加入溶解在thf (2.0 ml) 溶液中的化合物1a (127 mg, 0.6 mmol, 1 equiv),室温下搅拌2 min;然后加入溶解在thf (0.4 ml) 溶液中的化合物2a (496 mg, 196
ꢀµ
l, 1.5 mmol, 2.5 equiv),室温反应1小时;再将反应液加入水(5.0 ml)中,用乙酸乙酯(3 x 3.0 ml)萃取,合并有机层,用无水na2so4干燥,过滤,蒸干,快速柱层析纯化,得到2-碘芳基化产物3a,产率90%。单因素更换条件,取得不同产物收率,为分离收率。
25.在上述标准反应条件下进行底物拓展,参见图5、图6、图7、图8、图9。图5对芳香酰胺进行了底物拓展,无论是具有强吸电子基的三氟甲基、三氟甲氧基,给电子基的甲氧基,还是乙烯基、卤素等基团,都能得到非常高的产率(3b-3aa),芳杂环酰胺(3ab-3ad)也能有不错的收率,图5中,从产物可确定芳香酰胺化合物的结构;nah (1.5 mmol, 2.5 equiv) 、化合物1 (0.6 mmol, 1.0 equiv) 溶于thf (2.0 ml) 、2a (1.5 mmol, 2.5 equiv) 溶于thf (0.4 ml) ,室温反应(除了两个底物),其中:b40
ꢀ°
c反应,c50
ꢀ°
c反应;反应时间见图5。图6对脂肪族酰胺进行了拓展,无论是烯基、炔基还是烷基都能有中等产率的产物(3ae-3an) ,图6中,从产物可确定脂肪族酰胺化合物的结构;nah (1.5 mmol, 2.5 equiv) 、化合物1 (0.6 mmol, 1.0 equiv) 溶于thf (2.0 ml) 、2a (1.5 mmol, 2.5 equiv) 溶于thf (0.4 ml) ,室温反应(除了三个底物),其中:b40
ꢀ°
c反应;反应时间见图6。图7对伯胺被boc或者cbz保护后的一系列化合物进行拓展,无论是boc还是cbz保护下的伯胺反应情况差别不大,各种类型的脂肪胺都能有中等偏上的收率(3ba1-3bz);抗感染药物利奈唑胺在经过boc保护后反应可以给出82%的收率(3bw),boc保护的肼类化合物也能有30%的产率(3baa) ,图7中,从产物可确定酰胺化合物1的结构;nah (1.5 mmol, 2.5 equiv) 、化合物1 (0.6 mmol, 1.0 equiv) 溶于thf (2.0 ml) 、2a (1.5 mmol, 2.5 equiv) 溶于thf (0.4 ml) ,40℃反应(除了三个底物),其中:b50
ꢀ°
c反应,c室温反应;反应时间见图7。图8对芳胺类型的底物进行了拓展,boc或cbz保护的单取代芳香胺(3ca1-3cg)、多取代芳香胺(3ch-3cl)、杂环类芳胺(3cam-3cp)以及双反应位点的芳胺类化合物(3cq-3cs)都能有非常高的产率,甚至吡啶酮类、哌啶胺类以及脲类化合物也都有不错的产率(3ct-3cw),图8中,从产物可确定芳胺化合物的结构;nah (1.5 mmol, 2.5 equiv) 、化合物1 (0.6 mmol, 1.0 equiv) 溶于thf (2.0 ml) 、2a (1.5 mmol, 2.5 equiv) 溶于thf (0.4 ml) ,40℃反应(除了五个底物),其中:b50
ꢀ°
c反应,d室温反应,有三个底物的原料用量变化,c2a (5.0 equiv)、nah (5.0 equiv);反应时间见图8。图9对邻碘苯化合物进行了拓展,具有对称结构的二碘苯都能有不错的收率(3da-3df),无论邻位是甲基、甲氧基、苯基还是苯乙烯基都能有不错的产率,并且没有检测到异构体的产生,区域选择性优秀(3dg-3dk) ,图9中,从产物
107.40, 101.27, 98.90, 37.86. lr-ms (esi): m/z 382.0 [m+h]
+
.n-(2-iodophenyl)-n-methyl-1-naphthamide (3y):1h nmr (400 mhz, cdcl3) major isomer: δ 8.19 (d, j = 8.4 hz, 1h), 7.76-7.66 (m, 2h), 7.64 (d, j = 8.2 hz, 1h), 7.61
ꢀ–ꢀ
7.35 (m, 3h), 7.16 (t, j = 7.6 hz, 1h), 6.94 (d, j = 7.6 hz, 1h), 6.87 (t, j = 7.4 hz, 1h), 6.71 (t, j = 7.5 hz, 1h), 3.51 (s, 3h); minor isomer: δ 7.98 (d, j = 7.8 hz, 1h), 7.91 (t, j = 7.1 hz, 2h), 7.76-7.66 (m, 1h), 7.61
ꢀ–ꢀ
7.35 (m, 6h), 7.13-7.05 (m, 1h), 3.07 (s, 1h). 13
c nmr (101 mhz, cdcl3) δ 170.49, 170.37 (minor), 146.28, 145.51 (minor), 140.14 (minor), 140.02, 134.11 (minor), 133.83, 133.63 (minor), 133.33, 130.39, 129.96 (minor), 129.73 (minor), 129.61 (minor), 129.49 (minor), 129.36, 129.21, 129.10, 129.04, 128.49 (minor), 128.27, 127.11 (minor), 126.78, 126.53 (minor), 126.11, 125.71, 125.13 (minor), 124.33, 124.32, 124.24 (minor), 98.69, 98.22 (minor), 39.86 (minor), 36.89. lr-ms (esi): m/z 388.0 [m+h]
+
.n-(2-iodophenyl)-n-methyl-2-naphthamide (3z):1h nmr (400 mhz, cdcl3) δ 7.90 (s, 1h), 7.75 (s, 1h), 7.69 (d, j = 6.8 hz, 2h), 7.60 (d, j = 8.4 hz, 1h), 7.47
ꢀ–ꢀ
7.38 (m, 3h), 7.14 (s, 2h), 6.82 (s, 1h), 3.42 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 170.75, 147.02, 140.18, 133.67, 133.04, 132.21, 130.14, 129.43, 129.08, 128.94, 128.66, 127.56, 127.30, 127.14, 126.28, 125.28, 99.11, 37.73.lr-ms (esi): m/z 387.9 [m+h]
+
.n-ethyl-n-(2-iodophenyl)-4-methoxybenzamide (3aa):1h nmr (400 mhz, cdcl3) δ 7.82 (d, j = 7.6 hz, 1h), 7.41
ꢀ–ꢀ
7.26 (m, 2h), 7.23 (t, j = 6.8 hz, 1h), 7.04 (d, j = 4.5 hz, 1h), 6.92 (t, j = 6.9 hz, 1h), 6.64 (d, j = 6.8 hz, 2h), 4.28 (s, 1h), 3.71 (s, 3h), 3.49 (m, 1h), 1.22 (t, j = 6.8 hz, 3h). 13
c nmr (101 mhz, cdcl3) δ 169.76, 160.60, 145.45, 140.28, 131.44, 130.45, 128.99, 128.85, 128.34, 112.89, 100.20, 77.42, 77.10, 76.78, 55.16, 44.72, 12.49. lr-ms (esi): m/z 382.0 [m+h]
+
.n-ethyl-n-(2-iodophenyl)-1-methyl-1h-indole-2-carboxamide (3ab):1h nmr (400 mhz, cdcl3) δ 7.77 (d, j = 6.6 hz, 1h), 7.36 (d, j = 6.5 hz, 2h), 7.31 (d, j = 7.9 hz, 2h), 7.22 (d, j = 7.5 hz, 1h), 7.04
ꢀ–ꢀ
6.93 (m, 2h), 5.93 (s, 1h), 4.18 (m, 1h), 4.01 (s, 3h), 3.70 (m, 1h), 1.29 (t, j = 7.0 hz, 3h). 13
c nmr (101 mhz, cdcl3) δ 163.01, 145.43, 140.31, 138.00, 131.99, 130.23, 129.29, 129.28, 126.11, 123.60, 121.90, 119.88, 109.86, 107.16, 100.65, 44.83, 31.97, 12.92. lr-ms (esi): m/z 405.0 [m+h]
+
.n-ethyl-n-(2-iodophenyl)thiophene-2-carboxamide (3ac):1h nmr (400 mhz, cdcl3) δ 7.97 (d, j = 7.9 hz, 1h), 7.42 (t, j = 7.5 hz, 1h), 7.30 (s, 2h), 7.14 (t, j = 7.6 hz, 1h), 6.81 (s, 2h), 4.35 (m, 1h), 3.37 (m, 1h), 1.26 (t, j = 7.1 hz, 3h). 13
c nmr (101 mhz, cdcl3) δ 161.80, 144.43, 140.52, 138.07, 132.05, 131.40, 130.85, 130.22, 129.55, 126.76, 101.44, 45.14, 12.62. lr-ms (esi): m/z 357.9 [m+h]
+
.
(minor),127.77,127.54,110.42,109.50,109.03(minor),100.15,99.88(minor),67.87(minor),67.57,46.44(minor),45.97.lr-ms(esi):m/z434.0[m+h]
+
.tert-butyl(4-fluorobenzyl)(2-iodophenyl)carbamate(3bc):1hnmr(400mhz,cdcl3)δ7.89(minor)/7.85(major)(brd,j=7.6hz1h),7.24
–
7.14(brm,3h),7.02
–
6.88(brm,3h),6.73(brd,j=7.7hz,1h),5.17(major)/5.09(minor)(brd,j=14.8hz1h),4.13(brd,j=14.8hz1h),1.55(minor)/1.37(major)(brs,9h).
13
cnmr(101mhz,cdcl3)δ163.50,161.06,154.28,143.99,139.88(minor),139.50,133.57(minor),130.87(d,j=7.9hz,130.91,130.83),130.57,130.19,129.07(minor),128.72(d,j=12.2hz,128.78,128.66),115.22(d,j=21.3hz,115.33,115.12),100.32,81.25(minor),80.53,53.31(minor),51.98,28.55(minor),28.30.
19
fnmr(377mhz,cdcl3)δ-114.9,-115.0.lr-ms(esi):m/z450.0[m+na]
+
.tert-butyl(4-chlorobenzyl)(2-iodophenyl)carbamate(3bd):1hnmr(400mhz,cdcl3)δ7.89(minor)/7.85(major)(brd,j=7.6hz1h),7.30
–
7.14(brm,5h),6.94(brt,j=7.3hz,1h),6.74(brd,j=7.6hz,1h),5.18(major)/5.09(minor)(brd,j=14.8hz1h),4.13(brd,j=14.8hz1h),1.54(minor)/1.36(major)(brs,9h).
13
cnmr(101mhz,cdcl3)δ154.28,153.99(minor),144.38(minor),144.00,139.89(minor),139.52,136.45(minor),136.29,133.32,130.53,130.13,129.83(minor),129.10(minor),128.83,128.70,128.56,100.24,81.32(minor),80.60,53.41(minor),52.10,28.53(minor),28.28.lr-ms(esi):m/z466.0[m+na]
+
.tert-butyl(4-bromobenzyl)(2-iodophenyl)carbamate(3be):1hnmr(400mhz,cdcl3)δ7.88(minor)/7.84(major)(brd,j=7.6hz1h),7.46
–
7.30(brm,2h),7.24
–
7.07(brm,3h),6.94(brt,j=6.3hz,1h),6.75(brd,j=7.1hz,1h),5.17(major)/5.08(minor)(brd,j=14.8hz1h),4.08(brd,j=14.8hz1h),1.54(minor)/1.36(major)(brs,9h).
13
cnmr(101mhz,cdcl3)δ154.24,153.93(minor),144.10(minor),143.95,139.87(minor),139.50,136.95(minor),136.77,131.49,130.84,130.49(minor),130.09,129.11(minor),128.82,128.70,121.45,100.21,81.28(minor),80.58,53.41(minor),52.13,28.52(minor),28.26.lr-ms(esi):m/z509.9[m+na]
+
.tert-butyl(2-iodophenyl)(4-(trifluoromethyl)benzyl)carbamate(3bf):1hnmr(400mhz,cdcl3)δ7.90(minor)/7.86(major)(brd,j=7.7hz1h),7.55(brd,j=7.7hz,2h),7.38(brd,j=8.0hz,2h),7.19(brt,j=7.6hz,1h),6.96(brt,j=7.3hz,1h),6.78(brd,j=7.6hz,1h),5.27(major)/5.18(minor)(brd,j=14.8hz1h),4.23(minor)/4.18(major)(brd,j=14.8hz1h),1.54(minor)/1.37(major)(brs,9h).
13
cnmr(101mhz,cdcl3)δ154.37,153.97(minor),144.51(minor),144.13,142.10(minor),141.87,140.02(minor),139.66,130.41(minor),130.25(minor),130.03,
mhz, cdcl3) δ 7.48 (s, 1h), 7.38 (d, j = 7.2 hz, 2h), 7.32
ꢀ–ꢀ
7.25 (m, 5h), 7.24
ꢀ–ꢀ
7.16 (m, 2h), 7.12 (t, j = 7.2 hz, 2h), 6.42 (s, 1h), 5.73 (d, j = 14.2 hz, 1h), 4.25 (d, j = 14.2 hz, 1h), 2.08 (s, 3h), 1.91 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 170.48, 142.16, 140.44, 138.25, 137.49, 137.04, 136.17, 132.64, 129.55, 128.37, 128.34, 127.53, 127.50, 95.91, 52.78, 19.18, 18.92. lr-ms (esi): m/z 442.0 [m+h]
+
.n-benzyl-n-(2-iodo-3,4,5,6-tetramethylphenyl)benzamide (3df):1h nmr (400 mhz, cdcl3) δ 7.39
ꢀ–ꢀ
7.35 (m, 2h), 7.28
ꢀ–ꢀ
7.15 (m, 6h), 7.11
ꢀ–ꢀ
7.06 (m, 2h), 5.76 (d, j = 13.7 hz, 1h), 4.23 (d, j = 13.7 hz, 1h), 2.55 (s, 3h), 2.23 (s, 3h), 1.88 (s, 3h), 1.31 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 170.10, 140.54, 138.83, 136.49, 136.45, 136.32, 135.40, 134.98, 130.83, 129.55, 128.13, 127.83, 127.68, 127.33, 107.12, 53.89, 28.04, 18.47, 17.55, 16.77. lr-ms (esi): m/z 470.1 [m+h]
+
.tert-butyl (2-iodo-3-methoxyphenyl)(p-tolyl)carbamate (3dh):1h nmr (400 mhz, cdcl3) δ 7.28 (t, j = 8.1 hz, 1h), 7.21 (d, j = 8.4 hz, 2h), 7.06 (d, j = 8.2 hz, 2h), 6.90 (dd, j = 7.9, 1.2 hz, 1h), 6.73 (dd, j = 8.3, 1.0 hz, 1h), 3.90 (s, 3h), 2.28 (s, 3h), 1.44 (s, 9h). 13
c nmr (101 mhz, cdcl3) δ 159.54, 152.88, 146.71, 139.30, 134.63, 129.71, 129.08, 124.88, 122.57, 109.36, 93.45, 81.27, 56.74, 28.34, 20.94. lr-ms (esi): m/z 462.0 [m+na]
+
.tert-butyl (2-mercaptophenyl)(p-tolyl)carbamate (9j):1h nmr (400 mhz, cdcl3) δ 7.54 (d, j = 7.4 hz, 1h), 7.19
ꢀ–ꢀ
7.11 (m, 5h), 7.05 (d, j = 8.4 hz, 2h), 2.29 (s, 3h), 1.45 (s, 9h). 13
c nmr (101 mhz, cdcl3) δ 141.01, 140.45, 137.62, 133.47, 131.24, 130.80, 130.75, 129.97, 129.68, 129.16, 128.67, 120.66, 119.29, 116.85, 20.74. 13
c nmr (101 mhz, cdcl3) δ 153.43, 153.13 (minor), 140.46 (minor), 140.41, 139.42, 136.11, 135.94 (minor), 135.07 (minor), 135.00, 129.33, 129.26 (minor), 129.19, 129.07 (minor), 128.02, 127.76, 127.46, 125.47, 125.16 (minor), 81.49, 81.17 (minor), 28.27, 27.95 (minor), 20.96, 20.67 (minor). lr-ms (esi): m/z 316.1 [m+h]
+
.本发明的反应无需金属催化剂,邻二碘苯有市售,价格便宜、化学性质稳定;反应条件温和,既不需要低温也不需要高温,所用试剂廉价易得,是非常实用的c-n偶联芳基化的新方法。因此,发展这样一种无金属催化的酰胺以及boc (cbz)保护的胺类化合物的c-n偶联芳基化反应意义非常重大。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1