一种多取代手性四氢喹啉类化合物的合成方法
:
1.本发明属于有机化学技术领域,具体涉及一种多取代手性四氢喹啉类化合物的合成方法。
背景技术:
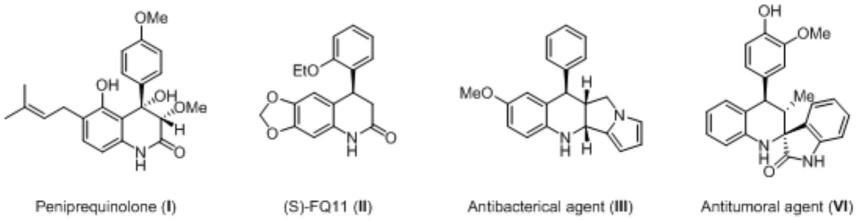
2.近年来对醌甲基化物被认为是有机合成中很重要的中间体,具有较高活性和广泛应用性。尽管有研究者提出通过氧化对醌甲基化物前体,然后与烯烃进行[4+2]环加成合成产物。但是通过同时氧化对醌甲基化物前体和苯丙醛,随后在手性催化剂的控制下通过[4+2]环加成反应,得到具有手性的产物。4-苯基取代的四氢喹啉骨架是一个非常重要的结构单元,广泛存在于天然产物和药物分子。例如青霉烯酮i具有很强的杀菌作用,化合物ii和化合物iii已被证明分别具有抗癌和抗菌特性,化合物iv表现出较强的抗肿瘤活性。
[0003][0004]
在2015年,霍聪德团队(org lett,2015,17(20):5028-5031)开发了一种新型的铁催化双氧化脱氢甘氨酸衍生物与四氢呋喃的串联环化反应,从而得到多取代喹啉稠合内酯。
[0005][0006]
2018年,胡立宏课题组(org lett,2018,20(19):5995-5998)报道了通过aza-michael/1,6-共轭加成反应,由于对醌甲基化物前体经氧化产生对醌甲基化物,随后与硝基烯烃进行[4+2]环加成反应,得到4-芳基取代的四氢喹啉产物。
[0007][0008]
2018年,吴祥课题组(org lett,2018,20(1):32-35)报道了通过ddq氧化2-甲基-3-苯基甲基吲哚,随后氧化后的产物和α,β-不饱和醛进行不对称diels-alder反应。该反应中,在二芳基脯氨醇硅醚的催化下,对α,β-不饱和醛进行经典的lumo降低活化能提供出色的立体控制,得到具有手性的四氢咔唑衍生物。
[0009][0010]
上述现有技术尽管能通过双氧化和单氧化得到产物或单氧化得到不对称产物,但是通过对醌甲基化物前体和苯丙醛进行双氧化得到不对称产物尚未有人报道。因此我们通过ddq和mno2组合和手性催化剂的作用下,通过双氧化得到不对称的多取代手性四氢喹啉产物。尚未有人报道关于双氧化合成多取代手性四氢喹啉类化合物。
技术实现要素:
[0011]
本发明的目的是克服上述现有技术存在的不足,提供一种高效性、对底物普适性强和高对映选择性的四氢喹啉类化合物的合成方法。
[0012]
为实现上述目的,本发明采用以下技术方案:
[0013]
一种多取代手性四氢喹啉类化合物的合成方法,包括以下步骤:
[0014]
(1)按摩尔量的比,底物1:底物2:氧化剂:手性催化剂:添加剂=(1-3):1:(2-4):0.15:0.1,备料,其中,所述的氧化剂为ddq与mno2的混合物,二者摩尔量的比为(0.5-3):1;
[0015]
(2)将底物1与底物2充分溶解于反应溶剂中,获得混合溶剂,将氧化剂、手性催化剂和添加剂放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时,得到目标产物多取代手性四氢喹啉类化合物;反应路线如下所示:
[0016][0017]
上述通式中:
[0018]
r1、r3选自甲基、甲氧基、三氟甲基、3,4-亚甲基二氧基和卤素;r2选自甲基和甲氧基。
[0019]
所述的步骤(1)中,底物1包括底物1a、底物1b、底物1c、底物1d,底物1e或底物1f,其中,所述的底物1a为n-(2-(3,5-二叔丁基-4-羟基苄基)苯基)-4-甲基苯磺酰胺,底物1b为n-(2-(3,5-二叔丁基-4-羟基苄基)-4-甲基苯基)-4-甲基苯磺酰胺,底物1c为n-(2-(3,5-二叔丁基-4-羟基苄基)-4-氟苯基)-4-甲基苯磺酰胺,底物1d为n-(2-(3,5-二叔丁基-4-羟基苄基)-4-氯苯基)-4-甲基苯磺酰胺,底物1e为n-(2-(3,5-二叔丁基-4-羟基苄基)-4-甲基苯基)-4-甲基苯磺酰胺,底物1f为n-(2-(3,5-二甲基-4-羟基苄基)-4-甲基苯基)-4-甲基苯磺酰胺。
[0020]
所述的步骤(1)中,底物2包括底物2a、底物2b、底物2c、底物2d或底物2e,其中,所述的2a为苯丙醛,底物2b为4-甲基苯丙醛,底物2c为4-甲氧基苯丙醛,底物2d为4-氟苯丙醛,底物2e为4-氯苯丙醛,底物2f为4-溴苯丙醛,底物2g为4-硝基苯丙醛。
[0021]
所述的步骤(2)中,室温搅拌反应的48小时内,首先发生ddq和mno2组合对底物1和
底物2的双氧化,分别原位生成对醌甲基化物和肉桂醛中间体,随后的搅拌过程中进行aza-michael/1,6-共轭加成反应,从而得到产物3。
[0022]
所述的步骤(1)中,由于氧化剂对反应产率和对映选择性有一定的影响,通过对ag2co3、ag2o、k2s2o8、ddq、phi(oac)2、mno2或ddq/mno2氧化剂的研究,本发明优先选择氧化剂为ddq和mno2的组合,最优比例为1:1。
[0023]
所述的步骤(1)中,手性催化剂为4a、4b、4c、4d、4e或4f中的一种,由于手性催化剂对对映选择性有很大的影响,通过对4a、4b、4c、4d、4e或4f的研究,所述的4a具体为l-脯氨酸、4b具体为(s)-5-苄基-2,2-二甲基咪唑啉-4-酮三氟乙酸盐、4c具体为(2r,5s)-5-苄基-2-叔丁基咪唑烷酮、4d具体为(r)-2-[二苯基[(三甲基硅酯)氧基]甲基]-吡咯烷、4e具体为(r)-(-)-2-[羟基(二苯基)甲基]-1-甲基吡咯烷、4f具体为(r)-2-[二[3,5-二(三氟甲基)苯基][[叔丁基二甲基硅烷基]氧基]甲基]吡咯烷,本发明优先选择手性催化剂为4d。
[0024][0025]
所述的步骤(1)中,所述的反应溶剂为1,2-二氯乙烷、二氯甲烷、三氯甲烷、乙腈、1,4-二氧六环、苯、甲苯、丙酮、四氢呋喃或dmf有机溶剂中的一种,经研究,本发明优选二氯甲烷作为反应溶剂。
[0026]
所述的步骤(1)中,对反应中的添加剂进行优化包括cs2co3、na2co3、k2co3、et3n、k3po4、dipea、dbu或ipr2nh,本发明优先选择添加剂为ipr2nh。
[0027]
本发明为了验证底物的普适性,在上述最优的条件下,改变底物1上的取代基,反应路线和对应产物如下所示:
[0028][0029]
将底物1a-e(0.15mmol,1.5equiv)与底物2a(0.10mmol,1equiv)溶解在1ml的二氯甲烷中,然后将氧化剂ddq(0.2mmol)与mno2(0.2mmol)、4d(15mol%)和ipr2nh(0.02mmol)放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时,得到目标产物。该反应中改变1上不同的取代基,发现其都能使反应顺利进行进而得到目标产物。同时发现苯环上连有给电子基的产率高于苯环上连有吸电子基的产率,对映选择性相差不大。当把底物1的r2上的叔丁基换成甲基时,产率和对映选择性都有降低。
[0030]
另外,本发明也改变底物2上的取代基,反应路线和对应产物如下所示:
[0031][0032]
将底物1a(0.15mmol,1.5equiv)与底物2b-g(0.10mmol,1equiv)溶解在1ml的二氯甲烷中,将氧化剂ddq(0.2mmol)和mno2(0.2mmol)、4d(15mol%)和ipr2nh(0.02mmol)放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时,得到目标产物。本反应实现1和2反应生成4,现有技术中完全未有涉及。该反应中改变2上不同的取代基,发现其都能使反应顺利进行得到产物。发现苯环上连有给电子基的产率相对好于苯环上连有吸电子基的产率,对映选择性差别不大。
[0033]
本发明的有益效果:
[0034]
该申请是一种尚未见文献报道的双氧化串联反应,具有高效性、对底物普适性强和对映选择性高等优点。在天然产物以及具有药物活性的分子的不对称合成中能有广泛的应用,能够满足市场需求,具有良好的转化前景。
具体实施方式:
[0035]
下面结合实施例对本发明作进一步的详细说明。
[0036][0037]
首先对氧化剂进行筛选,将底物1a(0.15mmol,1.5equiv)与底物2a(0.10mmol,1equiv)溶解在1ml的1,2-二氯乙烷中,在schlenk管中分别加入0.4mmol ag2co3、ag2o、k2s2o8、ddq、phi(oac)2、mno2或者是加入各0.2mmol的ddq与mno2,然后加入4a(15mol%)和ipr2nh(0.02mmol),最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时。减压蒸发溶剂,残留物通过硅胶柱色谱纯化,石油醚/乙酸乙酯=20/1~2/1,得到产物3aa。产率分别为18%、20%、41%、55%、trace、45%、59%。ee值分别是0、30%、0、83%、79%、80%、86%。可以看出氧化剂为ddq与mno2的组合使得产率和对映选择性最好。
[0038]
在最优的氧化剂条件下,对手性催化剂进行筛选。将底物1a(0.15mmol,1.5equiv)与底物2a(0.10mmol,1equiv)溶解在1ml的1,2-二氯乙烷中,在schlenk管中分别加入15mol%的4a、4b、4c、4d、4e或4f,然后加入各0.2mmol的ddq与mno2和ipr2nh(0.02mmol)放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时。减压蒸发溶剂,残留物通过硅胶柱色谱纯化,石油醚/乙酸乙酯=20/1~2/1,得到产物3aa。产率分别为59%、50%、47%、72%、48%、53%。ee值分别是86%、80%、76%、89%、79%、70%。可以看出手性催化剂为4d时使得产率和对映选择性最好。
[0039]
在最优的氧化剂和最优的手性催化剂下,对反应溶剂进行筛选。将底物1a(0.15mmol,1.5equiv)和底物2a(0.10mmol,1equiv)分别溶解在1ml的1,2-二氯乙烷、二氯甲烷、三氯甲烷、乙腈、1,4-二氧六环、苯、甲苯、丙酮、四氢呋喃或dmf中,加入氧化剂ddq(0.2mmol)和mno2(0.2mmol)、4d(15mol%)和ipr2nh(0.02mmol)放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时,减压蒸发溶剂,残留物通过硅胶柱色谱纯化,石油醚/乙酸乙酯=20/1~2/1,得到产物3aa。产率分别为72%、80%、71%、50%、37%、53%、55%、60%、72%、69%。ee值分别是89%、93%、77%、81%、40%、75%、73%、90%、88%、75%。可以看出二氯甲烷作为溶剂时使得产率和对映选择性最好。
[0040]
在最优的氧化剂、手性催化剂和溶剂下,对反应中的添加剂进行筛选。将底物1a(0.15mmol,1.5equiv)与底物2a(0.10mmol,1equiv)溶解在1ml的二氯甲烷中,在schlenk管中分别加入0.02mmol的cs2co2、na2co3、k2co3、et3n、k3po4、dipea、dbu或ipr2nh,然后加入氧化剂ddq(0.2mmol)和mno2(0.2mmol)和4d(15mol%),最后将混合溶剂加入史莱克管中,在室温下搅拌反应48小时,减压蒸发溶剂,残留物通过硅胶柱色谱纯化,石油醚/乙酸乙酯=20/1~2/1,得到产物3aa。产率分别为56%、77%、73%、75%、47%、58%、69%、80%。ee值分别是82%、69%、80%、90%、85%、88%、93%。可以看出ipr2nh作为添加剂时使得产率和对映选择性最好。
[0041]
综上所述,可以得出氧化剂为ddq与mno2的组合、4d为手性催化剂,二氯甲烷为溶剂、ipr2nh为反应中的添加剂,使得反应效果是最好的。
[0042]
实施例1:化合物3aa的制备
[0043][0044]
将底物1a(0.15mmol,1.5equiv)与底物2a(0.10mmol,1equiv)溶解在1ml的二氯甲烷中,然后将氧化剂ddq(0.2mmol)和mno2(0.2mmol)、4d(15mol%)和ipr2nh(0.02mmol)放入史莱克管中,最后将混合溶剂加入到史莱克管中,在室温下搅拌反应48小时,得到目标产物。产率80%,93%ee值,用高效液相色谱(chiralpak ic柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=17.10min(minor),tr=19.19min(major))测定。
[0045]1h nmr(500mhz,cdcl3)δ9.93(d,j=6.2hz,1h),7.77
–
7.72(m,2h),7.43
–
7.36(m,2h),7.36
–
7.18(m,7h),7.09
–
7.00(m,2h),6.88(dd,j=1.9,1.0hz,1h),6.57(dd,j=7.4,2.0hz,1h),5.17(dt,j=7.0,1.0hz,1h),4.18
–
4.12(m,1h),3.79
–
3.70(m,1h),2.80(s,1h),2.42(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ197.99,154.30,141.71,141.17,136.29,135.49,134.88,134.60,132.89,129.36,128.74,128.49,128.16,128.07,124.34,122.59,120.14,69.87,53.91,46.60,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h42
no4s:596.8053,observed:596.8057.
[0046]
对比例1-1
[0047]
同实施例1,区别在于,手性催化剂替换为4a、4b、4c、4e或4f中的一种,最终结果如下表:
[0048][0049][0050]
对比例1-2
[0051]
同实施例1,区别在于,氧化剂替换为ag2co3、ag2o、k2s2o8或phi(oac)2中的一种,最终结果如下表:
[0052] 氧化剂收率(%)ee(%)1ag2co350912ag2o72903k2s2o80-4phi(oac)26088
[0053]
对比例1-3
[0054]
同实施例1,区别在于,氧化剂替换为ddq或mno2中的一种,最终结果为如下表:。
[0055] 氧化剂收率(%)ee(%)1ddq10922mno25093
[0056]
实施例2:化合物3ba的制备
[0057][0058]
用底物1b代替1a,通过实施例1的方法,得到产物3ba。产率76%,94%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=20.14min(minor),tr=21.98min(major))测定。
[0059]1h nmr(500mhz,cdcl3)δ9.90(d,j=6.2hz,1h),7.82
–
7.76(m,2h),7.40
–
7.26(m,6h),7.26
–
7.18(m,1h),7.10(dt,j=2.2,1.1hz,2h),6.99(ddd,j=7.6,2.1,1.1hz,1h),6.71(dd,j=1.9,0.9hz,1h),6.52(d,j=7.5hz,1h),5.22(dt,j=7.0,1.0hz,1h),4.44
–
4.38(m,1h),3.61(q,j=6.9hz,1h),2.69(s,1h),2.42(s,3h),2.36(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ196.84,154.30,141.71,141.17,140.90,139.21,134.88,133.93,133.11,132.06,129.36,128.73,128.49,128.20,128.16,127.94,124.45,119.66,69.87,53.91,46.67,34.50,30.33,21.63,20.93.hrms(esi)m/z(m+h)
+
calculated for c
38h44
no4s:610.8323,observed:610.8328.
[0060]
实施例3:化合物3ca的制备
[0061][0062]
用底物1c代替1a,通过实施例1的方法,得到产物3ca。产率64%,96%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=23.34min(minor),tr=24.89min(major))测定。
[0063]1h nmr(500mhz,cdcl3)δ9.98(d,j=6.2hz,1h),δ7.75
–
7.69(m,2h),7.42(ddd,j=7.5,2.0,1.0hz,2h),7.36
–
7.26(m,4h),7.26
–
7.18(m,1h),7.09
–
6.97(m,2h),6.89
–
6.80(m,2h),6.55(dd,j=7.5,5.7hz,1h),5.18(dt,j=7.0,1.1hz,1h),3.96(q,j=6.8hz,1h),3.69
–
3.63(m,1h),2.99(s,1h),2.42(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ
196.84,154.30,141.71,141.17,140.90,134.88,133.93,129.36,128.73,128.49,128.16,124.45,120.45,120.38,116.64,116.48,113.38,113.22,69.87,53.91,46.68,46.65,34.50,30.33,21.63.
19
f nmr(377mhz,cdcl3)δ-115.76.hrms(esi)m/z(m+h)
+
calculated for c
37h41
fno4s:614.7957,observed:614.7960.
[0064]
实施例4:化合物3da的制备
[0065][0066]
用底物1d代替1a,通过实施例1的方法,得到产物3da。产率67%,96%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=22.57min(minor),tr=24.24min(major))测定。
[0067]1h nmr(500mhz,cdcl3)δ9.99(d,j=6.2hz,1h),δ7.74
–
7.68(m,2h),7.46(ddd,j=7.5,2.0,1.0hz,2h),7.36
–
7.26(m,5h),7.26
–
7.18(m,1h),7.10(ddd,j=10.5,2.0,1.0hz,2h),7.02(dd,j=7.5,2.0hz,1h),6.51(d,j=7.5hz,1h),5.18(dt,j=7.1,1.1hz,1h),4.40
–
4.34(m,1h),3.90(m,1h)2.42(s,3h),2.04(s,1h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ196.84,154.30,141.71,141.17,140.90,139.90,134.88,133.93,132.78,129.75,129.36,129.07,128.73,128.49,128.16,127.90,124.45,120.45,69.87,53.91,46.67,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h41
clno4s:631.2473,observed:631.2476.
[0068]
实施例5:化合物3ea的制备
[0069][0070]
用底物1e代替1a,通过实施例1的方法,得到产物3ea。产率66%,95%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=25.04min(minor),tr=26.11min(major))测定。
[0071]1h nmr(500mhz,cdcl3)δ9.56(d,j=6.2hz,1h),δ7.73
–
7.67(m,2h),7.49
–
7.43(m,2h),7.38(dd,j=2.0,1.0hz,1h),7.36
–
7.26(m,4h),7.26
–
7.18(m,2h),7.07(ddd,j=12.7,1.9,0.8hz,2h),6.46(d,j=7.5hz,1h),5.18(dt,j=6.9,1.0hz,1h),4.36(dq,j=7.2,1.2hz,1h),3.92(q,j=6.8hz,1h),2.88(s,1h),2.42(s,3h),1.37(s,18h).13c nmr(125mhz,cdcl3)δ196.84,154.30,141.71,141.17,140.90,137.76,134.88,133.93,
132.31,131.98,129.94,129.36,128.73,128.49,128.16,124.45,120.21,118.85,69.87,53.91,46.67,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h41
brno4s:675.7013,observed:675.7017.
[0072]
实施例6:化合物3fa的制备
[0073][0074]
用底物1f代替1a,通过实施例1的方法,得到产物3fa。产率46%,85%ee值,用高效液相色谱(chiralpak ic柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=16.64min(minor),tr=18.04min(major))测定。
[0075]1h nmr(500mhz,cdcl3)δ9.72(d,j=6.2hz,1h),δ7.73
–
7.67(m,2h),7.47
–
7.40(m,2h),7.36
–
7.24(m,5h),7.26
–
7.16(m,2h),7.01(td,j=7.4,2.0hz,1h),6.98(s,2h),6.57(dd,j=7.4,2.0hz,1h),5.31
–
5.26(m,1h),4.70(s,1h),4.47(q,j=6.7hz,1h),3.96(dd,j=7.1,1.1hz,1h),2.42(s,3h),2.26(s,6h).
13
c nmr(125mhz,cdcl3)δ192.20,151.59,141.71,141.17,140.90,136.29,135.57,132.89,129.36,128.89,128.75,128.73,128.49,128.16,128.07,123.32,122.58,120.15,69.87,53.91,46.60,21.63,16.10.hrms(esi)m/z(m+h)
+
calculated for c
31h30
no4s:512.6433,observed:512.6437.
[0076]
实施例7:化合物3ab的制备
[0077][0078]
用底物2b代替2a,通过实施例1的方法,得到产物3ab。产率85%,97%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=18.36min(minor),tr=18.09min(major))测定。
[0079]1h nmr(500mhz,cdcl3)δ9.92(d,j=6.2hz,1h),7.81
–
7.76(m,2h),7.36
–
7.27(m,5h),7.31
–
7.21(m,1h),7.12
–
7.02(m,4h),6.72(dd,j=2.0,1.1hz,1h),6.57(dd,j=7.5,2.0hz,1h),5.21(dt,j=7.0,1.0hz,1h),4.42
–
4.36(m,1h),3.62(q,j=6.9hz,1h),2.72(s,1h),2.42(s,3h),2.21(t,j=1.0hz,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ192.20,154.30,141.71,141.17,136.65,136.29,136.01,135.49,134.88,132.89,129.36,129.14,128.75,128.16,128.07,127.90,124.34,122.58,120.15,69.87,53.91,46.60,34.50,30.33,21.63,21.18.hrms(esi)m/z(m+h)
+
calculated for c
38h44
no4s:610.8323,
observed:610.8327.
[0080]
实施例8:化合物3ac的制备
[0081][0082]
用底物2c代替2a,通过实施例1的方法,得到产物3ac。产率80%,95%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=20.57min(minor),tr=21.98min(major))测定。
[0083]1h nmr(500mhz,cdcl3)δ9.98(d,j=6.2hz,1h),7.75
–
7.69(m,2h),7.33(dq,j=7.4,1.2hz,2h),7.26
–
7.12(m,5h),7.07
–
6.97(m,2h),6.79
–
6.73(m,2h),6.57(dd,j=7.3,2.0hz,1h),4.79(dt,j=7.0,1.0hz,1h),4.55(dt,j=7.0,1.0hz,1h),3.80(s,3h),3.54(q,j=6.9hz,1h),2.84(s,1h),2.42(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ192.20,158.76,154.30,141.71,141.17,136.29,135.49,134.88,132.89,132.11,129.36,128.75,128.16,128.12,128.07,124.34,122.58,120.15,114.94,69.87,55.35,53.91,46.60,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
38h44
no5s:626.2935,observed:626.2939.
[0084]
实施例9:化合物3ad的制备
[0085][0086]
用底物2d代替2a,通过实施例1的方法,得到产物3ad。产率77%,96%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=22.64min(minor),tr=23.99min(major))测定。
[0087]1h nmr(500mhz,cdcl3)δ7.73
–
7.67(m,2h),7.44(ddd,j=7.0,5.8,1.1hz,2h),7.33(dq,j=7.4,1.2hz,2h),7.25(ddd,j=7.4,2.1,1.0hz,1h),7.14
–
7.05(m,5h),7.09
–
6.99(m,2h),6.57(dd,j=7.4,2.1hz,1h),5.17(dt,j=7.1,1.1hz,1h),4.37(dd,j=6.9,1.2hz,1h),3.91(q,j=6.8hz,1h),2.42(s,3h),2.02(s,1h),1.37(s,19h).
13
c nmr(125mhz,cdcl3)δ192.20,163.53,161.51,154.30,141.71,141.17,136.29,135.49,134.88,134.29,134.27,132.89,131.01,130.95,129.36,128.75,128.16,128.07,124.34,122.58,120.15,115.52,115.37,69.87,53.91,46.60,34.50,30.33,21.63.
19
f nmr(377mhz,cdcl3)δ-121.76.hrms(esi)m/z(m+h)
+
calculated for c
37h41
fno4s:614.2735,observed:614.2739.
[0088]
实施例10:化合物3ae的制备
[0089][0090]
用底物2e代替2a,通过实施例1的方法,得到产物3ae。产率65%,98%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=24.56min(minor),tr=26.03min(major))测定。
[0091]1h nmr(500mhz,cdcl3)δ7.73
–
7.67(m,2h),7.49(dd,j=7.5,1.1hz,2h),7.40
–
7.30(m,4h),7.26(ddd,j=7.3,2.1,1.0hz,1h),7.15
–
6.99(m,4h),6.57(dd,j=7.3,2.2hz,1h),5.16(dt,j=7.0,1.0hz,1h),4.42
–
4.36(m,1h),3.89(q,j=6.8hz,1h),2.77(s,1h),2.42(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ192.20,154.30,141.71,141.17,136.29,135.49,135.43,134.88,134.59,132.89,129.76,129.36,128.75,128.61,128.16,128.07,124.34,122.58,120.15,69.87,53.91,46.60,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h41
clno4s:630.2440,observed:630.2444.
[0092]
实施例11:化合物3af的制备
[0093][0094]
用底物2f代替2a,通过实施例1的方法,得到产物3af。产率70%,97%ee值,用高效液相色谱(chiralpak od-h柱,2-propanol/n-hexane=15%,流速1.0ml/min,tr=24.69min(minor),tr=26.03min(major))测定。
[0095]1h nmr(500mhz,cdcl3)δ9.99(d,j=6.2hz,1h),7.72
–
7.67(m,2h),7.58
–
7.52(m,2h),7.40
–
7.30(m,4h),7.25(ddd,j=7.3,2.1,1.0hz,1h),7.14
–
7.07(m,2h),7.11
–
6.99(m,2h),6.57(dd,j=7.4,2.1hz,1h),5.18(dt,j=6.9,1.0hz,1h),4.39
–
4.33(m,1h),3.91(td,j=7.1,6.1hz,1h),2.42(s,3h),2.23(s,1h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ192.20,154.30,141.71,141.17,136.29,135.49,135.11,134.88,132.89,131.36,129.36,128.75,128.16,128.07,127.29,124.34,122.58,121.24,120.15,69.87,53.91,46.60,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h41
brno4s:674.1934,observed:674.1938.
[0096]
实施例12:化合物3ag的制备
[0097][0098]
用底物2g代替2a,通过实施例1的方法,得到产物3ag。产率50%,91%ee值,用高效液相色谱(chiralpak ic柱,2-propanol/n-hexane=20%,流速1.0ml/min,tr=27.33min(minor),tr=28.88min(major))测定。
[0099]1h nmr(500mhz,cdcl3)δ8.10
–
8.04(m,2h),7.73
–
7.68(m,2h),7.62
–
7.56(m,2h),7.38
–
7.24(m,4h),7.20(td,j=7.5,2.0hz,1h),7.07
–
6.98(m,2h),6.57(dd,j=7.5,2.0hz,1h),5.37(dt,j=7.2,1.2hz,1h),4.47(q,j=6.8hz,1h),3.92
–
3.87(m,1h),2.97(s,1h),2.42(s,3h),1.37(s,18h).
13
c nmr(125mhz,cdcl3)δ192.20,154.30,147.63,141.71,141.27,141.17,136.29,135.49,134.88,132.89,129.36,128.83,128.75,128.16,128.07,124.34,123.89,122.58,120.15,69.87,53.91,46.60,34.50,30.33,21.63.hrms(esi)m/z(m+h)
+
calculated for c
37h41
n2o6s:641.2680,observed:641.2684。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1