一种可放大的可拉酸纯化方法与流程
1.本发明属于可拉酸生产纯化领域,尤其涉及一种可放大的高分子量可拉酸纯化方法。
背景技术:
2.微生物胞外多糖是细菌、真菌、蓝藻等微生物在代谢过程中产生的对微生物有保护作用的生物高聚物。在自然条件下,多数细菌被多糖包被。包被于细菌表面的多糖对于细菌在竞争环境中的存活和生长都有重要作用。可拉酸是其中一种微生物胞外多糖,固体是白色纤维状的无定型结构杂多糖,主要由d-葡萄糖醛酸、d-葡萄糖、d-半乳糖和l-岩藻糖组成,组成比例为 1:2:2:1,还包含o-乙酰和丙酮酸等多种侧链上的化学修饰结构。分子量最大可达1000万道尔顿以上的高分子量聚合杂多糖。
3.微生物胞外多糖具有独特的物理和流变特性,在食品工业中被广泛用作稳定剂、增稠剂、凝胶剂和乳化剂。近年来研究发现细菌多糖在抗肿瘤、抗病毒、免疫刺激、抗炎症活性和抗氧化作用、抗微生物作用等方面表现出了显著的生物活性,因此引起了人们的更多关注。2017年在杂志cell上首次报道了可拉酸使得线粒体片段化且具有延长秀丽隐杆线虫寿命的作用。可拉酸由于其多孔的纤维素结构和位于胶体表面的大量亲水基团,是一种天然的水凝胶,具有优异的补水能力和柔软的质地,是未来化妆品和医疗保健市场的良好候选产品。此外,可拉酸作为一种独特的活性生物聚合物,具有特殊的生物学特性和生理参数,对延长寿命及抗衰老方面具有广泛的研究与应用前景。
4.大肠杆菌在表达可拉酸的同时,相应的会产生与目标物相似的杂质如单糖、蛋白、核酸、细胞碎片、糖蛋白等,这些杂质影响可拉酸最终的含量与纯度,对产品质量的好坏有重要影响。文献中报道多采用离心去除菌体乙醇沉淀的方式来分离纯化可拉酸,再用sevag法去除核酸和蛋白杂质。如何高效的将蛋白和核酸等杂质的残留量降到极低的水平,是产品大规模生产和医药和医美应用的关键。但是,目前仍然没有商品化的可拉酸产品,也缺少完善的可拉酸生产与纯化方法,这严重限制了可拉酸的商业化应用。
5.多糖领域通常采用乙醇沉淀来粗纯、盐析或sevag法除蛋白、最后采用阴离子层析的方法来精纯化多糖。sevag法是经典的除蛋白质方法,但损失大、溶剂不友好、难以放大且不能完全去除蛋白杂质。deae阴离子层析脱色、除杂适合分子量小于2000kda的多糖纯化,因为填料孔径的原因对于超高分子量的可拉酸并不适用。
6.专利cn113637620a采用煮沸后离心去除菌体,接着冰醋酸沉淀去除脂多糖,采用氯仿和甲醇去除杂质蛋白,冷冻干燥得到固体。报道的方法中使用了有毒害的有机溶剂,且核酸和蛋白杂质去除不彻底,同时也不适合放大生产。
7.专利cn111893150a公布了采用煮沸后离心去除菌体,接着加入冰醋酸沉淀脂多糖,上清液旋转蒸发减少水分后冷冻干燥得粗品。粗品复融后,超滤除盐,接着冷冻干燥得产品可拉酸。报道的方法中需要煮沸和旋转蒸发手段导致效率低,放大实现难度大,同时对关键杂质蛋白和核酸的去除没有研究,方法不适合大规模生产高纯度的可拉酸产品。
技术实现要素:
8.本发明的目的在于提供一种低成本、高纯度、可放大纯化制备1000万道尔顿分子量可拉酸的方法。
9.本发明根据上述技术背景的不足,提供了一种1000万道尔顿可拉酸的分离纯化工艺,该工艺方法简单、成本低廉、工艺环保,可以有效去除蛋白、核酸类杂质及一些相对小分子量的杂质。
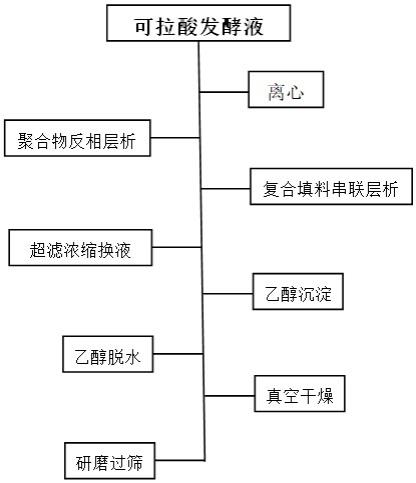
10.本发明的纯化方法以可拉酸发酵液为原料,包含以下步骤:1、发酵液中加入cacl2进行固液分离预处理;2、滤液进行聚合物反相层析;3、流穿液进行复合填料串联层析;4、流穿液进行超滤浓缩换液;5、乙醇沉淀、脱水、真空干燥。
11.根据上述提供的方法,步骤1向发酵液中加入0.1~2.0wt%的cacl2溶液,调节ph8.0~10.0进行絮凝预处理;离心或板框压滤去除菌体等沉淀物,得到澄清液。
12.将步骤1中的澄清液进行流穿模式反相层析纯化,调节样品ph6.0~9.0,上样载量100~300mg/ml,保留时间2~6分钟,收集流穿液a。聚合物反相填料基质可以是聚甲基丙烯酸酯类或聚苯乙烯类,所用的填料孔径大小为500~2000a,填料粒径大小为50~150μm。
13.将步骤2中的流穿液a进行串联羟基磷灰石和离子复合填料层析纯化,上样载量200~400mg/ml,保留时间2~6分钟,收集流穿液b。羟基磷灰石为cht ii型,离子复合填料为阴离子与疏水复合填料,粒径为30~150μm。
14.将步骤3中的流穿液b进行中空纤维膜超滤浓缩和换液,流穿液b中加edta固体,控制跨膜压力<1bar,样品先进行浓缩3~5倍,接着用超纯水洗滤3~7倍,超滤结束后排空收集截留液,1~3倍死体积的超纯水循环洗膜5~20min后排空收集。合并截留液与洗膜液得到溶液c。超滤膜孔径为50~300kd。
15.向步骤4中的溶液c中加入1.5~4倍体积的95%(v/v,下同)乙醇,接着缓慢滴加饱和氯化钠溶液至其终浓度为1~3wt%,静置收集沉淀。向沉淀中加入95%乙醇进行脱水,脱水两次,每次脱水1~3h。脱水后,滤掉乙醇进行真空干燥,干燥温度为30~50℃,干燥时间3~6h,将固体研磨过200目筛。接着继续干燥8~15h,收集得最终产品。
16.本发明的效果与现有技术相比,本发明采用了聚合物反相填料、羟基磷灰石串联离子复合填料等连续纯化手段,可以制备得到1000万道尔顿高分子量可拉酸,并且在超滤换液时可以加入螯合剂以去除重金属离子杂质,使用乙醇沉淀时采用先加乙醇,再滴加氯化钠的方式可以制备得到细微颗粒状的可拉酸,便于后续取用。
17.本发明提供的透明质酸发酵液分离纯化方法为清洁生产工艺,不使用活性炭,无添加任何毒害物质,超滤浓缩后最小量的乙醇加入,生产的成品因此更加安全、环保。本发明提供的对可拉酸发酵液分离纯化方法,采用流穿的层析模式能够大规模、高效率的制备1000万道尔顿以上的可拉酸。本发明提供的对可拉酸发酵液分离纯化方法,制备所得的产品蛋白残留<0.1%、核酸残留a260<0.1(2g/l)、重金属残留<10ppm及内毒素符合药用级要求。
附图说明
18.图1为实施例1的gpc色谱图;图2为可拉酸纯化工艺流程图。
具体实施方式
19.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明,对于本领域的技术人员来说在此发明创造构思的基础上,做出的若干变形和改进,都属于本发明的保护范围。实施例中所用的原料均可以通过商业途径获得。
20.以下结合具体实施例对本发明的具体实现进行详细描述。
21.本发明中使用的可拉酸发酵液由深圳柏垠生物有限公司采用埃希氏大肠杆菌构建的工程菌株发酵提供。蛋白含量测定采用bradford法,可拉酸含量测定采用硫酸半胱氨酸法,内毒素测定采用鲎试剂凝胶法。
22.实施例1取可拉酸发酵液500ml,纯化水稀释二倍,加0.5wt%的cacl2溶液,充分溶解后调ph9.0,离心去除菌体残渣,得到澄清液。澄清液中加入5%的乙醇,进行polyrp (50μm,孔径500
å
)填料层析,柱体积20ml,流速5ml/min,收集流穿液a。调节流穿液a ph至7.0,进行10ml capto adhere+10ml cht ii串联柱层析,流速5ml/min,收集流穿液b。向流穿液b中加入0.05wt%的edta固体,进行50kd中空纤维膜超滤,先浓缩3倍体积,接着用超纯水洗滤5倍体积。收集超滤截留液与洗膜液,加入2倍体积乙醇,接着滴加饱和氯化钠溶液至终浓度为2wt%,静置沉淀。沉淀用95%乙醇,脱水2次,每次2h。脱水后的样品,进行50℃真空干燥5h,研磨过200目筛,干燥后得成品。
23.实施例2取可拉酸发酵液500ml,纯化水稀释二倍,加1.0wt%的cacl2溶液,充分溶解后调ph9.0,离心去除菌体残渣,得到澄清液。澄清液中加入5%的乙醇,进行polyrp(50μm,孔径1000
å
)填料层析,柱体积20ml,流速5ml/min,收集流穿液a。调节流穿液a ph至7.5,进行10ml capto adhere+10ml cht ii串联柱层析,流速5ml/min,收集流穿液b。向流穿液b中加入0.05wt%的edta固体,进行100kd中空纤维膜超滤,先浓缩3倍体积,接着用超纯水洗滤5倍体积。收集超滤截留液与洗膜液,加入2倍体积乙醇,接着滴加饱和氯化钠溶液至终浓度为2wt%,静置沉淀。沉淀用95%乙醇,脱水2次,每次2h。脱水后的样品,进行50℃真空干燥5h,研磨过200目筛得成品。
24.实施例3取可拉酸发酵液500ml,纯化水稀释二倍,加1.0wt%的cacl2溶液,充分溶解后调ph9.0,离心去除菌体残渣,得到澄清液。澄清液中加入5%的乙醇,进行polyrp(30μm,孔径2000
å
)填料层析,柱体积20ml,流速5ml/min,收集流穿液。调节流穿液a ph至8.0,进行10ml capto adhere+10ml cht ii串联柱层析,流速5ml/min,收集流穿液b。向流穿液b中加入0.05wt%的edta固体,进行300kd中空纤维膜超滤,先浓缩3倍体积,接着用超纯水洗滤5倍体积。收集超滤截留液与洗膜液,加入2倍体积乙醇,接着滴加饱和氯化钠溶液至终浓度为2wt%,静置沉淀。沉淀用95%乙醇,脱水2次,每次2h。脱水后的样品,进行37℃真空干燥10h,
研磨过200目筛得成品。
25.实施例4取可拉酸发酵液10l,纯化水稀释二倍,加0.5wt%的cacl2溶液,充分溶解后调ph9.0,离心去除菌体残渣,得到澄清液。澄清液中加入5%的乙醇,进行polyrp(150μm,孔径1000
å
)填料层析,柱体积500ml,流速100ml/min,收集流穿液a。调节流穿液a ph至7.0,进行250ml capto adhere+250ml cht ii串联柱层析,流速100ml/min,收集流穿液b。向流穿液b中加入0.05wt%的edta固体,进行300kd中空纤维膜超滤,先浓缩3倍体积,接着用超纯水洗滤5倍体积。收集超滤截留液与洗膜液,加入2倍体积乙醇,接着滴加饱和氯化钠溶液至终浓度为2wt%,静置沉淀。沉淀用95%乙醇,脱水2次,每次2h。脱水后的样品,进行37℃真空干燥10h,研磨过200目筛得成品。
26.表1 可拉酸成品纯度、分子量及蛋白含量测定结果由表1数据可以看出,本发明提供的对可拉酸发酵液分离纯化方法,采用流穿的层析模式能够大规模、高效率的制备1000万道尔顿以上的可拉酸,产品中蛋白残留最低可达0.075%。由此可见,本技术提供的工艺方法简单、成本低廉、工艺环保,可以有效去除蛋白并可以制备得到1000万道尔顿以上的可拉酸,适合放大化生产。
27.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1