用于特异性检测鞘磷脂酶的比率型荧光纳米脂质体探针、试剂盒及检测方法
1.本发明属于荧光探针、生物化学、纳米生物医学领域,尤其涉及用于特异性检测鞘磷脂酶的比率型荧光纳米脂质体探针、试剂盒及检测方法。
背景技术:
2.鞘磷脂酶是一种酸性糖蛋白,是一类水解酶,催化鞘磷脂降解成神经酰胺和磷酸化胆碱。在哺乳动物中,根据其阳离子依赖性和最适作用ph值,已经确定了五种类型的鞘磷脂酶:溶酶体酸鞘磷脂酶、分泌型锌依赖酸鞘磷脂酶、镁依赖中性鞘磷脂酶、镁非依赖中性鞘磷脂酶和碱性鞘磷脂酶。
3.现有的检测鞘磷脂酶活性的方法中,存在放射性元素的危害,对人和环境不友好,且合成复杂,操作繁琐,可能呈现假信号等缺点。
技术实现要素:
4.本发明的目的是提供用于特异性检测鞘磷脂酶的比率型荧光纳米脂质体探针、试剂盒及检测方法,该探针生物相容性好、合成方法简单,利用该探针对鞘磷脂酶活性进行检测的方法选择性和灵敏性较高。
5.本发明的第一个目的是提供用于检测酶活性的探针,该探针为内部包覆荧光体ⅰ和荧光体ⅱ的纳米脂质体;
6.所述荧光体ⅰ和所述荧光体ⅱ在所述纳米脂质体内能够发生荧光共振能量转移;
7.待检测的酶能够水解并破坏所述纳米脂质体的脂膜使所述荧光体ⅰ和所述荧光体ⅱ分离。
8.上述的探针中,所述酶具体可为鞘磷脂酶,如酸性鞘磷脂酶;所述脂质体具体可为鞘磷脂脂质体。
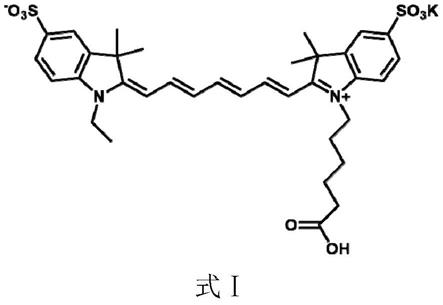
9.优选地,所述荧光体ⅰ具体可为式ⅰ所示化合物(简写为cy7)且所述荧光体ⅱ具体可为式ⅱ所示化合物(如ir780):
10.[0011][0012]
式ⅱ中,x为卤素,如cl、br、i。
[0013]
上述的探针中,所述荧光体ⅰ和所述荧光体ⅱ的摩尔比具体可为2:1。
[0014]
上述的探针中,所述纳米脂质体的尺寸可为60~300nm,最大含量尺寸可为100nm,约呈正态分布。所述纳米脂质体为双分子层结构。
[0015]
本发明的第二个目的是提供上述探针的制备方法,包括如下步骤:
[0016]
(1)将磷脂和胆固醇在有机溶剂中混合后进行第一次超声,超声完毕后减压旋转蒸发除去溶剂,得到脂质体脂膜;
[0017]
(2)将所述脂质体脂膜与含有所述荧光体ⅰ和所述荧光体ⅱ的缓冲液混合后进行搅拌,搅拌完毕后进行第二次超声,得到所述探针。
[0018]
上述的制备方法中,所述磷脂、所述胆固醇、所述荧光体ⅰ和所述荧光体ⅱ的摩尔比具体可为8:8:2:1。
[0019]
所述有机溶剂具体可为氯仿;
[0020]
所述磷脂和所述胆固醇在所述有机溶剂中的总摩尔浓度具体可为7.5μmol/ml;
[0021]
所述第一次超声的频率为40khz,时间为5min;
[0022]
所述旋转蒸发的温度具体可为40℃。
[0023]
所述含有荧光体ⅰ和荧光体ⅱ的缓冲液中,所述荧光体ⅰ的浓度具体可为2mm;
[0024]
所述搅拌的转速为800r,时间具体可为1h,温度具体可为40℃;
[0025]
所述第二次超声的频率为40khz,时间为10min。
[0026]
所述方法还包括用截留分子量为3500道尔顿的膜去除未包覆的荧光体的步骤。
[0027]
本发明的第三个目的是提供上述任一项所述的探针在下述a1)
‑
a7)至少一项中的应用:
[0028]
a1)制备用于检测酶活性的产品;
[0029]
a2)制备用于检测鞘磷脂酶活性的产品;
[0030]
a3)制备用于诊断或辅助诊断腹膜炎的产品;
[0031]
a4)制备用于诊断或辅助诊断心血管疾病的产品;
[0032]
a5)制备用于诊断或辅助诊断动脉粥样硬化的产品;
[0033]
a6)制备用于诊断或辅助诊断脂类代谢疾病的产品;
[0034]
a7)制备用于诊断或辅助诊断结肠癌的产品。
[0035]
上述的应用中,所述产品具体可为试剂盒。
[0036]
上述的应用中,待检测的样品可为细胞、组织或体液。
[0037]
本发明的第四个目的是提供用于检测酶活性的试剂盒,包括上述任一项所述的探针。所述试剂盒具体可包括上述任一项所述的探针和缓冲液。
[0038]
上述的试剂盒还可包括可读性载体,所述可读性载体上记载有如下检测酶活性的步骤:
[0039]
s1、对待测的酶样品、上述任一项所述的探针和缓冲液组成的初始体系进行孵育;
[0040]
s2、在作为供体的荧光体的最大激发波长的激发下,检测步骤s1孵育后的体系中所述荧光体ⅰ和所述荧光体ⅱ的荧光光谱,计算所述荧光体ⅰ和所述荧光体ⅱ的荧光强度的比值,根据酶活性与所述比值的关系实现酶活性的检测。
[0041]
上述的试剂盒中,步骤s1中,所述初始体系中探针的浓度可为1~2mm,优选为50mg/ml;
[0042]
所述初始体系的ph值可为5.0;
[0043]
所述孵育的温度可为37℃;所述孵育的时间可为90min;步骤s2中,所述作为供体的荧光体的最大激发波长为700nm;
[0044]
所述荧光体ⅰ和所述荧光体ⅱ的荧光强度的比值为所述荧光体ⅰ在750nm处的荧光强度和所述荧光体ⅱ在830nm处的荧光强度的比值;
[0045]
所述根据酶活性与比值的关系实现酶活性的检测可采用标准曲线法。
[0046]
本发明的第五个目的是提供一种检测酶活性的方法,包括如下步骤:
[0047]
s1、对待测的酶样品、上述任一项所述的探针和缓冲液组成的初始体系进行孵育;
[0048]
s2、在作为供体的荧光体的最大激发波长的激发下,检测步骤s1孵育后的体系中所述荧光体ⅰ和所述荧光体ⅱ的荧光光谱,计算所述荧光体ⅰ和所述荧光体ⅱ的荧光强度的比值,根据酶活性与所述比值的关系实现酶活性的检测。
[0049]
上述的方法中,步骤s1中,所述初始体系中探针的浓度可为1~2mm,优选为50mg/ml;
[0050]
所述初始体系的ph值可为5.0;
[0051]
所述孵育的温度可为37℃;所述孵育的时间可为90min;
[0052]
步骤s2中,所述作为供体的荧光体的最大激发波长为700nm;
[0053]
所述荧光体ⅰ和所述荧光体ⅱ的荧光强度的比值为所述荧光体ⅰ在750nm处的荧光强度和所述荧光体ⅱ在830nm处的荧光强度的比值;
[0054]
所述根据酶活性与比值的关系实现酶活性的检测可采用标准曲线法。
[0055]
本发明具有如下有益效果:
[0056]
(1)本发明探针为内部包覆能够发生荧光共振能量转移的两种荧光体的纳米脂质体,该脂质体为鞘磷脂酶的天然底物,生物相容性好,合成简单。
[0057]
(2)本发明方法具有较高的选择性和灵敏性。
[0058]
(3)本发明探针和检测方法可用于腹膜炎患者的细胞和尿液样品中酸性鞘磷脂酶活性的检测,可进一步诊断或辅助诊断腹膜炎。
[0059]
(4)本发明方法为开发检测酯酶的方法提供了新的策略。
附图说明
[0060]
图1(a)为实施例中dls和cyro
‑
tem分析fen探针的尺寸分布和形貌的粒径分布图和透射电镜照片;比例尺,100nm;图1(b)为实施例中dls和cyro
‑
tem检测fen探针贮存30天后的粒径分布图和透射电镜照片;比例尺,100nm。
[0061]
图2为实施例中检测cy7的荧光光谱(λ
ex
=700nm,红线3)和ir780的荧光光谱(λ
ex
=780nm,浅蓝色线4),以及cy7的吸收光谱(紫色线1)和ir780的吸收光谱(蓝色线2)。
[0062]
图3为实施例中fen探针在0.2m pbs缓冲液(ph 5.0)中储存不同时间cy7和ir780的荧光强度及其比值(i
750
/i
830
)。
[0063]
图4为本发明检测机理示意图,其中,图4(a)为制备fen探针的示意图及其对应的荧光光谱图;图4(b)为利用fen探针检测酶活性的示意图及其对应的荧光光谱图。
[0064]
图5为实施例中检测体系中i
750
/i
830
的荧光强度值随ph值的变化曲线。
[0065]
图6为实施例中检测体系中i
750
/i
830
的荧光强度值随温度的变化曲线。
[0066]
图7为实施例中fen探针(50μg/ml)在10mm na2hpo4/nah2po4缓冲液中与不同浓度(0
‑
0.5u/ml)酸鞘磷脂酶作用90min后的荧光发射光谱(a)和i
750
/i
830
与酸性鞘磷脂酶浓度在0
‑
0.5u/ml范围内的图谱(b),λ
ex
=700nm。
[0067]
图8为细胞中不同物质对fen探针荧光的影响(a)和尿液中不同物质对fen探针荧光的影响(b)。
[0068]
图9为不同浓度no(0,0.05,0.1,0.2mm)存在下,fen探针与酸性鞘磷脂酶反应后i
750
/i
830
的荧光强度值变化(a);不同浓度(0,2,5,10μm)des存在下,fen探针与酸性鞘磷脂酶反应后i
750
/i
830
的荧光强度值变化(b)。
[0069]
图10为(a)不同浓度(1
‑
100μg/ml)fen探针与mcf
‑
7孵育后的细胞活力,结果用五次独立测量的平均值
±
标准差表示;(b)mcf
‑
7细胞的western blot分析。用特异性sirna(asm
‑
1si和asm
‑
2si)或非特异性sirna(ncsi)转染mcf
‑
7细胞。β
‑
actin为内参;(c)在mcf
‑
7细胞、asm
‑
1si mcf
‑
7细胞和asm
‑
2si mcf
‑
7细胞中,fen探针与酸性鞘磷脂酶反应后i
750
/i
830
的荧光强度值变化;(d)质谱分析mcf
‑
7细胞和sirna转染mcf
‑
7细胞中d18:1/16:0鞘磷脂和16:0神经酰胺。*:p<0.05,**:p<0.01。
[0070]
图11为腹膜炎及正常人尿中酸性鞘磷脂酶与fen探针反应后根据i
750
/i
830
荧光强度值的变化计算出对应的酶的活性;***:p<0.001。
具体实施方式
[0071]
本发明提供的用于检测酶活性的探针,为内部包覆荧光体ⅰ和荧光体ⅱ的纳米脂质体;
[0072]
荧光体ⅰ和荧光体ⅱ在纳米脂质体内能够发生荧光共振能量转移;
[0073]
待检测的酶能够水解并破坏纳米脂质体的脂膜使荧光体ⅰ和所述荧光体ⅱ分离。
[0074]
本发明探针为内部包覆能够发生荧光共振能量转移的两种荧光体的纳米脂质体,该脂质体为磷脂酶的天然底物,生物相容性好,合成简单。
[0075]
下面以鞘磷脂酶为具体待检测的酶,纳米脂质体为鞘磷脂脂质体;式ⅰ所示化合物(简写为cy7)为荧光体ⅰ;式ⅱ所示化合物(如ir780)为荧光体ⅱ对本发明进行详细说明,但本发明并不局限于下述实施例;
[0076][0077]
式ⅱ中,x为卤素。
[0078]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0079]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0080]
鞘磷脂购自购自安诺伦(北京)生物科技有限公司鞘磷脂;产品名称:鞘磷脂;cas号:6254
‑
89
‑
3。
[0081]
胆固醇购自西格玛奥德里奇(上海)贸易有限公司;产品名称:胆固醇;cas号:57
‑
88
‑
5。
[0082]
cy7购自购自西安瑞禧生物科技有限公司;产品名称:cy7荧光染料;cas号:943298
‑
08
‑
6;其结构式如式ⅰ所示:
[0083][0084]
ir780购自西格玛奥德里奇(上海)贸易有限公司;产品名称:ir
‑
780碘化物;cas号:207399
‑
07
‑
3;其结构式如式
ⅱ‑
a所示:
[0085][0086]
酸性鞘磷脂酶(acid smase鞘磷脂酶)购自北京义翘神州生物技术有限公司;产品名称:酸性鞘磷脂酶;cas号:50749
‑
m08b。
[0087]
中性鞘磷脂酶购自西格玛奥德里奇(上海)贸易有限公司;产品名称:中性鞘磷脂酶;cas号:9031
‑
54
‑
3。
[0088]
羧酸酯酶carboxylesterase购自西格玛奥德里奇(上海)贸易有限公司;产品名称:羧酸酯酶;cas号:9016
‑
18
‑
6。
[0089]
磷脂酶a2购自西格玛奥德里奇(上海)贸易有限公司;产品名称:磷脂酶a2;cas号:9001
‑
84
‑
7。
[0090]
noc
‑
5购自西格玛奥德里奇(上海)贸易有限公司;产品名称:n
‑
亚硝基化合物
‑
5;cas号:146724
‑
82
‑
5。
[0091]
(des)购自安诺伦(北京)生物科技有限公司;产品名称1:16:0鞘磷脂;cas号:6254
‑
89
‑
3;产品名称2:c17神经酰胺;cas号:67492
‑
16
‑
4。
[0092]
mcf
‑
7购自南京凯基生物科技发展有限公司,全称:人乳腺癌细胞;货号:cbp60380。
[0093]
实施例1、制备用于特异性检测鞘磷脂酶的比率型荧光纳米脂质体探针(fen探针)
[0094]
按照如下步骤制备fen探针:
[0095]
首先,将d18:1/16:0鞘磷脂与胆固醇按摩尔比1:1(共30μmol,溶于4ml氯仿中)混合,超声5min(超声频率为40khz),然后将溶液于40℃下减压旋转蒸发以除去溶剂,此时在圆底烧瓶内壁上产生一层薄薄的脂膜。然后于圆底烧瓶中加入2ml包含1mm ir780和2mm cy7的pbs缓冲液(0.2m,ph 7.4),在烧瓶中剧烈搅拌(转速为800r)1小时,温度为40℃。之后使用浴式超声器超声10分钟(超声频率为40khz),最终成功制备fen探针。最后,将所得脂质体透析,具体用截留分子量为3500道尔顿的膜去除未包覆的荧光体,在pbs(0.2m,ph 7.4)中常温搅拌24小时,得到fen探针(fen探针原液浓度5mg/ml)。
[0096]
经检测:cy7的包封率约为50%,ir780的包封率约61%。
[0097]
在jem
‑
2011f显微镜上拍摄fen探针的低温透射电子显微镜(cryo
‑
tem)图像。采用动态光散射(dls)仪测量fen探针的尺寸分布和ζ电位。制备得到的fen探针及其在30天后的尺寸分布和形貌如图1所示。
[0098]
分别检测cy7的荧光光谱(λ
ex
=700nm,线3)和ir780的荧光光谱(λ
ex
=780nm,线4),以及cy7的吸收光谱(线1)和ir780的吸收光谱(线2),实验结果如图2所示。
[0099]
fen探针在0.2m pbs缓冲液(ph 5.0)中储存不同时间cy7和ir780的荧光强度及其比值(i
750
/i
830
)见图3。
[0100]
实施例2、基于比率型荧光纳米脂质体探针特异性检测鞘磷脂酶
[0101]
一、检测方法的建立
[0102]
按照如下步骤检测鞘磷脂酶的酶活性:
[0103]
在10ml的试管中,加入5ml pbs(10mm)和100μl的fen探针原液(5mg/ml),然后加入适量样品溶液(商品化酸性或中性鞘磷脂酶,细胞裂解液或尿液),用pbs调节终体积至10ml,涡旋使反应液混合均匀。于37℃下孵育90分钟,然后取3ml反应后液体转移到石英皿中测量荧光强度/光谱(λ
ex
=700nm),激发和发射狭缝宽度均设置为10nm。同时,准备pbs空白溶液,在相同条件下进行检测以进行空白对照。
[0104]
检测机理如图4所示,样品中的鞘磷脂酶将鞘磷脂脂质体水解,造成cy7和ir780的分离,导致i
750
/i
830
值增大。通过比较i
750
/i
830
值的大小进而推断出鞘磷脂酶的活性高低,即i
750
/i
830
的值越大,鞘磷脂酶的活性越高。
[0105]
二、检测条件优化
[0106]
按照上述步骤,选择商品化酸性鞘磷脂酶(浓度:0.30u/ml)探究ph值对fen探针荧光强度的影响。通过hcl和naoh来调节10mm na2hpo4‑
nah2po4溶液的ph值,分别探究ph值为5.0、7.4、9.0的i
750
/i
830
的荧光强度值变化,其余条件为温度37℃,孵育时间90min,酶浓度0.30u/ml。实验结果如图5所示。
[0107]
探究反应温度对fen探针荧光强度的影响。通过金属浴控制反应温度,分别探究温度为20、30、37℃条件下的i
750
/i
830
的荧光强度值变化,其余条件为ph 5.0;孵育时间90min;酶浓度:0.30u/ml。实验结果如图6所示。
[0108]
分别观察fen探针(50μg/ml)在10mm na2hpo4/nah2po4缓冲液中与不同浓度(0
‑
0.5u/ml)酸性鞘磷脂酶作用90min后的荧光发射光谱(温度37℃;ph 5.0),并绘制i
750
/i
830
与酶浓度的关系曲线。实验结果如图7所示。
[0109]
三、选择性
[0110]
研究细胞内其他潜在干扰物,如无机盐(kcl,mgcl2,cacl2,nano3,cuso4)、活性氧(
·
oh、h2o2)、葡萄糖(glucose)、还原性谷胱甘肽(gsh)、半胱氨酸(cysteine)、牛血清白蛋(bsa)、人血清白蛋白(hsa)和细胞中两种主要酶,羧酸酯酶(carboxylesterase)和磷脂酶2(pla2)对fen探针的干扰。实验结果如图8(a)所示,其中,acid smase鞘磷脂酶(0.3u/ml),mgcl2(2mm),cacl2(2mm),kcl(150mm),nano3(100μm),cuso4(100μm),h2o2(100μm),
·
oh(100μm),glucose(10mm),gsh(1mm),cysteine(1mm),bsa(bovine serum albumin,100mm),hsa(human serum albumin,100mm),carboxylesterase(0.20u/ml),pla2(3.2ng/ml),blank(控制组),于10mm pbs(ph 5.0)中检测,λ
ex
=700nm。证明了探针对酸性鞘磷脂酶具有较高的选择性。
[0111]
同时对尿液中常见的潜在干扰物进行了检测,包括尿素(urea)、尿酸(uric acid)、l
‑
组氨酸(l
‑
histidine)、甘氨酸(glycine)和草酸(oxalic acid)。实验结果如图8(b)所示,其中,urea(20mm),uric acid(0.3mm),l
‑
histidine(0.1mm),glycine(0.2mm),oxalic acid(0.05mm),acid smase鞘磷脂酶(0.3u/ml),blank(控制组);于10mm pbs(ph 5.0)中检测,λ
ex
=700nm。结果显示即使干扰物浓度相当高,对fen探针几乎没有干扰。
[0112]
四、机理验证
[0113]
为了进一步证实荧光共振能量转移效应是由酸性鞘磷脂酶引起的,选择两种常见的酸性鞘磷脂酶抑制剂no和地昔帕明(des),酸性鞘磷脂酶与不同浓度的noc
‑
5(noc
‑
5是no的供体)、des在37℃预孵育30分钟,与fen探针混合后,检测i
750
/i
830
荧光值的变化(酶浓度:
0.30u/ml;fen探针浓度:50μg/ml)。实验结果如图9所示。结果表明,基于荧光共振能量转移效应的反应确实是由酸性鞘磷脂酶引起。
[0114]
实施例3、mcf
‑
7细胞和sirna转染的mcf
‑
7细胞中酸性鞘磷脂酶的活性检测
[0115]
在细胞实验之前,通过mtt细胞毒性试验对fen探针的细胞毒性进行了评估。如图10a,结果显示,当用量不超过100μg/ml时,细胞活力保持在90%左右。
[0116]
为了验证fen探针用于细胞酸性鞘磷脂酶活性检测的可行性,首先培养具有不同酸性鞘磷脂酶表达水平的细胞,包括野生型乳腺癌细胞(mcf
‑
7)和sirna(asm
‑
1si和asm
‑
2si)转染的mcf
‑
7细胞,具体步骤如下:
[0117]
细胞均在t75培养瓶中培养,所用的培养液是添加了10%fbs,1%(体积比)青霉素
‑
链霉素的dmem培养液,置于37℃、5%co2培养箱中培养。所有sirna是从上海吉玛制药技术有限公司购买,脂质体lipofectamine 2000购自赛默飞公司。操作过程:首先将16μl sirna(10μm)、8μl(1mg/ml)lipofectamine 2000、50μl dmem混合均匀,避光静置15分钟,然后转入到6孔板中,与细胞培养液(培养液体积为2ml)混合均匀,使得sirna最终浓度为100nm,孵育6
‑
8h后,吸弃液体,再加入新的细胞培养液继续培养细胞以进行后续的western blot实验。如图10b,western blot结果清楚地显示,特异性sirna(asm
‑
1si和asm
‑
2si)转染的细胞中,酸性鞘磷脂酶低表达。此外,如图10c,酸性鞘磷脂酶活性检测结果显示,与未转染的mcf
‑
7细胞相比,转染的mcf
‑
7细胞显示出更低的荧光比值(i
750
/i
830
)。表明sirna转染(asm
‑
1si和asm
‑
2si)的mcf
‑
7细胞中酸性鞘磷脂酶活性较低。
[0118]
由于酸性鞘磷脂酶可以催化鞘磷脂水解成神经酰胺,基于超高效液相色谱电喷雾电离串联质谱(uhplc
‑
esi
‑
ms/ms),在mcf
‑
7细胞和转染sirna的mcf
‑
7细胞中检测并比较了d18:1/16:0鞘磷脂及其水解产物16:0神经酰胺,如图10d,sirna(asm
‑
1si和asm
‑
2si)转染mcf
‑
7细胞时,使得酸性鞘磷脂酶活性降低,质谱检测d18:1/16:0鞘磷脂水平较高,d18:1/16:0神经酰胺的水平较低。此结果进一步证实了fen探针检测酸性鞘磷脂酶活性的准确性。
[0119]
实施例4、人尿中的酸性鞘磷脂酶活性的检测
[0120]
用fen探针检测尿中酸性鞘磷脂酶活性,结果表明,腹膜炎患者尿液中酸性鞘磷脂酶活性明显高于正常人,而正常人尿液中酸性鞘磷脂酶几乎没有活性。检测步骤如下:在10ml的试管中,加入5ml pbs(10mm)和100μl的fen探针原液(5mg/ml),然后分别加入适量正常人的尿液和腹膜炎患者的尿液,用pbs调节终体积至10ml,涡旋使反应液混合均匀。于37℃下孵育90分钟,然后取3ml反应后液体转移到石英皿中测量荧光强度/光谱(λ
ex
=700nm),激发和发射狭缝宽度均设置为10nm。同时,准备pbs空白溶液,在相同条件下进行检测以进行空白对照。
[0121]
实验结果如图11所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1