一种蛋白类药物的干燥工艺的制作方法
本发明涉及化学制药工艺领域,具体涉及一种蛋白类药物的干燥工艺。
背景技术:
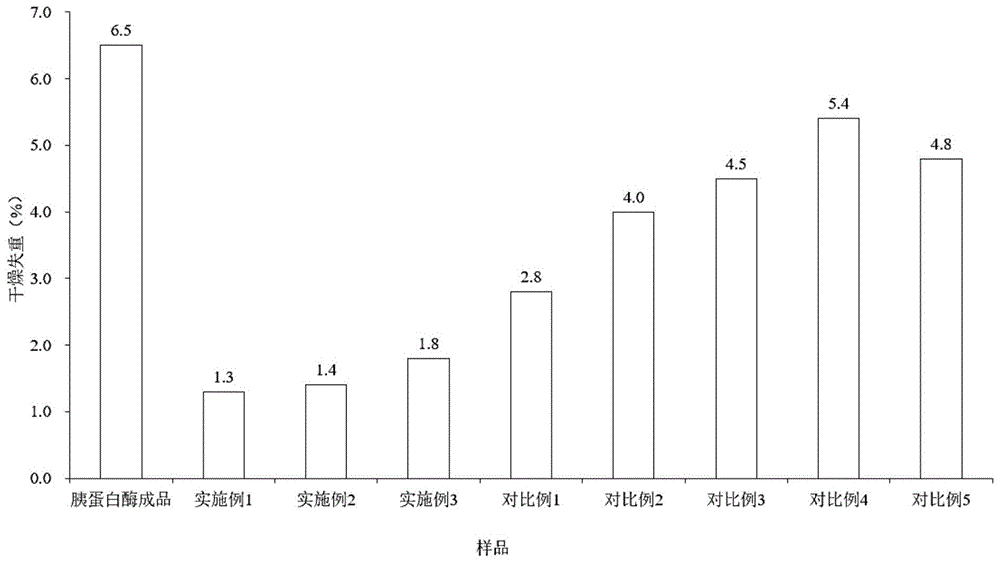
:胰蛋白酶、糜蛋白酶和玻璃酸酶等蛋白类药物是从猪、牛或羊等动物组织提取的重要的蛋白水解酶。胰蛋白酶能水解蛋白质为多肽或氨基酸,对精氨酸和赖氨酸的肽链具有选择性的水解作用,为一肽链内切酶。糜蛋白酶不仅具有肽链内切酶作用,能迅速分解蛋白质为分子量较小的肽,而且具有脂酶作用,可以水解酯键,因此能促进血凝块、脓性分泌物和坏死组织等的消化清除。玻璃酸酶催化透明质酸等酸性黏多糖水解,产生以丁糖为主的偶寡糖,使透明质酸的黏滞性明显下降,从而降低组织黏度,提高毛细血管和组织的通透性,加速细胞内外物质的扩散。但是,胰蛋白酶、糜蛋白酶和玻璃酸酶真空冷冻干燥后的成品都极易吸潮,例如冻干出箱时成品含水量较高,或者储存的环境湿度过大,都容易导致干燥失重不合格,从而降低成品的稳定性。目前,本领域常规的处理方法是五氧化二磷干燥法,即把胰蛋白酶成品、糜蛋白酶成品或玻璃酸酶成品置于真空干燥箱中,并加入干燥剂五氧化二磷进行减压干燥处理;但这种方式存在处理量小,干燥时间过长,成品稳定性差,需要使用大量五氧化二磷等干燥剂,且容易产生干燥剂残留等问题。因此,为了使胰蛋白酶成品、糜蛋白酶成品或玻璃酸酶成品的干燥失重符合《中华人民共和国药典》中的限度要求,且不影响生物活性,提高产品稳定性,亟需提供一种蛋白类药物的干燥工艺解决上述问题。技术实现要素:本发明所要解决的问题在于克服现有技术中蛋白类药物的干燥工艺处理量小,干燥时间过长,成品稳定性差等缺陷,并提供一种蛋白类药物的干燥工艺。本发明的干燥工艺采用真空干燥法,相比于现有技术,节约了1~2天的干燥时间,有效地提高了工业生产效率;同时,本发明的干燥工艺制得的干燥后的蛋白类药物的干燥失重能够降低至2.0%以下,且不影响生物活性,稳定性较好。本发明是通过以下技术方案解决上述技术问题的:本发明提供了一种蛋白类药物的干燥工艺,其特征在于,所述干燥工艺包括如下步骤:将蛋白类药物进行真空干燥处理;其中,所述蛋白类药物包括胰蛋白酶成品、糜蛋白酶成品和玻璃酸酶成品中的一种或多种;所述真空干燥的真空度为20pa以下;所述真空干燥的温度为35~45℃;所述真空干燥的时间为6h以上;所述真空干燥的过程中,所述蛋白类药物的厚度为16mm以下。本发明中,所述干燥工艺优选为不添加干燥剂。其中,所述干燥剂一般是指本领域常规的用于干燥蛋白类药物的干燥剂,例如五氧化二磷或无水氯化钙。本发明中,本领域技术人员应当知晓所述胰蛋白酶成品、所述糜蛋白酶成品或所述玻璃酸酶成品一般是指冻干粉。其中,所述冻干粉一般是指在洁净区将药液冷冻成固态,抽真空将水分升华干燥而成的无菌粉。本发明中,所述胰蛋白酶成品、所述糜蛋白酶成品或所述玻璃酸酶成品一般是指干燥失重>5%的冻干粉,例如干燥失重为6.5%的胰蛋白酶冻干粉、干燥失重为5.8%的糜蛋白酶冻干粉或干燥失重为5.2%的玻璃酸酶冻干粉。本发明中,所述干燥失重一般是指干燥至恒重后减失的质量占所述蛋白类药物取样量的质量百分比。本发明中,所述真空干燥的真空度可为10~20pa;例如10~15pa;再例如10pa或15pa。本发明中,所述真空干燥的温度可为35~40℃,例如40℃。本发明中,所述真空干燥的时间可为6~20h;优选为8~15h;例如8~12h;再例如9h或10h。本发明中,所述真空干燥的过程中,所述蛋白类药物的厚度可为15mm以下,例如0~15mm但不为0,再例如10mm、12mm或者15mm。本领域技术人员可根据成本、样品含水量和样品处理量等实际情况选择所述蛋白类药物的厚度,例如6~10mm。其中,所述样品一般是指如前所述的蛋白类药物。本发明中,所述真空干燥的设备一般可为真空冷冻干燥机。当所述真空干燥的设备为真空冷冻干燥机时,本领域技术人员知晓所述温度一般是指所述真空冷冻干燥机的板层温度。其中,所述真空冷冻干燥机可为本领域常规的真空冷冻干燥机,例如lyo-1真空冷冻干燥机。优选地,所述真空干燥中,所述蛋白类药物的厚度均匀。当采用真空冷冻干燥机进行所述真空干燥时,根据常识可知,一般将所述蛋白类药物平铺在所述真空冷冻干燥机的冻干盘中。本发明中,所述蛋白类药物的质量可为能够满足所述蛋白类药物的厚度为16mm以下即可,或者根据实际需要进行选择。本发明中,本领域人员均知晓所述真空干燥处理包括下述步骤:(1)开启所述真空干燥设备,设置所述真空干燥设备的温度和真空度,对所述蛋白类药物进行干燥;(2)关闭所述真空干燥设备,并将所述真空干燥设备设置为常压,取出干燥后的所述蛋白类药物,即可。其中,本领域技术人员应当知晓,步骤(2)中所述常压一般是指一个标准大气压(101325pa)。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:(1)本发明的干燥工艺采用真空干燥法,相比于现有技术,节约了1~2天的干燥时间,有效地提高了工业生产效率。(2)采用本发明的干燥工艺,制得的干燥后的胰蛋白酶成品、干燥后的糜蛋白酶成品或干燥后的玻璃酸酶成品,其干燥失重能够降低至2.0%以下,且不影响生物活性,稳定性较好。附图说明图1为实施例1~3和对比例1~5中干燥后的胰蛋白酶成品干燥失重柱状图;图2为实施例4~7和对比例6~9中干燥后的糜蛋白酶成品干燥失重柱状图;图3为实施例8~10和对比例10~13中干燥后的玻璃酸酶成品干燥失重柱状图。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。下述实施例和对比例中,所述的干燥失重不合格的胰蛋白酶成品为干燥失重>5%的胰蛋白酶成品。所述的干燥失重不合格的糜蛋白酶成品为干燥失重>5%的糜蛋白酶成品。所述的干燥失重不合格的玻璃酸酶成品为干燥失重>5%的玻璃酸酶成品。下述实施例和对比例中的原料胰蛋白酶成品、糜蛋白酶成品和玻璃酸酶成品均可按照本领域常规方法制得,但是由于出箱过程中未控制好出箱时温度和湿度,导致干燥失重不合格;胰蛋白酶成品、糜蛋白酶成品和玻璃酸酶成品的干燥失重和效价如表1所示。其中,胰蛋白酶成品的干燥失重和湿品效价分别按照《中国药典》2015版(二部)第1170页胰蛋白酶中的干燥失重、效价测定测得;糜蛋白酶成品的干燥失重和湿品效价分别按照《中国药典》2015版(二部)第1591页糜蛋白酶中的干燥失重、效价测定测得;玻璃酸酶成品的湿品效价按照《中国药典》2015版(四部)第167页玻璃酸酶测定法测得;玻璃酸酶成品的干燥失重按照《中国药典》2015版第一增补本第259页干燥失重测定法测得。其中,表1中的干品效价可按照公式:湿品效价=干品效价×(1-干燥失重)计算得到。表1注:干品为扣除水份的样品;湿品是未扣除水份的样品。实施例1~3和对比例1~4实施例1~3和对比例1~4中的样品为表1中所示的干燥失重不合格的胰蛋白酶成品。实施例1~3和对比例1~4中干燥工艺的步骤如下:(1)称量样品(干燥失重不合格胰蛋白酶成品),混合均匀后平铺在冻干盘中,放入真空冷冻干燥机中;其中,样品质量和平铺厚度如表2所示;(2)开启真空冷冻干燥机,设置真空冷冻干燥机的板层温度,并调节真空冷冻干燥机的真空度,再对胰蛋白酶成品进行干燥;其中,板层温度和真空度如表2所示;(3)干燥后关闭真空冷冻干燥机;其中,干燥时间如表2所示;(4)将真空冷冻干燥机设置为常压,取出干燥后的胰蛋白酶成品,即可。实施例1~3和对比例1~4中,除表2中所示工艺条件或参数外,其他均相同。其中,对比例1~2中,胰蛋白酶成品平铺的厚度不在本申请请求保护的16mm以下范围内;对比例3中,板层温度不在本申请请求保护的35~45℃范围内;对比例4中,真空度和干燥时间均不在本申请请求保护的范围内。表2对比例5对比例5中的样品为表1中所示的干燥失重不合格的胰蛋白酶成品。对比例5采用现有技术中的五氧化二磷干燥工艺,步骤如下:(1)称量胰蛋白酶成品60.0g,混合均匀后平铺在冻干盘中,平铺的厚度为12mm,放入真空干燥箱中;(2)称量30.0g五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(3)开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,对胰蛋白酶成品进行干燥;(4)干燥24h后关闭真空干燥箱,并将真空干燥箱的压力调节至常压;(5)更换步骤(2)中的干燥剂,将30.0g的五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(6)再次开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,再次对胰蛋白酶成品进行干燥;(7)干燥24h后关闭真空干燥箱,将真空干燥箱的压力调节至常压,取出干燥后的胰蛋白酶成品。效果实施例1按照《中国药典》2015版(二部)第1170页胰蛋白酶中的干燥失重、效价测定法,检测实施例1~3和对比例1~5制得的干燥后的胰蛋白酶成品的干燥失重和湿品效价;其中,可按照公式:湿品效价=干品效价×(1-干燥失重),将湿品效价换算为干品效价进行比较。结果如图1和表3所示:表3干燥失重(%)干品效价(u/mg)胰蛋白酶成品6.52851实施例11.32819实施例21.42856实施例31.82839对比例12.82839对比例24.02859对比例34.52833对比例45.42819对比例54.82750由表3可以看出,将干燥失重不合格的胰蛋白酶成品(干燥失重为6.5%),采用实施例1~3中的干燥工艺,干燥失重均符合《中国药典》2015版(二部)第1170页中的要求,干燥后的胰蛋白酶成品的干燥失重降低至1.8%以下,且与对比例4~5相比,干燥时间节约了1~2天。对比例1~2中,胰蛋白酶成品平铺的厚度不在16mm以下,对比例3中,板层温度不在35~45℃范围内;虽然干燥后的胰蛋白酶成品干品效价没有明显变化,但是干燥后的胰蛋白酶成品的干燥失重仍为2.8%以上,不如实施例1~3。对比例4中,胰蛋白酶成品在40℃、400pa条件下真空干燥48h,虽然干燥后的胰蛋白酶成品干品效价没有明显变化,但是干燥后的胰蛋白酶成品的干燥失重为5.4%(>5%),不符合《中国药典》2015版(二部)第1170页中的要求。对比例5中,采用现有技术中的五氧化二磷干燥工艺将胰蛋白酶成品在真空干燥箱中干燥48h,虽然其干燥失重降低至4.8%,符合《中国药典》2015版(二部)第1170页中的要求,但接近合格线上限,且干燥后胰蛋白酶成品干品效价略有降低,影响了生物活性。实施例4~7和对比例6~8实施例4~7和对比例6~8中的样品为表1中所示的干燥失重不合格的糜蛋白酶成品。实施例4~7和对比例6~8中干燥工艺的步骤如下:(1)称量样品(干燥失重不合格糜蛋白酶成品),混合均匀后平铺在冻干盘中,放入真空冷冻干燥机中;其中,样品质量和平铺厚度如表4所示;(2)开启真空冷冻干燥机,设置真空冷冻干燥机的板层温度,并调节真空冷冻干燥机的真空度,再对糜蛋白酶成品进行干燥;其中,板层温度和真空度如表4所示;(3)干燥后关闭真空冷冻干燥机;其中,干燥时间如表4所示;(4)将真空冷冻干燥机设置为常压,取出干燥后的糜蛋白酶成品,即可。实施例4~7和对比例6~8中,除表4中所示工艺条件或参数外,其他均相同。其中,对比例6的干燥工艺中,真空干燥的真空度不在本申请请求保护的20pa以下;对比例7的干燥工艺中,真空干燥的时间不在本申请请求保护的6h以上;对比例8的干燥工艺中,真空度和干燥时间均不在本申请请求保护的范围内。表4对比例9对比例9中的样品为表1中所示的干燥失重不合格的糜蛋白酶成品。对比例9采用现有技术中的五氧化二磷干燥工艺,步骤如下:(1)称量糜蛋白酶成品60.0g,混合均匀后平铺在冻干盘中,平铺的厚度为12mm,放入真空干燥箱中;(2)称量30.0g五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(3)开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,对糜蛋白酶成品进行干燥;(4)干燥24h后关闭真空干燥箱,并将真空干燥箱的压力调节至常压;(5)更换步骤(2)中的干燥剂,将30.0g的五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(6)再次开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,再对糜蛋白酶成品进行干燥;(7)干燥24h后关闭真空干燥箱,将真空干燥箱的压力调节至常压,取出干燥后的糜蛋白酶成品。效果实施例2按照《中国药典》2015版(二部)第1591页糜蛋白酶中的干燥失重、效价测定法,检测实施例4~7和对比例6~9制得的干燥后的糜蛋白酶成品的干燥失重和湿品效价;其中,可按照公式:湿品效价=干品效价×(1-干燥失重),将湿品效价换算为干品效价进行比较。结果如图2和表5所示:表5干燥失重(%)干品效价(u/mg)糜蛋白酶成品5.81327实施例41.31306实施例51.31289实施例61.71293实施例71.71306对比例63.51295对比例74.81289对比例84.81260对比例94.71200由表5可以看出,将干燥失重不合格的糜蛋白酶成品(干燥失重为5.8%),采用实施例4~7中的干燥工艺,干燥失重均符合《中国药典》2015版(二部)第1591页中的要求,干燥后的糜蛋白酶成品的干燥失重降低至1.8%以下,且与对比例8~9相比,干燥时间节约了1~2天。对比例6中,真空干燥的真空度不在本申请请求保护的范围内,虽然其干燥失重降低至3.5%,符合《中国药典》2015版二部第1591页中的要求,但明显高于1.7%,不如实施例4~7。对比例7中,真空干燥的时间不在本申请请求保护的范围内,虽然其干燥失重降低至5%以下,符合《中国药典》2015版(二部)第1591页中的要求,但接近合格线上限,不如实施例4~7。对比例8中,糜蛋白酶成品在40℃、400pa条件下真空干燥48h,但是干燥后的糜蛋白酶成品的干燥失重为4.8%,虽然符合《中国药典》2015版(二部)第1591页中的要求,但干燥时间过长,效率低,且干燥后糜蛋白酶成品的干品效价略有降低,影响了生物活性。对比例9中,采用现有技术中的五氧化二磷干燥工艺将糜蛋白酶成品在真空干燥箱中干燥48h,虽然其干燥失重降低至4.7%,符合《中国药典》(2015版)二部第1591页中的要求,但干燥后糜蛋白酶成品的干品效价降低,影响了生物活性。实施例8~10和对比例10~12实施例8~10和对比例10~12中的样品为表1中所示的干燥失重不合格的玻璃酸酶成品。实施例8~10和对比例10~12中干燥工艺的步骤如下:(1)称量样品(干燥失重不合格玻璃酸酶成品),混合均匀后平铺在冻干盘中,放入真空冷冻干燥机中;其中,样品质量和平铺厚度如表6所示;(2)开启真空冷冻干燥机,设置真空冷冻干燥机的板层温度,并调节真空冷冻干燥机的真空度,再对玻璃酸酶成品进行干燥;其中,板层温度和真空度如表6所示;(3)干燥后关闭真空冷冻干燥机;其中,干燥时间如表6所示;(4)将真空冷冻干燥机设置为常压,取出干燥后的玻璃酸酶成品,即可。实施例8~10和对比例10~12中,除表6中所示工艺条件或参数外,其他均相同。其中,对比例10的干燥工艺中,真空干燥的真空度不在本申请请求保护的20pa以下;对比例11的干燥工艺中,真空干燥的时间不在本申请请求保护的6h以上;对比例12的干燥工艺中,真空度和干燥时间均不在本申请请求保护的范围内。表6对比例13对比例13中的样品为表1中所示的干燥失重不合格的玻璃酸酶成品。对比例13采用现有技术中的五氧化二磷干燥工艺,步骤如下:(1)称量玻璃酸酶成品60.0g,混合均匀后平铺在冻干盘中,平铺的厚度为12mm,放入真空干燥箱中;(2)称量30.0g五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(3)开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,对玻璃酸酶成品进行干燥;(4)干燥24h后关闭真空干燥箱,并将真空干燥箱的压力调节至常压;(5)更换步骤(2)中的干燥剂,将30.0g的五氧化二磷干燥剂,平铺在另一个冻干盘中,放入真空干燥箱中;(6)再次开启真空干燥箱,将真空干燥箱的温度设置为40℃,并将真空干燥箱的真空度调节至400pa,再对玻璃酸酶成品进行干燥;(7)干燥24h后关闭真空干燥箱,将真空干燥箱的压力调节至常压,取出干燥后的玻璃酸酶成品。效果实施例3按照《中国药典》2015版(四部)第167页玻璃酸酶测定法,检测实施例8~10和对比例10~13制得的干燥后的玻璃酸酶成品的湿品效价;可按照公式:湿品效价=干品效价×(1-干燥失重),将湿品效价换算为干品效价进行比较。按照《中国药典》2015版第一增补本第259页干燥失重测定法,检测实施例8~10和对比例10~13制得的干燥后的玻璃酸酶成品的干燥失重。结果如图3和表7所示:表7由表7可以看出,将干燥失重不合格的玻璃酸酶成品(干燥失重为5.2%),采用实施例8~10中的干燥工艺,干燥失重均符合《中国药典》2015版第一增补本第259页中的要求,干燥后的玻璃酸酶成品的干燥失重降低至1.7%以下,且与对比例12~13相比,干燥时间节约了1~2天。对比例10中,真空干燥的真空度不在本申请请求保护的范围内,虽然其干燥失重降低至3.9%,符合《中国药典》2015版第一增补本第259页中的要求,但干燥失重值偏大,不如实施例8~10。对比例11中,真空干燥的时间不在本申请请求保护的范围内,虽然其干燥失重降低至4.3%,符合《中国药典》2015版第一增补本第259页中的要求,但接近合格线上限,不如实施例8~10。对比例12中,玻璃酸酶成品在40℃、400pa条件下真空干燥48h,干燥后的玻璃酸酶成品的干燥失重为4.6%,符合《中国药典》2015版第一增补本第259页中的要求,但接近合格线上限,不如实施例8~10。对比例13中,采用现有技术中的五氧化二磷干燥工艺将玻璃酸酶成品在真空干燥箱中干燥48h,虽然其干燥失重降低至3.8%,符合《中国药典》2015版第一增补本第259页中的要求,但是干燥后玻璃酸酶成品干品效价略有降低,影响了生物活性。以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本
技术领域:
的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1