一种削减养殖废水中抗生素抗性基因的方法
1.本发明属于生物环保技术领域,具体涉及一种削减养殖废水中抗生素抗性基因的方法。
背景技术:
2.近年来,养殖业的快速发展加大了畜禽养殖废水的排放量,该类废水是无法通过人工湿地、农田回用等方式消纳的。畜禽养殖废水中含有大量的有机物和氨氮,主要为畜禽尿液、冲洗污水,生活污水等,其中冲洗污水占比较大。此外,为了提高出栏率,畜禽饲料被掺入大量抗生素。由于抗生素大多数是水溶性的,不易被肠道吸收,代谢不完全,部分抗生素以母体形式伴随着其代谢产物排出体外,从而进入环境中。这些化合物在水中持久性强,难降解,经市政污水处理厂处理后仍有残留。
3.19世纪80年代起,环境中开始检测到多种抗生素,这些抗生素会给人类及其他生物带来毒副作用,甚至会危及生命。残余的抗生素导致的环境污染和生态毒害问题尤其引人关注。抗生素在环境中的残余不仅对自然生态系统构成了潜在的危害,也诱导了抗生素抗性基因(antibiotic resistance genes,args)和抗生素耐药细菌(antibiotic resistance bacteria,arb)的产生和传播。越来越多的研究证明,args及arb在水环境的增殖和扩散已经成为一个比抗生素残留更难处理的环境问题。
4.args是导致细菌产生抗生素耐药性的主要因素,因其具备生物活性、迁移转化途径复杂、种类多样等特点,被视为一种新型的环境污染物。总的来说,其通过垂直进化和水平转移在环境中扩散和传播,对生态环境和人类健康造成了很大的威胁和破坏。近年来,args已被报道在不同环境介质中被广泛检测出来。而水环境一直是大多数污染物的最终受体,同时也是args的研究热点。据报道,我国众多水体均有不同程度的检出磺胺类args。
5.值得注意的是,能降解抗生素的方法技术不一定能降解args。比如在文献中(water research,2018,145,498-508),活性污泥法可以有效去除羟氨苄青霉素、阿奇霉素、环丙沙星、氯霉素、二甲胺四环素、氧四环素、磺胺甲嘧啶、万古霉素等抗生素(去除效率高达70%),但是,对多数args没有起到削减的功效。目前去除args的技术主要包括絮凝膜生物反应器、人工湿地、光催化、氯消毒、臭氧消毒、紫外消毒以及fenton氧化等方法。比如在文献中(environmental pollution,2019,249,894-903),87.8%-99.1%的args可以通过中试人工湿地的方法被去除。虽然这些手段对于水体中args具有一定的去除作用,但是由于操作复杂,经济成本较高,容易产生二次污染等问题,大多数处理方法难以满足实际生产要求。因此,开发一些新型的能够有效削减args的工艺十分重要。
技术实现要素:
6.本发明的目的是为了解决现有降解水体中抗生素的方法无法削减args以及现有削减水体中args的方法成本高、易产生二次污染的技术问题,而提供一种削减养殖废水中抗生素抗性基因的方法。
7.本发明的一种削减养殖废水中抗生素抗性基因的方法按以下步骤进行:
8.步骤1:将微藻加入已灭菌的bg-11培养基,然后于光生物反应器中进行预培养,培养至对数期,离心得到小球藻沉淀;
9.步骤2:将步骤1的小球藻沉淀加入养殖废水中,然后于光生物反应器中进行培养,培养5~6天,消减养殖废水中args,完成水处理。
10.进一步限定,步骤1中所述微藻为蛋白核小球藻chlorellapyrenoidosa。
11.进一步限定,步骤1中所述于光生物反应器中进行预培养的参数为:培养温度为25~30℃,培养转速为150rpm~300rpm,培养光照150μmol/m2/s~300μmol/m2/s,曝气量为45ml/min~65ml/min。
12.进一步限定,所述曝气的气体为co2质量分数为2%~2.5%的空气和co2的混合气体。
13.进一步限定,步骤1中培养4~5天至对数期。
14.进一步限定,步骤2中所述于光生物反应器中进行培养的参数为:温度25~35℃,转速为150rpm~300rpm,光照强度为150μmol/m2/s~300μmol/m2/s,曝气量为45ml/min~65ml/min。
15.进一步限定,所述曝气的气体为co2质量分数为2%~2.5%的空气和co2的混合气体。
16.进一步限定,步骤2中所述养殖废水理化参数为ph:6~8、cod:600mg/l~950mg/l、no
3-‑
n:40mg/l~60mg/l、nh
4+-n:400mg/l~700mg/l、tp:12mg/l~40mg/l。
17.进一步限定,步骤2中所述养殖废水中细菌群落包括rhodanobacter,chryseobacterium,dyella,stenotrophomonas,rhodobacter,dechloromonas,hyphomicrobium,thermomonas,rhodovastum,真菌群落包括cryptococcus,clonostachys,geotrichum,fusarium,cutaneotrichosporon,inocybe,fusicolla,trichoderma,psathyrella,archaeorhizomyces,mortierella,trichosporon。
18.进一步限定,进一步限定,步骤2中所述args具体为16s rrna、sul1、sul2、sul3。
19.本发明具有的优点:
20.1)小球藻广泛分布于自然界,易于培养;
21.2)操作简单易行,制备成本较为低廉;
22.3本发明的方法对养殖废水中的抗生素抗性基因起到削减效果,因此,本发明有很大优势,具有大规模推广应用的潜力。
附图说明
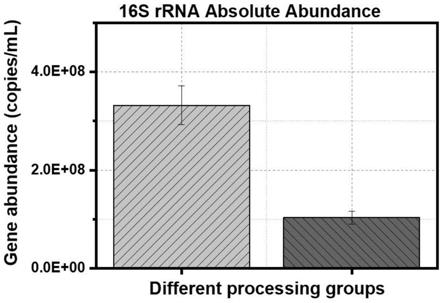
23.图1为实施例1步骤2培养第0天和第6天出水中16s rrna的去除效果图;
24.图2为实施例1步骤2培养第0天和第6天出水中sul1的去除效果图;
25.图3为实施例1步骤2培养第0天和第6天出水中sul2的去除效果图;
26.图4为实施例1步骤2培养第0天和第6天出水中sul3的去除效果图;
27.图1-4的柱形图中,左侧为第0天出水,右侧为第6天出水。
具体实施方式
28.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
29.下述实施例中所使用的实验方法如无特殊说明均为常规方法。所用材料、试剂、方法和仪器,未经特殊说明,均为本领域常规材料、试剂、方法和仪器,本领域技术人员均可通过商业渠道获得。
30.下述实施例中所使用的实验仪器和药品如下:
31.实验仪器:
32.光度计(li-cor inc.,lincoln,ne,usa)
33.立式高压蒸汽灭菌器(ldzx-75kbs,shenan)
34.可见分光光度计(spectronic genesis 8,thermo electric,uk)
35.实时荧光定量pcr(thermo)
36.实验药品:
37.蛋白核小球藻chlorellapyrenoidosa(中科院武汉水生生物研究所)
38.原畜禽养殖废水(哈尔滨某畜禽厂)
39.dna快速提取试剂盒tiannamp soil dnakit
40.tb green
tm premix ex taq
tm ii(tli rnaseh plus)(takara,code no.rr820a)
41.qpcr反应体系:
[0042][0043][0044]
qpcr反应条件为:第一阶段温度为95℃,时间为30s,循环次数为1;第二阶段温度为95℃,时间为5s,循环次数为40;第三阶段温度为60℃,时间为30s,循环次数为40。
[0045]
16s rrna,sul1,sul2和sul3的引物公开于environmental microbiology,2015,70,425-432中。
[0046]
实验方法:
[0047]
实施例1:本实施例的一种削减养殖废水中抗生素抗性基因的方法按以下步骤进行:
[0048]
步骤1:将蛋白核小球藻chlorellapyrenoidosa加入已灭菌的bg-11培养基,然后
于光生物反应器中进行预培养,培养4天至对数期,第四天的od
680
范围为6-7,离心得到小球藻沉淀;所述预培养的参数为:培养温度为30℃,培养转速为200rpm,培养光照200μmol/m2/s,曝气量为50ml/min,曝气的气体为co2质量分数为2%的空气和co2的混合气体;
[0049]
步骤2:将步骤1的小球藻沉淀加入原畜禽养殖废水(哈尔滨某畜禽厂)中,然后于光生物反应器中进行培养,培养6天,削减养殖废水中args,完成水处理,所述培养的参数为:温度30℃,转速为200rpm,光照强度为200μmol/m2/s,曝气量为50ml/min,曝气的气体为co2质量分数为2%的空气和co2的混合气体,经检测原畜禽养殖废水理化参数为ph:7、cod:680mg/l、no
3-‑
n:46mg/l、nh
4+-n:495mg/l、tp:20mg/l,所述原畜禽养殖废水中细菌群落包括rhodanobacter,chryseobacterium,dyella,stenotrophomonas,rhodobacter,dechloromonas,hyphomicrobium,thermomonas,rhodovastum,真菌群落包括cryptococcus,clonostachys,geotrichum,fusarium,cutaneotrichosporon,inocybe,fusicolla,trichoderma,psathyrella,archaeorhizomyces,mortierella,trichosporon,所述args具体为16s rrna、sul1、sul2、sul3。
[0050]
为了验证实施例1的技术效果,采用下述试验对实施例1步骤2第0天和第6天出水进行args定量检测,具体步骤如下:
[0051]
步骤(1):采集实施例1步骤2培养第0天(即原水)和第6天反应器出水,采集过程如下:首先将反应器内的液体旋转均匀,采集体积为30ml,在滤膜为0.22微米下进行抽滤,得到分离体;
[0052]
步骤(2):提取dna,a260/280条件下的dna浓度为1.65~1.8,之后采用荧光定量qpcr方法检测出水中args扩增曲线;
[0053]
步骤(3):首先测量args标准品的质粒dna浓度,然后稀释至-1梯度(即0.7ng/ul),之后取10μl-1梯度样品加入到90μl的ddh2o中,得到-2梯度(即0.07ng/ul)稀释样品,按照该方法,直至稀释到-6梯度,将得到的各个稀释梯度的样品用定量qpcr检测,得到args标准曲线;
[0054]
步骤(4):将步骤(3)获得的args扩增曲线的fold值带入args标准曲线中以获得args绝对含量。
[0055]
实验结果如图1-4所示:相较于原污水,本发明的方法可以明显削减出水中16s rrna、sul1、sul2、sul3的绝对数值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1