膜清洁溶液和使用其加速膜清洁的方法与流程
相关申请的交叉引用
本申请要求于2017年6月30日提交的共同待决的美国临时申请号62/527162的优先权,其全部内容通过引用并入本文。
发明领域
本发明涉及用于过滤膜的清洁操作的清洁溶液。本发明还提供了使用这种清洁溶液的方法。
背景
过滤是使一种材料与另一种材料分离。过滤可以通过使用膜来实现。保留在膜上的物质的特征是渗余物或浓缩物。穿过膜的液体是溶质、滤液或渗透液(permeate),后者是膜过滤最常用的术语。处理流后残留在膜上的污垢的特征是膜污染。这些膜过滤器随后必须进行清洁操作,以去除在处理操作过程期间发生的任何污染,以便继续使用这种过滤系统来连续生产渗透液。
在乳制品、酿造和饮料以及加工食品操作中,膜设备用于分馏、分离和浓缩(upconcentration)期望产品成分。然后,这种膜过滤器随后必须进行清洁操作,以去除该过程期间发生的任何污染。
常规地,已经使用水力和/或化学处理来清洁这些污染膜。然而,这些方法在有效去除几乎所有沉积材料方面并不完全有效。历经这种操作中以及这种清洁操作常规需要的化学处理中常规使用的多个步骤,提供污染材料大量去除的方法往往耗时、昂贵(就能量和用水量而言)。
已经配制了清洁剂以具体解决污染物的性质和物理化学性能。配制这些清洁剂以试图分解污染物和构成膜的材料之间形成的联结。
化学清洁涉及必须按照具体的规定顺序执行的几个步骤。首先,必须漂洗膜以去除不易变得沉积在膜上的污垢。然后可以将化学清洁溶液引入膜并在膜上适当保持一定的规定时间。然后必须在这种清洁步骤之后进行另一漂洗步骤。然后常规地对膜进行其他步骤以从膜上去除清洁溶液,所述步骤可能包括酸处理步骤和/或碱处理步骤,其中每个采用的步骤之后是另一漂洗步骤。
四个参数主要决定清洁剂的有效性。这些参数包括接触时间、化学反应、温度和机械能。这些参数与部署的基于化学的清洁剂以及沉积在膜上的污染物的性质具体相关。本发明的目的是提供一种清洁过滤膜的方法。
清洁剂还包括用于膜的酶促处理的酶。在这种膜的清洁操作中已经使用酶促处理,以将沉积的材料分解成较小的化合物,从而使它们更容易从膜上去除。酶促清洁步骤可以有利地减少或消除可能由膜上的有机污垢如蛋白质和脂质吸附引起的不可逆污染。特别地,蛋白酶利用水分子催化各种键的水解反应。
在本领域中仍然需要提供有效减少或消除不可逆污染的基于酶的清洁溶液和膜清洁操作。如果水力清洁后的过滤阻力等于前一个过滤周期开始时的过滤阻力,则认为污染是完全可逆的。如果需要施加化学清洁,则认为污染是不可逆的。长期以来需要这种清洁操作,该清洁操作可以随着减少总体时间、用水量、能量和化学药品中的任何一种或多种而实现。
发明概述
本发明涉及用于清洁膜的基于酶的清洁方法。不意欲受理论的束缚,相对于常规清洁操作,本发明的清洁方法导致清洁时间、总用水量、能量和化学药品中的一种或多种减少。
本发明的一个方面提供了一种清洁膜的方法,该方法包括:预漂洗膜;使用包含酶和具有与酶相容的ph的试剂的溶液清洁膜,该组合物具有与膜相容的温度;防止溶液中的二价离子沉淀;降低酶活性;和后漂洗膜以去除溶液。在本发明的一个实施方案中,溶液可以另外包含结合剂。在本发明的某些实施方案中,溶液另外包含表面活性剂。
进一步根据本发明的该实施方案,表面活性剂可包含阴离子、非离子和两性表面活性剂中的至少一种。
根据本发明的一个实施方案,用于清洁膜的溶液可以另外包含结合剂。进一步根据该实施方案,结合剂可以包括以下物质中的至少一种:乙二胺四乙酸(edta)及其任何盐、(羟乙基)乙二胺三乙酸(hedta)及其任何盐、三聚磷酸钾(ktpp)、膦酸及其任何盐、次氮基三乙酸(nta)及其任何盐、二乙烯三胺五乙酸(dtpa)及其任何盐、葡萄糖酸(ga)及其任何盐、谷氨酸二乙酸(glda)及其任何盐、甲基甘氨酸二乙酸(mgda)及其任何盐、亚氨基二琥珀酸(ids)及其任何盐、氨基羧酸及其任何盐、羟基乙烷二膦酸(hedp)及其任何盐、氨基三(亚甲基膦酸)(atmp)及其任何盐、2-膦酸丁烷-1,2,4-三羧酸(pbtc)及其任何盐、乙二胺四(亚甲基膦酸)(edtmp)及其任何盐、二乙烯三胺五(亚甲基膦酸)(dtpmp)及其任何盐、聚丙烯酸盐、丙烯酸-马来酸共聚物及其任何盐以及葡萄糖酸钠(葡萄糖酸na),及其任何组合。进一步根据本发明的该实施方案,基于溶液的总重量,结合剂的浓度为约0.001wt%至约1wt%。在本发明的一个实施方案中,结合剂包括分子量范围为约2.5k至约5k的部分中和的聚丙烯酸。
在本发明的某些实施方案中,清洁膜的方法另外包括添加用于使酶失活的结合剂的步骤。进一步根据这些实施方案,用于使酶失活的结合剂包括以下物质中的任一种或组合:乙二胺四乙酸(edta)及其任何盐、(羟乙基)乙二胺三乙酸(hedta)及其任何盐、三聚磷酸钾(ktpp)、膦酸及其任何盐、次氮基三乙酸(nta)及其任何盐、二乙烯三胺五乙酸(dtpa)及其任何盐、谷氨酸二乙酸(glda)及其任何盐、甲基甘氨酸二乙酸(mgda)及其任何盐、亚氨基二琥珀酸(ids)及其任何盐、氨基羧酸及其任何盐、羟基乙烷二膦酸(hedp)及其任何盐、氨基三(亚甲基膦酸)(atmp)及其任何盐、2-膦酸丁烷-1,2,4-三羧酸(pbtc)及其任何盐、乙二胺四(亚甲基膦酸)(edtmp)及其任何盐、二乙烯三胺五(亚甲基膦酸)(dtpmp)及其任何盐、聚丙烯酸盐、丙烯酸-马来酸共聚物及其任何盐,以及它们的任何组合。进一步根据本发明的该实施方案,基于溶液的总重量,用于使酶失活的结合剂的浓度为约0.005wt%至约1wt%。
在本发明的某些实施方案中,用于使酶失活的结合剂或失活结合剂的重量比为至少约0.2g结合剂比1克酶,优选每克酶约0.2至约200g结合剂,或更优选每克酶约0.2至约80g结合剂。
在本发明的一些实施方案中,清洁膜的方法另外包括添加用于使酶失活的还原剂的步骤。进一步根据这些实施方案,用于使酶失活的还原剂包括连二亚硫酸钠。进一步根据该实施方案,其中连二亚硫酸钠的浓度为至少约0.2wt%,优选为约0.25wt%至约10wt%,或更优选为约0.25wt%至约2.5wt%。
在本发明的某些实施方案中,任选地,增加溶液的ph和/或增加溶液的温度以降低酶的活性。进一步根据该实施方案,取决于膜耐受性,ph可以增加至约11至约13。仍进一步根据该实施方案,温度可以增加至约50℃至约85℃。仍进一步根据该实施方案,ph可以增加至约12.0至约13.0,而温度可以增加至约50℃至约60℃。仍又进一步根据该实施方案,ph可以增加至约11.0至约12.0,而温度可以增加至约60℃至约85℃。
在本发明的一个实施方案中,该膜已用于蛋白质的处理。特别地,根据本发明的某些实施方案,该膜已用于处理酸乳清、甜乳清和脱脂乳之一。
在另一方面,本发明提供了一种清洁膜的方法,该方法包括用包含水的预漂洗溶液预漂洗约2分钟至约30分钟的时段,使用包含酶和具有与该酶相容的ph的试剂的溶液来清洁膜约2分钟至约45分钟的时段,并防止溶液中的任何二价离子沉淀,通过加入结合剂和还原剂中的至少一种来降低酶的活性,任选地,降低酶的活性包括增加溶液的ph和溶液的温度中的至少一种,在添加和任选的增加步骤之后,继续洗涤膜近似至多约40分钟,并用包含水的后漂洗溶液后漂洗约2分钟至约30分钟的时段。
在审阅以下描述时,其他方面和实施方案将变得显而易见。但是,本发明由所附的权利要求特别指出。
附图简述
已经如此概括地描述了本发明,现在将参考附图,这些附图不必须按比例绘制,并且其中:
图1是显示根据本发明实施方案的清洁膜的方法的步骤的流程图;
图2是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.5wt%的edta;
图3是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.125wt%的edta;
图4是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的1.0wt%的edta;
图5是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.001wt%的edta、0.005wt%的edta和0.01wt%的edta;
图6是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.46wt%的mgda;
图7是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.115wt%的mgda;
图8是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的0.33wt%的hedp;和
图9是甜乳清粉在酶底物溶液中的水解度变化的图示,所述酶底物溶液掺有作为结合剂的1.0wt%的聚丙烯酸盐。
发明详述
现在将在下文中更全面地描述本发明。可以描述本发明的优选实施方案,但是本发明可以以许多不同的形式实施,并且不应被解释为限于本文阐述的实施方案。而是,提供这些实施方案使得本公开内容将是透彻和完整的,并将向本领域技术人员充分传达本发明的范围。本发明的实施方案不以任何方式解释为限制本发明。
如说明书和所附权利要求所使用的,单数形式“一”、“一个”和“该”包括复数对象,除非上下文另外明确指出。例如,提及“一种酶(anenzyme)”包括多种这样的酶。
尽管本文采用了具体术语,但是它们仅在一般性和描述性意义上使用,而不是出于限制目的而使用。除非另外定义了术语,否则本文所使用的所有术语,包括技术术语和科学术语,具有与本发明所属领域的普通技术人员通常所理解的相同含义。将进一步理解的是,术语如在常用词典中定义的那些术语应被解释为具有本发明所属领域的普通技术人员通常理解的含义。将进一步理解的是,术语如在常用词典中定义的那些术语应被解释为具有与它们在相关领域和本公开内容的上下文中的含义一致的含义。除非本文的公开内容明确地另外如此定义,否则这种常用术语将不会以理想化或过于正式的意义来解释。
如本文所用,“碱度剂”是指增加溶液ph的化合物。
如本文所用,术语“缓冲剂”意指将清洁溶液的ph保持在狭窄限度范围内的化合物。本发明的清洁溶液中包含的缓冲剂将ph保持在期望范围内。
如本文所用,“结合剂”是与离子结合的物质,优选地,二价离子包括但不限于钙和镁离子。在本发明的优选实施方案中,结合剂包括二价结合剂。结合剂可以包括但不限于螯合物和螯合剂。结合剂包括能够通过形成防止金属离子容易地参与或催化化学反应的络合物而分离或灭活溶液中可能存在的金属离子的化合物。在本文提供的公开内容中,术语“螯合物”、“螯合试剂”或“螯合剂”也可以与术语“结合剂”互换使用。结合剂、螯合物、螯合试剂或螯合剂络合物可以防止某些金属离子沉淀在膜表面上并阻塞膜的孔。例如,装置中存在的用于清洁目的的水可能包括决定水硬度的钙阳离子(ca2+)和镁阳离子(mg2+)。可以包括与ca2+和mg2+金属离子络合以防止诸如磷酸盐、硫酸盐或碳酸盐的化合物沉淀的结合剂。除了提供改善的水硬度控制的结合剂之外,结合剂还可以通过防止钙或镁皂的堆积来帮助控制来自皂化脂肪中的溶解性游离脂肪酸。在非限制性实例中,硬脂酸钠可溶于水,这将导致硬脂酸盐残留在溶液中。然而,在皂化时,可代替地形成硬脂酸钙,其在很大程度上不溶于水并且不能从产生的溶液中漂洗掉。因此,结合剂避免了硬脂酸钙的这种形成。
如本文所用,术语“酶”可以催化已经沉积在装置表面上的蛋白质材料和/或有机污垢的分解。在较高温度(典型高于60℃)下不宜使用任何这种酶,因为酶在这些较高温度下易分解。更优选使用酶进行清洁,甚至更优选在约40℃至约50℃的范围内。蛋白酶(分解蛋白质)、淀粉酶(分解淀粉)和脂肪酶(分解脂肪)是清洁系统中最常用的酶类型。
蛋白酶(protease)(也称为肽酶或蛋白酶(proteinase))是进行蛋白水解(通过水解肽键进行蛋白质分解代谢)的任何酶。蛋白酶已经进化了多次,并且不同种类的蛋白酶可以通过完全不同的催化机制进行相同的反应。蛋白酶可在动物界、植物界、真菌、细菌、古细菌和病毒中找到。通常,蛋白酶根据催化类型分为几大类,包括但不限于丝氨酸、半胱氨酸、天冬氨酸和金属蛋白酶(锌)。
在merops数据库中找到了蛋白酶进化超家族的最新分类(参见http://merops.sanger.ac.uk/)。在该数据库中,首先根据结构、机理和催化残基顺序通过“clan”(超家族)对蛋白酶进行分类。
目前已知超过50个clan,每个clan表明蛋白水解的独立进化起源。
酶的天然3d结构通过多种作用来稳定,例如通过一价和二价离子、二硫键、氢键和疏水相互作用。取决于其具体的3d结构及稳定性,有几个适用的灭活步骤。所有蛋白酶的ph和温度增加都会影响氢键和疏水相互作用,但膜设备中的装置材料可能会限制ph和温度的可接受范围,因此该方法不能始终用于膜清洁应用中。
如本文所用,术语“还原剂”或“酶还原剂”是指能够降低酶活性的化合物或化合物的混合物。在非限制性实例中,酶还原剂能够通过分解其结构来展开蛋白质。例如,酶还原剂可通过分解二硫键而使酶失活。这种试剂包括但不限于硫化钠、硼氢化钠、连二亚硫酸钠、二硫苏糖醇和谷胱甘肽。
还原剂的应用限于通过二硫键稳定的蛋白酶。许多还原剂是有机硫化合物,即使很小的溢出也会引起恶臭,这在处理这种酶时往往是不期望的。
可以对二价离子稳定的蛋白酶做进一步的区分,在大多数情况下,可以通过应用二价离子结合剂(如螯合试剂、螯合物、螯合剂、膦酸及其盐和聚丙烯酸盐)使其失活。这类酶的商业实例是savinase®或alcalase®,它们各自可从novozymes(总部位于bagsvaerd,denmark)获得。在蛋白酶对二价结合剂如blaze®pro100l或esperase®不敏感的情况下,这是因为二价离子可以与酶非常牢固地结合,则必须通过前两种方法之一使酶失活(通过暴露于还原剂以还原二硫键,应用极端ph或增加温度以干扰疏水相互作用而灭活)。
在非限制性实例中,钙对于酶的稳定性是必不可少的。某些酶类型在其结构中具有非常牢固地结合的钙离子,而其他酶则可能更容易将钙离子释放到周围的水中。如果不存在水硬度,则酶结构中的ca离子与其释放到水相之间可能存在平衡。水相中的“可得游离”ca离子可与结合剂、螯合物、膦酸盐或这些物质的任何组合结合。可以通过在不存在ca离子的环境中释放其ca离子来使酶失活。然后,释放的ca离子与例如螯合物结合得更牢固。结果,没有可得游离ca离子来稳定酶,并且该酶没有保持活性。用ph-stat方法可以间接测量酶活性。在非限制性实例中,在包括螯合物和膦酸盐的结合剂的存在下,已经使用该方法来测量酶活性。
如本文所用,术语“表面活性剂”意指清洁溶液的活性清洁剂,其可以以下操作的任何组合:润湿,甚至渗透待清洁装置中的污垢,疏松装置表面沉积的污垢并乳化该污垢以使其保持悬浮在溶液中以便从装置中除去。表面活性剂往往还降低清洁溶液中的表面张力。可以选择性质上是极性或亲水的表面活性剂,例如带负电荷或阴离子表面活性剂。可以选择性质上是非极性或疏水的表面活性剂,例如不带电荷的非离子表面活性剂。尽管根据本发明的某些实施方案不太优选使用阳离子表面活性剂,但是也可以使用行为类似阴离子、阳离子和非离子表面活性剂的两性表面活性剂,这取决于ph。常规地,已经针对特定的使用温度选择了在清洁溶液中的表面活性剂。
如本文所用,“vol%”是指基于化合物体积的命名化合物相对于包含该化合物的溶液总体积的百分比,除非另有明确规定。
如本文所用,“wt%”是指基于化合物重量的命名化合物相对于包含该化合物的溶液总重量的百分比,除非另有明确规定。
本文描述的本发明的一个方面涉及用于清洁膜的清洁溶液,其具有酶和试剂,该试剂提供清洁的适当ph控制。清洁溶液可以另外包含结合剂和/或表面活性剂。特别地,当另外需要升高的温度和/或更高的ph,特别是为了最终使酶失活时,本发明的清洁溶液特别可用于清洁膜。在本发明的一个实施方案中,清洁溶液通常包含酶和碱度剂。
在清洁某些膜时,清洁溶液中可能包含的化合物类型以及温度和/或ph的上限都存在严格的限制。本发明的清洁溶液允许满足这些限制。
还需要控制进行沉淀的离子。特别地,这种离子包括钙。在本发明的一个实施方案中,清洁溶液包含结合剂,该结合剂可以包含螯合试剂以防止溶液中存在的任何二价离子沉淀。
在本发明的一个实施方案中,表面活性剂可以用作助促进剂或用作碱或酸清洁组合物的一部分。在本发明的某些实施方案中,表面活性剂可以用作膜清洁助剂,用于改善从膜上去除蛋白质、脂肪和其他污垢。在本发明的某些其他实施方案中,可以选择表面活性剂以改善膜的亲水性能并改善加工渗透性能。在本发明的某些实施方案中,选择表面活性剂以提供良好的漂洗特性、低起泡、良好的污垢去除或清洁性能、生物降解性和/或相对低的成本。使用导致膜污染以及关于膜表面的其他问题的表面活性剂不是优选的。例如,由于不能从表面漂洗或洗涤掉表面活性剂,某些阳离子表面活性剂可能经常与膜的不可逆污染有关。可以理解,该膜具有负的表面电荷,因此阳离子表面活性剂变得强烈地吸引到该膜的表面,并且不容易除去。表面上残留的任何表面活性剂均会充当污染物,导致低产量和水侵量,从而引起差的生产性能。
在某些实施方案中,选择不对膜表面产生负面影响的表面活性剂,例如但不意欲限于,由于膜和表面活性剂均倾向于带负电荷而不易被吸引到膜表面的阴离子表面活性剂。在本发明的某些实施方案中,选择阴离子表面活性剂以改善表面活性剂的可漂洗性,同时由于其降低的表面张力而允许表面活性剂辅助清洁脂肪和蛋白质。
根据本发明的某些实施方案,非离子表面活性剂可包含在清洁溶液中。非离子表面活性剂的特征可以为具有积极性能,例如脱脂,低起泡,润湿和降低表面张力。然而,由于其一般差的可漂洗性特征而可能引起膜污染问题的非离子表面活性剂不是优选的。非离子表面活性剂在技术上是中性分子,但是对于它们是否将作为表面活性剂助促进剂在特定的膜类型上很好地表现,其可预测性尚不确定。分子量、亲水-亲脂平衡支链、线性度、醇链长、draves润湿和乙氧基化程度不足以单独预测非离子表面活性剂在膜上是否能很好地起作用。此外,膜表面类型(例如聚醚砜(pes)、聚偏二氟乙烯(pvdf))具有不同的表面能,这也影响表面活性剂如何在表面上起作用以及污染物如何在表面上起作用。特定膜的截留分子量或孔径也可能会由于孔隙污染,用于清洁孔的孔隙渗透,分支和分子量引起的膜渗透排斥以及线性度引起的渗透容易性而影响表面活性剂的功能。
在本发明的某些实施方案中,表面活性剂包括一种或多种阴离子表面活性剂,包括以下物质中的任何一种或组合:烷基(c12)苯磺酸钠盐;烷基(c12)苯磺酸、十二烷基苯磺酸;烷烃(c13-17)磺酸钠盐、仲烷烃磺酸盐;2-乙基己基硫酸盐;枯烯磺酸盐;二甲苯磺酸盐;烷基芳基烷氧基磷酸酯钾盐;α-烯烃磺酸钠盐;和烷基醚羧酸,其在非限制性实例中包括烷基(c4-8)醚(5eo)羧酸、烷基(c8)醚(5eo)羧酸、烷基(c4)醚(6eo)羧酸和烷基(c8)醚(8eo)羧酸。根据本发明的某些实施方案,本文公开的阴离子表面活性剂可与本文公开的任何其他表面活性剂组合使用。
在本发明的某些实施方案中,表面活性剂包括一种或多种非离子表面活性剂,其包括以下物质中的任何一种或组合:氧化胺,诸如,例如但不意欲限于,烷基二甲基氧化胺,例如,在非限制性实例中,烷基(c12-14)二甲基氧化胺;聚葡萄糖苷,例如,在非限制性实例中,c10聚葡萄糖苷;烷基葡萄糖苷,例如,在非限制性实例中,c8烷基葡萄糖苷;十三醇乙氧基化物;己-1-醇乙氧基化物;槐糖脂,一种表面活性的糖脂化合物,可以由非致病性酵母菌种合成;甘油磷脂,一种可在许多食物中找到的卵磷脂脂肪;和聚乙二醇。根据本发明的某些实施方案,本文公开的任何非离子表面活性剂可以与本文公开的任何其他表面活性剂组合使用。
在本发明的某些其他实施方案中,非离子表面活性剂通常可以以有机疏水基团和有机亲水基团的存在为特征,并且可以通过有机脂肪族、烷基芳香族或聚氧化烯疏水化合物与亲水性碱氧化物部分(实际上通常是环氧乙烷或其多水合产物,聚乙二醇)的缩合来制备。在本发明的某些实施方案中,丙二醇可以包含在清洁溶液中。清洁溶液可包含具有羟基、羧基、氨基或酰胺基且带有反应性氢原子的疏水化合物,该疏水化合物可与环氧乙烷或其多水合加合物或其与环氧烷烃如环氧丙烷的混合物缩合以形成非离子表面活性剂。与任何特定的疏水化合物缩合的亲水性聚氧化烯部分的长度可以容易地调节以产生在亲水和疏水性能之间具有期望平衡度的水分散性或水溶性化合物。
在本发明中有用的非离子表面活性剂可包括1摩尔具有6至24个碳原子的饱和或不饱和、直链或支链醇与3至50摩尔环氧乙烷的缩合产物;聚乙二醇酯,通过与甘油酯、甘油和多元醇(糖或脱水山梨糖醇/山梨糖醇)反应形成的其他链烷酸酯;乙氧基化的c6-c18脂肪醇和c6-c18混合的乙氧基化和丙氧基化脂肪醇,特别是水可溶的那些;乙氧基化程度平均为约3至约50的c10-c18乙氧基化脂肪醇;非离子烷基多糖,包括含有约6至约30个碳原子的疏水基团和多糖,例如聚糖苷,一种平均含有约1.3至10个糖单元的亲水基团;式r1-(oc2h4)n-(oh)的guerbet醇乙氧基化物,其中r1为支链c9-c20烷基,和n为约2至约10;式r1-(oc2h4)n-(oh)的guerbet醇乙氧基化物,其中r1为支链c10-c18烷基,和n为5至10或7至9。在本发明的某些实施方案中,r1可以为c8至c12支链烷基,和n为2至4。
清洁溶液的表面活性剂可包括具有含约6至约24个碳原子的烷烃基团的烷烃磺酸盐。在某些非限制性实例中,所述烷烃磺酸盐可包括仲烷烃磺酸盐,例如c14-c17仲烷基磺酸钠。
在本发明的某些实施方案中,表面活性剂包括一种或多种两性表面活性剂,其包括烷基(c12-14)二甲基甜菜碱;烷基(c12-14)氨基二丙酸单钠盐;烷基(c8)氨基二丙酸单钠盐;和椰油酰两性基二丙酸钠盐中的任何一种或组合。根据本发明的某些实施方案,本文公开的两性表面活性剂可以与本文公开的任何其他表面活性剂组合使用。
尽管其他功能性化合物可以包括在清洁溶液中,但是根据本发明的某些实施方案,清洁溶液将至少包含酶和具有与酶相容的ph的试剂。在本发明的一个实施方案中,清洁溶液可包含约5-约1000ppm,约10-约750ppm,约25-约600ppm或约50-约500ppm的酶。在本发明的优选实施方案中,清洁溶液包含丝氨酸蛋白酶。
在本发明的某些实施方案中,清洁溶液包括用于稳定溶液中酶的酶稳定剂。例如,稳定剂可以是产生钙和/或镁离子的水溶性试剂。取决于多种因素,包括掺入的酶的多样性、类型和浓度,这种离子浓度的变化是可能的。在某些非限制性实例中,酶稳定剂可包含二水合氯化钙和/或甲酸钠。可以使用的水溶性钙盐或镁盐的非限制性实例包括氯化钙、氢氧化钙、甲酸钙、苹果酸钙、马来酸钙、氢氧化钙和乙酸钙。相当于所鉴定的盐的钙或镁盐也可能是有用的。不意欲受限制,在某些情况下,增加钙和/或镁的水平可能是有用的。
在某些条件下,不意欲受限制,钙对于酶的稳定性是必不可少的。某些酶类型允许钙离子变得非常牢固地结合在其结构上。其他酶可能更容易将钙离子释放到周围的水中。当然,酶的多样性、浓度和其他清洁溶液条件也可能影响钙离子保持与酶结合的程度。特别地,当基本上不存在水硬度时,可以在酶结构中的钙离子与钙离子向水相的释放之间建立平衡。水相中的“可得游离”钙离子可与结合剂结合,所述结合剂在非限制性实例中包括螯合物、膦酸盐、葡萄糖酸盐或这些物质的任何组合或充当结合剂的任何物质。在本发明的一个实施方案中,可以通过在不存在钙离子的环境中释放与其结合的钙离子来使酶失活。在这种情况下,钙离子的释放是钙离子变得更牢固地与清洁溶液中存在的结合剂结合的时候。结果,将没有任何可得游离钙离子来稳定酶,并且该酶将不再具有活性。
在本发明的某些实施方案中,清洁溶液可以包含碱度剂。在本发明的一个实施方案中,清洁溶液可包含约0.01至约2wt%,约0.01至约1wt%或约0.01至约0.5wt%或约0.01至0.2wt%的碱度计。在本发明的某些实施方案中,包括足够量的碱度剂以提供约8.5至约12,或优选约9至约11的清洁溶液的ph范围。
在本发明的其他实施方案中,清洁溶液可包含缓冲剂。在本发明的一个实施方案中,清洁溶液可包含约0.05至约1wt%,约0.05至约0.8wt%,约0.1至约0.5wt%的缓冲剂。可以包含在清洁溶液中的ph调节剂包括氢氧化钾(例如,在4.5-6.5wt%的范围内),碳酸氢钠(例如,在8-12wt%的范围内)和碳酸钠(例如,在4-8wt%的范围内)中的任何一种或多种。
在本发明的某些实施方案中,清洁溶液另外包含结合剂。根据本发明的某些实施方案,清洁溶液可包含约1至约500ppm,约10至约500ppm,约25至约300ppm或约50至约200ppm的结合剂。
可以包括在本发明的清洁溶液中的结合剂的非限制性实例是乙二胺四乙酸(edta)及其任何盐、(羟乙基)乙二胺三乙酸(hedta)及其任何盐、三聚磷酸钾(ktpp)、膦酸及其任何盐、次氮基三乙酸(nta)及其任何盐、二乙烯三胺五乙酸(dtpa)及其任何盐、葡萄糖酸(ga)及其任何盐、谷氨酸二乙酸(glda)及其任何盐、甲基甘氨酸二乙酸(mgda)及其任何盐、亚氨基二琥珀酸(ids)及其任何盐、氨基羧酸及其任何盐、羟基乙烷二膦酸(hedp)及其任何盐、氨基三(亚甲基膦酸)(atmp)及其任何盐、2-膦酸丁烷-1,2,4-三羧酸(pbtc)及其任何盐、乙二胺四(亚甲基膦酸)(edtmp)及其任何盐、二乙烯三胺五(亚甲基膦酸)(dtpmp)及其任何盐、聚丙烯酸盐、葡萄糖酸钠(葡萄糖酸na)及其任何组合。根据本发明的一个实施方案,部分中和的聚丙烯酸(m范围为约2.5k至约5k)可包含在清洁溶液中。
在本发明的某些其他实施方案中,清洁溶液可以包含烷基聚葡萄糖苷,该烷基为约c2至约c18,约c5至约c12或约c8至约c10。根据本发明的某些实施方案,烷基硫酸或其任何盐可以包含在清洁溶液中。在本发明的某些实施方案中,表面活性剂可包括2-乙基己基硫酸盐、烷基(c8)氨基二丙酸单钠盐、c10聚葡萄糖苷、烷基(c12)苯磺酸钠盐,及其任何组合以及与本文公开的其他表面活性剂的任何组合。
在本发明的其他实施方案中,清洁溶液另外包含表面活性剂。在本发明的一个实施方案中,清洁溶液可包含约1至约2000ppm,约25至约1000ppm,约50至约750ppm,或优选约150至约1000ppm的表面活性剂。
本发明的一个方面提供了本发明的清洁溶液在清洁膜中的用途。图1是显示根据本发明实施方案的清洁膜的方法的步骤的流程图。清洁膜的方法1包括预漂洗膜的步骤10。预漂洗时间可以持续约2分钟至约30分钟。
清洁膜的另一个步骤1包括使用包含酶和具有与酶相容的ph的试剂的溶液清洁膜,并防止溶液中的任何二价离子沉淀20。配置含有酶和具有与膜相容的ph和与膜相容的温度的试剂的清洁溶液。该清洁步骤可以持续约2分钟至约45分钟。
清洁膜的另一步骤1包括降低酶的活性30。如本文进一步所述,降低酶的活性30可包括添加结合剂,添加还原剂,增加ph和增加温度中的任一种或多种。不意欲受理论的束缚,用于降低酶活性30的任何ph和温度增加都受到膜能够承受的ph和温度增加的限制。另外,膜必须与所用的任何结合剂和/或还原剂相容。降低酶的活性30可持续至多约45分钟。
清洁膜的另一步骤1包括后漂洗膜以去除溶液40。后漂洗时间可以持续约2分钟至约30分钟。
在本发明的一个实施方案中,清洁膜的方法包括以下步骤:预漂洗膜;使用包含酶和具有与酶相容的ph的试剂的溶液清洁膜,该组合物具有与膜相容的温度;防止溶液中的任何二价离子沉淀;降低酶活性;和后漂洗膜以去除溶液。在本发明的某些实施方案中,溶液可以另外包含结合剂和表面活性剂中的至少一种。
在本发明的一个实施方案中,清洁膜的方法可以另外包括添加用于使酶失活的结合剂的步骤。在本发明的某些实施方案中,降低酶活性的步骤包括添加还原剂。在本发明的又一个实施方案中,降低酶的步骤可以包括增加ph和增加溶液温度中的一种或两种。
优选地,在酶在清洁操作中执行其期望功能之后,将使用足够的结合剂使酶失活。在本发明的一个实施方案中,添加到清洁溶液中的结合剂可以占溶液的约1至约6000ppm,约5至约2000ppm或约10至约500ppm。为了除去钙盐,清洁溶液可包含约1至约4000ppm的另外的结合剂。可以添加的结合剂的非限制性实例包括乙二胺四乙酸(edta)及其任何盐、(羟乙基)乙二胺三乙酸(hedta)及其任何盐、三聚磷酸钾(ktpp)、膦酸及其任何盐、次氮基三乙酸(nta)及其任何盐、二乙烯三胺五乙酸(dtpa)及其任何盐、谷氨酸二乙酸(glda)及其任何盐、甲基甘氨酸二乙酸(mgda)及其任何盐、亚氨基二琥珀酸(ids)及其任何盐、氨基羧酸及其任何盐、羟基乙烷二膦酸(hedp)及其任何盐、氨基三(亚甲基膦酸)(atmp)及其任何盐、2-膦酸丁烷-1,2,4-三羧酸(pbtc)及其任何盐、乙二胺四(亚甲基膦酸)(edtmp)及其任何盐、二乙烯三胺五(亚甲基膦酸)(dtpmp)及其任何盐、聚丙烯酸盐、丙烯酸-马来酸共聚物及其任何盐,以及它们的任何组合。
在本发明的一个实施方案中,相对于酶含量的结合剂总量为至少约0.2g结合剂/g溶液中存在的酶,约0.2g结合剂/g溶液中存在的酶至约200g结合剂/g溶液中存在的酶,或约0.2g结合剂/g溶液中存在的酶至约80g结合剂/g溶液中存在的酶。在本发明的某些实施方案中,结合剂包含edta,并且清洁溶液包含约0.2gedta/g溶液中存在的酶至约80gedta/g溶液中存在的酶,约0.2gedta/g溶液中存在的酶至约60gedta/g溶液中存在的酶,或约0.2gedta/g溶液中存在的酶至约40gedta/g溶液中存在的酶。
在本发明的某些其他实施方案中,结合剂包含mgda,清洁溶液包含约0.2gmgda/g溶液中存在的酶至约100gmgda/g溶液中存在的酶,约0.2gmgda/g溶液中存在的酶至约80gmgda/g溶液中存在的酶或约0.5gmgda/g溶液中存在的酶至约60gmgda/g溶液中存在的酶。
在本发明的一个实施方案中,清洁步骤中溶液的ph可以为约2.0至约11.0,约7.0至约11.0,约8至约11,或约8.5至约10.5。在本发明的某些实施方案中,清洁步骤中溶液的温度可以为约10℃至约70℃,约30℃至约50℃,小于约60℃或小于约50℃。
在本发明的一个实施方案中,溶液接触膜约2至约90分钟,约10分钟至约60分钟,或约10分钟至约45分钟。在本发明的一个实施方案中,酶活性的降低可能至少部分是由于添加了结合剂和还原剂中的至少一种。
在本发明的某些实施方案中,ph可以增加至约10.5至约13.5,约8.5至约13.0,约11.0至约12.0或约12.0至约13.0。在本发明的其他实施方案中,温度可以增加至小于约55℃,小于约70℃,小于约75℃或小于约80℃。在本发明的某些实施方案中,温度增加至约50℃至约70℃,约50℃至约60℃,约60℃至约85℃或约60℃至约70℃。
在本发明的某些实施方案中,ph增加至约8.5至约13.5,并且温度增加至约50℃至约85℃或约50℃至约70℃。在本发明的某些其他实施方案中,ph增加至约8.5至约13.5,并且温度增加至约50℃至约60℃。在本发明的其他实施方案中,ph增加至约8.5至约13.0,并且温度增加至约50℃至约70℃。在本发明的又其他实施方案中,ph增加至约8.5至约13.0,并且温度增加至约60℃至约85℃或约60℃至约70℃。在本发明的其他实施方案中,ph增加至约8.5至约11.5,并且温度增加至约50℃,随后接着添加还原剂以降低酶活性。
在本发明的一个实施方案中,酶的活性减弱至少约50%,至少约60%,至少约70%,至少约80%,至少约85%,至少约90%,或至少约95%。在本发明的某些实施方案中,可以通过将溶液的ph或温度中的至少一种增加约2分钟至约45分钟,约5分钟至约30分钟或约10分钟至约20分钟来降低酶的活性。在本发明的某些实施方案中,通过增加溶液的ph或温度中的至少一种约15分钟来降低酶的活性。
清洁膜的方法可以包括在添加结合剂以降低酶的活性之前,向与膜接触的溶液中添加碱度剂。
在本发明的一个实施方案中,在清洁溶液与膜接触的时间至用于降低酶活性的时间之间,执行清洁膜的方法而不从膜上漂洗溶液。
本发明的一个实施方案提供了一种清洁用于处理任何可溶性蛋白质污垢的膜的方法,该方法包括以下步骤:用包含水的预漂洗溶液预漂洗约2分钟至约30分钟的时段;根据溶液的定义和本文进一步定义的清洁步骤,使用包含酶和具有与酶相容的ph的试剂的溶液清洁膜约2分钟至约45分钟的时段;添加结合剂和还原剂中的一种或两种,任选地包括增加溶液的ph和温度中的至少一种;在添加和任选增加步骤之后,继续洗涤膜近似至多约45分钟;和用包含水的后漂洗溶液后漂洗约2分钟至约30分钟的时段。
溶液中的酶活性可以使用ph-stat方法间接测量。ph-stat方法可用于测量在结合剂存在下的酶活性,所述结合剂在非限制性实例中包括螯合物、膦酸盐和葡萄糖酸盐。蛋白酶对蛋白质的作用产生酸性官能团。因此,蛋白质的水解会随着时间的推移降低溶液的ph。酶促分解期间氨基酸的释放程度可以通过保持溶液ph恒定所需的苛性物质量来衡量。此外,不意欲受理论的束缚,优选将ph保持在酶活性为其最大值的值。另外,温度和ph的组合需要保持在优选值,以使酶的活性最大化。
水解度由以下方程式鉴定:
其中:
dh%=水解度,%
v=加入的naoh的体积,ml
n=naoh溶液的摩尔浓度,mol/l
m=总蛋白质质量,g
α=水解期间释放的α-氨基的平均解离度
htot=肽键总数,mmol/g。
实施例
通过参考以下实施例进一步定义本发明,所述实施例描述了根据本发明的用于进行基于乳制品的膜操作的加速清洁的清洁溶液和方法,以及这种清洁溶液和方法在膜清洁操作中的性能。
实施例1
使用比色分析进行不同酶的灭活测试,以确定酶活性。最初配制具有9.53的ph的0.5wt%缓冲剂的标准溶液。使用该标准溶液形成单独的酶溶液。加入不同浓度的氢氧化钠(naoh)以将溶液的ph调节至期望水平。表1确认了使用蛋白酶alcalase®2.5l、esperase®8.0l、savinase®ultra16xl和blaze®pro100l配制的酶溶液,它们均适用于水解各自可从novozymes(总部位于bagsvaerd,denmark)获得的蛋白质。
表2显示了在不同温度下表1中确认的溶液的酶活性。那些标有100%的溶液表示酶活性高于测量方法的检测上限,而那些标有u.d.的溶液则确认酶活性低于测量方法的检测限。
表3a确认了一系列清洁溶液,所述清洁溶液具有0.5wt%的缓冲剂和0.2wt%的esperase8.0l。在各种稀释水平下,在不同浓度的酶还原剂连二亚硫酸钠(na2s2o4)下测量清洁溶液的酶活性,这些结果也示于表3a中。那些标有o.d.的溶液表明酶活性超出测量方法的检测限,而标有u.d.的那些确认了酶活性低于测量方法的检测限。
对于具有0.5wt%的缓冲剂和0.5wt%的blazepro100l的一系列清洁溶液进行了相似的测试,其结果包括在表3b中。
表3a和3b中的测试表明,在50℃下,在五分钟的接触时间下,0.25wt%的连二亚硫酸钠浓度使esperase8.0l失活,但不使blazepro100l失活。
实施例2
关于哪种结合剂(例如edta、ktpp、ids、pbtc或atmp以及最终的碳酸钠缓冲剂体系本身,作为非限制性的示例性结合剂)对降低使用溶液中的酶活性的影响最大的研究,通过将不同的结合剂与属于丝氨酸蛋白酶类别或更确切地说属于枯草杆菌酶类别的酶esperase8.0l或alcalase2.5l型dx混合在一起进行了测试。
在不含酶的反渗透(ro)水中制备清洁溶液,并加热到50℃。将清洁溶液的ph调节至9.0,然后添加酶。将清洁溶液的温度在50℃下保持60分钟。在添加酶时以及在添加酶之后的以下间隔,采集清洁溶液的两个样品:10分钟、20分钟、30分钟和60分钟。采集后,立即将样品置于冰浴中以淬灭进一步的反应,并测量样品的酶活性。表4确认了所测试的清洁溶液,其包括苛性物质、表面活性剂、缓冲剂和蛋白酶esperase8.0l。
表5显示了esperase8.0l在刚加入清洁溶液后,加入后20分钟和加入后60分钟的相对活性。注意*5表示没有缓冲剂。
如表5所示,使用清洁溶液24(使用0.0157wt%edta+0.0033wt%atmp的结合剂组合)(20分钟后相对活性为63%和60分钟后相对活性为54%),然后使用清洁溶液20(使用0.0157wt%edta+0.0495wt%ktpp+0.0033wt%atmp的结合剂组合)(20分钟后相对活性为65%和60分钟后相对活性为59%)在60分钟后实现了esperase8.0l活性的最大程度降低。
表6确认了所测试的清洁溶液,其包括苛性物质、缓冲剂和蛋白酶alcalase2.5l。
表7显示了alcalase2.5l在刚加入清洁溶液后,加入后20分钟和加入后60分钟的相对活性。注意*表示没有缓冲剂。
如表7所示,使用清洁溶液32(使用0.0157wt%edta+0.0495wt%ktpp+0.0033wt%atmp的络合组合)(20分钟后相对活性为35%和60分钟后相对活性为3%),然后使用清洁溶液30(使用0.0157wt%edta+0.0495wt%ktpp+0.0033wt%atmp的结合剂组合)(20分钟后相对活性为39%和60分钟后相对活性为10%)在60分钟后实现了alcalase2.5l活性的最大程度降低。
实施例3
使用结合剂的混合物对多种不同类型的酶进行了一系列测试。在这些测试中使用的蛋白酶是各自可从novozymes(总部位于bagsvaerd,denmark)获得的alcalase®2.5l、esperase®8.0l、savinase®ultra16xl、savinase®evity16xl和blaze®pro100l。测试的结合剂是以下物质的盐:edta、mgdanta、glda、hedta、dtpa、葡萄糖酸盐、ktpp、atmp、pbtc、hedp、edtmp、dtpmp和聚丙烯酸盐。
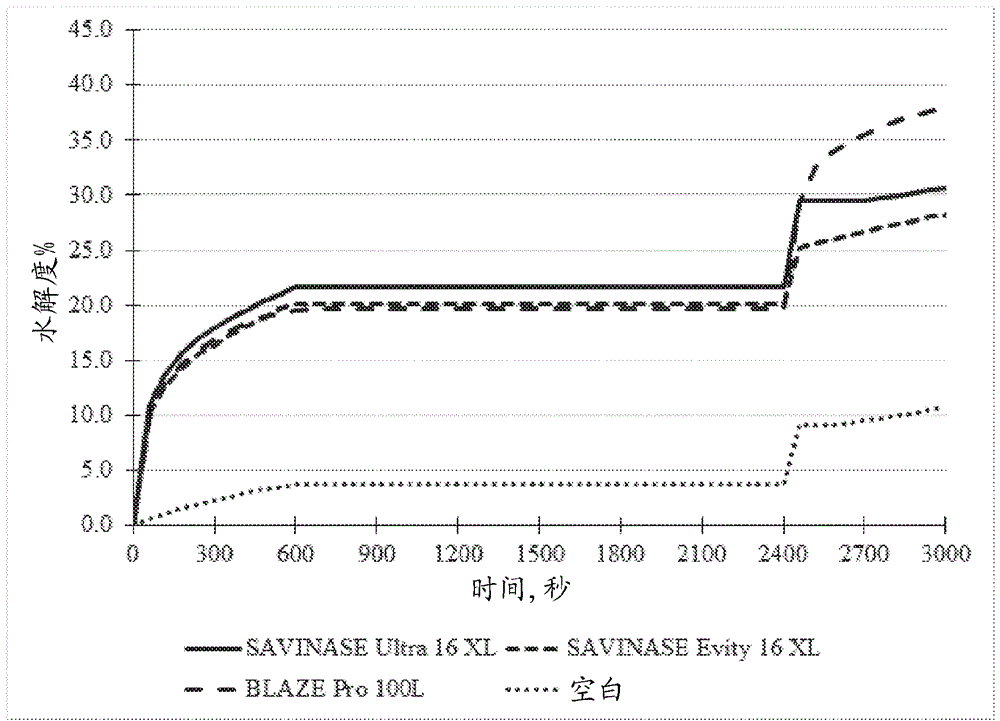
制备100ml底物溶液,基于溶液的总体积,其具有0.25vol%的于软水中的甜乳清浓度。这是通过向1升软水中添加约0.9588g密度为0.3084g/ml的80%甜乳清粉溶液来实现的。将该溶液加热至50℃,并将溶液的ph调节至10。将0.3ml的酶浓度为5vol%的酶溶液添加至加热/ph调节的底物溶液中。然后在10分钟的过程中用0.1mnaoh滴定该合并的溶液以将ph保持在10。然后在30分钟的过程中加入结合剂并与溶液混合,同时仍保持ph在10。然后将约0.09588g的新鲜乳清粉溶液添加到100ml的溶液中,并在10分钟的过程中用0.1mnaoh滴定溶液以将ph保持在10。
乳清蛋白浓缩物的htot值为8.8,在50℃和ph为10时的1/α值为1。在添加酶,添加结合剂和添加新鲜酶的过程中,计算水解度dh%。如数据所示,dh%首先迅速增加,然后随时间的推移较慢增加。同时,苛性物质也与底物反应。使用没有任何酶的“空白”溶液测量该反应程度的作用。
在添加结合剂之后,取决于底物,减弱或终止dh%的任何变化。加入新鲜的底物后,酶继续起作用并遵循与实验开始时所经历的相似的反应速率,或者失活,从而水解的任何变化主要是仅苛性物质与底物反应的结果。
表8a、8b和8c提供了在ph为10和50℃下,对于将不同浓度的edta-na盐作为结合剂掺入到相应的命名的酶底物溶液中,甜乳清粉的dh%的变化。
图2提供了对于掺有作为结合剂的0.5wt%edta的酶底物溶液,甜乳清粉的dh%变化的图示。结果表明,酶blazepro100l在掺有0.5wt%edta后30分钟添加新鲜底物后仍然具有活性,因为水解度遵循实验开始时发现的相似反应速率。但是,0.5wt%edta使测试的savinaseultra16xl和savinaseevity16xl酶失活,因为在添加新鲜底物后,水解度遵循空白溶液发现的反应速率。
图3提供了对于掺有作为结合剂的0.125wt%edta的酶底物溶液,甜乳清粉的dh%变化的图示,而图4对于掺有作为结合剂的1.0wt%edta的酶底物溶液,甜乳清粉的dh%变化的图示。随着edta量的减少,测试的酶savinaseultra16xl和alcalase2.5l失活,因为在添加新鲜底物后,水解度遵循空白溶液发现的反应速率。然而,如图3所示,在添加edta和新鲜底物后,测试的esperase8.0l仍然保持活性。随着edta量的增加,在掺有1.0wt%edta后,在添加新鲜底物后30分钟,测试的酶esperase8.0l和blazepro100l都仍具有活性,因为水解度遵循在实验开始时发现的相似反应速率,参见图4。
表8a所示的数据证明了,并且在图5中图形化说明了,即使当向基于savinaseultra16xl酶的底物溶液中掺入0.01wt%edta时,该结合剂在该浓度下对使该酶失活仍然有效,因为在添加新鲜底物后,水解度遵循空白溶液发现的反应速率。但是,以低至0.001wt%edta或甚至为0.005wt%edta的浓度掺入对使savinaseultra16xl酶失活是无效的,因为在添加新鲜底物后,水解度不会继续遵循在该降低的edta浓度下空白溶液的反应速率。
表9a和9b提供了在ph为10和50℃下,对于将作为结合剂的0.115wt%、0.23wt%和0.46wt%mgda-na盐掺入相应命名的酶底物溶液,甜乳清粉的dh%的变化。
图6提供了对于掺有作为结合剂的0.46wt%mgda的酶底物溶液,甜乳清粉的dh%变化的图示,而图7提供了对于掺有作为结合剂的0.115wt%mgda的酶底物溶液,甜乳清粉的dh%变化的图示。如图6所示,酶blazepro100l在添加0.46wt%mgda和添加新鲜底物后30分钟仍具有活性,因为水解度遵循与实验开始时发现的相似的反应速率。然而,0.46%mgda使测试的savinaseultra16xl和savinaseevity16xl酶失活,并且0.115wt%mgda至少使savinaseultra16xl酶失活(参见图7),因为在添加新鲜的底物后,水解度遵循空白溶液发现的反应速率。
表10提供了在ph为10和50℃下,对于将作为结合剂的0.33wt%hedp-na盐掺入相应命名的酶底物溶液,甜乳清粉的dh%的变化。
图8提供了对于掺有作为结合剂的0.33wt%hedp的酶底物溶液,甜乳清粉的dh%变化的图示。如该图所示,在添加0.33wt%hedp和添加新鲜底物后30分钟,测试的esperase8.0l和blazepro100l的水解度遵循与实验开始时发现的相似的反应速率,表明这些酶仍然具有活性。相反,通过添加0.33wt%hedp使测试的savinase和alcalase2.5l失活,因为在添加新鲜底物之后,水解度遵循与空白溶液相似的反应速率。
表11提供了在ph为10和50℃下,对于将作为各种结合剂的1.0wt%聚丙烯酸盐、0.48wt%atmp和0.57wt%edtmp的钠盐掺入savinaseultra16xl酶底物溶液,甜乳清粉的dh%的变化。
图9提供了对于掺有作为结合剂的1.0wt%聚丙烯酸盐的酶底物溶液,甜乳清粉的dh%变化的图示。该测试显示,当使用1.0wt%聚丙烯酸盐使savinaseultra16xl失活时,添加额外底物后(自测试开始40分钟后)的水解度遵循与实验开始时相比明显降低的速率。但是,与空白溶液相比,反应速率增加,这表明savinaseultra16xl并未完全失活。
表12提供了在ph为10和50℃下,对于将作为结合剂的0.63wt%ktpp掺入相应命名的酶底物溶液,甜乳清粉的dh%的变化。
表13提供了在ph为10和50℃下,对于将作为结合剂的0.37wt%和1.0wt%葡萄糖酸钠掺入savinaseultra16xl酶底物溶液,甜乳清粉的dh%的变化。
表14提供了在ph为10和50℃下,对于将作为结合剂的0.45wt%hedta-na盐掺入相应命名的酶底物溶液,甜乳清粉的dh%的变化。
表15提供了在ph为10和50℃下,对于将作为各种结合剂的0.66wt%dtpa、0.08wt%nta和0.46wt%glda的钠盐掺入savinaseultra16xl酶底物溶液,甜乳清粉的dh%的变化。
表16提供了在ph为10和50℃下,对于将作为各种结合剂的0.36wt%pbtc和0.75wt%dtpmp的钠盐掺入savinaseultra16xl酶底物溶液,甜乳清粉的dh%的变化。
表17提供了在ph为10和50℃下将每种结合剂的盐掺入酶底物溶液中的测试结果的概述。“d”表示酶失活,而“a”表示酶在第二次底物添加后具有活性。“-”表示未测试。如该表所示,在ph为10和50℃的清洁条件下,几乎所有测试的结合剂均显示savinaseultra16xl失活。某些浓度的测试结合剂在使savinaseevity16xl失活方面有效。所测试的结合剂在使blazepro100l和esperase8.0l失活方面无效。0.125wt%edta和0.33wt%hedp能够使alcalase2.5l失活。
表18显示了使用savinaseultra16xl的结合剂盐的测试结果。
可以通过添加确认浓度的结合剂使利用savinaseultra16xl的酶促清洁失活,除了使用表18中的葡萄糖酸盐和pbtc之外,在该清洁溶液中没有中间漂洗并且没有使用例如酸降低ph的额外失活步骤。这显著降低了总清洁时间,从而加速了膜清洁。
表19显示有效地使savinaseevity16xl酶失活的结合剂盐的测试结果。
表19中的结果表明,savinaseevity16xl也可以使用结合剂以相似方式失活,并且也可以用于加速膜清洁程序。
表20显示了对blazepro100l酶的结合剂盐的测试结果。
表21显示了对esperase8.0l酶的结合剂盐的测试结果。
表22显示了对alcalase2.5l酶的结合剂盐的测试结果。
表22中的结果表明,alcalase2.5l也可以使用结合剂以相似的方式失活,并且也可以用于加速膜清洁程序。
总之,不意欲受理论的束缚,这些测试表明,结构上具有牢固钙结合的酶(例如blazepro100l和esperase8.0l)往往不容易被结合剂失活。相反,典型地,必须施加增加的ph和/或温度以使对这种结合剂有一定程度或完全抗性的酶失活,并且还可以用于加速膜清洁程序。
实施例4
进行这些测试以显示在实验室膜测试仪器中本发明选择的清洁方案的工作原理。使用半自动实验室膜测试装置,其含有四(4)个膜单元。这些单元中的每一个含有20*5cm2的膜表面积。这些测试使用超滤(uf)膜类型,并且它们由可从alfalaval型gr81pp获得的聚醚砜(pes)制造。四(4)个单元并行运行,并使用从四(4)个单元中收集的信息获取平均值。这些试验的污染溶液包括0.55wt%的于软水中的80wt%wpc酸乳清粉。以下确认了测试程序的步骤:
1用苛性溶液清洁新膜:ph为12的基于氢氧化钠(naoh)的溶液和0.0375wt%的2-乙基己基硫酸钠
2测量清洁水通量(cwf)或cwf(1)
3通过使用上面确定的酸乳清溶液在2-3℃的起始温度下执行一(1)小时的过滤来实现污染
4漂洗
5测量cwf(2)
6用所述清洁溶液清洁
7漂洗
8测量cwf(3)
如上所确定的,在污染步骤之前和之后以及清洁步骤之后都测量清洁水通量(cwf)。使用下式按百分比计算cwf:
下表23确认了三种经过测试的单独清洁溶液以及这些溶液中的每一种的cwf结果。
如表23中的结果所示,在用溶液3清洁膜之后,cwf被完全恢复并且被认为是清洁的。不需要额外的失活步骤和膜润湿来分别使酶失活并恢复膜的润湿。本发明的清洁溶液显著降低了清洁时间以及在随后的步骤中用于中间漂洗的水的使用和用于随后加热清洁溶液的能量需求以及清洁溶液和漂洗步骤的循环。
另外,将提供浓缩的产品制剂,其在清洁过程中用水稀释后将实现上面确认的溶液的浓度。
受益于本文描述中给出的教导,本发明所属领域的技术人员将想到本文阐述的发明的许多修改和其他实施方案。本领域技术人员将认识到,在不脱离其广泛发明构思的情况下,可以对本文描述的实施方案进行改变。因此,应当理解,本发明不限于所公开的特定实施方案,而是旨在涵盖由所附权利要求限定的本发明的精神和范围内的修改。
- 还没有人留言评论。精彩留言会获得点赞!