一种全透明螺旋式声体波微流控分选芯片及其制备方法与流程
本发明属于微全分析系统领域,特别涉及一种全透明螺旋式声体波微流控分选芯片及其制备方法。
背景技术:
微流控芯片将样片预处理、反应、分离、检测等集成在一块微米尺度的芯片上,具有集成度高,试剂消耗少,制作成本低,分析效率高等特点,在物理、化学、生物等领域展示很好的应用前景。传统的微流控芯片有很多种,可以基于尺寸,磁性以及抗原抗体的特异性结合来分选。但这些微流控芯片在临床应用中还存在很多的问题。比如,采用滤膜结构的微流控芯片,因为部分细胞尺寸的重叠,会造成分选效率很低,此外在处理病人血样本的过程中,血液中的其它杂质会将滤膜堵塞。采用磁性分选的微流控芯片,磁颗粒易团聚,难以去除多余的磁颗粒,也在一定程度上限制了其在医学方面的应用。利用抗原抗体的特异性结合,可以提高捕获纯度及效率,但捕获之后,无法将抗原抗体分开,一系列的修饰与释放,对细胞的活性会产生很大的影响。但微流控芯片的缺点是通量比较低,有时不能满足临床上大批量处理样本的需求。
声镊技术的提出大大增加了样本的通量,利用声波来操控微粒或细胞。通过压电材料的压电效应产生0.1~10mhz的超声波,通过信号产生器和功率放大器调节声波信号,两列由同一声源产生的超声波叠加在声学谐振腔内形成稳定的驻波声场。在声学辐射力的作用下,不同微粒或细胞产生不同位移,从而达到分选的目的。
目前,在体波器件的制备中,通常采用干法和湿法刻蚀的方法,在单晶硅上制备出微沟道,然后采用阳极键合的方式将玻璃和硅片键合在一起,最后在硅片底部贴上pzt压电陶瓷片,从而形成声体波芯片。这种体波芯片,工艺复杂,耗材昂贵,对设备(热蒸发仪,电感耦合等离子体设备,阳极键合仪)要求较高,因器件不透光,实验结果在显微镜下观察比较困难。螺旋式沟道单纯利用离心力可以对细胞进行分选,但不可以富集。
技术实现要素:
针对目前微流控芯片在医学前期诊断和治疗中存在的问题,本发明旨在提供一种成本低廉,制备工艺简单的全透明螺旋式声体波微流控分选芯片及其制备方法。本发明所制备的微流控芯片采用全透明的玻璃片进行组装,材料成本低廉,组装设备要求低,极大地降低了生产成本,可用于在无修饰、无损伤、不影响细胞的活性条件下分选细胞,利于对分选后的细胞进一步检测。
本发明制备的芯片均由透明材料组成。玻璃经过激光加工制备出符合半波长整数倍的微米级沟道,双面均镀有掺锡氧化铟(ito)导电薄膜层的铌酸锂单晶作为压电材料粘贴于声学谐振腔的底部作为声波产生器,并在两面引出两根铜线作为信号输入导线。全透明的器件,有利于对循环肿瘤细胞、胎儿有核红细胞和微粒等样品的分选效果进行观测。普通玻璃的应用,易于操作的同时也大大缩减了器件成本。不同频率的压电材料对应不同深度的沟道,也对应不同的通量,可以根据临床需求,快速方便地调整器件的参数。采用激光加工来制备芯片,便于实现大规模的器件集成化。全透明螺旋式声体波微流控芯片可用于分选细胞,分选过程中细胞无修饰,无损伤,不影响细胞的活性,有利于对分选后的细胞进行进一步的检测。压电材料产生的驻波谐振腔,可以使目标细胞集中在波节处,所有的目标细胞集中在同一水平面上,便于对分选的细胞进行收集,在未来的临床医学上有非常大的应用空间。
本发明提供的技术方案如下:
一种全透明螺旋式声体波微流控分选芯片,由玻璃片堆叠的声学谐振腔和压电材料构成,其结构如下:
(1)所述声学谐振腔由两块玻璃片堆叠形成;
(2)所述声学谐振腔的上层玻璃片加工有微米级螺旋沟道用于循环肿瘤细胞、胎儿有核红细胞、微粒等样品的分选,还开有与沟道连通的孔位作为进出样口;
(3)所述声学谐振腔的下层玻璃片结构完整用于谐振腔的封装;
(4)所述压电材料双面镀有导电薄膜粘贴于声学谐振腔底部,并在两面引出两根铜线作为信号输入导线。
具体的,上述步骤(1)中声学谐振腔的上层玻璃片的沟道通过激光加工形成,沟道深度符合半波长的整数倍。
具体的,使用压电材料的谐振频率是3.8mhz,螺旋沟道宽度500μm,对应的深度为200μm。
具体的,上述玻璃片之间采用低温预键合和马弗炉分段升温的方法进行封接。
具体的,上述沟道在玻璃片的平面上为螺旋状。沟道为两圈螺旋线,最外侧螺圈的直径为20mm。螺旋式沟道相比于直沟道,可以减少小颗粒的扩散,进一步提高分选效率。在螺旋式沟道中,单纯利用离心力可以对细胞进行分选,但不可以富集,和声场结合,分选的同时可以对颗粒或细胞进行富集,提高了分选的效率和纯度。
具体的,上述步骤(2)中的进出样口通过转换接头连接到容器中。优选的,转换接头为peek生物转接头,用环氧树脂将peek生物转接头与玻璃出口的打孔处粘结起来。
具体的,上述步骤(4)中压电材料为双面均镀有掺锡氧化铟导电薄膜层的铌酸锂单晶。
具体的,上述铌酸锂单晶厚度为1mm,36°y切,单晶谐振频率是3.8mhz。
本发明的另一目的在于提供上述分选芯片的制备方法,包括以下步骤:
(1)设计模板
根据理论计算来调整微沟道的参数;使用单晶的谐振频率是3.8mhz,螺旋沟道宽度500μm,对应的深度为200μm;沟道为两圈螺旋线。优选的,两圈螺旋线五个半圆来组成,最外侧螺圈的直径为20mm,从大到小,圆的直径依次为20mm,19mm,18mm,17mm,16mm;
(2)加工玻璃
切割两块大小的玻璃,其中一块用于加工沟道,另一块用于封装;优选的,玻璃片的厚度为1mm;
用于加工沟道的玻璃片,根据模板尺寸,利用激光加工制备出符合半波长整数倍的微米级沟道,然后进行打孔,作为进样口和出样口;
(3)集成器件
将两块玻璃片通过热键合的方法进行封装,形成密封的腔室;
(4)构造谐振腔
在深度符合半波长整数倍的沟道底部,将一定尺寸的具有压电效应的铌酸锂单晶粘贴在底部,两面引出导线,利用功率放大器进行驱动。
图1-3示出了本发明的提供的微流控芯片的结构。
本发明还提供了上述的全透明螺旋式声体波微流控分选芯片在无修饰、无损伤、不影响细胞活性条件的细胞分选中的应用。
微流控芯片分选细胞的原理是离心力和声辐射力共同作用,流体动力学分选是根据迪恩拉力去和惯性力竞争,致使不同尺寸的粒子分布在不同的平衡位置,从而使循环肿瘤细胞,白细胞,血小板分选开来。声辐射力的作用,使得已经分选的各种细胞进一步富集,从而提高了分选的效率和纯度。
图4(a)是细胞在芯片沟道内仅在离心力作用下的受力示意图,图4(b)是在仅离心力作用下对不同细胞分选的理论示意图;
流体动力学分离的原理是在弯曲的微流体通道内诱发作用在粒子上的迪恩拉力去和惯性力竞争,致使不同尺寸的粒子分布在不同的平衡位置。曲线的通道内悬浮的中性粒子要经受由梯度切变力和壁效应组成的惯性力作用。梯度切变力是由速度抛物线产生的且与它的切变率梯度有关,方向由曲线微通道中心直接指向墙壁;壁效应是由墙壁附近的粒子的不对称唤醒诱发的,并且有把粒子推向远离墙壁的趋势。两种效应竞争的结果是粒子集中在特定的平衡位置。惯性力作用使粒子在通道中心和墙壁之间迁移,理论预测可表述为:
fl=fl(re,xl)·ρu2a4/dh2(1)
这里,系数fl是雷诺数re(re=ρudh/μ)和粒子在通道横断面内的位置xl(与通道中心的距离)的函数。u是微通道内的最大速度,ρ和μ分别表示密度和流体的动态黏度,dh是微通道的驱动力直径(四倍通道截面除以周长),a是粒子直径。根据公式,粒子尺寸对横向力有极大的影响,这是明显区分不同尺寸粒子平衡位置的根本机制。因此可以将尺寸不同的循环肿瘤细胞,包细胞,血小板分开。
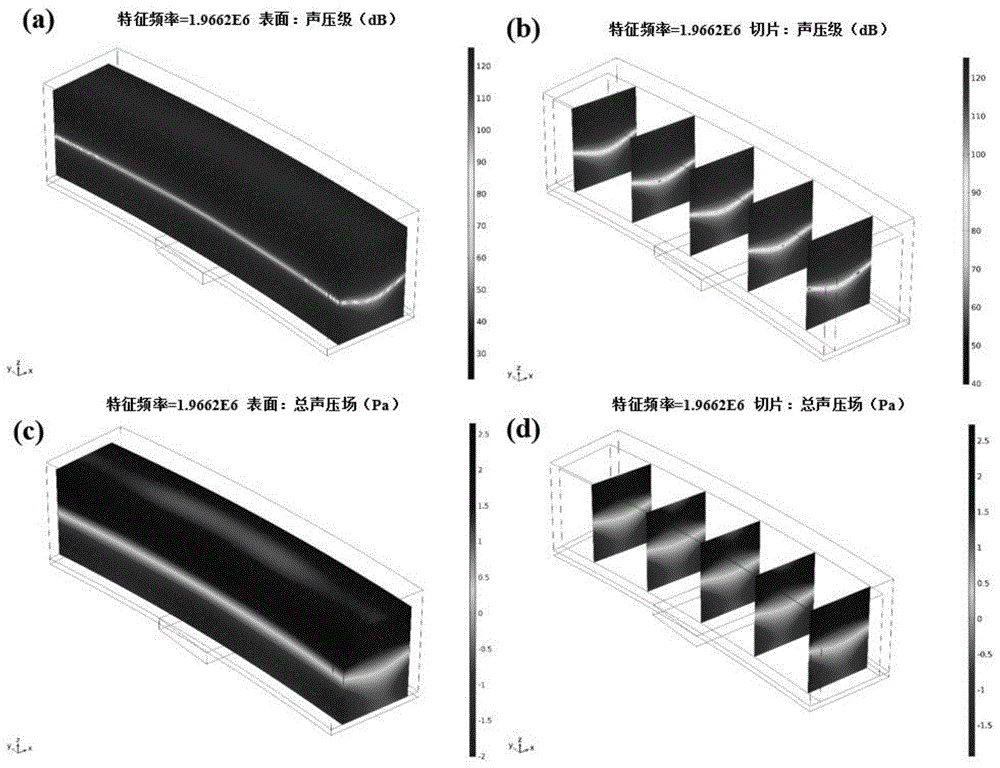
图5是本发明提供的微流控芯片仅在声辐射力作用下对细胞分选的模拟效果图;
其中,图5(a)声场整体图;图5(b)声场切片图;图5(c)声压级;图5(d)声压级切片图;
细胞受力大小与细胞半径、密度以及可压缩系数有关,具体的声辐射力的大小可以用下面的公式来表示。
声辐射力的大小可以用上面公示表示。在其中vc是粒子的体积,p0是声压大小,是由上面公式定义。介质和粒子的密度分别用ρc和ρw两个参数表示,相应的压缩系数为βw和βc。当φ>0时,粒子朝着波节点运动;当φ<0时,粒子朝着波腹点运动。从而将循环肿瘤细胞,白细胞和血小板在不同水平面上富集起来。
图6是本发明提供的微流控芯片仅在声辐射力作用下对距离边界不同位置的细胞分选的模拟效果图;图6(a)声场远离边界整体图;图6(b)声场靠近边界整体图;图6(c)声压级远离边界整体图;图6(d)声压级靠近边界整体图;
在尺寸满足半波长整数倍的沟道内,上下方向形成驻波腔室,无数的波节点形成一个波节面,距离边界不同位置的细胞,会被聚集在波节处,从而将细胞富集。
图7是本发明提供的微流控芯片在离心力和声辐射力共同作用下对细胞分选的理论示意图。图7(a)无任何作用力;图7(b)仅离心力作用;图7(c)仅声辐射力作用;图7(d)离心力和声辐射力共同作用;
(a)无任何作用力下,所有细胞混合在一起。(b)仅根据流体动力学分离循环肿瘤细胞,白细胞,血小板,会发现细胞粒子集中在特定的平衡位置。(c)仅声辐射力作用,细胞会在不同的水平面上富集起来。(d)共同作用下,细胞会在特定的平衡位置上进一步富集。
本发明的有益效果:
1.采用全透明的材料进行组装,利于高效、快速、实时的进行光学分析鉴定;
2.普通玻璃代替传统的单晶硅片和耐高温硼硅酸玻璃,极大地降低了生产成本;
3.激光切割来制备芯片,便于实现大规模的器件集成化;
4.热键合代替阳极键合,对设备的要求降低,降低加工成本;
5.用转换接头连接样品的进样口和出样口,克服了传统的漏液问题;
6.离心力和声辐射力共同作用来分选细胞,效率更高;
7.不同频率的压电材料对应不同深度的沟道,也对应不同的通量,可以根据临床需求,快速方便调整器件的参数,克服了传统微流控芯片低通量的问题;
8.所制备的微流芯片可在无修饰、无损伤和不影响细胞的活性的条件下分选细胞,有利于对分选后的细胞进行进一步的检测,为微流控芯片在细胞分选中的应用提供一种新思路;
9.本发明能够实现不同细胞的分选,如循环肿瘤细胞、有核红细胞、骨髓瘤细胞和微粒等,对生命科学领域具有重要意义。
附图说明
图1是本发明提供的微流控芯片的结构示意图;
图2是本发明提供的微流控芯片各部分的相对位置示意图;
图3是本发明提供的螺旋式沟道微流控芯片的尺寸图;
图4(a)是细胞在芯片沟道内仅在离心力作用下的受力示意图,图4(b)是在仅离心力作用下对不同细胞分选的理论示意图;
图5是本发明提供的微流控芯片仅在声辐射力作用下对细胞分选的模拟效果图;其中,图5(a)声场整体图;图5(b)声场切片图;图5(c)声压级;图5(d)声压级切片图;
图6是本发明提供的微流控芯片在仅在声辐射力作用下对距离边界不同位置的细胞分选的模拟效果图;
图7是本发明提供的微流控芯片在离心力和声辐射力共同作用下对细胞分选的理论示意图7(a)无任何作用力;图7(b)仅离心力作用;图7(c)仅声辐射力作用;图7(d)离心力和声辐射力共同作用;
附图标记:1-双面均镀有掺锡氧化铟导电薄膜层的铌酸锂单晶(36°y切,厚度为1mm);2-紫外光固化环氧树脂层;3-双层玻璃片;4-热键合层;5-进样口;6-出样口。
具体实施方式
下面结合附图对本发明进一步说明,本发明的内容完全不限于此。
实施例1
全透明螺旋式声体波微流控分选芯片的制备
制备步骤如下:
1.设计模板
为保证分选的不同细胞有一个明显的分界线,确保在不同的出样口收集到不同的分选样本,根据理论计算来调整微沟道的参数。本实施例单晶的谐振频率是3.8mhz,螺旋沟道宽度500μm,对应的深度为200μm;沟道为两圈螺旋线,五个半圆来组成,最外侧螺圈的直径为20mm,从大到小圆的直径依次为20mm,19mm,18mm,17mm,16mm。根据循环肿瘤细胞,白细胞,和血小板在螺旋沟道中所受的力大小不同,在沟道末端距离出口的位移不同,我们设置三个出口,来分选循环肿瘤细胞,白细胞,和血小板。三个出口离分叉点的距离依次为150μm,300μm,500μm处。
2.加工玻璃
切割两块大小相同、厚度为1mm的玻璃,其中一块用于加工沟道,另一块用于谐振腔的封装。依照模板尺寸,利用激光加工制备出符合半波长整数倍的微米级沟道。单晶的谐振频率是3.8mhz,螺旋沟道宽度500μm,对应的深度为200μm;沟道为两圈螺旋线,五个半圆来组成,最外侧螺圈的直径为20mm,从大到小圆的直径依次为20mm,19mm,18mm,17mm,16mm。图3示出了螺旋沟道的结构和尺寸。不同频率的压电材料对应不同深度的沟道,也对应不同的通量,可以根据临床需求,快速方便调整器件的参数。加工好沟道后,在同一块玻璃上,对玻璃进行打孔,作为进样口和出样口。进样口为两个,一个为血液进样口,另一个为缓冲液进样口。出样口有三个。结构如图2所示。
3.集成器件
将同样大小的完整玻璃作为下层玻璃,用于封装腔室。上下层玻璃片采用热键合方法进
行键合,形成密封的腔室。结构如图1和图2所示。
加工步骤如下:
(1)低温预键合
清洗上下层玻璃片,依次用洗洁精清洗10min,自来水冲洗15min,去离子水冲洗五次以上,最后在去离子水的水流作用下,将两片玻璃紧密贴合。吹干贴好的玻璃上下面,在80℃烘台上加热,观察是否存在衍射条纹。如果有衍射条纹,说明清洗不彻底,需重新清洗就封合,若不存在衍射条纹,则说明清洗干净,在此烘台上继续加热2h。
(2)高温键合,540℃~550℃实现玻璃与玻璃之间的高温封接
在80℃烘台上加热2h之后,将此芯片放入马弗炉中。升温程序如下:
4.构造谐振腔
在深度符合半波长整数倍的沟道底部,将10mm*10mm的具有压电效应的铌酸锂单晶(厚度1mm,36°y切)利用环氧树脂紫外固化的方式粘接在下层玻璃片底部,两面引出导线,利用功率放大器进行驱动,调整信号的频率和大小,将目标细胞固定在波节处,实现同种细胞在同一水平面上的分选效果。
应用实施例1
利用实施例1所制备的微流控分选芯片进行细胞分选
取病人血样后,首先使用红细胞裂解液将红细胞去除,然后根据不同细胞的密度,体积,压缩率,在离心力作用下,不同细胞在螺旋沟道中的半径不同,离出口处的位移就会不同,加上驻波的存在,同种细胞会聚集在同一波节面上,从而将细胞分选出来,从内侧到外侧,分别对应的细胞是循环肿瘤细胞,白细胞,和血小板。操作过程中没有对目标细胞进行修饰,所以对细胞无损伤,活性也就不受影响。
以上所述,仅为本发明较佳的具体实施方式,但本发明保护的范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内所做的任何修改,等同替换和改进等,均应包含在发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!