一种析氧电催化材料及其制备方法和应用与流程
本发明属于电化学领域,特别涉及一种析氧电催化材料及其制备方法和应用。
背景技术:
近年来,随着能源短缺,气候暖化与环境污染问题的日益严峻,寻找新型可再生绿色能源已成为材料和能源研究领域的重要课题之一。氢能由于能量密度高、零碳排放无污染等优点而被认为是最具潜力取代传统化石燃料的新能源。地球上的水资源极其丰富,电化学水分解制氢有着不可估量的巨大优势和应用前景。然而,电化学水分解过程中阳极发生的氧析出反应(oer)涉及到多步质子耦合电子转移过程和复杂的中间体吸附行为,具有缓慢的反应动力学。因此,需要高效的催化剂来降低反应能垒进而提高析氧反应速度。贵金属氧化物如ruo2和iro2是目前公认的高活性析氧电催化剂,然而其储量稀少,价格昂贵,极大限制了其工业化应用。因此,发展和设计成本低廉、性能优越的析氧反应电催化剂是实现高效电化学水分解技术的关键,因而成为广大科研工作者们研究的热点。
目前,作为oer电催化剂的层状双氢氧化物(ldh)由于其可调的化学组成和独特电子结构,使其在电催化领域具有很大的发展潜力。其中feni基ldh由于fe、ni元素具有活跃的d电子,且二者之间可形成很好的协同效应,使其作为性能优异的oer电催化剂在ldh材料中脱颖而出。但由于feni基ldh自身结构及导电性的限制,活性位点暴露不充分,使其催化活性不能得到最大程度的利用。因此,开发一种简单高效经济的方法制备具有高催化活性和导电性的feni基ldh材料对实现电解水的大规模工业化应用有着重要的现实意义。
技术实现要素:
根据本申请的一个方面,本发明提供一种新型高效经济的析氧电催化材料及其制备方法和应用。该催化材料可直接作为自支撑电极电催化析氧反应,在实现高效电催化析氧反应的同时,又可保证催化剂材料的稳定性。
本发明的第一方面提供一种析氧电催化材料,该催化材料含有铁镍铬层状双氢氧化物(fenicr-ldh)和金属基底,所述fenicr-ldh原位垂直生长在所述金属基底的表面,所述金属基底中含有铁元素、镍元素和铬元素。
其中,所述金属基底可以为不锈钢(ss)和泡沫铁镍铬合金(fnc)中的至少一种,优选为不锈钢。
示例性的,该催化材料含有铁镍铬层状双氢氧化物(fenicr-ldh)和不锈钢(ss),以fenicr-ldh-ss表示,所述fenicr-ldh原位垂直生长在所述不锈钢的表面。
示例性地,该催化材料含有铁镍铬层状双氢氧化物(fenicr-ldh)和泡沫铁镍铬合金(fnc),以fenicr-ldh-fnc表示,所述fenicr-ldh原位垂直生长在所述泡沫铁镍铬合金的表面。
根据本发明的技术方案,所述fenicr-ldh形成超薄二维纳米片阵列。其中,所述纳米片的厚度为0.5-5nm,例如1-4nm,又如1.3-3nm;示例性地,厚度可以为0.8nm、1.5nm、1.69nm、2nm、2.5nm。
根据本发明的技术方案,所述电催化材料具有由fenicr-ldh形成的超薄二维纳米片阵列组成的三维开放多孔结构。
本发明的第二方面提供上述析氧电催化材料的制备方法,包括如下步骤:
将有机溶剂、酸溶液与2,5-二羟基对苯二甲酸搅拌均匀形成混合溶液,以含铁、镍和铬的金属作为基底和金属源放入所述混合溶液中,经水热反应制备得到所述析氧电催化材料。
根据本发明的技术方案,所述酸溶液可以选自盐酸溶液、硫酸溶液或硝酸溶液,优选为盐酸溶液或硝酸溶液。进一步地,所述酸溶液的浓度为0.5-5mol/l,例如1-4mol/l,示例性地,浓度为1.5mol/l、2mol/l、3mol/l。
根据本发明的技术方案,所述有机溶剂可以选自n,n-二甲基乙酰胺和n,n-二甲基甲酰胺中的至少一种。进一步地,所述有机溶剂与酸溶液的体积比为1:5-5:1,例如体积比为1:3-3:1,示例性地,体积比为1:1。
根据本发明的技术方案,所述金属与所述有机溶剂的质量体积比(g/ml)为(1-4):30,例如(1.3-3):30,示例性地,质量体积比(g/ml)为1.6:30。进一步地,以质量百分比计,所述金属中含有铁元素50-60%、镍元素8-25%和铬元素18-25%,优选含有铁元素50-60%、镍元素8-11%和铬元素18-20%。例如,所述金属可以为不锈钢或泡沫铁镍铬合金,例如304不锈钢。本方法中金属作为半牺牲模板,充当金属源和基底,反应所需的铁元素、镍元素和铬元素皆来自于金属材料。
根据本发明的技术方案,所述金属在加入反应釜之前,可以对其进行预处理,以除去金属表面的氧化层和有机残留物。其中,所述预处理的操作可以为:将金属依次浸入酸(例如稀盐酸、稀硫酸、稀硝酸)、乙醇和水中超声洗涤,而后干燥。
根据本发明的技术方案,反应过程中,在酸溶液的刻蚀下,铁离子、镍离子和铬离子在金属基底表面溶出的同时在金属表面原位生长fenicr-ldh材料。所加入的2,5-二羟基对苯二甲酸配体用于调控fenicr-ldh纳米片厚度。
根据本发明的技术方案,所述2,5-二羟基对苯二甲酸与有机溶剂的质量体积比(mg/ml)为(1-10):3,例如(2-7):3,又如(3-5):3,示例性地,质量体积比(mg/ml)为4:3。
根据本发明的技术方案,所述水热反应的温度为50-300℃,例如100-200℃,示例性地,温度为130℃、150℃、170℃。进一步地,所述水热反应的时间不超过48小时,例如12-30小时,示例性地,时间为15小时、18小时、24小时。
根据本发明的技术方案,所述水热反应完成后,待产物自然冷却至室温,而后对产物进行洗涤。例如,使用乙醇和水(比如蒸馏水或去离子水)对产物进行多次洗涤。进一步地,洗涤完成后,在50-70℃下干燥产物。
根据本发明的实施方式,所述析氧电催化材料的制备方法,包括以下步骤:
a)将盐酸溶液、2,5-二羟基对苯二甲酸配体与n,n-二甲基乙酰胺混合均匀后,加入预处理后的金属材料,将其置于聚四氟乙烯反应釜中;
b)所述反应釜密封,在50-300℃下保持不超过48小时进行水热反应,反应完成得到所述析氧电催化材料。
本发明的第三个方面提供由上述制备方法得到的析氧电催化材料。
本发明的第四个方面提供上述析氧电催化材料在电催化析氧反应中的应用,优选作为反应中的自支撑电极。
本发明的有益效果:
(1)本发明所提供的析氧电催化材料,fenicr-ldh原位生长在金属(如不锈钢)表面,二者之间接触紧密牢固,从而增强催化剂整体导电性和稳定性。
(2)本发明所提供的电催化材料,具有超薄二维纳米片阵列所构成的三维开放多孔结构,不仅可以暴露出更多催化活性位点,还有利于电解质的渗透,以促进电子和质量传递,从而加快催化的反应动力学。
(3)本发明所提供的电催化材料,其可直接作为自支撑电极电催化析氧反应,避免了粘合剂的使用,减少电极制备步骤,简便快捷。
(4)本发明所提供的电催化材料,应用于碱性电解质下析氧反应能显著降低过电势,当实现电流密度为10和100macm-2时,所需过电位仅为202mv和242mv,且具有较小的塔菲尔斜率。
(5)本发明所提供的电催化材料,以金属(如不锈钢)为原料,采用一步水热合成法,成本低廉,操作简便,性能优越,且在催化过程中能实现较大的电流密度,使得该析氧电催化剂材料在能源转化,能源储存等领域具有广阔的应用前景。
附图说明
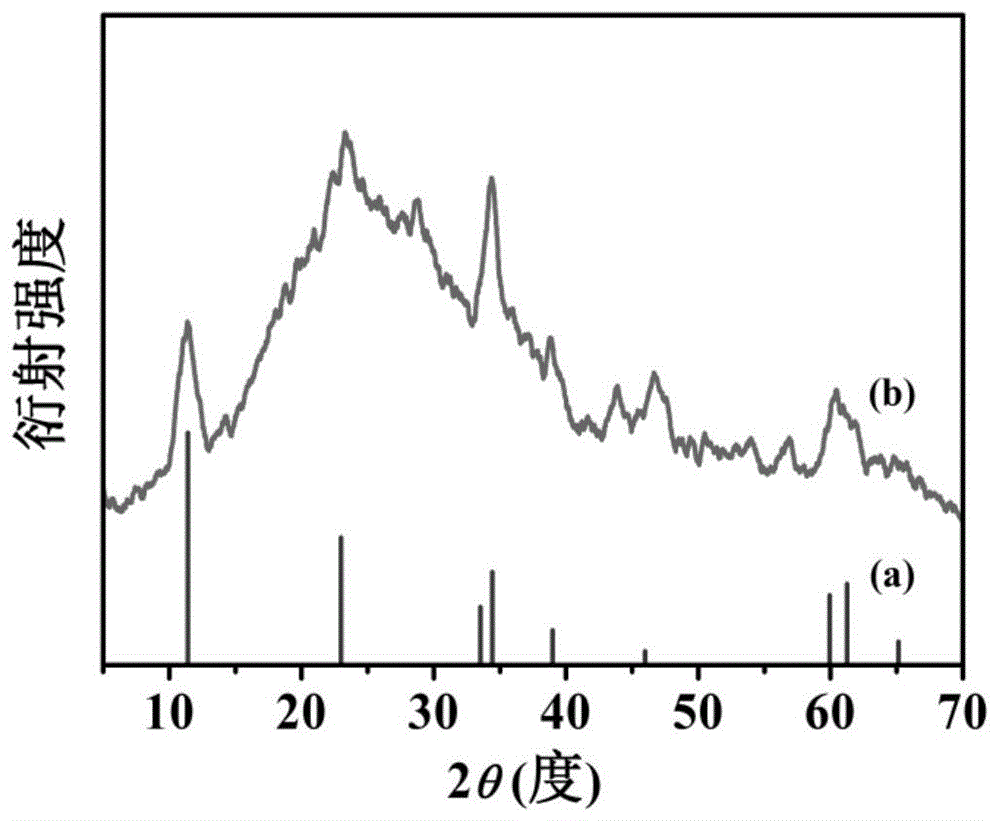
图1是实施例1中不锈钢表面生长的fenicr-ldh粉体的x射线衍射图谱。
图2是实施例1~4制备的fenicr-ldh-ss的扫描电镜图。
图3是实施例1制备的fenicr-ldh-ss的原子力显微镜图。
图4是实施例1制备的fenicr-ldh-ss的x射线光电子能谱图。
图5是实施例1~4产品采用线性扫描伏安法(lsv)获得的极化曲线图。
图6是实施例1产品的恒电流稳定性测试图。
具体实施方式
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
以下实施例中所用仪器信息如表1所示,实施例中所用试剂信息如表2所示。
表1.实施例中所用仪器信息表
表2.实施例中所用试剂信息表
实施例1
(1)基底的预处理:将0.8g且尺寸为4cm×2.5cm的不锈钢(ss,304,含fe:50-60wt%,ni:8-11wt%,cr:18-20wt%,1000目)依次浸入稀盐酸(2.0mol/lhcl),乙醇和蒸馏水中超声洗涤,除去其表面氧化层和有机残留物,而后置于60℃的烘箱中干燥。
(2)在聚四氟乙烯反应釜(50ml)中加入20.0mg2,5-二羟基对苯二甲酸,15ml盐酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将步骤(1)预处理的不锈钢片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-ss用乙醇和蒸馏水洗涤数次并在60℃下干燥。
实施例2
(1)基底的预处理,与实施例1步骤(1)相同。
(2)在聚四氟乙烯反应釜(50ml)中加入15ml盐酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将预处理的不锈钢片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-ss用乙醇和蒸馏水洗涤数次并在60℃下干燥。
实施例3
(1)基底的预处理,与实施例1步骤(1)相同。
(2)在聚四氟乙烯反应釜(50ml)中加入5mg2,5-二羟基对苯二甲酸,15ml盐酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将预处理的不锈钢片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-ss用乙醇和蒸馏水洗涤数次并在60℃下干燥。
实施例4
(1)基底的预处理,与实施例1步骤(1)相同。
(2)在聚四氟乙烯反应釜(50ml)中加入35mg2,5-二羟基对苯二甲酸,15ml盐酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将预处理的不锈钢片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-ss用乙醇和蒸馏水洗涤数次并在60℃下干燥。
实施例5
(1)基底的预处理,与实施例1步骤(1)相同。
(2)在聚四氟乙烯反应釜(50ml)中加入20mg2,5-二羟基对苯二甲酸,15ml硝酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将预处理的不锈钢片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-ss用乙醇和蒸馏水洗涤数次并在60℃下干燥。
实施例6
(1)采用泡沫铁镍铬合金(缩写为fnc,以质量百分比计:铁50%、镍25%、铬25%)作为基底,基底的预处理与实施例1步骤(1)相同。
(2)在聚四氟乙烯反应釜(50ml)中加入20.0mg2,5-二羟基对苯二甲酸,15ml盐酸溶液(2.0mol/l)和15mln,n-二甲基乙酰胺(dma)并搅拌均匀,形成混合溶液。然后将步骤(1)预处理的泡沫铁镍铬合金片放入反应釜中作为生长基底和金属源。密封反应釜置于烘箱中加热,于150℃下保持18小时。自然冷却至室温后,将得到的深绿色fenicr-ldh-fnc乙醇和蒸馏水洗涤数次并在60℃下干燥。
(一)实施例1-4产品的结构表征
将实施例1得到的产品进行超声以收集不锈钢表面生长的fenicr-ldh粉体,对该fenicr-ldh粉体的x射线粉末衍射进行分析,图1中,(a)是feni基ldh的理论粉末x射线衍射图谱,(b)是实验测得实施例1粉体的粉末x射线衍射图谱。由图可知,实施例1粉体实验测得的xrd谱图与理论谱图基本一致,由此表明,实施例1中其不锈钢表面生长的是feni基ldh。
图2为实施例1-实施例4产品的扫描电镜图。图2中,(a)为实施例2产品的扫描电镜图,(b)为实施例3产品的扫描电镜图,(c)为实施例1产品的扫描电镜图,(d)为实施例4产品的扫描电镜图。由图中可以清晰地看出,(a)~(d)中随着配体2,5-二羟基对苯二甲酸加入量的增加,所形成的纳米片厚度逐渐减小,且整体上仍能保持三维开放多孔结构。当配体加入量过多如(d),尽管纳米片厚度进一步减小,但因纳米片过薄而发生卷曲,使得无法形成三维开放多孔结构,从而影响催化性能。由此可见,配体对由超薄二维纳米片阵列组成的开放多孔结构的形成起到至关重要的作用。实验结果表明,实施例1产品具有最优的形貌结构和催化性能。由图3实施例1产品的原子力显微镜图可知,该超薄纳米片厚度仅为1.69nm。
实施例1产品所形成的超薄二维纳米片和开放多孔结构可以避免催化剂发生严重的聚集,不仅暴露出更多催化活性位点,还有利于电解质的渗透,以促进电子和质量传递,从而加快催化的反应动力学。
图4是实施例1产品的x射线光电子能谱图。证实了实施例1中fe、ni和cr元素的存在。即表明实施例1中,不锈钢表面生长的为三金属fenicr-ldh。
(二)实施例1~实施例4产品的电催化析氧性能测试
实施例的电催化析氧性能测试采用三电极测试系统,将上述实施例1~4产品制成的fenicr-ldh-ss作为工作电极,电极面积为1×1cm2,铂网作为对电极,银/氯化银电极作为参比电极。电解液为1mol/lkoh溶液。在25℃扫描速率为5mvs-1的条件下记录线性扫描伏安法(lsv)以获得极化曲线,结果如图5所示,可知实施例1产品显示出最优异的催化性能,其在10macm-2与100macm-2的过电位最小仅为201mv和242mv。所有电极电势数据都进行了95%的ir补偿。
对实施例1产品进行稳定性测试是在10macm-2和20macm-2交替恒电流密度下保持15小时,如图6所示,测试过程中测试电压未发生明显的变化,可见实施例1具有较高的稳定性。测试结果表明实施例1催化性能优异,稳定性高,是迄今为止性能最佳的析氧电催化剂之一。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!