一种基于碱热法制备碳氮气凝胶材料的方法与流程
本发明涉及一种基于碱热法制备碳氮气凝胶材料的方法,属于纳米材料技术领域。
背景技术:
三维气凝胶结构具有比表面积大、暴露活性位点多等优势,因此在光催化、电催化及污染物吸附等领域被广泛应用。然而,目前大部分具有三维气凝胶结构的碳氮材料的构建都需要借助于交联剂。
交联剂一般为高分子材料,这种高分子对气凝胶的本征性能具有负面影响,此外,高分子交联剂制备工艺比较复杂,增加了使用成本。
因此,发展更加简便并且环境友好的构建碳氮三维气凝胶的方法具有重要意义。
技术实现要素:
本发明的技术解决问题是:克服现有技术的不足,提出一种基于碱热法制备碳氮气凝胶材料的方法,该方法通过简单的碱热剪切-自组装工艺,制备出碳氮气凝胶材料,以实现简便合成碳氮气凝胶材料的目的。
本发明的技术解决方案是:
一种基于碱热法制备碳氮气凝胶材料的方法,该方法包括基于氢氧化钠碱热制备碳氮气凝胶和基于氢氧化钾碱热制备碳氮气凝胶,其中,基于氢氧化钠碱热制备碳氮气凝胶的步骤包括:
(1)制备bcn,具体方法为:将双氰胺和硫脲混合后在马弗炉中进行煅烧,煅烧结束后自然冷却至室温;
双氰胺与硫脲的质量比为8-1:1;
在马弗炉中进行煅烧的升温程序为:首先从30℃升温到300℃,升温速率为1~12℃/min,然后从300℃升温到500℃,升温速率为1~5℃/min,再从500℃升温到550℃,升温速率为1~5℃/min,最后在550℃保温1-6h,最后自然降温;
(2)基于氢氧化钠碱热制备碳氮气凝胶,以下简称cna-na的制备,具体方法为:将步骤(1)制备的bcn与naoh溶液进行混合,然后升温至40-80℃进行回流1-15h,期间每隔3-6h取出来超声1h,然后洗涤离心后,静置15-30h后得到碳氮水凝胶hcn-na,再将得到的碳氮水凝胶hcn-na进行冷冻干燥15-30h,得到碳氮气凝胶hcn-na;
naoh溶液的浓度为1-4m,bcn的质量与naoh溶液的体积比为3-15g:100ml。
基于氢氧化钾碱热制备碳氮气凝胶的步骤包括:
(1)制备bcn,具体方法为:将双氰胺和硫脲混合后在马弗炉中进行煅烧,煅烧结束后自然冷却至室温;
双氰胺与硫脲的质量比为8-1:1;
在马弗炉中进行煅烧的升温程序为:首先从30℃升温到300℃,升温速率为1~12℃/min,然后从300℃升温到500℃,升温速率为1~5℃/min,再从500℃升温到550℃,升温速率为1~5℃/min,最后在550℃保温1-6h,最后自然降温;
(2)基于氢氧化钾碱热制备碳氮气凝胶,以下简称hcn-k的制备,具体方法为:将步骤(1)制备的bcn与koh溶液进行混合,然后升温至40-80℃进行回流1-15h,期间每隔3-6h取出来超声1h,然后洗涤离心后,静置15-30h后得到碳氮水凝胶hcn-k,再将得到的碳氮水凝胶hcn-k进行冷冻干燥15-30h,得到碳氮气凝胶hcn-k;
koh溶液的浓度为1-4m,bcn的质量与koh溶液的体积比为3-15g:100ml。
本发明提出的基于碱热法制备碳氮气凝胶材料,其优点是:
1、本发明方法制备的具有疏松棉花状结构的碳氮气凝胶材料,相比于一般的体相氮化碳,具有三维网络结构和开放的孔道结构,能够暴露更多的反应位点,提供快捷的传质通道,进而污染物吸附或者促进表面化学反应速率,使本发明的应用前景非常广阔。
2、本发明方法通过简单的碱热剪辑和自组装工艺,制备了具有三维网络结构的碳氮气凝胶材料,而且制备方法操作简单,易于重复,不采用外加支撑材料,为商业化应用提供了良好的技术基础和物质保证。
3、本发明涉及一种基于碱热法制备碳氮气凝胶材料的方法,属于纳米材料技术领域。本发明方法通过简单的碱热剪辑和自组装工艺,制备了具有三维网络结构的碳氮气凝胶材料,而且制备方法操作简单,易于重复,不采用外加支撑材料,为商业化应用提供了良好的技术基础和物质保证。本发明方法制备的具有疏松棉花状结构的碳氮气凝胶材料,相比于一般的体相氮化碳,具有三维网络结构和开放的孔道结构,能够暴露更多的反应位点,提供快捷的传质通道,进而污染物吸附或者促进表面化学反应速率,使本发明在光催化、电催化及污染物吸附等领域的应用前景非常广阔。
附图说明
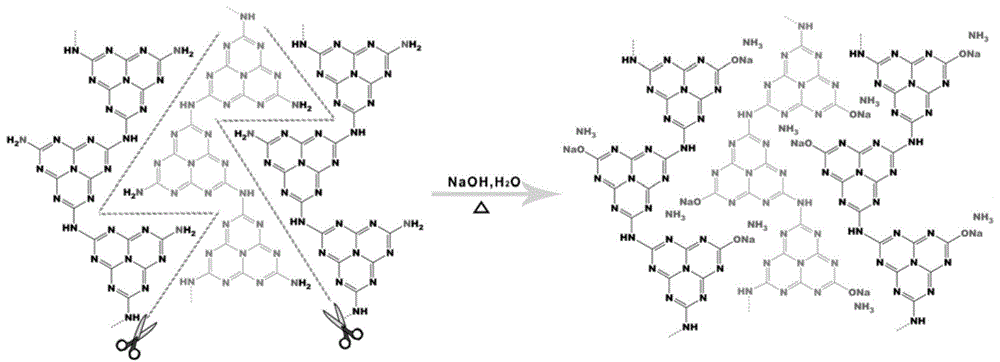
图1为本发明实施例1中以naoh为介质碱热剪切制备碳氮气凝胶的示意图;
图2为实施例2中制备的hcn-na,cna-na,hcn-k及cna-k的光学照片;
图3为实施例3中制备的bcn扫描电子显微镜照片;
图4为实施例4中制备的cna-na扫描电子显微镜照片;
图5为实施例5中制备的cna-na扫描电子显微镜照片;
图6为实施例5中制备的cna-na透射电子显微镜照片;
图7为实施例5中制备的cna-k扫描电子显微镜照片;
图8为实施例5中制备的cna-k扫描电子显微镜照片;
图9为实施例5中制备的bcn,cna-na及cna-k的xrd图;
图10为实施例5中制备的bcn,cna-na及cna-k的红外谱图。
具体实施方式
本发明提出的氧掺杂氮化碳气凝胶光催化剂的制备方法,包括如下步骤:
(1)体相氮化碳,以下简称bcn的制备:双氰胺和硫脲按照(8~1):1的质量比混合均匀,在马弗炉中煅烧。升温程序为30℃到300℃升温速率为1~12℃/min,300℃到500℃升温速率为1~5℃/min,500℃到550℃升温速率为1~5℃/min,然后550℃保持1~6小时,最后自然降温。
(2)基于氢氧化钠碱热制备碳氮气凝胶,以下简称cna-na的制备:0.1~1.5gbcn在10~30ml浓度为1~4m的naoh溶液中保持40~80℃回流搅拌1~15h,每隔3~6小时取出来超声一小时,洗涤离心后,将样品静置15~30小时后得到碳氮水凝胶,简称hcn-na。将上述hcn-na冷冻干燥,冷冻干燥时间为15~30小时,得到棉花状的hcn-na;
(3)基于氢氧化钾碱热制备碳氮气凝胶,以下简称cna-k的制备:0.1~1.5gbcn在10~30ml浓度为1~4m的koh溶液中保持40~80℃回流搅拌1~15h,每隔3~6小时取出来超声一小时,洗涤离心后,将样品静置15~30小时后得到碳氮水凝胶,简称hcn-k。将上述hcn-k冷冻干燥,冷冻干燥时间为15~30小时,得到疏松的cna-k。
下面结合附图通过具体实施例对本发明的方法进行说明,但本发明并不局限于此,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
下述实施例中所用的材料、试剂等,均可从商业途径得到。
实施例1、基于氢氧化钠碱热制备碳氮水凝胶
(1)体相氮化碳,以下简称bcn的制备:双氰胺和硫脲按照4:1的质量比混合均匀,在马弗炉中煅烧。升温程序为30℃到300℃升温速率为8℃/min,300℃到500℃升温速率为2℃/min,500℃到550℃升温速率为1℃/min,然后550℃保持4小时,最后自然降温。
(2)基于氢氧化钠碱热制备碳氮水凝胶,以下简称hna-na的制备:0.5gbcn在20ml浓度为3m的naoh溶液中保持60℃回流搅拌10h,在第五个小时的时候取出来超声一小时,洗涤离心后,将样品静置15小时后得到碳氮水凝胶hcn-na。
如图1所示,在碱热条件下,水分子的羟基与三嗪环的c相连,氧钠与桥连的n结合,形成各种类型的含n集团,同时释放出nh3。据图2可观察,经naoh处理后,洗涤离心,并且静置后,得到碳氮水凝胶(hcn-na)呈水凝胶结构,并且具有丁达尔现象,证明具有胶体性质。
实施例2、基于氢氧化钠碱热制备碳氮气凝胶
(1)体相氮化碳,以下简称bcn的制备:双氰胺和硫脲按照4:1的质量比混合均匀,在马弗炉中煅烧。升温程序为30℃到300℃升温速率为8℃/min,300℃到500℃升温速率为2℃/min,500℃到550℃升温速率为1℃/min,然后550℃保持4小时,最后自然降温。
(2)基于氢氧化钠碱热制备碳氮气凝胶,以下简称cna-na的制备:0.5gbcn在20ml浓度为3m的naoh溶液中保持60℃回流搅拌10h,在第五个小时的时候取出来超声一小时,洗涤离心后,将样品静置15~30小时后得到碳氮水凝胶,简称hcn-na。将上述hcn-na冷冻干燥,冷冻干燥时间为15~30小时,得到棉花状的hcn-na。
据图2可观察,冷冻干燥后得到的碳氮气凝胶呈疏松的棉花状结构。图3中体相氮化碳呈微米级的大块状结构。图4和图5中的碳氮气凝胶样品的形貌为类似石墨烯的片层状结构。通过图6tem中的褶皱推测片层的厚度是50nm。图9所示,对于naoh处理的样品cna-na,11.1度是100衍射峰,对应平面内重复结构,100峰衍射角相比于bcn的减小说明晶面间距增加;27.6度是002衍射峰,对应于层间距,相比于bcn明显弱化和宽化,说明层状结构的堆积程度降低,即层变薄。图10所示,naoh处理的样品cna-na的红外光谱与bcn相比均发生了较大的变化,1265cm-1处的峰代表c-o的伸缩振动,2900-3300cm-1处的峰强度减少说明n-h减少。
实施例3、基于氢氧化钾碱热制备碳氮水凝胶
(1)体相氮化碳,以下简称bcn的制备:双氰胺和硫脲按照4:1的质量比混合均匀,在马弗炉中煅烧。升温程序为30℃到300℃升温速率为8℃/min,300℃到500℃升温速率为2℃/min,500℃到550℃升温速率为1℃/min,然后550℃保持4小时,最后自然降温。
(2)基于氢氧化钾碱热制备碳氮水凝胶,以下简称hna-k的制备:0.5gbcn在20ml浓度为3m的koh溶液中保持60℃回流搅拌10h,在第五个小时的时候取出来超声一小时,洗涤离心后,将样品静置15小时后得到碳氮水凝胶hcn-k。
据图2可观察,经koh处理后,洗涤离心,并且静置后,得到碳氮水凝胶(hcn-k)呈水凝胶结构,并且具有丁达尔现象,证明具有胶体性质。
实施例4、基于氢氧化钾碱热制备碳氮气凝胶
(1)体相氮化碳,以下简称bcn的制备:双氰胺和硫脲按照4:1的质量比混合均匀,在马弗炉中煅烧。升温程序为30℃到300℃升温速率为8℃/min,300℃到500℃升温速率为2℃/min,500℃到550℃升温速率为1℃/min,然后550℃保持4小时,最后自然降温。
(2)基于氢氧化钾碱热制备碳氮气凝胶,以下简称cna-k的制备:0.5gbcn在20ml浓度为3m的koh溶液中保持60℃回流搅拌10h,在第五个小时的时候取出来超声一小时,洗涤离心后,将样品静置15~30小时后得到碳氮水凝胶,简称hcn-k。将上述hcn-k冷冻干燥,冷冻干燥时间为15~30小时,得到疏松的hcn-k。
据图2可观察,冷冻干燥后得到的碳氮气凝胶呈疏松的气凝胶结构。图7和图8中的碳氮气凝胶样品的形貌为片层状结构,但是其片层厚度较厚。图9所示,对于koh处理的样品cna-k,11.1度的100衍射峰衍射角减小,说明晶面间距增加;27.6度的002衍射峰,明显弱化和宽化,说明层状结构的堆积程度降低,即层变薄;此外,在7.2度出现了一个新的衍射峰。图10所示,koh处理的样品cna-k的红外光谱与bcn相比均发生了较大的变化,1249cm-1处的峰代表c-o的伸缩振动,2900-3300cm-1处的峰强度减少说明n-h减少。
按照上述各实施实例并按照前述处理方法即可制得碳氮气凝胶材料。本发明的实施实例均可实施,本发明不限于这些实例。
- 还没有人留言评论。精彩留言会获得点赞!