基于电学及荧光信号的微流控芯片和血细胞分析装置的制作方法
本发明属于生物医学检测领域,具体涉及一种基于电学及荧光信号的微流控芯片和血细胞分析装置。
背景技术:
血细胞分析是一种通过一些仪器的检测对白细胞等进行分析的技术。分析白细胞等各项参数指标的变化对临床进行提示预警,从而为临床疾病的诊断提供依据具有重要的意义。其中血细胞分类计数是血细胞分析的核心部分和关键环节,然而目前研究的瓶颈是缺乏有效的单细胞表征工具采集大量的单个血细胞的固有特性。单个细胞与细胞核尺寸信息作为单细胞的固有特性,已经被证明可以用来区分血细胞等。所以检测细胞与细胞核固有特性进行血细胞分析,对快速准确地应用于临床诊断和治疗具有重大的研究意义。
血细胞分析的常规方法主要是应用库尔特原理。库尔特原理是指悬浮在电解液中的白细胞随电解液通过小孔时,取代相同体积的电解液,在恒定电流设计的电路中导致小孔两侧电极间电阻发生瞬时变化,产生电位脉冲,其中脉冲信号的大小和次数与白细胞的大小和数目成正比。在低频下,根据细胞通过小孔产生的脉冲信号转化为细胞体积确定白细胞分类计数。而且,为了更大程度地区分白细胞种群,溶血剂被用于对白细胞质膜产生差分作用,淋巴细胞质膜收缩导致其细胞体积变小,粒细胞免于溶血剂的收缩作用,而单核细胞体积收缩反而小于粒细胞体积但在一定程度保持稳定又大于淋巴细胞体积。细胞分析时将每个细胞的脉冲根据其体积大小分配在相应的体积通道,每个体积通道收集的数据被统计出相对数,白细胞分布初步确定为三分群,小体积区主要是淋巴细胞,中体积区主要是单核细胞,大体积区主要是中性粒细胞。该方法虽然可以应用于白细胞分类,但测定的细胞体积并不是细胞的生理体积,无法表征白细胞的固有特性。而且由于体积相同的不同类型细胞产生的脉冲信号幅度相同而无法被区分开,因此后续发展,同时应用高频信号弥补这一缺陷。高频电流解决了低频电流无法通过细胞膜的问题,依据细胞核的大小、密度不同对高频电流的阻抗不同来区分白细胞。该方法虽然可以进一步细分白细胞,但同样无法表征细胞核的固有特性。
因此发展一种新型的血细胞分析的装置及方法,利用细胞的固有特性实现更精确的血细胞分析是非常有意义的。
技术实现要素:
有鉴于此,本发明的主要目的之一在于提出一种基于电学及荧光信号的微流控芯片及其制备方法、微流控芯片模块及血细胞分析装置,以期至少部分地解决上述技术问题中的至少之一。
为了实现上述目的,作为本发明的一个方面,提供了一种微流控芯片,包括绝缘承载体和绝缘衬底,其中,所述绝缘承载体包括细胞溶液注入通道、细胞溶液回收通道以及四t型压缩通道的主压缩通道和四个侧压缩通道;
所述绝缘衬底包括金属电极和铬窗口,所述金属电极与各个侧压缩通道出口分别连接,所述铬窗口设置在主压缩通道上。
作为本发明的另一个方面,还提供了一种微流控芯片的制备方法,制备如上所述的微流控芯片,包括在基片上形成铬标记;
在形成铬标记的玻璃片上形成种子层;
在种子层上制备微流控通道阳模;
在微流控通道阳模上制备得到含有微流控通道的绝缘承载体;
在另一个基片上形成铬窗口并制备金属电极层,剥离后得到片上电极;
在绝缘承载体的微流控通道相应位置打孔,并与含有片上电极和铬窗口的绝缘衬底键合,即可得到所述的微流控芯片。
作为本发明的又一个方面,还提供了一种微流控芯片模块,内含有至少一个如上所述的微流控芯片或如上所述制备方法得到的微流控芯片,其中,多个所述微流控芯片采用串联或并联的方式连接。
作为本发明的再一个方面,还提供了一种血细胞分析装置,包括:
如上所述的微流控芯片模块;
压力控制模块,与细胞溶液注入通道或细胞溶液回收通道连接,用于驱动细胞进入四t型压缩通道;
阻抗测量模块,与侧压缩通道连接,用于检测细胞通过侧压缩通道时阻抗的变化;以及
荧光检测模块,与铬窗口连接,用于检测荧光染色过的细胞内细胞核的荧光强度。
基于上述技术方案可知,本发明的基于电学及荧光信号的微流控芯片及其制备方法、微流控芯片模块及血细胞分析装置相对于现有技术至少具有以下优势之一:
1、本发明通过四t型压缩通道检测细胞尺寸的同时,利用其中的铬窗口荧光检测获取细胞核的尺寸信息,与已有方法相比,消除了不同类型细胞由于细胞体积相同而无法被区分的影响。目前应用的白细胞区分方法,如利用低频信号区分,仅能将白细胞按照小、中、大体积区进行种群区分,结果难免存在误差。
2、本发明通过压缩通道结构可以准确地获取细胞和细胞核固有尺寸信息,与已有方法相比,提高了测量的准确性,从而提高了血细胞分析的准确性。目前白细胞分析的方法使用低频和高频信号结合的方法,测定的细胞与细胞核体积仍非细胞的生理体积,而是相对量,并不能准确的表征分析白细胞。
附图说明
图1为本发明实施例中血细胞分析装置的结构示意图;
图2为本发明实施例中所述微流控芯片模块结构示意图;
图3为本发明实施例中所述微流控芯片模块加工流程图;
图4为本发明实施例中所述细胞拉伸长度计算模型及相应的阻抗幅值曲线图;
图5为本发明实施例中所述细胞核拉伸长度计算模型及相应的荧光强度信号曲线图。
附图标记说明:
100-细胞溶液注入通道;200-四t型压缩通道;210-主压缩通道;221-第一侧压缩通道;222-第二侧压缩通道;223-第三侧压缩通道;224-第四侧压缩通道;300-细胞溶液回收通道;401-第一电极;402-第二电极;403-第三电极;404-第四电极;500-铬窗口。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
本发明公开了一种微流控芯片,包括绝缘承载体和绝缘衬底,其中,所述绝缘承载体包括细胞溶液注入通道、细胞溶液回收通道以及四t型压缩通道的主压缩通道和四个侧压缩通道;
所述绝缘衬底包括金属电极和铬窗口,所述金属电极与各个侧压缩通道出口分别连接,所述铬窗口设置在主压缩通道上。
在本发明的一些实施例中,四个所述侧压缩通道沿主压缩通道依次为第一侧压缩通道、第二侧压缩通道、第三侧压缩通道、第四侧压缩通道;
所述第一侧压缩通道和第二侧压缩通道均设置在铬窗口的靠近细胞溶液注入通道的一侧,第三侧压缩通道和第四侧压缩通道均设置在铬窗口的靠近细胞溶液回收通道的一侧;
所述第一侧压缩通道和第四侧压缩通道均设置在主压缩通道的同一侧,所述第二侧压缩通道和第三侧压缩通道均设置在主压缩通道的另一侧的同侧。
在本发明的一些实施例中,所述细胞溶液注入通道和细胞溶液回收通道的横截面高度均大于或等于40微米。
在本发明的一些实施例中,所述主压缩通道的横截面宽度为4至12微米。
在本发明的一些实施例中,所述侧压缩通道的横截面宽度为3至5微米。
在本发明的一些实施例中,所述主压缩通道的横截面的高度与侧压缩通道横截面的高度相同。
在本发明的一些实施例中,所述铬窗口的宽度为2至3微米。
本发明还公开了一种微流控芯片的制备方法,制备如上所述的微流控芯片,包括:
在基片上形成铬标记;
在形成铬标记的玻璃片上形成种子层;
在种子层上制备微流控通道阳模;
在微流控通道阳模上制备得到含有微流控通道的绝缘承载体;
在另一个基片上形成铬窗口并制备金属电极层,剥离后得到片上电极;
在绝缘承载体的微流控通道相应位置打孔,并与含有片上电极和铬窗口的绝缘衬底键合,即可得到所述的微流控芯片。
本发明还公开了一种微流控芯片模块,内含有至少一个如上所述的微流控芯片或如上所述制备方法得到的微流控芯片,其中,多个所述微流控芯片采用串联或并联的方式连接。
本发明还公开了一种血细胞分析装置,包括:
如上所述的微流控芯片模块;
压力控制模块,与细胞溶液注入通道或细胞溶液回收通道连接,用于驱动细胞进入四t型压缩通道;
阻抗测量模块,与侧压缩通道连接,用于检测细胞通过侧压缩通道时阻抗的变化;以及
荧光检测模块,与铬窗口连接,用于检测荧光染色过的细胞内细胞核的荧光强度。
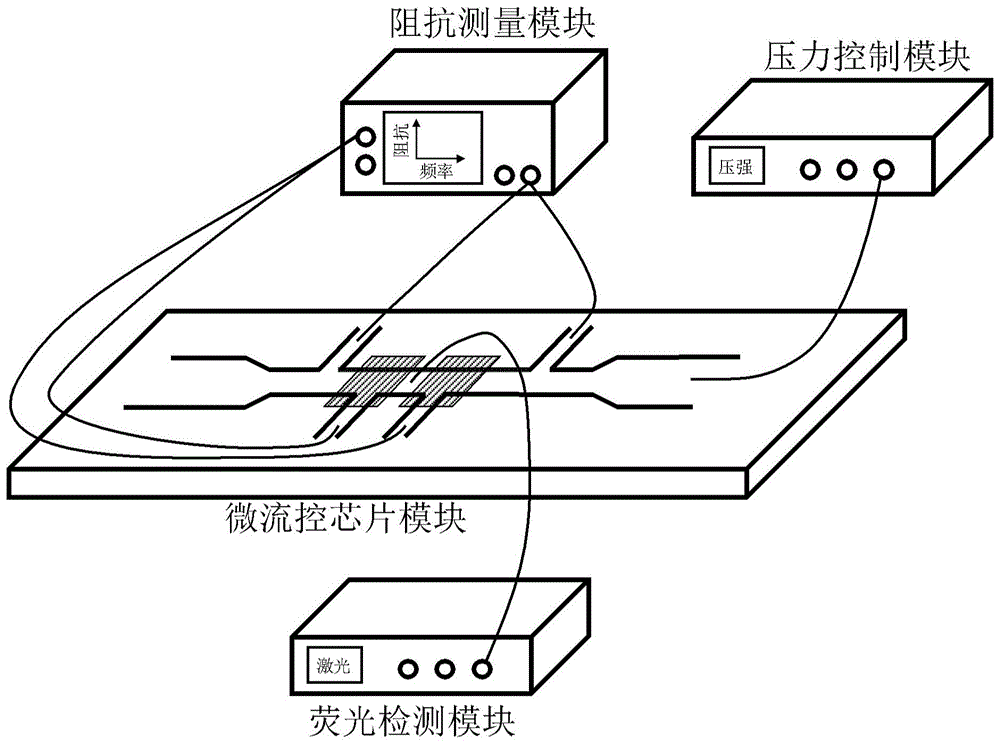
在一个示例性实施例中,本发明的基于电学及荧光信号进行血细胞分析的装置主要包括实现该方法所必需的硬件系统(微流控芯片模块、压力控制模块、阻抗测量模块和荧光检测模块),以及根据硬件系统获取血细胞分析的实现方法。工作时,利用压力控制模块施加负压,吸取细胞在四t型压缩通道主压缩通道中穿行,依次通过第一侧压缩通道、第二侧压缩通道、第三侧压缩通道和第四侧压缩通道,应用阻抗测量模块得到有无细胞穿行时的阻抗信息,同时应用荧光检测模块得到有无细胞(荧光染色的细胞核)通过铬窗口时的荧光强度信息。在上述阻抗信息和荧光强度信息的基础上,结合本发明提供的算法,即可得到细胞与细胞核的尺寸信息,最终实现血细胞分析。与已有方法相比,本发明利用细胞与细胞核的固有特性更精确地进行血细胞分析。
以下通过具体实施例结合附图对本发明的技术方案做进一步阐述说明。需要注意的是,下述的具体实施例仅是作为举例说明,本发明的保护范围并不限于此。
本实施例的基于电学及荧光信号进行血细胞分析的装置如附图1所示,主要包括微流控芯片模块、阻抗测量模块、荧光检测模块以及压力控制模块四部分。
微流控芯片模块为硬件装置中的核心模块,由绝缘承载体和绝缘衬底通过键合操作形成,结构示意图如附图2所示。微流控芯片模块的绝缘承载体依次包含细胞溶液注入通道100、四t型压缩通道200以及细胞溶液回收通道300。具体来讲,细胞溶液注入通道100结构特征是横截面远大于细胞直径以保证细胞的正常流动,该通道横截面高度最小尺寸在40微米左右(白细胞的直径在6-25微米左右)。四t型压缩通道200包含主压缩通道210及四个侧压缩通道,主压缩通道210结构特征是横截面小于细胞核横截面以便使流经的细胞内细胞核发生压缩,该横截面的宽度和高度均为4-12微米左右;侧压缩通道结构特征是横截面积小于细胞在主压缩通道210中拉伸的侧边横截面积,该通道横截面积宽度为3-5微米左右,侧压缩通道的横截面高度与主压缩通道210相同;四个侧压缩通道即第一侧压缩通道221、第二侧压缩通道222、第三侧压缩通道223和第四侧压缩通道224,第一侧压缩通道221和第二侧压缩通道222之间的长度l1为第三侧压缩通道223和第四侧压缩通道224之间的长度l2的长度不相同即可,例如l2=2l1,所述l1和l2的距离不相同即可,同时第二侧压缩通道222与第三侧压缩通道223之间的间距l12最小长度大于细胞拉伸长度;同时第一侧压缩通道221和第四侧压缩通道224在主压缩通道210的同一侧,第二侧压缩通道222和第三侧压缩通道223在主压缩通道210的同另一侧。细胞溶液回收通道300结构特征与细胞溶液注入通道100结构特征相同。微流控芯片模块的玻璃绝缘衬底主要包含金属电极和铬窗口500,即通过片上第一电极401和第二电极402实现四t型压缩通道的第一侧压缩通道221、第二侧压缩通道222与阻抗测量模块导电连接,片上第三电极403和第四电极404实现第三侧压缩通道223和第四侧压缩通道224与阻抗测量模块导电连接,同时铬窗口形成于主压缩通道210中,铬窗口500的宽度为2-3微米。其中侧沟道分别与片上电极重叠面积不能过小,以防止串联于检测系统中的双电层电容容抗过大影响测量有效性。后续玻璃绝缘衬底与绝缘承载体键合即可得到微流控芯片。
微流控芯片模块加工流程如附图3所示。具体来说,如附图3中a-b图所示,首先在溅射铬(cr)的玻璃片上旋涂az1500光刻胶,前烘、曝光、显影、坚膜后形成铬标记的掩膜,然后利用铬腐蚀液去除标记外的铬,再去除剩余掩膜的光刻胶,最终在玻璃片上形成铬标记,如附图3中c图所示。接下来在上述铬玻璃片上旋涂一层su8-2,前烘、泛曝光、后烘坚膜后形成种子层,如附图3中d图所示。下一步在种子层上旋涂一层su8-5,前烘、曝光、后烘,如附图3中e图所示;然后再此基础上旋涂一层su8-25,前烘、曝光、后烘、显影、坚膜,形成所需的微流控通道阳模,如附图3中g图所示。接下来使用制作好的模具浇筑一定厚度的pdms(聚二甲基硅氧烷)与固化剂混合液,如附图3中h图所示,固化后脱模即可得到含有微流控通道的pdms。接下来按照附图3中i~j图的工艺步骤,在玻璃片上形成铬窗口,后续在其上旋涂az1500,前烘、曝光、显影去除电极位置的光刻胶,并溅射金属电极铬/金(cr/au),如附图3中k图,之后进行剥离操作,获得片上电极,如附图3中1图。最后将得到的微流控通道相应位置打孔,并与含有片上电极和铬窗口的玻璃基底键合,即可得到完整的微流控芯片,如附图3中m图所示。
阻抗测量模块是公知技术,包括锁相放大器和数据采集卡。根据实施例需要,可以精确检测阻抗变化的有无,输出频率为100000个采样点/秒,并与前述微流控芯片模块连接的接口为金属钳或其他金属夹具。
荧光检测模块是公知技术,包括生物倒置荧光显微镜、光电倍增管和数据采集卡。根据实施例需要,可以精确检测前述微流控芯片模块中铬窗口荧光信号变化的有无。
压力控制模块是公知技术,包括压力控制器和导气软管。其中压力控制器可以输出-50kpa~50kpa之间的任意压强,并通过导气软管与前述微流控芯片模块连接。
本实施例具体实现方法包括获取原始数据的实验操作及原始数据处理方法:
本实施例实验操作中首先连接微流控芯片模块、阻抗测量模块、荧光检测模块和压力控制模块。连接方法是阻抗测量模块的一端连接四t型压缩通道中第一侧压缩通道221对应的片上第一电极401和第四侧压缩通道224对应的片上电极404,另一端连接第二侧压缩通道222对应的片上第二电极402和第三侧压缩通道223对应的片上第三电极403;荧光检测模块检测窗口对应到微流控芯片模块的铬窗口;压力控制模块的压力输出端连接到微流控芯片模块的细胞溶液回收通道。然后使用磷酸盐缓冲液pbs注满微流控芯片中的所有沟道,目的是防止通过微流控芯片的细胞溶液回收通道施加压力时在通道中产生气泡,影响细胞的流动。接下来,在微流控芯片的细胞溶液注入通道加入一定浓度的细胞悬浮液,利用压力控制模块施加负压,驱动细胞进入四t型压缩通道,利用阻抗测量模块检测电极间有无细胞穿行时的阻抗数据,同时利用荧光检测模块检测铬窗口有无细胞(荧光染色的细胞核)通过的荧光信号强度数据,这些作为实验的原始数据。
本实施例原始数据处理方法主要是细胞与细胞核拉伸长度即细胞与细胞核尺寸计算。
考虑四t型压缩通道第一侧压缩通道221和第二侧压缩通道222之间以及第三侧压缩通道223和第四侧压缩通道224之间有细胞通过时阻抗幅值(或者相位)变化,即可计算得到细胞拉伸长度。细胞拉伸长度计算模型如附图4所示,附图4中a图中的l1为第一侧压缩通道221和第二侧压缩通道222之间的间距,l2为第三侧压缩通道223和第四侧压缩通道224之间的间距;当细胞穿行到如附图4中i-b所示位置前时,细胞不阻挡阻抗线,阻抗幅值不变;当细胞在如附图4中i-b和i-c所示位置之间穿行时,细胞阻挡第一侧压缩通道221和第二侧压缩通道222之间电场线,阻抗幅值上升;当细胞在如附图4中i-c和i-d之间穿行时,由于第二电极402和第三电极403相连等电势,第二侧压缩通道222、第三侧压缩通道223间无电场线,所以细胞未阻挡电场线,阻抗幅值不变;当细胞在如附图4中i-d和i-e之间穿行时,细胞阻挡第三侧压缩通道223和第四侧压缩通道224间的电场线,阻抗幅值上升。根据以上分析,当细胞依次通过附图4中i-b~e位置时,阻抗幅值会呈现附图4中ii所示曲线,其中附图4中i-b~e中细胞位置分别对应在附图4中ii所示曲线上,并形成细胞穿行时间t1和t2。
考虑到主压缩通道长度足够小,故可认为细胞在第一侧压缩通道221和第二侧压缩通道222之间穿行以及在第三侧压缩通道223和第四侧压缩通道224之间穿行的过程中保持匀速运动:
求解得到细胞拉伸长度lc为:
根据体积等效进一步等效计算得到细胞直径dc,其中s为主压缩通道的横截面积:
考虑四t型压缩通道中铬窗口之间有细胞(荧光染色的细胞核)通过时荧光强度信号变化,即可计算得到细胞核拉伸长度。细胞核拉伸长度计算模型如附图5所示,附图5的i-a中的l3为铬窗口的间距;当细胞穿行到如附图5的i-b所示位置前时,荧光染色的细胞核未进入铬窗口产生荧光,荧光强度不变;当细胞在如附图5的i-b和i-c所示位置之间穿行时,荧光染色的细胞核进入铬窗口被激发光局部照射,产生荧光,荧光强度上升。根据以上分析,当细胞依次通过附图5中i-b~c位置时,荧光强度信号会呈现附图5中ii所示曲线,其中附图5中i-b~c中细胞位置分别对应在附图5的ii中,并形成细胞穿行时间t3。
考虑到细胞及细胞核在四t型压缩通道中穿行速度一致:
求解得到细胞核拉伸长度ln为:
将公式2求解得到的细胞拉伸长度lc代入公式5中即可进一步得到细胞核拉伸长度ln,同时根据体积等效进一步等效计算得到细胞核直径dn:
至此,已经结合附图对本实施例进行了详细描述。依据以上描述,本领域技术人员应当对本发明中一种应用电学及荧光信号进行血细胞分析的装置及方法有了清楚的认识。
本实施例中,衬底采用玻璃材料,本领域技术人员应当清楚,除了玻璃之外,衬底可以为硅片、聚甲基丙烯酸甲酯(polymethylmethacrylate,简称pmma,又称作压克力、亚克力,英文acrylic,或有机玻璃)或聚二甲基硅氧烷(polydimethylsiloxane,简称pdms)片等片状材料。
本实施例中,承载体的材料为pdms。本领域技术人员应当清楚,除了pdms之外,还可以采用玻璃、su-8、硅片等材料来形成上述承载体。
本发明中所演示的微流控芯片结构是这种方法的基础单元,可以方便地进行细胞穿行方向上的并联和串联排布,甚至某些结构的合并,会带来不同的效果。
本发明中微流控芯片中的通道横截面为矩形,也可以被替换成圆形或者半圆形等形状,不影响基础功能的实现。
本发明中使用盖板加基板封接的形式形成通道,也可以在玻璃等材料内部刻蚀实现,同样可以实现需要的功能。
本发明中使用负压驱动细胞溶液通过通道,但是也可以使用其他方式,如在细胞溶液注入通道端施加正压。
需要说明的是,在附图或说明书正文中,未绘示或描述的实现方式,均为所属技术领域中普通技术人员所知的形式,并未进行详细说明。此外,上述对各元件的定义并不仅限于实施例中提到的各种具体结构、形状或方式,本领域普通技术人员可对其进行简单地更改或替换,例如:
(1)实施例中提到的方向用语,例如“上”、“下”、“前”、“后”、“左”、“右”等,仅是参考附图的方向,并非用来限制本公开的保护范围;
(2)上述实施例可基于设计及可靠度的考虑,彼此混合搭配使用或与其他实施例混合搭配使用,即不同实施例中的技术特征可以自由组合形成更多的实施例。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!