适用于大规模质粒DNA生产的纯化方法与流程
适用于大规模质粒dna生产的纯化方法
技术领域
1.本发明属于生物分离纯化领域,具体涉及一种适用于大规模质粒dna生产的纯化方法。
背景技术:
2.目前市面常用的高纯度质粒dna纯化方法为三步层析:凝胶过滤层析去除rna、亲和层析超螺旋质粒选择性吸附、离子交换层析内毒素和其它杂质去除。
3.该法所涉凝胶过滤层析步骤中上样体积受层析柱体积和料液粘度约束,上样体积最多为柱体积的30%。工艺进一步放大时,所需层析柱直径较大、层析介质用量较多,成本较高。且凝胶过滤层析柱在使用过程中普遍存在流速偏低、易塌陷的现象,生产过程耗时相对较长、层析柱重装频率相对较高。由于原理限制,凝胶过滤层析仅能完成质粒捕获,无法去除比质粒分子大的杂质,也无法有效降低内毒素、大肠杆菌宿主蛋白、基因组等杂质水平。经第二步层析后,质粒纯度也相对较低,需要通过第三步离子交换层析进行精纯,但该步质粒dna收率相对较低,以致工艺总收率相对偏低。
4.因此,开发成本低,耗时短的质粒dna的纯化工艺十分有必要。
技术实现要素:
5.有鉴于此,本发明目的在于提供一种用于质粒纯化的阴离子交换层析介质。
6.阴离子交换层析介质的分离原理:在特定的ph值环境中,质粒带负电,可与带正电的阴离子交换层析介质由电荷相互作用结合。通过改变缓冲液ph值或电导,利用不同分子电荷的差异,可分别解除结合而洗脱,实现分离效果。deae是二乙胺基乙基,为阴离子交换层析介质所带配体的一种,相对电荷较弱,适用于质粒纯化。
7.层析介质配基有琼脂糖、聚苯乙烯、交联聚甲基丙烯酸酯聚合物等,按不同的工艺需求与不同的配体结合。常规质粒纯化的介质为凝胶过滤层析介质,利用分子的大小实现分离。用于纯化时,收集组分为大于特定尺寸的分子,分辨率较离子交换层析低。
8.所述阴离子交换层析介质为:配体为deae(二乙胺基乙基),配基为交联聚甲基丙烯酸酯聚合物小球。
9.进一步,所述配基密度为0.29-0.35mmol cl-1
/ml填料。
10.本发明目的在于还提供一种deae阴离子交换层析介质在质粒纯化中的应用。目前文献显示,deae目前只在蛋白纯化中有应用,在质粒纯化中未有相关的应用。
11.本发明目的在于还提供一种包含质粒的混合物纯化的方法。
12.所述方法为以前述的阴离子交换层析介质为固定相进行离子交换层析。前述的阴离子交换层析介质具体为:配体为deae(二乙胺基乙基),配基为聚苯乙烯刚性微球。
13.进一步,所述配基密度为0.29-0.35mmol cl-1
/ml填料。
14.进一步,所述混合物包括rna、质粒、内毒素、大肠杆菌基因组和大肠杆菌宿主蛋白。
15.进一步,所述方法具体为:将所述混合物上样至离子交换层析柱;上样结束后用平衡缓冲液冲洗层析柱冲洗3-5个柱体积直至275-285nm处吸收值降至近基线水平,不收集上样和洗柱过程的峰。用洗脱缓冲液进行洗脱,冲洗3-5个柱体积,收集该峰,至275-285nm处吸收值降至近基线水平时,停止收集。
16.进一步,所述平衡缓冲液冲为20-150mm mops和/或tris和/或hepes和/或pipes,ph值为6.5-7.5。
17.进一步,所述洗脱缓冲液为为20-150mm mops和/或tris和/或hepes和/或pipes,ph值为6.5-7.5。
18.进一步,所述离子交换层析的层析柱选择直径为26mm、50mm、100mm、200mm、600mm的,装柱高100-200mm。
19.具体地,所述离子交换层析是分离rna、质粒、内毒素和大肠杆菌宿主蛋白,先是去除rna、内毒素、大肠杆菌基因组和大肠杆菌宿主蛋白,保留质粒达到纯化的目的。
20.本发明目的在于提供一种大规模质粒dna的纯化方法。
21.所述纯化方法包括以下步骤:(1)将原料利用前述的混合物纯化的方法进行处理收集洗脱液;(2)所述洗脱液经缓冲液置换后进经亲和层析进行处理得纯化质粒dna。
22.进一步,步骤(1)中所述的原料进行预处理,所述预处理具体为:将初始料液进行碱裂解得料液,然后将所述料液用切向流超过滤系统,经100-500kd孔径的模包或中空纤维柱进行浓缩得浓缩料液,然后用ph值6.5-7.5的离子交换平衡缓冲液换液,换液倍数为浓缩料液体积的3-5倍。
23.进一步,步骤(2)中所述缓冲液为20-150mm mops和/或tris和/或hepes和/或pipes,ph值为7.0-8.0。
24.进一步,所述离子交换平衡缓冲液换液为20-150mm mops、tris、hepes、pipes。
25.进一步,步骤(2)中所述的纯化质粒dna进行后处理,所述后处理具体为:将所述纯化质粒dna使用孔径30-300kd的模包或中空纤维柱对洗脱峰收集组分进行浓缩换液,将缓冲液置换为低电导的磷酸盐缓冲液或te缓冲液中,然后将换液后的质粒dna溶液进行除菌过滤得药用质粒dna。
26.进一步,步骤(2)所述亲和层析的层析介质为plasmidselect xtra。
27.具体地,步骤(2)所述亲和层析主要去除吸附超螺旋质粒和其它微量的杂质。
28.本发明目的在于还提供一种适用于大规模质粒dna生产的纯化方法,所述方法为:
29.(1)将原料上样至离子交换层析柱;上样结束后用平衡缓冲液冲洗层析柱冲洗3-5个柱体积直至275-285nm处吸收值降至近基线水平,不收集上样和洗柱过程的峰。用洗脱缓冲液进行洗脱,冲洗3-5个柱体积,收集该峰,至275-285nm处吸收值降至近基线水平时,停止收集。
30.(2)将所述洗脱液经缓冲液置换后进经亲和层析进行处理得纯化质粒dna。
31.(3)将所述纯化质粒dna使用孔径30-300kd的模包或中空纤维柱对洗脱峰收集组分进行浓缩换液,将缓冲液置换为低电导的磷酸盐缓冲液或te缓冲液中,然后将换液后的质粒dna溶液进行除菌过滤得药用质粒dna。
32.进一步,所述平衡缓冲液和洗脱缓冲液为20-150mm mops和/或tris和/或hepes和/或pipes,ph值为7.0-8.0。
33.具体地,所述离子交换层析是分离rna、质粒、内毒素和大肠杆菌宿主蛋白,先是去除rna、内毒素大肠杆菌基因组和大肠杆菌宿主蛋白,保留质粒达到纯化的目的。
34.进一步,步骤(2)所述亲和层析的层析介质为plasmidselect xtra。
35.本发明的有益效果在于:
36.本发明将离子交换层析与亲和层析相结合用于质粒纯化,相较于传统纯化工艺时长短,成本低。
37.本发明无需凝胶过滤步骤,直接层析处理样品体积不受柱体积限制,仅与待纯化的质粒量有关,纯化同样体积的料液,层析介质用量仅为传统凝胶过滤层析介质的1/10及以下,工艺放大时所需层析柱直径较小,可节约成本。
附图说明
38.图1:离子交换层析图谱。
39.图2:亲和层析图谱。
40.图3:纯化过程样品琼脂糖凝胶电泳图。
具体实施方式
41.所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
42.实施例1菌液裂解
43.工程菌高密度发酵后,经高速离心收集菌体后重悬于重悬缓冲液中;或通过中空纤维柱收集浓缩菌液并置换为重悬缓冲液;向菌悬液中加入裂解液轻柔混匀进行裂解;裂解完成后,加入中和液后均匀混合中止反应。
44.实施例2菌液裂解物浓缩
45.用深层滤器或中空纤维柱对实施例1中得到的裂解液进行澄清后,使用切向流超过滤系统,经100-500kd孔径的模包或中空纤维柱进行浓缩,后用ph值6.5-7.5的离子交换平衡缓冲液换液,换液倍数为浓缩后料液体积的3-5倍。
46.实施例3离子交换层析
47.在ge公司akta层析系统中,用离子交换平衡缓冲液平衡离子交换层析柱,平衡3-5个柱体积;将实施例2中澄清后浓缩液上样至离子交换层析柱;上样结束后用平衡缓冲液冲洗层析柱冲洗3-5个柱体积直至280nm处吸收值降至近基线水平,不收集上样和洗柱过程的峰;
48.用洗脱缓冲液进行洗脱,冲洗3-5个柱体积,收集该峰,至280nm处吸收值降至近基线水平时,停止收集;用0.5m naoh冲洗层析柱,冲洗3-5个柱体积,至280nm处吸收值降至近基线水平,不收集冲洗液。层析图谱中有3个主峰,其中第一个峰主要成分为rna(图3中第4条带),第二个峰主要成分为质粒dna(图3中第5条带),第三个峰为其它杂质。结果如图1所示。
49.实施例4亲和层析
50.实施例3纯化后的样品在亲和层析柱进行纯化,层析介质为plasmidselect xtra。
层析过程中收集洗脱峰。在切向流超过滤系统中,使用孔径30-300kd的模包或中空纤维柱对洗脱峰收集组分进行浓缩换液,将缓冲液置换为低电导的磷酸盐缓冲液或te缓冲液中。
51.结果如图2所示:其中第一个峰为未结合或结合不紧密的组分,主要成分为质粒的开环结构(图3中第9条带),第二个峰主要成分为质粒的超螺旋结构(图3中第10条带)。
52.实施例5过滤除菌及纯化结果检验
53.将换液后的质粒溶液进行除菌过滤后分装,低温保存(2-8℃)或冻存(-20℃
--
80℃),检验合格后即可入库,作为药用质粒dna。
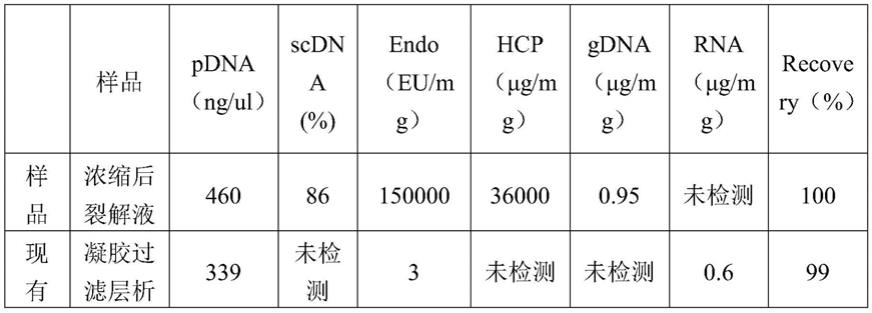
54.检验结果如图3所示:3、4、5依次为离子交换层析上样样品,上样阶段穿透和洗柱液(离子交换层析图谱第一个峰),洗脱收集组分(离子交换层析图谱第二个峰);8、9、10依次为亲和层析上样样品,上样阶段穿透和洗柱液(亲和层析图谱第一个峰),洗脱收集组分(亲和层析图谱第二个峰)。
55.本发明与传统方案纯化对比结果如表1所示:
56.表1本发明与现有技术纯化对比结果表
[0057][0058][0059]
表2本发明与现有技术纯化耗时和损耗对比结果表
[0060]
技术成本/耗时现有技术260元/mg,耗时28h/批本发明技术50元/mg,耗时16h/批
[0061]
表3各杂质及样品的中英文对照表
[0062]
英文中文pdna质粒scdna超螺旋质粒endo细菌内毒素hcp宿主蛋白gdna基因组rna核糖核酸recovery收率
[0063]
从表1、表2和表3得知,本发明纯化后的质粒,内毒素和大肠杆菌宿主蛋白含量低于背景技术,工序总收率为77%,高于现有技术的69%。纯化时长缩短12小时,纯化成本不到原工艺的1/5,收率高于原工艺,纯化效果不逊于原工艺。本发明纯化质粒的效果优于背景技术,且可放大性强,所需成本更低,耗时更短。
[0064]
实施例6现有技术与本发明技术材料比对
[0065]
生产100mg的质粒,本发明与现有技术所需材料对比如下表3。
[0066]
表4现有技术生产100mg质粒所需材料
[0067]
步骤介质种类介质数量第一步凝胶过滤层析1.3l第二步亲和层析50ml第三步离子交换层析50ml
[0068]
表5本发明生产100mg质粒所需材料
[0069]
步骤介质种类介质数量第一步离子交换层析(deae)100ml第二步亲和层析50ml
[0070]
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1