微滴操作方法与流程
微滴操作方法
1.本发明涉及操作含水微滴的改进方法,所述微滴任选地包含在不混溶的载体流体例如油中的生物细胞。它能够控制或调整微滴的大小,并且在给定的时间内保持或优化微滴内发生的任何酶促或化学反应。
2.在我们之前的专利申请,例如wo2014167323、wo2015121675、wo2016012789、wo2017140839和pct/ep2018066574中,我们已经描述了其中生物成分例如细胞、酶、寡核苷酸甚至单核苷酸在微滴内进行操作的方法,用于进行一系列分析,包括dna和rna测序以及细胞和病毒的检测和表征。在一些实施方案中,这些方法涉及使用电润湿推进力沿分析装置中的微流体路径转移分散在不混溶的载体流体中的微滴或通过将微滴直接印刷到涂覆有载体流体的基片上。在许多情况下,其中微滴的体积分数相对较低,我们发现这些微滴易于随着时间的推移发生显著收缩,这有时会干扰微滴内部进行的部分或全部酶促过程。此外,在其他情况下,在执行给定分析时,可能需要有意地使装置的一部分中的微滴的尺寸收缩或生长。
3.我们现在开发了克服这些问题的微滴操作方法。例如,它可用于操作微滴内容物的大小和/或反应性,或控制其中发生的化学或酶促反应。本发明如所附权利要求中所定义。根据本发明的第一方面,提供了一种操作(控制其内容物的大小和/或化学组成)微滴的通用方法,所述微滴的平均体积在0.5飞升至10纳升的范围内,所述微滴包含至少一种生物成分和第一水性介质组成,所述第一水性介质具有小于1的水活度a
w1
,其特征在于将微滴保持在与水不混溶的载体流体中的步骤,所述载体流体还包括平均体积小于所述微滴的25%的平均体积达到并包括最大4飞升的第二水性介质的次级液滴,并且其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。
4.不希望限制本发明的范围,据信本发明通过使用包含非常小的次级液滴的载体流体解决了该问题,次级液滴可以与微滴相互作用而不会对微滴的整体特性或应用于它们的任何检测方法的效力产生不利影响。当载体介质是油时,这种复合介质有时被称为“水合油”。在这方面的重要特征是微滴和次级液滴的相对水活度控制在某些参数内;任选地通过连续监测和/或反馈回路。此处,水性介质的水活度(a
w
)定义为在stp条件下所研究的水性介质与纯水的蒸汽分压之比。由于水倾向于沿着从高水活度到低水活度的梯度扩散,我们发现,在我们系统的限制范围内,当第二水性介质(a
w2
)的水活度高于第一水性介质(a
w1
)的水活度时,净效应是微滴经历膨胀,直到两个组分的水活度相等。相反地,当第二水性介质的水活度高于第一水性介质的水活度时,微滴将趋于收缩,直到这些水活度相等。在一个有用的实施方案中,第一和第二水性介质的水活度可以相同或基本相同,从而连续抵消微滴收缩或膨胀的任何趋势。因此,可以始终保持微滴的尺寸。我们还发现,通过这些方式,这些次级液滴可用于帮助保持甚至增强微滴中发生的任何酶促或化学反应;例如,通过使用次级液滴将细胞生长成分提供给采用该方法的任何设备中的一个或多个点上的微滴。在一个实施方案中,第一和第二水性介质可以具有相同的组成。
5.因此,在本发明的一个实施方案中,第一和第二水性介质的水活度独立地在0.9至1的范围内。在另一个实施方案中,第一水性介质的水活度为0.9至小于1。在又一个实施方
案中,第一和第二水性介质的水活度之比(a
w1
:a
w2
)在0.9:1至1:0.9的范围内。
6.执行操作的一种方便的方法是使用为缓冲液的第一和第二介质;并且,如果需要,通过改变两者的相对组成。例如,在一个应用中,第一水性介质的离子强度为第二水性介质的离子强度的1至5倍;优选3至5倍。另一方面,第二水性介质的离子强度为第一水性介质的离子强度的1至5倍;优选3至5倍。在又一应用中,离子强度相同或基本相同,离子强度的比值在3:1至1:3的范围内。在一个特别有用的实施方案中,第一和第二水性介质中的任一个或两者可以包括甘油作为组分;例如,以不同的浓度。另一方面,第一和第二水性介质的ph值相同或相似并且在6.5至8的范围内。
7.至于次级液滴,它们的平均体积比微滴的平均值小得多,并且在极限情况下可能包含第二水性介质的毫微微大小的液滴或胶束,所述第二水性介质在载体流体中乳化并通过相容的表面活性剂分子;例如,非离子表面活性剂的覆盖稳定。在一个实施方案中,这些次级液滴的尺寸小于所用微滴体积的10%,优选小于5%。另一方面,次级液滴的平均体积在微滴平均体积的10%至1%的范围内。合适地,次级液滴在载体流体中形成稳定乳液的一部分,在一个实施方案中,所述载体流体是不混溶的油。合适地,载体流体选自矿物油、硅油或氟碳油。如果需要,油还可以包含额外的表面活性剂和稳定剂。适当地,载体流体与微滴总体积的体积比大于3:1;优选5:1或更大。
8.本发明的方法可用于分析生物细胞的多种应用。一个例子是使永生化哺乳动物细胞培养物在微滴内增殖,目的是筛选细胞的单个克隆拷贝以获得所需的特征,例如蛋白质表达或特定的遗传性状。因此,在本发明的第二方面,在一个实施方案中,提供了使包含在微滴内的一种或多种细胞类型细胞增殖的方法,所述微滴的平均体积在4飞升至10纳升范围内且包含水性缓冲液,所述方法包括在合适的环境条件下温育液滴内的细胞并随后检测每个液滴内的细胞数量的步骤,其特征在于微滴悬浮在不混溶的载体流体中,所述载体流体还包括次级液滴,所述次级液滴的平均体积小于微滴平均体积的25%,达到并包括最大4飞升,并且其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。
9.在另一个实施方案中,还提供了检测所考虑细胞的一个或多个表型特征、遗传性状或蛋白质表达谱的方法,所述细胞包含在微滴内,所述微滴的平均体积在4飞升至10纳升范围内,并且包含含水生长培养基,所述方法包括以下步骤:用荧光探针标记源自细胞的靶标并随后检测来自探针的输出,其特征在于含有细胞的微滴悬浮在不混溶的载体流体中,所述载体流体还包括次级液滴,所述次级液滴的平均体积小于微滴平均体积的25%,达到并包括最大4飞升,其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。适用于该目的的荧光探针分子是众所周知的,并且包括荧光标记的抗体、fret报告探针和酶标记的抗原,它们在靶蛋白存在时被降解。
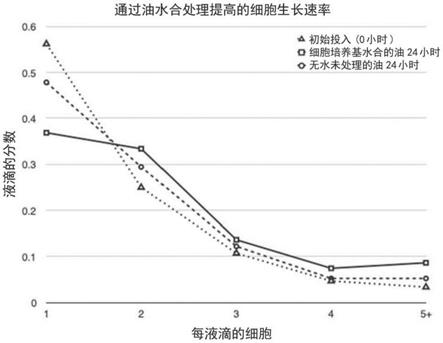
10.在另一个实施方案中,提供了分析源自包含在微滴中的生物细胞的寡核苷酸的方法,所述微滴的平均体积在4飞升至10纳升范围内且进一步包含水性缓冲液,所述方法包括以下步骤:用荧光杂交探针标记寡核苷酸,并随后检测相应的荧光,其特征在于微滴悬浮在不混溶的载体流体中,所述载体流体还包含平均体积小于微滴平均体积的25%、达到并包括最大4飞升的次级微滴,其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。
11.可用于此目的的荧光杂交探针是本领域众所周知的,并且包括分子信标、
探针、探针和探针。检测所有这些实施方案中产生的荧光的方法是本领域普通技术人员公知的;例如,这些方法采用了入射电磁辐射源(激光、led等)和用于检测荧光光子的相应光电检测器并输出可以使用微处理器算法进行分析的数据流。
12.因此,这些方法中的靶标可以是细胞本身、一种或多种源自细胞的寡核苷酸,或产物,例如当在微滴自身内培养时由细胞表达的蛋白质。此类寡核苷酸可通过裂解从细胞产生。
13.本发明的方法也可以合适地与非细胞或无细胞的生物成分结合使用,尽管在一个实施方案中它可以用于操作先前源自生物细胞的核酸或其成分。因此,在本发明的第三方面,提供了一种操作微滴的内容物的大小和/或反应性的方法,所述微滴的平均体积在0.5飞升至10纳升范围内;所述微滴包含至少一种生物成分和不含生物细胞的第一水性介质,所述水性介质的水活度a
w1
小于1,其特征在于将微滴保持在与水不混溶的载体流体中的步骤,所述载体流体进一步包括次级液滴,所述次级液滴包含第二水性,且平均体积小于微滴平均体积的25%,达到并包括最大0.5飞升,并且其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。
14.本发明的第三方面的方法可用于许多应用,其中生物成分是单核苷酸;例如,单核苷三磷酸或单核苷单磷酸。例如,该方法可以有利地与我们之前描述的测序方法之一一起使用,包括但不限于在ep3013987或读者所涉及的其他上述专利申请中描述的那些。因此,在第三方面,提供了一种测序方法,包括以下步骤:通过焦磷酸解将核酸分析物逐步消化成三磷酸核苷分子的有序流,并从其产生相应的微滴有序流,所述微滴的平均体积在0.5飞升至10纳升的范围内,每个微滴包含三磷酸核苷分子之一和水性缓冲液;使每个微滴内的每个三磷酸核苷分子与核碱基特异性荧光探针反应,随后检测与每个微滴相关的相应荧光,从而识别核碱基,其特征在于,微滴悬浮在不混溶的载体流体中,所述载体流体进一步包括次级液滴,所述次级液滴平均体积小于微滴平均体积的25%,达到并包括最大0.5飞升,并且其中每单位体积总量中载体流体与微滴总体积的体积比大于2:1。
15.适用于本技术的荧光探针已由我们在我们之前的专利申请中进行了描述;例如,wo2016012789和读者所涉及的随后公开的申请。这些探针的特征在于(a)在其未使用状态下不发荧光和(b)一旦被使用,就能够进行核酸外切,产生连接到单个核苷单磷酸的可检测状态的荧光团。可以如上所述检测和分析产生的荧光。
16.在本发明的所有这些额外方面中,优选地,分别与微滴和次级液滴相关联的第一和第二水性介质的水活度之比在0.9:1至1:0.9的范围内;优选为0.95:1至1:0.95,例如1:1。
17.现在通过以下实施例说明上述水合载体相的有利作用。
18.实施例1(细胞生长)
19.连续油相材料是通过将99份氢氟醚连续相与1份氟化表面活性剂混合制备的。通过将等分的rpmi 1640培养基(thermo fisher scientific,uk)与等体积的油/表面活性剂混合物混合并在37℃下搅拌混合物24小时以形成聚
‑
分散乳液来制备生长培养基处理的载体相。然后将该乳液静置直至其自发分级以形成包含大液滴和未分散的含水生长培养基栓(plug)的上相,以及仅包含悬浮在油相中的最小生长培养基囊泡的下相,该油相现在另外用溶解的水性介质饱和。使用移液管从容器中移出该下相并保留以备后用。
20.jurkat e6
‑
1 t细胞淋巴瘤细胞(atcc,virginia,usa)以8e6细胞/ml的浓度悬浮在rpmi培养基中。然后使该培养基和细胞流过乳化装置以形成直径为50微米的液滴,细胞分散在整个液滴中。乳液的外部载体相是与1%的合适表面活性剂混合的氢氟醚油,以稳定溶液中的液滴。由此形成的乳液自发分级以形成密集堆积的单分散含水液滴层,其漂浮在连续油/表面活性剂混合物柱的顶部。然后通过温和混合将该乳液均匀分散并分成三等份,其包含液滴和载体相。
21.将一等份(初始参考)立即转移到血细胞计数器流动池中,并使用20倍放大光学显微镜检查其中的液滴。通过计算每个液滴中不同细胞的数量来记录每个液滴的细胞占有率。空液滴被忽略。
22.允许再次分级第二等分试样,并使用移液管移除下层载体相。将等体积的早期处理过的载体相引入到样品中,以替换移除的未处理载体相。第三等分试样保持不变。然后将第二和第三等分试样转移到部分密封的容器中,该容器允许容器与其周围环境之间的气体渗透。两个容器都放置在环境可控的co2培养箱中,该培养箱设置为包含5%的co2/空气混合物、95%的湿度和37℃的设定温度。将等分试样温育24小时。
23.然后将这些等分试样从培养箱中取出,并以与参考等分试样相同的方式引入血细胞计数器进行检查和分析。然后可以在不同的油处理之间比较温育后细胞群分布的变化(细胞增殖的特征)。
24.图1比较了相对于在0小时和24小时没有油的水合的基线测量下,培养24小时后获得的结果。细胞生长在这里表示为包含一个以上细胞的液滴的分数。将看到,相对于基线细胞生长,当油用细胞培养基水合时发生改善。
25.实施例2(反应性)
26.连续水合油相是通过将按重量计99份轻质矿物油与1份聚乙二醇化表面活性剂混合制备的。将油置于旋转器上过夜以充分混合油和表面活性剂。水合油是通过将5份油与3份水性水合相混合而制备的,水合相由与分散乳液相中使用的相同盐水缓冲液组成或仅由水组成。混合物在50℃下旋转过夜,然后在70℃下旋转60分钟。使乳液静置15分钟。将乳液的上部等分,然后将等分试样离心以调节油的水合水平,离心时间越长,水合水平越低。水合水平使用卡尔费希尔滴定仪测量。一旦达到正确的水合水平,通常为500
‑
1000ppm,将等分试样的上清液移入新管中,将其冷冻备用。
27.通过将按体积计8份油(水合或未水合)与1份分散水相混合,然后在涡旋混合器上混合5分钟,并以400rpm离心1分钟来制备液滴的多分散乳液。将混合物的上半部分移入新管中,离心5秒。从管底部吸取乳液以供进一步使用。
28.对于酶促活性的测量,上述分散水相由先前描述并在ep3013987中示例的单个核苷酸检测化学物质组成。
29.为了测量荧光强度,将乳液夹在由与平均乳剂液滴尺寸相对应的间隔物隔开的两个透明基片之间。在用适当波长范围的光激发后,从每个乳液液滴发出的荧光信号与从乳液的明场图像收集的液滴直径一起测量。
30.图2中以柱状图形式呈现的数据显示了6um液滴的平均荧光强度,这些液滴在未水合的油中(“无水油”)、与水水合的油(“仅水”)或用三倍液滴的缓冲液浓度水合的油中(“3x缓冲液”)温育。在没有水合的油中温育的液滴显示出在背景之上非常低的强度,对于这些
样品,大约为1000个计数。与在没有水合的油中温育的液滴相比,那些在与水水合的油中温育的液滴显示出增加的强度。在用三倍缓冲液浓度水合的油中温育液滴显示平均强度进一步增加。这表明两种油水合都可用于维持这些液滴中的酶促反应性。
31.实施例3(液滴尺寸效应)
32.微滴沉积在浸没在连续油相中的基片上,例如如先前在读者所涉及的ep3008207中所述。
33.连续水合油相是通过将按重量计99份石蜡油与1份聚乙二醇化表面活性剂混合制备的。将油置于旋转器上过夜以充分混合油和表面活性剂。水合油是通过将5份油与3份水合水相混合制备的,水合水相由含有或不含有4%甘油的水组成。混合物在50℃下旋转过夜,然后在70℃下旋转60分钟。使乳液静置15分钟。将乳液的上部等分,然后将等分试样离心以调节油的水合水平,较长的离心时间导致较低的水合水平。水合水平使用卡尔费希尔滴定仪测量。一旦达到正确的水合水平,通常为500
‑
1000ppm,将等分试样的上清液移入新管中,将其冷冻直到使用。
34.分散水相由含有或不含4%甘油的水组成。沉积的液滴在70℃下进行115分钟的温育循环。然后从明场显微镜图像测量乳液液滴直径,并与温育周期之前测量的直径进行比较,以推断液滴收缩或生长。
35.下面提供的数据显示了高温温育步骤后液滴的平均体积变化,分别作为油水合和液滴中甘油百分比的函数。在参考样品中,如果甘油既不存在于油水合中也不存在于液滴中,则液滴通常收缩。如果液滴包含甘油,而油水合不包含甘油,则液滴相对于参照物生长,因为向液滴中添加甘油导致油中的水活度高于液滴中的水活度。当甘油被添加到油水合而不是液滴时,会发生相反的情况。由于与油相比液滴中的水活度更高,所述液滴相对于参照物收缩。这表明液滴的具体含量和油水合可用于控制液滴的收缩和生长。
36.油水合中的甘油%液滴中的甘油%液滴体积变化00
‑
30%(收缩)04+44%(生长)40
‑
51%(收缩)
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1