直流电压控制的带电膜吸附和解吸的方法和设备与流程
1.本发明涉及通常用于物质、生物分子、病毒和细菌的机械拦截的膜,特别是聚合物膜。
背景技术:
2.膜的拦截率由孔大小确定,并且流速由孔隙率、孔站膜基质的比例来确定。
3.所谓的色谱膜从聚合物膜中发展而来。所述色谱膜除了机械拦截特性外具有引起吸附带电物质的附加特性。所述膜具有由通过掺入物质而产生的一定的表面调节特性或色谱特性。
4.在wo00/50161中描述了带正电的膜。由例如聚芳烃、聚砜、聚烯烃、聚苯乙烯、聚酰胺、聚酰亚胺、氟聚合物、聚碳酸酯、聚酯、醋酸纤维素或硝酸纤维素组成的多孔膜基质的表面通过将它们与具有连接的带正电荷的阳离子基团(例如季铵基团)的聚合物结构交联来带电。所述阳离子基团经由共价键结合到膜的聚合物结构处。该所谓的色谱膜具有正电荷,无论待过滤溶液的ph值如何,其都保持带正电。借助这种带正电的表面,可以以吸附的方式结合带负电的生物分子,即例如白蛋白(bsa)。在wo00/50161中描述了基于bsa的结合容量可以达到25mg/ml(ml膜体积)或更高。
5.结合容量可以通过确定吸附物质的量来确定。这例如可以通过由膜过滤并确定在通过膜之前和之后的浓度并确定通过膜的通量来进行。可以以各种已知方式确定浓度。例如,可以以光度法确定浓度。
6.为此,可以使用uv/vis分光光度计,例如aqualytic型号xd7000,其具有:
[0007]-190和1100nm之间的波长范围,1nm的分辨率,光度分辨率:0.001(吸收)和/或0.1%(透射)。
[0008]
例如,经由细毛细管通过测量单元(比色皿)的滤液的在线测量可以在方法正进行的过程中执行,并且由此证实:完全拦住所输送的蛋白质即滤液不含蛋白质多长时间。如果输送具有已知浓度的溶液并确定通过膜的流速,则借此可以确定在发生穿透之前膜可以吸附的量。基于膜体积,这个量特别地是结合容量。
[0009]
在wo00/50160中描述了带负电的膜。由例如聚芳烃、聚砜、聚烯烃、聚苯乙烯、聚酰胺、聚酰亚胺、含氟聚合物、聚碳酸酯、聚酯、醋酸纤维素或硝酸纤维素组成的多孔膜基质的表面通过将它们与具有悬垂带负电的阴离子基团(例如羟基)的聚合物结构交联而带电。所述阴离子基团通过共价键与膜的聚合物结构结合。该所谓的色谱膜具有负电荷,待过滤溶液的ph值如何,其都保持带正电。借助这种负电荷,可以结合带正电的物质或蛋白质。wo00/50161描述了25mg/ml或更高的溶菌酶的结合容量。
[0010]
在au 2014277783 b2中描述了一种膜结构,所述膜结构由两个膜层构成,硅纳米可以以结合成团的方式定位在所述膜层之间。这两个膜层可以带正电或带负电,或者一个带正电而另一个带负电。一定量结合的硅颗粒也可以带有电荷。
[0011]
在这些示例中列出的产品用于分离生物分子。例如,可以将病毒与蛋白质分离。在
此,选择与待获取的蛋白质的等电点相对应的待进行过滤的溶液的ph值。如果该溶液经由带正电的膜过滤,该膜的孔足够大以不机械地拦住蛋白质(例如0.2μm、0.4μm或0.8μm),那么蛋白质会通过该膜,因为蛋白质在等电点处不具有电荷。所有其他在所设定的ph值下带负电的物质(例如病毒)都被吸附结合。蛋白质可以通过这些色谱特性进行纯化。
[0012]
生物分子也可以经由带正电或带负电的膜进行浓缩。在此,目标分子吸附结合,进而从溶液中去除。
[0013]
在进一步的步骤中,通过改变ph值或经由含有大量盐的溶液再次解吸目标分子,这些溶液在目标分子被吸附后被泵送通过膜。这可以逐渐地发生。因此,溶液的含盐量就可以逐渐增加。这意味着带弱电荷的物质最初会被盐离子从膜的接合位点置换。结合更强的其他物质需要更高浓度的盐离子,以便从膜的结合位点脱离。类似地,指示oh或h+离子的浓度的ph值也逐渐地改变,并且用于逐渐地脱离不同电荷强度的吸附分子。经由改变ph值或通过添加大浓度盐分子(例如1摩尔nacl溶液),大量带电离子将目标分子从结合位点置换出来。
[0014]
色谱膜除了机械拦截之外的吸附特定的优点之外,还具有一定缺点。因此,如果添加的化学物质超过所结合的带电分子的现有结合力,则吸附的物质只能再次解吸。这通常通过ph值的显著改变或通过添加高盐溶液来完成。由于离子浓度和强度,结合的分子通过盐离子或氢或氢氧根离子取代。然后,需要冲洗以再次冲洗掉ph值变化或高盐含量,使得可以再次使用膜的色谱特性。附加地,所获得的目标分子溶液也必须被中和和/或去除它们的盐负荷。诸如敏感生物分子的目标分子会因ph值急剧变化或高盐含量而受损。这也限制了色谱膜方法。膜的吸附结合力越大,解吸介质的离子含量就必须越大。然而,过强的酸和碱或盐浓度导致对待分离的生物分子的损坏增加。
[0015]
另一个缺点是结合容量固定直到突破或恢复后终止。如果目标分子溶液的浓度未知,则需要额外的测量方法,例如uv/vis分光光度法或滤液的电导率测量,以避免目标分子突破。
[0016]
对金属膜施加电压也是已知的。但是,为此,必须在有源面上恒定且可靠地施加电压,以实现或支持根据设计方案的过滤效果。此外,例如从ep 3 115 099 a1或wo 2018/122315 a1中还已知将电压施加到金属覆层的聚合物膜上。从ep 0 860 888 a1中还已知用薄金属层涂覆金属膜。
技术实现要素:
[0017]
本发明的目的在于尽可能在没有添加含大量离子的物质,例如酸、碱或盐的情况下,简单且可靠地吸附分子,并且简化在膜处吸附和色谱结合的目标分子的解吸。附加地,另一个目的在于开发可容易测量的值,所述值允许在吸附过程和/或其控制期间指示膜的当前和/或剩余的结合容量。
[0018]
根据本发明,所述目的通过以下方式实现:即在膜上,特别是在化学带电的膜上进行吸附,并且通过物理场、电磁场和/或通过产生电场来实现解吸。这特别地通过将薄金属层施加到带正电或带负电的膜,特别是化学带正电或带负电的膜的一侧或两侧上来实现。这种带电的膜特别地在没有施加电压的情况下具有电荷。特别地,金属层很薄,以至于它几乎不或根本不改变孔隙率,但特别地,该金属层的厚度确保其连续的导电性。优选地,使用
不能被氧化或很难被氧化的金属,例如金、铂、钯。
[0019]
金属层用作可以用直流电压充电的电极。优选地,所施加的直流电压的大小被选择成,使得通过所产生的电场实现吸附结合的分子完全解吸。
[0020]
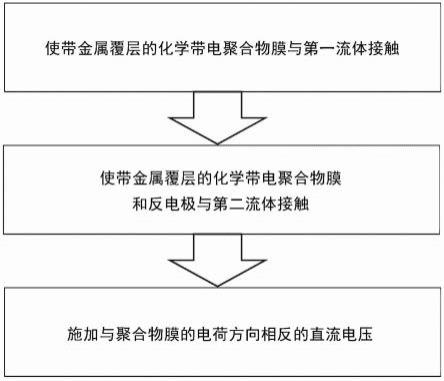
根据该方法,该目的还特别通过一种通过吸附和电吸附进行分离的方法来实现,所述方法包括以下步骤
[0021]
a.提供带电的聚合物膜、特别是化学带电的聚合物膜,所述聚合物膜至少在聚合物膜的第一侧上具有由金属构成的平面多孔的第一覆层,所述第一覆层特别地作为工作电极,并且在膜的另一侧上提供,特别是作为平面多孔的第二覆层的反电极,或者独立于所述膜提供反电极;
[0022]
b.i.使具有平面多孔的金属覆层的带电聚合物膜与至少一种第一流体的反电极接触,特别是流经该膜的至少一种第一流体,该至少一种第一流体特别是具有带电的物质的溶液,以在膜的带电表面(内部和/或外部)处吸附,特别是在没有将附加电压施加在工作电极处的情况下吸附,或在施加同步于膜电荷的电量的电压的情况下吸附以支持吸附过程.
[0023]
b.ii特别是将至少一种带电物质吸附在膜上,特别是在溶液的过滤过程中,特别是直到一定的,特别是预定的结合能力和/或带电膜的预定比例的结合能力已被用于吸附为止,
[0024]
c.将直流电压施加在带电的聚合物膜的金属覆层(工作电极)和反电极之间,特别是直流电压的施加方向与聚合物膜上的电荷方向相反。
[0025]
d.使膜与至少一种第一流体和/或第二流体接触(特别地,流过),该流体特别不含任何用于吸附的生物分子。特别地,反电极也接触与该膜接触的流体。
[0026]
e.特别是控制电压,特别是升高电压,该电压与膜的电荷相反,以确定和,特别是逐步地,解吸至少两种不同的物质,特别是生物分子,特别是具有不同的电荷强度。
[0027]
例如,该体积可以是容器。流体特别是液体和/或特别是溶剂,所述溶剂具有至少一种包含于其中的物质、特别是溶解的物质、特别是分子。例如,第一液体可以是具有蛋白质或肽或核酸的溶液。
[0028]
另一流体特别是液体和/或特别是溶剂、特别是纯溶剂。特别地,第一流体从第一体积中去除,和/或膜从第一体积中去除,和/或第一流体和膜彼此分离。在此,特别是通过排出第一流体和/或冲洗掉流体来实现去除。因此无需完全去除第一流体;残留物在任何情况下都是可以容忍的,但也可以被冲走。
[0029]
但是,第一流体可以与另一流体混合或用其替换。优选地,在排出和必要时冲洗第一流体和/或将膜从第一体积转移到第二体积中之后将另一流体填充到第一体积中,其中第二体积被另一流体填充。
[0030]
特别地,在步骤b中,特别是在b.i和/或b.ii中,发生包含在第一流体中的至少一种物质的吸附。这不是必须的,但可以完全地进行。吸附一部分就会是足够的。在此,特别地吸附基于膜的电荷和/或基于膜的电荷和额外施加的电压而进行。
[0031]
特别是在步骤c、d和/或e中,部分或完全解吸在步骤b中吸附的物质,特别是至少一种物质。在此,解吸发生在第二流体中或发生在由第一和第二流体构成的混合物中。
[0032]
在此,步骤d和/或e也至少在具有平面多孔的金属覆层的带电聚合物膜和反电极
与第一和/或另外的流体,特别是在第一和/或第二体积中接触时进行。步骤d和/或e也可以在步骤c之前开始。
[0033]
为了将先前吸附结合的生物分子解吸,在膜带正电(充电)的情况下,特别是在膜化学上带正电(充电)的情况下,特别是施加直流电压,使得连接到膜上的金属覆层被提供负电压作为工作电极。这例如通过将工作电极与电压源的负极连接并且将反电极与电压源的正极连接来完成。在膜带负电(充电)的情况下,特别是在膜化学上带负电(充电)的情况下,特别是施加直流电压,使得连接到膜的金属覆层被提供正电压作为工作电极。这例如通过将工作电极与电压源的正极连接并且将反电极与电压源的负极连接来完成。
[0034]
特别地,该方法是用于带电分子的色谱分离的方法,特别是离子交换色谱,或简称离子色谱。在此,生物分子主要根据其电荷进行分离。目的是通过根据电荷(分析)分离各个生物分子来实现更好的分离和/或测定,或从溶液中获取特定生物分子作为再生材料。在此,特别地将相同电荷的所获取的生物分子浓缩。例如,包含在第一流体中的至少一种带电物质从第一流体中获取并转移到第二流体中和/或在第一和/或第二流体中浓缩。
[0035]
在膜的两侧的金属覆层中,即在由金属构成的第一和第二覆层中,在所述覆层之间设置有聚合物膜,可以将第一覆层用作工作电极,而第二覆层可以用作反电极。
[0036]
该方法特别有利地被执行为和/或该设备被设计为,使得第一流体在步骤b中、特别是在步骤b.i和/或b.ii中以如下的方式流动:即其从工作电极流到反电极,然后工作电极在上游,反电极在下游。
[0037]
该方法特别有利地被执行为和/或该设备被设计为,使得第一流体在步骤c、d和/或e中以如下的方式流动:即其从工作电极流到反电极。在膜带正电(充电)的情况下,特别是膜在化学上带正电(充电)的情况下,直流电压在步骤b中、特别是在步骤b.i和/或b.ii中特别以如下方式施加:对工作电极供应正的直流电压。这特别在发生吸附过程期间进行。通过带正电的膜进行的吸附过程也可以在没有对工作电极进行电压供应的情况下发生,但可以通过附加的电压来加强。
[0038]
在步骤c、d和/或e期间和/或为了解吸,在膜带正电(充电)的情况下,特别是膜在化学上带正电(充电)的情况下,对工作电极供应负电压。该负电压供应可以例如可以逐步地从-10mv到-3v进行,以便依次解吸电荷不同的生物分子,由此特别地将其分离,特别是分离到不同的第二流体中或分离到不同体积的第二流体中。然而,-3v的电压也可以立即施加到工作电极上,使得所有吸附的生物分子迅速解吸。
[0039]
在膜带负电(充电)的情况下,特别是膜在化学上带负电(充电)的情况下,直流电压在步骤b中、特别是在步骤b.i和/或b.ii中特别地以如下方式施加:即对工作电极(连接到膜的金属覆层)供应负的直流电压。这特别在发生吸附过程期间进行。通过带负电(充电)的、特别是化学带负电(充电)的膜进行的吸附过程也可以在没有对工作电极进行电压供应的情况下发生,但可以通过附加的电压来加强。
[0040]
在步骤c、d和/或e期间和/或为了解吸,对工作电极供应正电压。该正电压供应可以例如可以逐步地从+10mv到+3v进行,以便依次解吸电荷不同的生物分子,由此特别地将其分离,特别是分离到不同的第二流体中或分离到不同体积的第二流体中。然而,+3v的电压也可以立即施加到工作电极上,使得所有吸附的生物分子迅速解吸。
[0041]
该覆层特别是与聚合物膜材料配合地连接和/或直接施加到其上。这可以例如通
过蒸镀或通过磁控溅射来进行。金属层的厚度典型地介于20nm和50nm之间,但也可以介于5nm和200nm之间。
[0042]
特别地,带电的聚合物膜,特别是化学带电的聚合物膜为阴离子或阳离子交换聚合物膜,其中所述聚合物膜具有由金属构成的平面且多孔的覆层。
[0043]
特别地,第一流体在步骤b的开始和步骤c的开始之间穿过膜(过滤)。例如,过滤速度可以在0.01ml/(cm2*min*bar)和40ml/(cm2*min*bar)之间。特别地,过滤进行至少一秒和/或步骤b和/或步骤d分别执行至少1秒,特别是至少30秒。
[0044]
在膜带正电(充电)的情况下,特别是在膜化学上带正电(充电)的情况下,尤其以如下方式施加直流电压:即对工作电极(连接到膜的金属覆层)供应正的直流电压,优点在于:带电(充电)的膜的结合容量可以借助于与膜的电荷相同定向的电压来提高,其中流体首先经过所述工作电极(在上游)。
[0045]
在膜带负电(充电)的情况下,特别是膜在化学上带负电(充电)的情况下,特别以如下方式施加直流电压:即对工作电极(连接到膜的金属覆层)供应负的直流电压,优点在于:带电(充电)的膜的结合容量可以借助于与膜的电荷相同定向的电压来提高,其中流体首先经过所述工作电极(在上游)。
[0046]
优选地,第一和/或第二直流电压的绝对值处于流体不被电解分解的范围内,特别是处于至少10mv,特别地,其绝对值处于10mv至3v的范围内。这对于含水流体特别有利。但是,也可以短暂地,特别最长3秒和/或至少10毫秒地,施加直至50v的较高电压。
[0047]
反电极优选地通过在与第一侧相对地第二侧上的另外的平面多孔的金属覆层形成,其中由金属构成的平面的覆层通过聚合物膜彼此绝缘,或者通过在其间放置绝缘且可渗透的隔离物的可渗透电极形成,特别是由金属网形成。由此,特别是在测量和/或控制电流时,可以进行限定且稳定的布置,其最小化外部影响并且可以以可再现的方式产生。
[0048]
优选使用不能被氧化或很难被氧化的金属用于覆层。因此,使用诸如金、铂或钯的金属。
[0049]
优选地,具有金属覆层的聚合物膜的孔隙率以初始泡点孔和/或平均孔大小计相对于未覆层的聚合物膜减少0.1%和10%之间,特别是减少0.1%和1%之间,和/或金属覆层的厚度处于1到100nm的范围内,和/或未覆层的聚合物膜的孔大小特别处于0.01μm和15μm的范围中。这实现了可靠的金属覆层和物理膜特性的相对较小且恒定的变化。
[0050]
该金属特别是贵金属,特别是金、银和/或铂。
[0051]
有利地,具有由金属覆层的聚合物膜具有多孔通道。对于由聚砜、聚醚砜、聚酰胺等构成的聚合物膜可以是海绵状的。这意味着该孔不是隧道形的通道,而是膜在内部具有孔形的结构和/或通道的壁面积相对于具有相同通道宽度的隧道形的通道提高到至少100倍,尤其至少1000倍。特别地,位于膜内部中的孔至少部分地涂覆有金属覆层,特别是仅部分地用涂覆有金属覆层。由此,可以提高表面活性。
[0052]
有利地,带电的膜,特别是化学带电的膜具有每ml膜体积至少25mg的溶菌酶或白蛋白,特别是bsa的结合容量。可以特别地理解为在一侧或两侧上具有金属覆层的膜可以吸附在每种情况下所提到的这种量的分子。膜体积是膜所具有的体积,其中膜中的孔的体积是体积的一部分并且不被减去。例如,注射器过滤器中使用的圆形膜的直径为25mm,厚度为0.15mm。因此,所述膜具有73.6mm3的膜体积。有利地,该结合容量特别存在于ph3和ph10之
间的整个ph值范围内。
[0053]
该目的还通过一种吸附和/或过滤设备,特别是电吸附和/或电过滤设备来实现,其包含:带电的聚合物膜,特别是化学带电的聚合物膜,该聚合物膜在其至少一侧上具有由金属构成的平面多孔的第一覆层,和尤其作为工作电极的由金属构成的覆层的接触部。此外,该设备具有反电极。特别地,该设备具有由金属构成的第二覆层的接触部作为反电极,所述第二覆层处于膜的与第一覆层相对的一侧上。
[0054]
有利地,所述设备还具有作为参考电极的第三电极。
[0055]
关于覆层、反电极和电压的施加上述内容类似地适用,该设备被设计用于相应地施加电压,特别地,所述设备被设计用于执行该方法并且为此尤其具有相应设计的控制装置,所述控制装置特别被设计用于:控制在电极(由金属覆层形成的工作电极)和反电极之间的电压,和/或控制第一和/或另一流体的流动。
[0056]
有利地,反电极或者通过与第一侧相对的第二侧上的由金属构成的另一平面多孔的覆层形成,或者通过布置成在其间具有绝缘且可渗透的间隔物的可渗透电极形成,特别是由金属网形成。
[0057]
优选地,具有由金属构成的覆层的聚合物膜的孔隙率以初始泡点孔和/或平均孔大小计相对于未覆层的聚合物膜减少0.1%和10%之间,特别是减少0.1%和1%之间,和/或由金属构成的覆层的厚度处于5到100nm的范围内,和/或未覆层的聚合物膜的孔大小处于0.01μm至15μm的范围中
[0058]
有利地,吸附和/或过滤设备具有用于在存在反电极的情况下将直流电压施加到工作电极(由金属构成的覆层)处的设备。
[0059]
为了支持带电(充电)的聚合物膜,特别是化学带电(充电)的聚合物膜的吸附,将工作电极上的直流电压配置成,使得所述直流电压与膜的电荷相同定向。尤其当吸附能力和/或zeta电位因电压而朝远离零的方向变化和/或增加时,和/或当膜带负电的情况下,特别是在膜化学上带负电的情况下工作电极或金属覆层与负极连接,并且膜在带正电的情况下,特别是在膜化学上带正电的情况下工作电极或由金属覆层与正极连接时,电压尤其才是相同定向的。
[0060]
为了从带电(充电)的膜、特别是化学带电(充电)的膜解吸分子,将工作电极上的直流电压配置成,使得所述直流电压与膜的电荷相反。特别当吸附能力和/或zeta电位因电压而朝零的方向变化和/或减小时,和/或当膜带负电的情况下工作电极与电压源的正极连接并且在膜带正电的情况下工作电极与负极连接时,电压尤其才是反向定向的。
[0061]
特别优选地,电吸附和/或电过滤设备呈注射器附件或注射器附件过滤器形式。在此,在没有施加电压的情况下,膜的吸附能力起特别有利的效果。在吸附后,于是可以因施加电压通过解吸所吸附的分子的方式对附件减载。
[0062]
在一侧或两侧涂履有金属覆层的膜可以有利地以与常规聚合物膜相同的方式处理。所述膜既可以在注射器附件过滤器中作为扁平膜进行处理,也可以在胶囊中作为折叠(交叠)膜进行处理。
[0063]
在此,特别接触工作电极,并且该接触经由诸如电线或薄金属箔的设备被向外引导,以便供应电压。借助反电极有利地以同样方式进行,所述反电极或者为在膜的相对置的侧上的第二覆层或者安装在不同的位置处。
[0064]
如此有利的结构运行制造具有两个触点的注射器附件过滤器或胶囊,所述触点(可以)从外部供应电压。
[0065]
该目的还通过一种系统来实现,所述系统由吸附和/或过滤设备和用于解吸的设备构成,所述用于解吸的设备具有:接收设备,所述接收设备用于接收聚合物膜与吸附和/或过滤设备的金属覆层和用于使接收的聚合物膜与吸附和/或过滤设备的金属覆层接触和使反电极与第一流体接触,并且所述系统具有用于在金属覆层和反电极之间施加直流电压的设备,其中反电极或者是吸附和/或过滤设备的组成部分或者是接收设备的组成部分。借助这种设备,可以简单且可靠地实现解吸,其中所述设备特别具有用于用流体冲洗膜的机构。特别地,该设备也可以具有用于测量流体中的至少一种浓度的机构。
[0066]
该目的还通过一种带电的聚合物膜来实现,其具有至少处于聚合物膜的第一侧上的由金属构成的平面且多孔的覆层。关于膜和其(多个)覆层,所有在设备或方法的膜方面描述的有利的设计方案相应地适用。
附图说明
[0067]
图1是示例性和示意性地说明根据本发明的方法的流程图。
具体实施方式
[0068]
金属层(电极)特别借助于磁控溅射或金属蒸镀被直接施加到膜的上侧和/或下侧。还存在如下可行性:仅膜的一侧设有金属层,并且所需的反电极独立于膜而定位在附近。也存在如下可行性:实现具有三个电极的布置,其中第一电极是工作电极,第二电极是反电极,并且第三电极是反电极。
[0069]
本发明涉及带正电或负电的,特别是化学带正电或负电的膜,所述膜具有色谱特性。所述膜用于优选带电的生物分子的色谱分离。通常,这种化学带电的膜由聚酰胺制成,但它们也可以由其他聚合物制成。标准膜典型地具有在0.2μm至0.8μm范围内的孔大小,但也可以具有0.01μm至10μm之间的孔大小。
[0070]
实现更高结合容量的可行性在于:使用典型2至10个膜(fa pall,acrodisc)的多膜堆叠和/或使用增强吸附的电压。
[0071]
特别地,该方法用作膜色谱法,其具有以化学方式在两侧金属覆层的膜,其中两侧彼此绝缘,并用作工作电极(ae)和反电极(ge),特别地,上游侧的覆层用作工作电极,下游侧的覆层用作反电极。
[0072]
膜特别地由多孔聚合物即例如pes或pa构成,其具有0.05至1μm的孔大小和具有100至150μm(10到200μm的范围)的典型的厚度。
[0073]
为了在膜中吸附带负电的分子,将特别工作电极置于正电位,并且将反电极置于负电位。
[0074]
为了在膜中吸附带正电的分子,将特别工作电极置于负电位,并将反电极置于正电位。
[0075]
假设工作电极和反电极之间产生的电场在工作电极区域中将附加的吸引交互作用作用于带电分子,并且在反电极的区域中将排斥交互作用作用于带点分子。
[0076]
可以通过串联设置多个膜,例如2至10个膜来增加结合容量典型的吸附参数是:
[0077]
·
跨膜通量,特别是单层膜布置的情况下,在1到50ml/(cm2*bar*min)之间;
[0078]
·
特别是在+1到+10v的范围内的负分子的情况下,在电极和反电极之间有利吸附的电位差在+0.1到30v的范围内。
[0079]
·
在正分子的情况下,在电极和反电极之间的用于吸附的有利的电位差为-0.1至-30v,特别是-1至-10v。
[0080]
吸附分子的脱离和回收可以仅通过所描述的电位变化引起,并且不需要盐化或ph值变化
[0081]
先前结合的分子的解吸和洗脱尤其发生在交换一定体积的第一流体或经过一定体积的第一流体和/或从一定体积的第一流体中吸附之后,其中该体积小于10倍的膜体积,由此可以实现以下有利的特性:
[0082]
·
更快的回收,即更短的处理时间
[0083]
·
扩散过程的较小的干扰作用
[0084]
·
比不施加相同定向的电压的分子浓度更高
[0085]
·
滤液不含较高浓度的干扰性的电解质(h+、oh-、kcl、nacl)
[0086]
·
吸附和解吸的过程引起》95%的高回收率
[0087]
·
吸附和解吸的过程可以和/或仅通过电位改变来重复,特别是改变至少10次,特别是至少20次
[0088]
所描述的可切换膜色谱设备的布置可用于通过以下方式分离具有不同等电点的分子类型:
[0089]
·
工作电极和反电极之间的电场通过直流电压设置,使得
[0090]
·
固定相的吸引交互作用对于分子类型1大于分子类型2,使得
[0091]
·
对分子类型1实现比对分子类型2更大的保留
[0092]
·
示例:在iep(等电点)《7的分子类型1和iep》7的分子类型2的情况下,借助仅一个膜在两侧金属化且ph为7
[0093]
·
在工作电极(正)和反电极(负)之间的正电位差的情况下,可以结合分子类型1,并且洗脱分子类型2
[0094]
·
在工作电极(负)和反电极(正)之间的负电位差的情况下,可以结合分子类型2,并且洗脱分子类型1
[0095]
在吸附阶段中,根据分析物和电解质浓度、电极直流电压、膜类型、浓度和流速(进给速度),在工作电极和反电极之间的典型电流可以在0.001到1ma/cm2膜面积的范围内测量。
[0096]
在解吸阶段中,根据分析物和电解质浓度、电极直流电压、膜类型、浓度和流速(进给速度),在工作电极和反电极之间的典型电流尤其高于在吸附时的电流,并且特别处于-0.01至-10ma的范围中。
[0097]
特别在物质浓度超过10e-5mol/l的情况下,测量的电极电流和每单位时间吸附或解吸分子的量(质量传输)之间存在相关性。
[0098]
因此,可以将测量的电极电流用于记录吸附或解吸分子的量。因此可以控制膜负载,使得在吸附阶段中不造成穿透或通流和/或吸附在穿透之前停止。因此,解吸阶段可以被设计成,使得在期望的回收时停止通流和/或解吸。
[0099]
有利的设计方案是:
[0100]
·
膜在两侧用0到100nm的au覆层,和/或
[0101]
·
膜孔大小(典型的孔径,截面):1至1000nm,和/或
[0102]
·
孔隙率:10-95%,和/或
[0103]
·
膜厚度或膜体积/有效过滤面积(cm):0.005至0.20cm(单膜堆叠至多重堆叠,其中n=1至n=10),和/或
[0104]
·
进料中的物质浓度:10e-10mg/ml(内毒素)至10mg/ml(蛋白质),和/或
[0105]
·
每cm2有效过滤面积的进料速率:0.1至10ml/(cm2*min),和/或
[0106]
·
每cm2有效过滤面积的传质速率:10e-11至100mg/(cm2*min),和/或
[0107]
·
电解质浓度nacl或kacl:0至10mmol/l,和/或
[0108]
·
分析物分子的斯托克斯半径:1至20nm,和/或
[0109]
·
分子量:100至1000000g/mol,和/或
[0110]
·
不带电或带正电的膜和电极直流电压(工作电极-反电极),v》0v,和/或
[0111]
·
不带电或带负电的膜和电极直流电压(工作电极-反电极),v《0v
[0112]
此外,所描述的方法实现通过电极和反电极之间的电场的相加效应来提高聚合物膜的结合容量(100%至1000%)。
[0113]
所描述的方法实现色谱分离,特别地
[0114]
·
通过如下方式在具有正工作电极直流电压的带正电的膜片上的带正电和带负电的分子的分离:在膜表面处吸附带负电的分子,带正电的分子通过膜传输
[0115]
·
通过如下方式在具有正工作电极直流电压的带正电的膜片上的带负电和带正电的分子的分离:在膜表面处吸附带正电的分子,带负电的分子通过膜传输
[0116]
·
在电极直流电压极性反转后,相应拦截的类型分子的洗脱
[0117]
·
当多个可电切换的单个膜串联堆叠或多个单个模块串联连接时,分离性能(结合容量、不同分子的分离)得到提高
[0118]
·
在多个串联的膜的情况下,将不同的电极直流电压用于至少两个膜、特别用于每个膜或用于每组膜
[0119]
与基于离子交换的传统的色谱膜相比,所描述方法通过如下方式实现更高的物质转移速率(每时间单位和每有效膜床体积的流体体积和分析物分离的量):即增加有效电场、结合力进而增加结合容量。由此,可以纯化或分离较高浓度的活性物质溶液。
[0120]
因此,本发明实现许多其他优点:
[0121]
·
由此,扩散效应对于占据自由表面结合位点中的作用比在纯离子色谱中的作用小
[0122]
·
由此,现有的膜孔可以更有效地且多层地用吸附分子填充
[0123]
·
因此,与没有电位控制的类似结构相比,具有一个或几个堆叠膜的膜布置可以实现更高的结合容量
[0124]
·
由此,在结合容量相同的情况下,跨膜阻力更低
[0125]
·
由此,在给定流速和分子浓度的情况下,每个膜的动态结合容量比在纯离子交换的情况下更接近静态结合容量
[0126]
·
由此实现更高的流速和更短的分离持续时间
[0127]
·
特别是在高导电金属覆层的条件下,例如由金制成的覆层,特别在两侧的金属覆层并且将两个覆层用作为电极和反电极的条件下,测量的电极电流(在工作电极和反电极之间)与如下参数相关:
[0128]
·
有效的膜面积或膜床体积
[0129]
·
电极间距
[0130]
·
基础电解质浓度
[0131]
·
进料中的分子的浓度和有效净电荷
[0132]
·
流速
[0133]
因此,所测量的电极电流与每单位时间吸附的带电分子的数量相关。因此,在所描述的方法中的电流测量实现对剩余的结合容量的检测和控制。借此,可以控制关于稍后突破的流入,并且特别是使用这种控制。因此可以实现膜的高效和有效的负载
[0134]
所描述的方法实现带电分子的解吸
[0135]
·
无盐浓度(典型地为1m nacl或kcl的数量级)
[0136]
·
对于带负电的分子,没有ph移动到ph《4,对于带正电荷的分子,没有ph移动到ph》10
[0137]
·
具有(活性物质)分子的所得出的过滤物不含或含有少量(典型地为1mmol/l nacl或kcl或更少)的离子
[0138]
·
具有(活性物质)分子的所得出的过滤物可以具有适中的ph值,特别是在6至8范围内的ph值
[0139]
·
所描述的方法实现集中释放结合在膜中的分子,即洗脱体积典型地仅为几(特别是直至10个)膜体积或交换体积,特别地
[0140]
·
对于带负电的分子,通过从正电位跳到负电位(工作电极-反电极)
[0141]
·
对于带正电的分子,通过从负电位跳到正电位(工作电极-反电极)
[0142]
由此实现了以下分离特性:
[0143]
·
电位切换后保留时间短
[0144]
·
回收体积非常低
[0145]
·
与纯离子色谱法相比,回收速率更高
[0146]
·
相对于起始溶液,滤液的高浓缩,特别是1至1000倍,特别是大于10倍
[0147]
·
可以通过增加通流量、特别是相对于吸附起始流量的10倍的通流量来加速解吸
[0148]
·
工作电极和反电极之间的测量电流可用于控制回收过程,其中所述测量电流与解吸速率相关。
[0149]
所描述的方法通过以下方式实现重复吸附和解吸带电分子:
[0150]
·
无需对膜进行化学再生以恢复自由的膜表面
[0151]
·
原始结合容量的》90%的结合容量和分子通过电位切换进行的相应的回收,所述电位交换特别进行至少10次,即吸附和解吸在相同的膜处特别发生至少10次,特别是彼此紧接进行
[0152]
示例1:
[0153]
选择市售的化学带正电(充电)的膜(膜1,制造商为pall corp.商品名mustang膜)作为与市售的另一制造商的设有电子的带正电的膜(膜2)的对比。两种膜均由聚酰胺制成,
并具有相对于白蛋白相似的结合容量。执行了bsa的吸附和解吸实验:
[0154]
市售的膜1实现了每ml膜体积60mg的bsa的结合容量。设有由金构成的40nm的两侧的金属层的膜2实现每ml床体积100mg的bsa的结合容量。差异可以通过不同制造商的不同产品来解释。
[0155]
在膜1上的吸附的bsa借助用1摩尔盐溶液再次解吸。恢复率在95%和96%之间。
[0156]
通过在膜的上侧(上游)施加-3伏的负直流电压来解吸膜2上的吸附的bsa。反电极位于膜的下侧(下游)。恢复率在95%和96%之间。
[0157]
示例2:
[0158]
对相同的正电充电的膜(膜1,制造商pall corp.,商品名mustang膜)设有由金构成的两侧的金属层,并且自行借助白蛋白的吸附和解吸的实验。在此,为了吸附施加a.+2伏和b.+3伏的直流电压。在用a.+2伏的实验中,可以每ml吸附120mg的bas,并且在借助b.+3伏的直流电压可以吸附161g bsa/ml。因此,相对于没有正直流电压的膜2(示例1),在+2伏的直流电压下可以多吸附20%的bsa,并且在+3伏的正直流电压下可以多吸附60%的bsa。这意味着通过施加在金属层上的附加整直流电压,可以将化学带正电的膜的结合容量提高多达60%。
[0159]
此外,在实验期间测量电流。在用a.+2伏实验的情况下,在bsa吸附开始时测量到2ma的电流。所述电流随着时间的推移连续下降直到突破,并且在达到结合容量时为0ma。在用b.+3伏实验的情况下,在bsa吸附开始时测量到8ma的电流。所述电流随着时间的推移连续下降直到突破,并且在达到结合容量时为0ma。这意味着电流可以用于结合容量的利用率的测量变量。在两个实验(a和b)中,bsa分子的解吸经由将直流电压切换到-3伏来进行。bsa分子的恢复率在95%和96%之间。
[0160]
示例表明,根据本发明,在化学带正电的膜处吸附的生物分子(bsa)可以借助于施加负直流电压再次解吸。
[0161]
此外,相对于使用仅化学带正电的膜,通过附加地施加介于+2伏和+3伏之间的正直流电压,可以将化学带正电的膜的结合容量提高多达60%。
[0162]
此外,令人惊讶的是,在化学带正电的膜的吸附期间,电极(膜上侧和膜下侧)之间的电流可以用作为用于结合容量的利用率的测量变量和/或用于剩余的结合容量的测量变量,其中所述化学带正电的膜经由在膜上施加的金属层供应直流电压。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1