高效药物筛选的微流控芯片
1.本发明涉及药物筛选领域,特别涉及一种高效药物筛选的微流控芯片。
背景技术:
2.在新药研发过程中,药物筛选是对可能作为药物使用的物质采用适当的方法,检测其可能存在的药理活性,为开发新药提供试验数据,恰当的药物筛选策略能提高筛选的效率,缩短新药的开发周期。
3.基于微流控芯片的高通量药物筛选技术由于其快速、高效等特点,现在被广泛用于药物的初步筛选。微流控芯片在细胞水平药物筛选方面具有许多独特优势,例如微流控芯片操作所需的细胞量、药物很少,适合来源稀缺的细胞或是价格昂贵的药物的研究;微流控芯片能够通过流道结构的设计,便利地生成多种浓度梯度,从而研究药物浓度与效果的关系。相比于传统实验操作中需要人工配置多种浓度的药物而言,采用微流控芯片生成浓度梯度具有显著的优势。
4.目前微流控芯片中普遍采用的浓度梯度生成结构是“圣诞树”结构及其变形结构,其基本原理是:当存在浓度差的两种流体通过设计好的微通道网络,溶液经过多次重复地分离、混合后,每个支路包含不同比例的原溶液,最终在圣诞树形的网络结构底部形成浓度梯度。例如专利cn113171807a公开的一种浓度梯度与细菌检测一体化的微流控芯片及其设计方法、cn206502830u公开的一种溶液梯度产生和细胞培养微流控芯片、cn105080627a公开的一种用于药物筛选的集成化微流控芯片及其应用方法,这些均是采用“圣诞树”结构或其变形结构来生成浓度梯度。但这种结构存在一些缺陷:一方面,其通过多个“圣诞树”层数实现多个浓度梯度的形成,每增加一层,该层中会增加1
‑
2个流道单元,从而增加1
‑
2个浓度梯度,例如,第一层一般为3个流道单元,从而具有3个浓度,第二层为4
‑
5个流道单元,从而具有4
‑
5个浓度,通过增加流道单元来增加浓度梯度数量,但其结构的原理是通过上层的几个不能浓度的溶液进行混合来新增若干个浓度,为保证较均匀的浓度梯度,每层增加的流道单元不能超过一定数量,所以,为获得较多的浓度梯度,会需要较多的层数。例如,当需要8
‑
9个浓度梯度时,通常至少需要4层(例如专利cn113171807a包括4层,能生成6个浓度;专利cn206502830u包括4层,能生成8个浓度;专利cn105080627a包括6层,能生成8个浓度)。这样导致流道冗长,浓度梯度生成效率低。另一方面,每个流道单元中通常时采用迂回弯折的流道结构(如s形流道结构)来实现两种液体的混匀,层数高、流道单元多,导致整个流道结构中存在众多迂回弯折的流道结构,这会使得流道阻力大大增加,流道长度成倍增长,从而会进一步降低液流速度,降低浓度梯度的形成效率,且还会导致因药物粘附流道壁而造成的药物损失增加。
5.所以,现在有必要对现有方案进行改进,以提供更为可靠的适用于药物筛选的微流控芯片。
技术实现要素:
6.本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种高效药物筛选的微流控芯片。
7.为解决上述技术问题,本发明采用的技术方案是:一种高效药物筛选的微流控芯片,包括:芯片本体以及形成于所述芯片本体内的微流道结构,所述微流道结构包括位于所述芯片本体上游的浓度梯度生成单元、位于所述芯片本体下游的细胞进样单元、与所述浓度梯度生成单元的下游连通的混合单元以及连通于所述混合单元和细胞进样单元之间的细胞培养单元;
8.所述浓度梯度生成单元包括梯度生成结构和浓度配置结构,所述梯度生成结构包括进药口、与所述进药口连通的第一分配腔、与所述第一分配腔连通的第一分配通道组以及与所述第一配通道组连通的若干个第二分配通道组。
9.优选的是,所述第一分配通道组包括n个沿y方向依次间隔布置的第一分配通道,所述第一分配通道与x方向平行,所有所述第一分配通道的长度相等,且由第一个向第n个,所述第一分配通道的通道容积依次增大;
10.每一个所述第一分配通道的下游连通一个所述第二分配通道组,每一个所述第二分配通道组包括通过一个第二分配腔与一个第一分配通道连通的m个第二分配通道,所述第二分配通道与x方向平行,所有所述第二分配通道的长度相等,且在同一个第二分配通道组中,由第一个向第m个,所述第二分配通道的通道容积依次增大;
11.所述混合单元包括沿y方向依次间隔布置的n*m个混合结构,所述细胞培养单元包括沿y方向阵列设置的n*m个细胞培养腔;
12.所述浓度配置结构包括配置液入口以及与所述配置液入口连通的n*m个沿y方向阵列设置的配置液通道,每个所述配置液通道的长度和通道容积均相等,一个所述配置液通道和一个所述第二分配通道共同与一个所述混合结构连通,然后再与一个所述细胞培养腔连通;
13.其中,n、m均不小于2,候选药物通过所述进药口进入,然后依次由所述第一分配通道和第二分配通道进行流量分配,使得单位时间内进入所述混合结构中的候选药物的流量由第一个向第n*m个依次增大,再通过所述配置液通道向n*m个混合结构中等流量输送一定量的配置液,最终使得由第一个向第n*m个混合结构中的候选药物的浓度依次增大。
14.优选的是,所述第一分配腔的包括相互连通的第一v形腔段和第一矩形腔段,所述第一v形腔段与所述药物进样口连通,所述第一矩形腔段与所述第一分配通道的上游连通;
15.所述第二分配腔的包括相互连通的第二v形腔段和第二矩形腔段,所述第二v形腔段与所述第一分配通道的下游连通,所述第二矩形腔段与所述第二分配通道的上游连通。
16.优选的是,所述芯片本体包括主芯片本体以及设置在所述主芯片本体上的副芯片本体,所述梯度生成结构、细胞进样单元、混合单元以及细胞培养单元均形成于所述主芯片本体内,所述浓度配置结构形成于所述副芯片本体内。
17.优选的是,所述混合结构包括呈锥体状的第一混合腔、设置在所述第二混合腔的上端中间的第一混合通道、与所述第一混合腔通过第二混合通道连通的呈锥体状的第二混合腔、与所述第二混合腔的上端中间连通的第三混合通道以及与所述第二混合腔的上端外周切向连通的第四混合通道,所述第四混合通道的出口端汇集至所述第三混合通道,所述
第三混合通道的出口端连通至所述细胞培养腔。
18.优选的是,所述第二分配通道的出口端与所述第一混合腔的上端外周切向连通,所述配置液通道的出口端与所述第一混合通道连通;
19.所述第二混合通道的入口端与所述第一混合腔的下端外周切向连通,所述第二混合通道的出口端与所述第二混合腔的下端外周切向连通;
20.以一条与x方向平行且同时通过第一混合腔的中心线和第二混合腔的中心线为参照线观察,所述第二分配通道、第二混合通道以及第四混合通道均处于该参照线的同一侧。
21.优选的是,所述第三混合通道的末端具有第一扩口段,所述第一扩口段与所述细胞培养腔的侧部连通;
22.所述第三混合通道内设置有单向阀,所述单向阀位于所述第四混合通道的出口端和第一扩口段之间。
23.优选的是,所述单向阀包括对称设置的两阀片,所述阀片包括连接在所述第三混合通道的内壁上的弧形状的弹性部以及与所述弹性部连接的直线状的封闭部,所述弹性部相对于所述封闭部更远离所述细胞培养腔;
24.当所述第三混合通道内无液体流动或液体的流动方向为由封闭部朝向弹性部时,两阀片的封闭部之间保持接触,两阀片封闭所述第三混合通道;
25.当所述第三混合通道内的液体的流动方向为由弹性部朝向封闭部时,两阀片的弹性部弯曲,两阀片的封闭部之间相互脱离,所述单向阀打开。
26.优选的是,两阀片的两封闭部的表面上,其中一个设置有锯齿状凸起,另一个设置有与所述锯齿状凸起配合的锯齿状凹槽。
27.优选的是,记第i个第一分配通道的通道容积为u
i
,第j个第二分配通道的通道容积为v
j
,其中,i=1,2,...,n,j=1,2,...,m;
28.则第一分配通道的通道容积和第二分配通道的通道容积的设置满足:
[0029][0030]
变形后为:v
m
*u
i
‑1<v1*u
i
。
[0031]
优选的是,所述细胞进样单元包括细胞进样口、与所述细胞进样口连通的细胞总通道以及与所述细胞总通道均连通的n*m个细胞分支通道,每一个细胞分支通道通过一个第二扩口段对应连通至一个所述细胞培养腔。
[0032]
本发明的有益效果是:
[0033]
本发明通过流道容积的设计,使得单位时间内的候选药物的流量具有一定的梯度、而配置液则保持等量,两种溶液混合后能够形成一系列浓度的候选药物溶液;本发明中,通过一层或两层流道结构即可获得大量的浓度梯度,先通过形成候选药物的流量梯度再形成浓度梯度,所以在形成候选药物的流量梯度的过程中不需要考虑两种溶液的均匀混合,故不局限于传统的“逐层增加”的方式,流道结构层数能大大减少;
[0034]
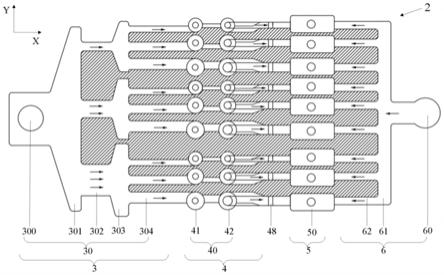
本发明中采用独立的混合单元对具有流量梯度的候选药物和等量分配的配置液进行混合,其中的混合结构能够实现两种流体的三次混合,从而能够保证两种流体充分混合,同时避免了采用冗长的曲折流动,可大大提高流体流速,提高混匀效率,从而最终能提高浓度梯度生成效率,且还能减小后续药物的损失;
[0035]
本发明的微流控芯片能够快速生成多种浓度梯度,可提高药物筛选效率,减少药物浪费。
附图说明
[0036]
图1为本发明的主芯片本体上的微流道结构的结构示意图;
[0037]
图2为本发明的微流道结构的结构示意图;
[0038]
图3为本发明的主芯片本体的结构示意图;
[0039]
图4为本发明的副芯片本体的结构示意图;
[0040]
图5为本发明的一个第二分配通道组的结构示意图;
[0041]
图6为本发明的实施例1中的理论上的浓度梯度曲线;
[0042]
图7为本发明的实施例1中生成的美罗培南溶液的浓度梯度曲线;
[0043]
图8为本发明的实施例2中的微流道结构的剖面结构示意图;
[0044]
图9为本发明的实施例2中的混合结构的结构示意图;
[0045]
图10为本发明的实施例2中的混合结构的俯视图;
[0046]
图11为本发明的实施例3中的一种单向阀的结构示意图(闭合);
[0047]
图12为本发明的实施例3中的一种单向阀的结构示意图(打开);
[0048]
图13为本发明的实施例3中的另一种单向阀的结构示意图(闭合);
[0049]
图14为本发明的实施例3中的另一种单向阀的结构示意图(打开)。
[0050]
附图标记说明:
[0051]
1—芯片本体;10—主芯片本体;11—副芯片本体;
[0052]
2—微流道结构;
[0053]
3—浓度梯度生成单元;
[0054]
30—梯度生成结构;300—进药口;301—第一分配腔;302—第一分配通道组;303—第二分配腔;304—第二分配通道组;3010—第一v形腔段;3011—第一矩形腔段;3020—第一分配通道;3030—第二v形腔段;3031—第二矩形腔段;3040—第二分配通道;
[0055]
31—浓度配置结构;36—配置液入口;37—配置液通道;
[0056]
4—混合单元;40—混合结构;41—第一混合腔;42—第一混合通道;43—第二混合通道;44—第二混合腔;45—第三混合通道;46—第四混合通道;47—第一扩口段;48—单向阀;480—阀片;481—弹性部;482—封闭部;483—锯齿状凸起;484—锯齿状凹槽;485—密封片;486—限位块;
[0057]
5—细胞培养单元;50—细胞培养腔;51—第二扩口段;52—废液口;
[0058]
6—细胞进样单元;60—细胞进样口;61—细胞总通道;62—细胞分支通道。
具体实施方式
[0059]
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
[0060]
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它结构或其组合的存在或添加。
[0061]
参照图1
‑
5,本实施例的一种高效药物筛选的微流控芯片,包括:芯片本体1以及形
成于芯片本体1内的微流道结构2,微流道结构2包括位于芯片本体1上游的浓度梯度生成单元3、位于芯片本体1下游的细胞进样单元6、与浓度梯度生成单元3的下游连通的混合单元4以及连通于混合单元4和细胞进样单元6之间的细胞培养单元5;
[0062]
浓度梯度生成单元3包括梯度生成结构30和浓度配置结构31,梯度生成结构30包括进药口300、与进药口300连通的第一分配腔301、与第一分配腔301连通的第一分配通道组302以及与第一配通道组连通的若干个第二分配通道组304;
[0063]
第一分配通道组302包括n个沿y方向依次间隔布置的第一分配通道3020,第一分配通道3020与x方向平行,所有第一分配通道3020的长度相等,且由第一个向第n个,第一分配通道3020的通道容积依次增大;
[0064]
每一个第一分配通道3020的下游连通一个第二分配通道组304,每一个第二分配通道组304包括通过一个第二分配腔303与一个第一分配通道3020连通的m个第二分配通道3040,第二分配通道3040与x方向平行,所有第二分配通道3040的长度相等,且在同一个第二分配通道组304中,由第一个向第m个,第二分配通道3040的通道容积(也即横截面积)依次增大;
[0065]
混合单元4包括沿y方向依次间隔布置的n*m个混合结构40,细胞培养单元5包括沿y方向阵列设置的n*m个细胞培养腔50;
[0066]
细胞进样单元6包括细胞进样口60、与细胞进样口60连通的细胞总通道61以及与细胞总通道61均连通的n*m个细胞分支通道62,每一个细胞分支通道62通过一个第二扩口段51对应连通至一个细胞培养腔50。
[0067]
浓度配置结构31包括配置液入口36以及与配置液入口36连通的n*m个沿y方向阵列设置的配置液通道37,每个配置液通道37的长度和通道容积均相等,一个配置液通道37和一个第二分配通道3040共同与一个混合结构40连通,然后再与一个细胞培养腔50连通;
[0068]
其中,n、m均不小于2,候选药物通过进药口300进入,然后依次由第一分配通道3020和第二分配通道3040进行流量分配,使得单位时间内进入混合结构40中的候选药物的流量由第一个向第n*m个依次增大,再通过配置液通道37向n*m个混合结构40中等流量输送一定量的配置液,最终使得由第一个向第n*m个混合结构40中的候选药物的浓度依次增大。
[0069]
在本发明中,由第一分配腔301分配到n个第一分配通道3020中的候选药物的流量与第一分配通道3020的通道容积呈正比例关系,即通道容积越大,其中分配的候选药物流量越多;同样的,就同一个第二分配通道组304而言,由第二分配腔303分配到m个第二分配通道3040中的候选药物的流量与第二分配通道3040的通道容积也呈正比例关系,通道容积越大,其中分配的候选药物流量越多。
[0070]
理论上,压差一定时,截面积越大流量就越大,所以对于相同长度的通道而言,通道容积越大流量就越大。考虑通道尺寸、单位管长阻力等因素,流量在多个支通道中的分配的计算方式有多种,但均能满足流量与通道容积呈正比的关系。
[0071]
在一种实施例中,第一分配通道3020和第二分配通道3040可均为圆形,或者均为矩形。
[0072]
本实施例中,记第i个第一分配通道3020的通道容积为u
i
,第j个第二分配通道3040的通道容积为v
j
,其中,i=1,2,...,n,j=1,2,...,m;
[0073]
第一分配通道3020的通道容积和第二分配通道3040的通道容积的设置满足:
[0074][0075]
变形后为:v
m
*u
i
‑1<v1*u
i
。
[0076]
上述条件的目的是:使得后一个第二分配通道组304中的第一个第二分配通道3040(第i个第二分配通道组304中第1个)内的候选药物流量大于前一个第二分配通道组304中的最后一个第二分配通道3040(第i
‑
1个第二分配通道组304中第m个)内的候选药物流量,从而使得在所有的第二分配通道组304中,满足由第1个想第n*m个第二分配通道3040内的候选药物流量保持依次递增。
[0077]
参照图1,本发明中,从上至下的n个第一分配通道3020的通道容积依次增大,所以在单位时间内,进入每个第一分配通道3020的候选药物流量由上至下依次增多,此处为候选药物流量的第一次分配;
[0078]
在每一个第二分配通道组304中,从上至下的m个第二分配通道3040的通道容积也依次增大,所以在同一个第二分配通道组304中,进入每个第二分配通道3040的候选药物流量从上至下也依次增多,此处为候选药物流量的第二次分配;
[0079]
从而通过对第一分配通道3020、第二分配通道3040的通道容积的尺寸设置,能够使得在单位时间内,从上至下的n*m个第二分配通道3040中流出的流量依次增大,在通过n*m个配置液通道37等流量输送n*m路配置液,从而可以在n*m个混合结构40中得到n*m种浓度由上至下依次增大的候选药物溶液,实现一定浓度梯度候选药物的生成。
[0080]
为了便于理解,以下采用具体的公式再对浓度梯度形成的原理进行说明。
[0081]
为方便表述,记输入的候选药物的浓度为1个单位浓度(例如1mol/l),所有第二分配通道3040中候选药物浓度相同,单位时间内,第k个第二分配通道3040中流出的流量为q
k
,第k+1个第二分配通道3040中流出的流量为q
k+1
,q
k+1
=q
k
+δ
k
,由于流量是依次增加的,所以显然δ
k
>0;
[0082]
单位时间内每个配置液通道37内流出的配置液的流量为v
p
;
[0083]
则在该单位时间中,充分混匀的状态下,第k个第二分配通道3040流出的候选药物与配置液混匀后的候选药物浓度为:
[0084]
记为第k组候选药物浓度;
[0085]
第k+1个第二分配通道3040流出的候选药物与配置液混匀后的候选药物浓度为:
[0086]
记为第k+1组候选药物浓度;
[0087]
上述q
k
、q
k+1
、v
p
单位相同;
[0088]
可以看出必然满足:c
k+1
>c
k
(正分数,分子分母同时加一个正数δ
k
,该分数值变大);
[0089]
以下给出具体的推导过程:
[0090][0091]
即第k+1组候选药物浓度大于第k组候选药物浓度,所以能够满足在n*m个混合结
构40中得到n*m种选药物的浓度由上至下依次增大。
[0092]
需要理解的是,该浓度生成过程是一个稀释的过程,所以得到的候选药物浓度是在0
‑
1单位浓度之间。即若将输入的候选药物的浓度为c0,则得到的候选药物浓度c为:所以0<c<c0。
[0093]
且其中,配置液是用于稀释候选药物,以配置得到一定浓度梯度候选药物。且通过调整配置液的输出量v
p
,能够获得不同浓度梯度范围的候选药物溶液。
[0094]
配置液可以为与候选药物的溶剂相同的溶液,或是为细胞培养基溶液,或是去离子水,或是生理盐水,或其他不会影响细胞培养且与候选药物不存在干扰的溶液。
[0095]
目前微流控芯片中普遍采用的浓度梯度生成结构30是“圣诞树”结构及其变形结构,其基本原理是:当存在浓度差的两种流体通过设计好的微通道网络,溶液经过多次重复地分离、混合后,每个支路包含不同比例的原溶液,最终在圣诞树形的网络结构底部形成浓度梯度。该结构存在一些缺陷:其通过多个“圣诞树”结构或其变形结构来生成浓度梯度。但这种结构存在一些缺陷:一方面,其通过多个“圣诞树”层数实现多个浓度梯度的形成,每增加一层,该层中会增加1
‑
2个流道单元,从而增加1
‑
2个浓度梯度,例如,第一层一般为3个流道单元,从而具有3个浓度,第二层为4
‑
5个流道单元,从而具有4
‑
5个浓度,通过增加流道单元来增加浓度梯度数量,但其结构的原理是通过上层的几个不能浓度的溶液进行混合来新增若干个浓度,为保证较均匀的浓度梯度,每层增加的流道单元不能超过一定数量,所以,为获得较多的浓度梯度,会需要较多的层数。例如,当需要8
‑
9个浓度梯度时,通常至少需要4层;这样导致流道冗长,浓度梯度生成效率低。另一方面,每个流道单元中通常时采用迂回弯折的流道结构(如s形流道结构)来实现两种液体的混匀,层数高、流道单元多,导致整个流道结构中存在众多迂回弯折的流道结构,这会使得流道阻力大大增加,流道长度成倍增长,从而会进一步降低液流速度,降低浓度梯度的形成效率,且还会导致因药物粘附流道壁而造成的药物损失增加。
[0096]
一方面,本发明中采用了不同的原理来进行浓度梯度的形成,具体的,本发明是通过流道容积的设计,使得单位时间内的候选药物的流量具有一定的梯度、而配置液则保持等量,两种溶液混合后能够形成一系列浓度的候选药物溶液。本发明中,通过一层或两层流道结构即可获得大量的浓度梯度,先通过形成候选药物的流量梯度再形成浓度梯度,所以在形成候选药物的流量梯度的过程中不需要考虑两种溶液的均匀混合,故不局限于传统的“逐层增加”的方式,流道结构层数能大大减少。例如,本实施例中,只需要两层,即可形成9个浓度梯度,大大减小了流道的长度,可提高效率。
[0097]
且本发明中,先通过第一分配通道组302形成不同容积的第一分配通道3020,进行第一次分配,再利用第二分配通道组304形成不同容积的第二分配通道3040,进行第二次分配,能够充分利用芯片本体1的长度、宽度以及厚度尺寸,可获得更多、更均匀的浓度梯度,还能放宽流道尺寸的设计需求。例如,第一分配通道组302中,由于宽度方向上通道数较少(3个),可主要通过逐渐增加宽度来增加通道容积;第二分配通道组304中,由于宽度方向上通道数较多(9个),可通过同时逐渐增加宽度和深度来增加通道容积,使得通道的尺寸设计能够更加灵活。
[0098]
另一方面,本发明中采用独立的混合单元4对具有流量梯度的候选药物和等量分
配的配置液进行混合,不需采用迂回弯折的流道结构,可大大提高混匀效率和浓度梯度生成效率,且还能减小后续药物的损失。在后续的实施例中,进行进一步说明。
[0099]
以上为本发明的总体构思,以下在其基础上提供更为详细的实施例,以对本发明做进一步说明。且在以下实施例中,以n=3,m=3(即第一分配通道3020为3个,第二分配通道3040为9个,能生成9个浓度梯度)为具体示例,以方便描述。
[0100]
实施例1
[0101]
在本实施例中,第一分配通道组302中的通道的宽度范围为50
‑
1500μm,深度范围为2
‑
20μm;第二分配通道3040的通道的宽度范围为30
‑
200μm,深度范围为2
‑
25μm。
[0102]
在一种实施例中,由上至下依次编号,第1
‑
3个第一分配通道3020的容积依次为u0、3u0、9u0,每一个第一分配通道3020后连接的3个第二分配通道3040的容积由上至下均为v0、1.5v0、2v0,也即每个第二分配通道组304中的3个第二分配通道3040的容积比为其中,u0和v0均可表示一个单位容积;且本实施例中,第一分配通道组302和第二分配通道组304中的通道长度相等,所以上述容积比也等于面积比(深度和宽度的沉积)。
[0103]
单位时间内进入第一分配腔301的候选药物的流量为13q0,则理论上分配进入第1
‑
3个第一分配通道3020的流量依次为:q0、3q0、9q0,第1
‑
9个第二分配通道3040中分配进入的流量依次为:的流量依次为:可见流量是依次递增的;其中,q0表示一个单位流量;
[0104]
再假设注入的候选药物的初始浓度为c0,配置液中的候选药物浓度为0,单位时间内每个配置液通道37输出的配置液的流量为q0,则生成的第1组候选药物溶液的浓度(第一分配通道3020输出的候选药物与第一个配置液通道37输出的配置液混合后得到的理论浓度)同理可得第2
‑
9组选药物溶液的浓度依次为:9组选药物溶液的浓度依次为:以候选药物溶液组号为横坐标、对应的单位浓度为纵坐标,得到理论的浓度梯度曲线,如图6所示,可以看出,浓度呈梯度递增的趋势。
[0105]
进一步的,在一种更为具体的实施例中,第一分配通道3020和第二分配通道3040均为矩形体,第1
‑
3个第一分配通道3020的尺寸如下表1:
[0106]
表1
[0107][0108]
每个第二分配通道3040中由上至下3个第二分配通道3040的尺寸如下表2:
[0109]
表2
[0110][0111]
采用精密微量泵输注液体,输入的候选药物为美罗培南,初始浓度c0=40mg/l,配置液为培养液,其中的候选药物浓度为0,且控制单位时间候选药物的注入量(可为0.01
‑
0.5ul/min)为配置液的13倍,稳定状态下生成的9中候选药物的浓度如下表3所示:
[0112]
表3
[0113]
美罗培南溶液组号美罗培南溶液浓度mg/l16.929.4312.2415.0521.0624.5728.0831.2933.9
[0114]
以候选药物溶液组号为横坐标、对应的单位浓度为纵坐标,作曲线,如图7所示,可以看出,生成的9组美罗培南溶液的浓度呈梯度递增的趋势,且曲线趋势与图1接近,说明本发明能实现浓度梯度的生成。
[0115]
实施例2
[0116]
参照图8
‑
10,本实施例中,第一分配腔301的包括相互连通的第一v形腔段3010和第一矩形腔段3011,第一v形腔段3010与药物进样口连通,第一矩形腔段3011与第一分配通道3020的上游连通;
[0117]
第二分配腔303的包括相互连通的第二v形腔段3030和第二矩形腔段3031,第二v形腔段3030与第一分配通道3020的下游连通,第二矩形腔段3031与第二分配通道3040的上游连通。
[0118]
通过v形腔段的设置,能使分配腔中的溶液更均匀的布满整个矩形腔段,从而能更好的按照入口截面的尺寸,分配至下游的分配通道中。
[0119]
本实施例中,芯片本体1包括主芯片本体10以及设置在主芯片本体10上的副芯片本体11,梯度生成结构30、细胞进样单元6、混合单元4以及细胞培养单元5均形成于主芯片本体10内,浓度配置结构31形成于副芯片本体11内。副芯片本体11扣合在主芯片本体10上,且浓度配置结构31连通至混合单元4。
[0120]
本实施例中,混合结构40包括呈锥体状的第一混合腔41、设置在第二混合腔44的上端中间的第一混合通道42、与第一混合腔41通过第二混合通道43连通的呈锥体状的第二
混合腔44、与第二混合腔44的上端中间连通的第三混合通道45以及与第二混合腔44的上端外周切向连通的第四混合通道46,第四混合通道46的出口端汇集至第三混合通道45,第三混合通道45的出口端连通至细胞培养腔50。
[0121]
其中,第二分配通道3040的出口端与第一混合腔41的上端外周切向连通,配置液通道37的出口端与第一混合通道42连通;
[0122]
第二混合通道43的入口端与第一混合腔41的下端外周切向连通,第二混合通道43的出口端与第二混合腔44的下端外周切向连通;
[0123]
以一条与x方向平行且同时通过第一混合腔41的中心线和第二混合腔44的中心线为参照线观察,第二分配通道3040、第二混合通道43以及第四混合通道46均处于该参照线的同一侧。
[0124]
第二分配通道3040输送的候选药物沿切线进入第一混合腔41,与由第一混合通道42输送的沿垂直方向向下进入第一混合腔41中的配置液相遇,沿切线进入的候选药物产生旋流(如图中俯视方向看为逆时针),配置液则产生由上向下的垂直流,两股流体相遇产生激烈的碰撞,使得第一混合腔41内的整体流体边旋转边向下运动,运动过程中两种流体充分混合;
[0125]
然后再从第一混合腔41底部切向流出至第三混合通道45,再切向进入第二混合腔44,由于第二混合腔44的上端外周切向连通一第四混合通道46、上端中部垂直连通第三混合通道45,在这两个通道的引导下,由第三混合通道45切向进入的混合流体在第二混合腔44内边旋转边上升,在这个过程中,两种流体进二次混合;之后一部分混合流体从顶部的第三混合通道45排出,另一部分从侧部的第四混合通道46排出;
[0126]
最后,第四混合通道46排出的流体再汇集至第三混合通道45中,在这个过程中,两种流体进第三次次混合。其中,第四混合通道46一方面配合第三混合通道45以在第二混合腔44内形成旋流,另一方面能再增加一次流体的混合。
[0127]
通过上述混合结构40能够实现两种流体的三次混合,从而能够保证两种流体充分混合,同时避免了采用冗长的曲折流动,可大大提高流体流速,提高混匀效率,从而最终能提高浓度梯度生成效率,且还能减小后续药物的损失。
[0128]
实施例3
[0129]
参照图3、图11
‑
14,第三混合通道45的末端具有第一扩口段47,第一扩口段47与细胞培养腔50的侧部连通;通过设置第一扩口段47,能利于液体快速进入细胞培养腔50。
[0130]
第三混合通道45内设置有单向阀48,单向阀48位于第四混合通道46的出口端和第一扩口段47之间。单向阀48起止逆作用,通过设置单向阀48,保证配置好浓度后的候选药物溶液能顺利进入细胞培养腔50,而细胞培养腔50中的培养液或是细胞不会逆向朝芯片本体1的上游流动。
[0131]
参照图11
‑
12,在一种实施例中,单向阀48包括一个密封片485和一个限位块486,密封片485的上端与第三混合通道45的内壁可转动或弹性连接,限位块486处于密封片485的下方左侧,且能够阻止密封片485的下端向左转动。当第三混合通道45内的流体从右向左流动时,密封片485的下端与限位块486接触并贴紧,使得密封片485和限位块486能将第三混合通道45封闭,阻止流体从右向左流动。而当第三混合通道45内的流体从左向右流动时,密封片485向右转动或是向右弯曲(逆时针),第三混合通道45打开,流体可以流过。密封片
485和限位块486可采用防腐的金属或塑料材质。
[0132]
参照图13
‑
14,在另一种实施例中,单向阀48包括对称设置的两阀片480,阀片480包括连接在第三混合通道45的内壁上的弧形状的弹性部481以及与弹性部481连接的直线状的封闭部482,弹性部481相对于封闭部482更远离细胞培养腔50;
[0133]
进一步的实施例中,封闭部482的表面具有倾斜面,两个封闭部482接触时会形成尖端状。
[0134]
当第三混合通道45内无液体流动或液体的流动方向为由封闭部482朝向弹性部481时,两阀片480的封闭部482之间保持接触,两阀片480封闭第三混合通道45;
[0135]
当第三混合通道45内的液体的流动方向为由弹性部481朝向封闭部482时,液体的作用力使得两阀片480的弹性部481弯曲,两阀片480的封闭部482之间相互脱离,单向阀48打开,液体能够流过两阀片480之间的空隙。
[0136]
在一种更优选的实施例中,两阀片480的两封闭部482的表面上,其中一个设置有锯齿状凸起483,另一个设置有与锯齿状凸起483配合的锯齿状凹槽484。
[0137]
弧形状的弹性部481使得两阀片480在无外力作用使会相互靠拢,并通过两直线状的封闭部482保持紧密贴合,实现密封,当液体反向流动时(从右向左),液体挤压弹性部481,会使两封闭部482更趋于靠紧,同时封闭部482上的倾斜面的设置,使得液体对封闭部482表面的压力能使得两封闭部482更加紧贴,能保证很好的密封效果。且进一步的,当弹性部481受液体压力产生向左运动的趋势时,由于两阀片480通过锯齿状结构结合,使得两者之间不会出现相互滑动,能更加紧密地贴合。
[0138]
当液体正向流动时(从左向右),弹性部481被液体挤压而弯曲,使得两个封闭部482相互远离,从而打开,液体能从两个封闭部482之间的间隙通过。本实施例中,由于两个封闭部482均能弯曲,打开后两者之间能获得更大的空隙,可提高液体通过的效率。
[0139]
需要理解的是,上述两种实施例中的单向阀48的形状尺寸与其所处位置的第三混合通道45需要相匹配,以保证单向阀48能够封闭第三混合通道45。在一种实施例中,单向阀48整体呈矩形状,单向阀48所处位置的第三混合通道45也为矩形状。
[0140]
在优选的实施例中,细胞分支通道62内也设置有单向阀48,使得细胞分支通道62内的流动反向只能从细胞进样口60朝细胞培养腔50;单向阀48的结构可采用上述中的任意一种。
[0141]
在优选的实施例中,细胞培养腔50的上部开设有废液口52。更为优选的实施例中,废液口52的尺寸需要满足小于该微流控芯片在应用中使用的细胞或是其他试体的尺寸,以避免细胞或是其他试体从该废液口52中排出。
[0142]
实施例4
[0143]
本实施例提供以上的高效药物筛选的微流控芯片的应用方法,包括以下步骤:
[0144]
1、通过注射泵将细胞经细胞进样口60注入,并经过细胞分支通道62均匀分配至各个细胞培养腔50,待各个细胞培养腔50注入适量的细胞(例如2/3),或是注满培养腔后停止,静置培养;
[0145]
2、待细胞贴壁后经细胞进样口60注入一定量的培养液继续培养,培养一定时间;
[0146]
以上过程中,由于单向阀48的作用,细胞或培养液不会进入到上游的混合单元4中,废液从废液口52排出;
[0147]
3、将细胞进样口60密封(若细胞分支通道62内也设置单向阀48,则可不密封细胞进样口60,通过单向阀48能防止细胞或候选药物溶液进入到细胞分支通道62内),以通过气压的作用尽量避免候选药物溶液或细胞进入到细胞分支通道62内;
[0148]
通过进药口300注入候选药物,注入过程中保持注入压力恒定,同时通过配置液入口36注入配置液,使得生成的不同浓度的候选药物溶液分别进入到各个细胞培养腔50中,继续培养一定的时间;此过程中,可以保持候选药物溶液持续注入,也可只注入一段时间;
[0149]
4、对各个细胞培养腔50内的细胞凋亡情况进行检测,从而评估不同浓度的药物下,细胞的凋亡率。此过程中,可采用显微镜直接观察细胞凋亡情况,或是先进行荧光染色,然后通过荧光检测来计算细胞凋亡率,此过程,操作人员可依据具体情况进行应用方案的设计,在本发明的微流控芯片的基础上结合常规的手段来进行细胞凋亡率的检测。
[0150]
需要理解的是,本发明的微流控芯片不仅可以用于基于细胞的药物筛选,也可用于基于其他试体的药物筛选。例如,在一种实施例中,可用于基于线虫的抗菌药物筛选,可采用以下方法来进行:
[0151]
1)将线虫和培养液经细胞进样口60注入,进入细胞培养腔50,培养一段时间;
[0152]
2)将后续药物作用的目标细菌经细胞进样口60注入细胞培养腔50,感染线虫;
[0153]
3)通过细胞进样口60注入培养液冲洗细胞培养腔50,去除剩余的目标细菌;
[0154]
4)通过进药口300注入候选药物,注入过程中保持注入压力恒定,同时通过配置液入口36注入配置液,使得生成的不同浓度的候选药物溶液分别进入到各个细胞培养腔50中,通过进药口300注入候选药物,注入过程中保持注入压力恒定,同时通过配置液入口36注入配置液,使得生成的不同浓度的候选药物溶液分别进入到各个细胞培养腔50中,持续注入一定的时间;
[0155]
5)培养一段时间后,在显微镜下观察线虫的存活情况,计算存活率,得到不同候选药物浓度下的线虫存活率,能表征其抗菌效果,从而可得到针对该目标细菌,候选药物较优的浓度。
[0156]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1