一种光诱导修饰二芳基二氢吩嗪类有机光催化剂的方法与流程
1.本发明属于有机化学合成领域,具体涉及一种光诱导修饰二芳基二氢吩嗪类有机光催化剂的方法。
背景技术:
2.5,10-二芳基-5,10-二氢吩嗪在有机光催化领域是一种广受关注的催化剂,其克服了金属催化剂在反应结束后残留于体系中,限制产品在医药微电子领域应用的问题。但是,合成此类催化剂具有较大的困难,且未经核修饰的催化剂在应用过程中,其活性位点会与反应体系中的底物产生结合,消耗底物,造成浪费。特别是在原子转移自由基聚合 (o-atrp)中,其对引发剂的消耗会造成产物分子量分布不均,聚合反应不可控等问题。因此,对其活性位点进行核修饰是必要的。然而传统手段进行合成,因化合物结构位阻较大,反应位点活性不高,反应难以进行,除了反应过程中需要而外加入碱来促进反应外,还需要分步进行底物处理,首先要对催化剂进行一步核修饰,获得两位修饰的产物,再进行下一步反应,从而导致了其反应时间长,产率低,副反应多等问题,限制了它的应用。
技术实现要素:
3.发明目的:针对现有技术的不足,本发明提供一种光诱导修饰二芳基二氢吩嗪类有机光催化剂的方法。
4.技术方案:为了解决上述技术问题,本发明提供了一种光诱导修饰二芳基二氢吩嗪类有机光催化剂的方法,包括以下步骤:
5.(1)将二芳基二氢吩嗪类有机光催化剂i溶解于溶剂中得到第一均相溶液;
6.(2)将苯乙烯类化合物ii、卤代烷基酸酯iii溶解于溶剂中得到第二均相溶液;
7.(3)将所述第一均相溶液和所述第二均相溶液分别同时泵入微反应装置中的微混合器中,充分混合后通入微通道反应器中,光照下充分反应,收集产物,即得如式iv 所示的经过修饰的二芳基二氢吩嗪类有机光催化剂,其反应式如下:
[0008][0009]
其中:
[0010]
r1选自非取代或取代的苯基或萘基,所述取代的苯基或萘基,其中,苯环或萘环上的取代基选自c1-c5烷基、卤素、硝基、胺基、氰基、c1-c5烷氧基或c1-c5卤代烷基;
[0011]
r2选自氢、c1-c5烷基、卤素、硝基、胺基、苯基、氰基、c1-c5烷氧基或c1-c5 卤代烷基;
[0012]
r3选自卤素;r4、r5独立的选自c1-c5烷基,或者r4、r5相连形成环烷基;r6选自c1-c5烷基。
[0013]
优选的,所述r1选自苯基、萘基、或者c1-c5烷基、卤素、氰基、c1-c5烷氧基或c1-c5卤代烷基取代的苯基;
[0014]
所述r2选自氢、c1-c5烷基或卤素;
[0015]
所述r3选自卤素;r4、r5独立的选自c1-c5烷基,或者r4、r5相连形成3-6元环烷基;r6选自c1-c5烷基。
[0016]
优选的,所述r1选自苯基、萘基、或者甲基、异丁基、卤素、氰基、甲氧基或-cf3取代的苯基;
[0017]
所述r2选自氢、甲基或卤素;
[0018]
所述r3选自卤素;r4和r5独立的选自甲基,或者r4、r5相连形成环丁基;r6选自甲基、乙基、异丙基或异丁基。
[0019]
优选的,步骤(1)和(2)中,所述溶剂为二甲基亚砜、n,n-二甲基甲酰胺、甲醇、乙醇、水、n,n-二甲基乙酰胺、1,4-二氧六环、甲苯和四氢呋喃中的任意一种或几种组合,更优选为1,4-二氧六环。
[0020]
优选的,所述第一均相溶液浓度为0.02~1mmol/ml,更优选为0.2mmol/ml;所述第二均相溶液中苯乙烯类化合物浓度为0.04~20mmol/ml更优选为0.08mmol/ml,卤代烷基酸酯类化合物浓度为0.04~40mmol/ml,更优选为0.16mmol/ml。
[0021]
优选的,所述二芳基二氢吩嗪类有机光催化剂、苯乙烯类化合物和卤代烷基酸酯之间的投料配比为1:2:2~1:20:40,更优选为1:4:8。
[0022]
优选的,所述反应的温度为0~80℃,更优选为室温;在微通道反应器中液流保留时间为5~30分钟,更优选为10分钟。
[0023]
优选的,所述光照采用的光源为功率10~40w,波长为254~450nm,光强度为1.2~ 7.6mw/cm2的紫外灯或太阳光,更优选为40w,390nm,7.6mw/cm2的紫外光源。
[0024]
优选的,所述第一均相溶液和第二均相溶液泵入速度为0.05~0.8ml/min,更优选为 1.5ml/min;所述微通道流反应器体积为5~30ml,更优选为15ml。
[0025]
所述微通道反应装置中,双管进料料液混合处结构为y型,t型或倒y型结构,优选为y型
[0026]
有益效果:经核修饰后的有机光催化剂,具有更好的光电物理性质,且催化过程中,催化剂活性位点对底物的消耗更少,催化过程可控性提高。此核修饰方法与现有技术相比,可通过一步反应获得,减少了中间产物后处理的资源消耗,且反应时间大幅缩短,由36小时缩短至30分钟内,从起始原料出发,产率提高了一倍以上,反应过程中无需额外的金属催化剂及配体加入,反应更加绿色高效。。
附图说明
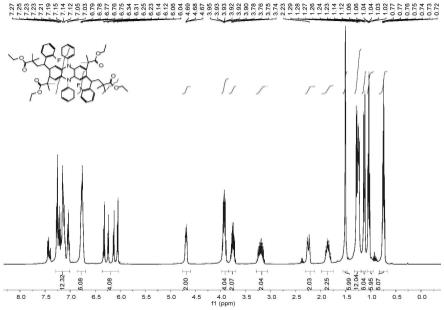
[0027]
图1为本发明实施例1所得d1的氢谱。
[0028]
图2为本发明实施例1所得d1的碳谱。
[0029]
图3为本发明实施例2所得d2的氢谱。
[0030]
图4为本发明实施例2所得d2的碳谱。
[0031]
图5为实验装置图例。
具体实施方式
[0032]
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
[0033]
实施例1:
[0034]
涉及反应方程式如下:
[0035][0036]
室温下,取a1(100mg,0.299mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b1(145.9mg,1.196mmol,4eq),c1(466.4mg,2.392mmol, 8eq)溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为10ml的微流场通道中,每管溶液流速0.5ml/min,光源使用40w,390nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe: ea)10:1体系柱层析分离纯化产物,获得290.7mg(收率94%)淡黄色产物。
[0037]1h nmr(400mhz,benzene-d6)δ7.29
–
7.01(m,12h),6.86
–
6.70(m,6h),6.36
–
6.04(m, 4h),4.69(dd,j=8.6,4.5hz,2h),3.98
–
3.84(m,4h),3.75(dt,j=10.9,7.0hz,2h),3.29
ꢀ–
3.06(m,2h),2.31
–
2.12(m,2h),1.98
–
1.75(m,2h),1.56
–
1.47(m,6h),1.32
–
1.20(m, 12h),1.13(d,j=9.8hz,6h),1.04(td,j=7.1,2.4hz,6h),0.75(tt,j=7.1,3.7hz,6h).
[0038]
13
c nmr(101mhz,c6d6)δ176.47,176.43,176.28,176.25,161.84,159.41,159.38,140.60, 140.54,140.20,139.86,139.83,135.44,135.40,134.86,134.82,134.77,134.52,134.45, 134.36,133.01,132.86,131.64,131.51,131.39,131.11,131.06,131.00,130.96,130.92, 129.57,129.52,129.48,128.19,128.14,128.04,127.94,127.82,127.70,127.58,127.46, 127.33,127.25,123.32,123.28,123.23,115.43,115.39,115.30,115.19,111.49,111.43,60.12, 60.08,59.67,59.62,46.74,46.41,45.44,42.32,42.26,35.71,27.85,27.75,27.68,24.91, 24.81,13.80,13.58
[0039]
ms:1034.52
[0040]
实施例2:
[0041]
涉及反应方程式如下:
[0042][0043]
室温下,取a2(100mg,0.212mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b2(88.2mg,0.848mmol,4eq),c2(330.8mg,1.696mmol,8eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速0.5ml/min,光源使用 40w,390nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 8:1体系柱层析分离纯化产物,获得230.9mg(收率96%)淡黄色产物。
[0044]1h nmr(400mhz,benzene-d6)δ7.10(d,j=6.8hz,8h),6.93
–
6.76(m,10h),6.06
–
[0045]
5.82(m,4h),4.12(t,j=6.8hz,2h),3.63
–
3.40(m,6h),2.89
–
2.76(m,2h),2.04(dt,j= 12.1,6.0hz,2h),1.82
–
1.69(m,6h),1.58
–
1.49(m,2h),1.23(s,6h),1.02
–
0.85(m, 12h),0.77(s,6h),0.39(p,j=6.7hz,6h).
[0046]
13
c nmr(101mhz,c6d6)δ176.85,176.34,176.31,149.52,149.43,138.34,138.05,137.91, 137.76,137.48,137.13,135.19,135.09,134.90,134.87,132.51,132.47,131.78,131.73, 131.69,130.74,129.23,129.19,128.16,128.11,127.93,127.81,127.69,127.57,127.45, 126.16,124.57,124.53,123.46,114.63,114.58,110.96,60.18,59.87,48.65,45.20,42.28, 42.25,42.20,29.85,29.20,29.14,28.11,27.47,24.20,20.71,20.65,20.60,13.65,13.39, 13.37.
[0047]
ms=1134.56
[0048]
实施例3:
[0049]
涉及反应方程式如下:
[0050][0051]
室温下,取a2(100mg,0.212mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b2(88.2mg,0.848mmol,4eq),c2(282.4mg,1.696mmol,6eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速0.5ml/min,光源使用40w,425nm,7.9mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 12:1体系柱层析分离纯化产物,获得251.1mg(收率95%)淡黄色产物。
[0052]
实施例4:
[0053]
涉及反应方程式如下:
[0054][0055]
室温下,取a4(100mg,0.276mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b4(153mg,1.104mmol,4eq),c4(430mg,2.208mmol,8eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为10ml的微流场通道中,每管溶液流速0.5ml/min,光源使用 40w,390nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 10:1体系柱层析分离纯化产物,获得298.99mg(收率94%)黄色产物。
[0056]
实施例5:
[0057]
涉及反应方程式如下:
[0058][0059]
室温下,取a5(100mg,0.260mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b5(61.4mg,0.520mmol,2eq),c5(374.3mg,2.08mmol,8eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为10ml的微流场通道中,每管溶液流速0.5ml/min,光源使用 30w,420nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 4:1体系柱层析分离纯化产物,获得245.5mg(收率92%)黄色油状产物。
[0060]
实施例6:
[0061]
涉及反应方程式如下:
[0062]
[0063]
室温下,取a6(100mg,0.254mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b6(70.1mg,0.508mmol,2eq),c6(211.3mg,1.016mmol,4eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速1ml/min,光源使用 30w,420nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 4:1体系柱层析分离纯化产物,获得279.3mg(收率93%)淡黄色产物。
[0064]
实施例7:
[0065]
涉及反应方程式如下:
[0066][0067]
室温下,取a7(100mg,0.230mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b7(119.7mg,1.15mmol,5eq),c7(224.3mg,1.15mmol,5eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为10ml的微流场通道中,每管溶液流速0.8ml/min,光源使用 30w,420nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea) 6:1体系柱层析分离纯化产物,获得242.6mg(收率96%)淡黄色产物。
[0068]
实施例8:
[0069]
涉及反应方程式如下:
[0070][0071]
室温下,取a8(100mg,0.270mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b8(190.3mg,1.62mmol,6eq),c8(667.4mg,3.24mmol,12eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速0.8ml/min,光源使用太阳光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe:ea)15:1体系柱层析分离纯化产物,获得266.8mg(收率89%)淡黄色产物。
[0072]
实施例9:
[0073]
涉及反应方程式如下:
[0074][0075]
室温下,取a9(100mg,0.299mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b9(153.7mg,1.19mmol,4eq),c9(466.4mg,2.39mmol,8eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速0.8ml/min,,光源使用30w,450nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe: ea)10:1体系柱层析分离纯化产物,获得300.9mg(收率96%)淡黄色产物。
[0076]
实施例10:
[0077]
涉及反应方程式如下:
[0078][0079]
室温下,取a
10
(100mg,0.224mmol,1eq),溶解于10ml的1,4-二氧六环中获得第一均相溶液备用,取b
10
(93.3mg,0.896mmol,4eq),c
10
(349.3mg,1.79mmol,8eq) 溶解于10ml1,4-二氧六环中获得第二均相溶液备用,将两备用溶液氮气10分钟,除尽溶解氧后,同时泵入体积为15ml的微流场通道中,每管溶液流速0.8ml/min,,光源使用15w,420nm,5.8mw/cm2紫外光,用烧杯接流出液,使用石油醚:乙酸乙酯(pe: ea)10:1体系柱层析分离纯化产物,获得235.6mg(收率93%)淡黄色产物。
[0080]
比较例1:
[0081]
涉及反应方程式如下:
[0082][0083]
室温下,向向20ml透明玻璃样品瓶中依次加入聚四氟乙烯磁力搅拌子、h1(100mg, 0.178mmol,1eq),苯乙烯(186mg,1.78mmol,10eq)、2-溴-2-甲基丙酸乙酯(694mg,3.56mmol, 20eq)、1,4-二氧六环(10ml),塞好橡胶塞并密封,置换出瓶中空气并冲入氮气。
(957.2mg,4.60mmol,20eq)、碳酸钠(48.7mg,0.460mmol,2eq)、1,4-二氧六环(10ml),塞好橡胶塞并密封,置换出瓶中空气并冲入氮气。然后将反应瓶置于光照40w,420nm, 5.8mw/cm2紫外光条件下,反应24h后。通过柱层析进行分离,获得产物193.9mg(收率 73%)淡黄色产物。
[0096]
比较例5:
[0097]
涉及反应方程式如下:
[0098][0099]
室温下,向向20ml透明玻璃样品瓶中依次加入聚四氟乙烯磁力搅拌子、 h5(100mg,0.299mmol,1eq),苯乙烯(311.1mg,2.99mmol,10eq)、1-溴代环丁烷羧酸乙酯 (1231.8mg,5.98mmol,20eq)、碳酸钠(63.4mg,0.598mmol,2eq)、1,4-二氧六环(10ml),塞好橡胶塞并密封,置换出瓶中空气并冲入氮气。然后将反应瓶置于光照40w,420nm, 5.8mw/cm2紫外光条件下,反应24h后。通过柱层析进行分离,获得产物222.1mg(收率 71%)淡黄色产物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1