一种亲和层析填料及其制备方法以及亲和纯化工艺与流程
1.本技术涉及生物大分子分离纯化技术领域,具体而言,涉及一种亲和层析填料及其制备方法以及亲和纯化工艺。
背景技术:
2.氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶可以用于转录合成rna,目前氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶的制备一般是通过设计含有相应氨基酸突变位点的密码子引物,在pcr反应体系中,通过聚合酶链式反应扩增含有正确突变序列的t7rna聚合酶的基因序列,再利用表达菌体表达所需的突变的t7rna聚合酶。
3.但是,表达菌体的表达体系复杂,所表达的聚合酶不仅包含所需的氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶,还包括其他未良好表达的非目的蛋白。目前,对上述体系的纯化以获得目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶的纯化方法复杂,且目的蛋白的得率和纯度都不高,不利于目的蛋白的工业化放大生产和进一步应用。
技术实现要素:
4.本技术的目的在于提供一种亲和层析填料及其制备方法以及亲和纯化工艺,其旨在改善现有的获得氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶的得率和纯度均不高的技术问题。
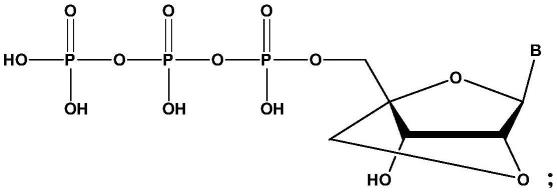
5.本技术第一方面提供一种亲和层析填料,包括活化后的载体以及连接于活化后的载体上的配体;配体的结构式如下:
[0006][0007]
其中,b为天然的或修饰的含有氨基的核苷碱基。
[0008]
本技术提供的亲和层析填料通过将含有锁核酸结构以及氨基基团的配体连接至活化后的载体上,可以有效对目的蛋白含有氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行分离纯化,有效提高纯化后的目的蛋白的收率以及纯度。
[0009]
本技术第二方面提供一种亲和层析填料的制备方法,包括将上述第一方面提及的
配体与活化后的载体进行偶联反应;活化后的载体的制备方法包括采用活化剂对载体进行活化处理。
[0010]
采用上述方法制备得到的亲和层析填料用于对目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行纯化分离时,可有效提高纯化后的目的蛋白的收率以及纯度。
[0011]
本技术第三方面提供一种亲和纯化工艺,包括采用放置有如上述第一方面提供的亲和层析填料的亲和层析柱对含有目的蛋白的体系进行纯化处理;目的蛋白包括突变的t7rna聚合酶,突变的t7rna聚合酶的氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示。
[0012]
采用上述亲和纯化工艺对目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行纯化分离时,可有效提高纯化后的目的蛋白的收率以及纯度,操作简单,易于工业化放大生产。
附图说明
[0013]
为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0014]
图1示出了本技术实施例1中亲和纯化工艺得到的含有目的蛋白的产物的凝胶电泳图。
[0015]
图2示出了本技术实施例2中sp sepharose fast flow阳离子层析得到的洗脱样品的凝胶电泳图。
[0016]
图3示出了本技术实施例3中磷酸纤维素层析得到的洗脱样品的凝胶电泳图。
具体实施方式
[0017]
为使本技术实施例的目的、技术方案和优点更加清楚,下面将对本技术实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0018]
下面对本技术实施例提供的一种亲和层析填料及其制备方法以及亲和纯化工艺进行具体说明。
[0019]
本技术提供一种亲和层析填料,包括活化后的载体以及连接于活化后的载体上的配体;配体的结构式如下:
[0020][0021]
其中,b为天然的或修饰的含有氨基的核苷碱基。
[0022]
需要说明的是,上述配体结构式中的b可以为天然的含有氨基的核苷碱基,例如,腺嘌呤、鸟嘌呤以及胞嘧啶等;上述配体结构式中的b也可以为修饰的含有氨基的核苷碱基,例如,氨基取代的尿嘧啶、氨基取代的腺嘌呤、氨基取代的鸟嘌呤以及氨基取代的胞嘧啶等。
[0023]
配体结构中核糖上2'-o-和4'-c-位之间通过亚甲基基团桥接,形成“锁核酸”结构。
[0024]
可以理解的是,只要满足上述结构式限定的物质,均属于本技术可选的配体。
[0025]
通过将含有锁核酸结构以及氨基基团的配体连接至活化后的载体上制得亲和层析填料,可以有效对目的蛋白含有氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行分离纯化,有效提高纯化后的目的蛋白的收率以及纯度。
[0026]
在本实施例中,配体可以选自商品化的lna-atp、lna-gtp或lna-utp,上述物质具有锁核酸结构以及氨基基团,可以与目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶发生生物亲和作用,实现配体与目的蛋白的特异性结合,从而在亲和纯化过程中对目的蛋白进行纯化。
[0027]
在本实施例中,载体可以选自琼脂糖凝胶、聚丙烯酰胺凝胶、葡聚糖凝胶、多孔硅胶或纤维素,上述物质具有亲水性、多孔结构、无特异性吸附性能、比表面积大以及较高的机械强度等性能,适宜作为亲和层析柱中的固相载体;此外,上述物质含有可活化的反应基团,有利于载体活化后可以与具有氨基的配体进行偶联反应,从而固定化配体于载体上。
[0028]
进一步地,在本技术的一些实施例中,载体可以选自商品化的cnbr-activated sepharose 4 fast flow(溴化氰活化琼脂糖凝胶4ff),其可以有效与具有氨基的配体进行偶联反应。
[0029]
本技术还提供一种亲和层析填料的制备方法,包括将配体与活化后的载体进行偶联反应;其中,配体的结构式如下:
[0030][0031]
其中,b为天然的或修饰的含有氨基的核苷碱基。
[0032]
载体活化后具有可与配体进行偶联反应的活化基团,从而可以固定化配体于载体
上。
[0033]
在本实施例中,活化后的载体的制备方法包括采用活化剂对载体进行活化处理。活化剂可以选自溴化氰、环氧基材料以及戊二醛中的任意一种。进一步地,环氧基材料选自环氧氯丙烷。上述物质不仅可以有效对载体进行活化以固定配体于载体上;还有利于使得活化后的载体与配体之间可以形成一个“间隔臂”,以增大配体与载体之间的距离,克服载体空间位阻的影响,有利于配体与目的蛋白更好地结合。
[0034]
需要说明的是,在本技术的其他实施例中,亲和层析填料的制备方法也可以不包括用活化剂对再进行进活化处理,可以采用已经活化好的载体直接与配体进行偶联反应,例如,采用商品化的cnbr-activated sepharose 4 fast flow直接与配体进行偶联反应。
[0035]
当选用cnbr-activated sepharose 4 fast flow时,在进行偶联反应前,还需要对cnbr-activated sepharose 4 fast flow进行预处理,包括:于ph为2-3下进行清洗。具体的,上述预处理包括将cnbr-activated sepharose 4 fast flow冻干粉于ph为2-3的酸性溶液中进行悬浮溶胀后用酸性溶液进行清洗。
[0036]
作为示例性地,cnbr-activated sepharose 4 fast flow冻干粉在酸性溶液中的质量浓度为0.1-0.3g/ml,上述酸性溶液可以选自盐酸,清洗时间可以为10-30min;进一步地,清洗时间可以为15min。上述预处理步骤有利于后续活化的载体与配体的偶联。
[0037]
在本实施例中,在对配体与活化后的载体进行偶联反应前,还需要采用偶联缓冲液溶解配体。偶联缓冲液包括无机盐缓冲剂,无机盐缓冲剂可以选自碳酸盐或者碳酸氢盐,例如碳酸钠或者碳酸氢钠等。偶联缓冲液中无机盐缓冲剂的浓度为0.02-0.2m,可以快速溶解配体,使得偶联缓冲液中的ph稳定,也有利于配体和活化后的载体进行偶联。作为示例性地,偶联缓冲液中无机盐缓冲剂的浓度可以为0.02m、0.05m、0.1m或者0.2m等等。进一步地,偶联缓冲液中无机盐缓冲剂的浓度为0.1m。
[0038]
偶联缓冲液中还包括离子强度稳定剂,离子强度稳定剂可以选自氯化钠;偶联缓冲液中离子强度稳定剂的浓度为0.1-1m,有利于稳定偶联缓冲液中的离子强度。作为示例性地,偶联缓冲液中离子强度稳定剂的浓度可以为0.1m、0.5m或者1m等等。进一步地,偶联缓冲液中离子强度稳定剂的浓度为0.5m。
[0039]
在本实施例中,偶联缓冲液的ph为8.0-9.0;进一步地,偶联缓冲液的ph为8.3。
[0040]
在本实施例中,配体与活化后的载体进行偶联反应的ph为8.0-9.0,有利于促进配体与活化后的载体的偶联。作为示例性地,配体与活化后的载体进行偶联反应的ph可以为8.0、8.2、8.5、8.8或者9.0等等。进一步地,在本技术的一些实施例中,配体与活化后的载体进行偶联反应的ph为8.3,可以使得配体与活化后的载体的偶联效率较高。
[0041]
需要说明的是,在本技术的其他实施例中,配体与活化后的载体的偶联反应也可以直接在溶解配体的偶联缓冲液中进行;即偶联缓冲液溶解配体后,加入待反应的活化后的载体,进行偶联反应。
[0042]
在本实施例中,配体与活化后的载体进行偶联反应的温度为4-8℃,偶联反应的时间为12-16h;上述温度和时间可以促进偶联反应的进行。作为示例性地,偶联反应的温度可以为4℃、6℃或者8℃等等,偶联反应的时间可以为12h、14h或者16h等等。进一步地,在本技术的一些实施例中,偶联反应的温度为4℃,偶联反应的时间为12h,上述温度和时间下,偶联效果较佳。
[0043]
在本技术的一些实施例中,偶联反应后还需要对未与载体偶联的多余的配体进行初步冲洗去除,可以选用上述偶联缓冲液对多余的配体进行初步冲洗去除。
[0044]
在本技术的一些实施例中,在对多余配体进行初步冲洗去除后,还包括对载体上残留的未偶联的配体进行二次去除,可以采用清洗液和偶联缓冲液交替清洗,将游离配体残留清洗干净避免游离配体结合到固定的配体上。其中,清洗液包括醋酸钠和氯化钠,醋酸钠在清洗液中的浓度为0.05-0.3m,氯化钠在清洗液中的浓度为0.2-0.7m,清洗液的ph为3.5-4.5;进一步地,醋酸钠在清洗液中的浓度为0.1m,氯化钠在清洗液中的浓度为0.5m,清洗液的ph为4.0;上述清洗液有利于更好地将载体上残留的配体清洗干净。
[0045]
在本技术的一些实施例中,偶联反应后还需要采用灭活处理液对载体中未与配体偶联的活化基团进行灭活处理。灭活处理液中包括tris酸含伯胺的试剂乙醇胺以及甘氨酸中的至少一种,以实现封闭端基基团。tris酸含伯胺的试剂乙醇胺以及甘氨酸在灭活处理液中的浓度为0.05-0.2m。
[0046]
灭活处理液的ph为7.5-8.5,灭活处理的温度10-25℃,灭活处理的时间为1-4h;进一步地,灭活处理液的ph为8.0,灭活处理的温度20℃,灭火处理的时间为2h,可以提高对载体中未与配体偶联的活化基团的灭活效果。
[0047]
本技术提供的亲和层析填料的制备方法至少具有以下优点:
[0048]
本技术提供的亲和层析填料的制备得到的亲和层析柱用于对目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行纯化分离时,可有效提高纯化后的目的蛋白的收率以及纯度。
[0049]
本技术还提供一种亲和纯化工艺,包括采用放置有上述提供的亲和层析填料的亲和层析柱对含有目的蛋白的体系进行纯化处理;目的蛋白包括突变的t7rna聚合酶,突变的t7rna聚合酶的氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示。
[0050]
采用上述亲和纯化工艺对目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶进行纯化分离时,可有效提高纯化后的目的蛋白的收率以及纯度,操作简单,易于工业化放大生产。
[0051]
在本实施例中,纯化处理包括将含有目的蛋白的体系的结合平衡缓冲液上样至亲和层析柱,再采用淋洗洗杂缓冲液进行清洗,然后采用梯度洗脱缓冲液进行洗脱。
[0052]
将含有目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶的结合平衡缓冲液上样至亲和层析柱,目的蛋白与亲和层析柱上的配体进行特异性结合,使得目的蛋白被固定于亲和层析柱上;再采用淋洗洗杂缓冲液对亲和层析柱上残留的未结合到亲和层析柱上的杂质或者非目的蛋白进行淋洗去除;然后再采用梯度洗脱缓冲液对结合了目的蛋白的亲和层析柱进行洗脱,降低目的蛋白与配体之间的亲和作用,使得目的蛋白脱附亲和层析柱,收集得到分离纯化后的目的蛋白。
[0053]
在本实施例中,结合平衡缓冲液包括第一缓冲剂、第一螯合剂、第一还原剂以及第一稳定剂。
[0054]
第一缓冲剂选自生物缓冲剂或磷酸盐缓冲剂,例如,生物缓冲剂可以选自tris(三羟甲基氨基甲烷)、hepes(4-羟乙基哌嗪乙磺酸)、mops(3-(n-吗啡啉)丙磺酸)、pipes(哌嗪-1,4-二乙磺酸)、bicine(n,n-二羟乙基甘氨酸)、caps(3-(环己胺)-1-丙磺酸)、taps(n-三(羟甲基)甲基-3-氨基丙磺酸)、epps(n-(2-羟乙基)哌嗪-n'-3-丙磺酸)以及mopso(3-(n-吗啉基)-2-羟基丙磺酸)等;磷酸盐缓冲剂可以为磷酸二氢钾以及磷酸二氢钠等。上述物质可以有效维持目的蛋白上样所需的ph。
[0055]
第一缓冲剂在结合平衡缓冲液中的终浓度为10-100mm,作为示例性地,第一缓冲剂在结合平衡缓冲液中的终浓度可以为10mm、20mm、30mm、50mm或者100mm等等。
[0056]
进一步地,在本实施例中,第一缓冲剂选用tris,tris在结合平衡缓冲液中的终浓度为50mm。
[0057]
第一螯合剂选自乙二胺四乙酸(edta)、次氮基三乙醇(nta)、二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸的取代盐以及二亚乙基三胺五乙酸的取代盐中的至少一种,可以有效避免目标产物与结合平衡缓冲液中的金属离子反应而失活。第一螯合剂在在结合平衡缓冲液中的终浓度为1-10mm,可以进一步避免目标产物与结合平衡缓冲液中的金属离子反应;作为示例性地,第一螯合剂在结合平衡缓冲液中的终浓度可以为1mm、2mm、5mm或者10mm等等。
[0058]
进一步地,在本实施例中,第一螯合剂选用edta,edta在结合平衡缓冲液中的终浓度为5mm。
[0059]
第一还原剂选自dtt(二硫苏糖醇)、巯基乙醇以及三(2-甲酰乙基)膦盐酸盐中的至少一种,可以稳定目的蛋白的活性。第一还原剂在结合平衡缓冲液中的终浓度为1-10mm,可以进一步稳定目的蛋白的活性;作为示例性地,第一还原剂在结合平衡缓冲液中的浓度可以为1mm、5mm或者10mm等等。
[0060]
进一步地,在本实施例中,第一还原剂选自dtt,dtt在结合平衡缓冲液中的终浓度为5mm。
[0061]
第一稳定剂选自丙三醇,可以降低体系的极性来稳定目的蛋白的活性。第一稳定剂在结合平衡缓冲液中的终体积浓度为5-15%,若第一稳定剂在结合平衡缓冲液中的终浓度较低,会使得得到的目的蛋白的纯度降低,若第一稳定剂在结合平衡缓冲液中的终浓度较高,会使得得到的目的蛋白的收率降低;作为示例性地,第一稳定剂在结合平衡缓冲液中的终体积浓度可以为5%、10%或者15%等等。
[0062]
进一步地,在本实施例中,第一稳定剂选自丙三醇,丙三醇在结合平衡缓冲液中的终体积浓度为10%。
[0063]
在一些实施例中,结合平衡缓冲液还包括离子强度稳定剂,离子强度稳定剂选自钠盐或钾盐,例如,离子强度稳定剂可以选自氯化钠或氯化钾。离子强度稳定剂在结合平衡缓冲液中的终浓度为10-100mm。
[0064]
进一步地,在本实施例中,离子强度稳定剂选自氯化钠,氯化钠在结合平衡缓冲液中的终浓度为50mm。
[0065]
在本实施例中,结合平衡缓冲液的ph为7.0-8.0,可以有利于目的蛋白与亲和层析柱上的配体进行特异性结合;作为示例性地,结合平衡缓冲液的ph可以为7.0、7.5或者8.0等等。进一步地,结合平衡缓冲液的ph为7.5。
[0066]
在本实施例中,淋洗洗杂缓冲液包括第二缓冲剂、第二螯合剂以及第二还原剂。
[0067]
第二缓冲剂选自磷酸盐缓冲剂,例如磷酸氢二钾或磷酸氢二钠,可以有效维持淋洗除杂所需的ph。第二缓冲剂在淋洗洗杂缓冲液中的终浓度为10-100mm,作为示例性地,第二缓冲剂在淋洗洗杂缓冲液中的终浓度可以为10mm、20mm、50mm或者100mm等等。
[0068]
进一步地,在本实施例中,第二缓冲剂选自磷酸二氢钾,磷酸二氢钾在淋洗洗杂缓冲液中的终浓度为45mm。
[0069]
第二螯合剂选自乙二胺四乙酸(edta)、次氮基三乙醇(nta)、二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸的取代盐以及二亚乙基三胺五乙酸的取代盐中的至少一种,可以有效避免目标产物与淋洗洗杂缓冲液中的金属离子反应而失活。第二螯合剂在淋洗洗杂缓冲液中的终浓度为0.5-10mm,可以进一步避免目标产物与淋洗洗杂缓冲液中的金属离子反应;作为示例性地,第二螯合剂在淋洗洗杂缓冲液中的终浓度可以为0.5mm、1mm、2mm、5mm或者10mm等等。
[0070]
进一步地,在本实施例中,第二螯合剂选自edta,edta在淋洗洗杂缓冲液中的终浓度为1mm。
[0071]
第二还原剂选自dtt(二硫苏糖醇)、巯基乙醇以及三(2-甲酰乙基)膦盐酸盐中的至少一种,可以稳定目的蛋白的活性。第二还原剂在淋洗洗杂缓冲液中的终浓度为1-10mm,可以进一步稳定目的蛋白的活性;作为示例性地,第二还原剂在淋洗洗杂缓冲液中的浓度可以为1mm、5mm或者10mm等等。
[0072]
进一步地,在本实施例中,第二还原剂选自dtt,dtt在淋洗洗杂缓冲液中的终浓度为5mm。
[0073]
在一些实施例中,淋洗洗杂缓冲液还包括离子强度稳定剂,离子强度稳定剂选自钠盐或钾盐,例如,离子强度稳定剂可以选自氯化钠或氯化钾。离子强度稳定剂在淋洗洗杂缓冲液中的终浓度为200-400mm。进一步地,在本实施例中,离子强度稳定剂选自氯化钠,氯化钠在淋洗洗杂缓冲液中的终浓度为300mm。
[0074]
在本实施例中,淋洗洗杂缓冲液的ph为6.0-6.5,有利于对亲和层析柱上残留的未结合到亲和层析柱上的杂质或者非目的蛋白进行淋洗去除;作为示例性地,淋洗洗杂缓冲液的ph可以为6.0、6.2或者6.5等等。进一步地,淋洗洗杂缓冲液的ph为6.4。
[0075]
在本实施例中,梯度洗脱缓冲液包括第三缓冲剂、第三螯合剂、第三还原剂以及第三稳定剂。
[0076]
第三缓冲剂选自醋酸盐缓冲剂,例如醋酸钠;可以有效维持梯度洗脱所需的ph。第三缓冲剂在梯度洗脱缓冲液中的终浓度为10-100mm,作为示例性地,第三缓冲剂在梯度洗脱缓冲液中的终浓度可以为10mm、20mm、50mm或者100mm等等。进一步地,在本实施例中,第三缓冲剂选自醋酸钠,醋酸钠在梯度洗脱缓冲液中的终浓度为50mm。
[0077]
第三螯合剂选自乙二胺四乙酸(edta)、次氮基三乙醇(nta)、二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸的取代盐以及二亚乙基三胺五乙酸的取代盐中的至少一种,可以有效避免目标产物与梯度洗脱缓冲液中的金属离子反应而失活。第三螯合剂在梯度洗脱缓冲液中的终浓度为0.5-10mm,可以进一步避免目标产物与梯度洗脱缓冲液中的金属离子反应;作为示例性地,第三螯合剂在梯度洗脱缓冲液中的终浓度可以为0.5mm、1mm、2mm、5mm或者10mm等等。进一步地,在本实施例中,第三螯合剂选自edta,edta在梯度洗脱缓冲液中的
终浓度为1mm。
[0078]
第三还原剂选自dtt(二硫苏糖醇)、巯基乙醇以及三(2-甲酰乙基)膦盐酸盐中的至少一种,可以稳定目的蛋白的活性。第三还原剂在梯度洗脱缓冲液中的终浓度为5-20mm,可以进一步稳定目的蛋白的活性;作为示例性地,第三还原剂在梯度洗脱缓冲液中的浓度可以为5mm、10mm或者20mm等等。进一步地,在本实施例中,第三还原剂选自dtt,dtt在梯度洗脱缓冲液中的终浓度为10mm。
[0079]
第三稳定剂各自丙三醇,可以降低体系的极性来稳定目的蛋白的活性。第三稳定剂在梯度洗脱缓冲液中的终体积浓度为5-15%,可以进一步降低体系的极性;作为示例性地,第三稳定剂在梯度洗脱缓冲液中的终体积浓度可以为5%、10%或者15%等等。进一步地,在本实施例中,第三稳定剂选自丙三醇,丙三醇在梯度洗脱缓冲液中的终体积浓度为10%。
[0080]
在一些实施例中,梯度洗脱缓冲液还包括离子强度稳定剂,离子强度稳定剂选自钠盐或钾盐,例如,离子强度稳定剂可以选自氯化钠或氯化钾。离子强度稳定剂在梯度洗脱缓冲液中的终浓度为50mm-4m,有利于使得目的蛋白和配体更好地分离,以获得所需的目的蛋白;进一步地,在本实施例中,离子强度稳定剂选自氯化钠,氯化钠在梯度洗脱缓冲液中的终浓度为3m。
[0081]
在本实施例中,梯度洗脱缓冲液的ph为4.5-5.5,可以有利于使得目的蛋白和配体分离,从而得到所需目的蛋白;作为示例性地,梯度洗脱缓冲液的ph可以为4.5、5.0或者5.5等等。进一步地,梯度洗脱缓冲液的ph为5.0。
[0082]
在本技术的一些实施例中,在洗脱后还需要采用高、低ph再生缓冲液交替对亲和层析柱进行清洗再生处理,以使得亲和层析柱可以多次重复使用。
[0083]
在一些实施例中,高ph再生缓冲液的ph为7-10,进一步地,高ph再生缓冲液的ph为8.5,高ph再生缓冲液包括tris缓冲剂。低ph再生缓冲液的ph为4-5,进一步地,低ph再生缓冲液的ph为4.5,低ph再生缓冲液包括醋酸钠无机盐缓冲剂。高、低ph再生缓冲液均含有氯化钠,氯化钠在高、低ph再生缓冲液中的浓度均为0.5m。
[0084]
进一步地,在本技术的一些实施例中,再生处理后还包括将再生处理后的亲和层析柱于长期保存液中保存以备用。长期保存液中含有质量分数为0.1%的叠氮化钠,保存温度为2-8℃。
[0085]
为了进一步提高对目的蛋白氨基酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6或seq id no.7所示的突变的t7rna聚合酶的纯化效果,在本技术的一些实施例中,在采用本技术提供的亲和纯化工艺对目的蛋白进行纯化后,还采用阳离子层析和磷酸纤维素层析对目的蛋白进行进一步纯化。
[0086]
以下结合实施例对本技术提供的一种亲和层析填料及其制备方法以及亲和纯化工艺的特征和性能作进一步的详细描述。
[0087]
实施例1
[0088]
本实施例提供了一种亲和层析填料及其制备方法以及亲和纯化工艺,具体采用如下步骤:
[0089]
(1)亲和层析填料的制备:
[0090]
将60g的cnbr-activated sepharose 4 fast flow冻干粉于450ml的ph为3的1mm
的盐酸溶液中进行悬浮溶胀30min,再用6759ml浓度为1mm的盐酸溶液用玻璃过滤器重悬后进行清洗,得到待偶联反应的活化后的载体。
[0091]
将1.2g的lna-atp冻干粉溶解于ph为8.3的100ml的偶联缓冲液中得到待偶联的体系。其中,偶联缓冲液由nahco3和nacl溶于超纯水中制得,偶联缓冲液中的nahco3的浓度为0.1m,nacl的浓度为0.5m。
[0092]
将上述得到的待偶联反应的活化后的载体加入225ml的待偶联的体系中,轻轻搅拌均匀后在4℃下温和搅拌孵育12h,进行偶联反应。采用1500ml的上述偶联缓冲液对偶联后的体系进行清洗,再采用ph为8.0的1500ml的灭活处理液于20℃下进行清洗2h,随后采用ph为4.0的3000ml的清洗液和1500ml的上述偶联缓冲液交替进行清洗,制得亲和层析填料。其中,灭活处理液由tris-hcl溶于超纯水中制得,tris-hcl在灭活处理液中的浓度为0.1m;清洗液有naac和nacl溶于超纯水中制得,naac在清洗液中的浓度为0.1m,nacl在清洗液中的浓度为0.5m。
[0093]
(2)目的蛋白的制备:
[0094]
针对氨基酸序列如seq id no.1所示的突变的t7rna聚合酶,通过聚合酶链式反应扩增含有正确突变序列的t7rna聚合酶的基因序列,并将扩增出的基因序列转入大肠杆菌中。大肠杆菌先在lb培养基中培养12h,再在2xyt培养基中于37℃、180rpm培养至od
600
值为0.3,然后将培养体系降温至20℃在缓慢扩培至od
600
值为0.5,加入iptg诱导表达12h,其加入iptg终浓度为0.2mm。离心收获沉淀得到菌体。
[0095]
对表达收获后的菌体用均质机650psi进行破膜二次、在台式离心机8500rpm转速4℃下离心30min后收获上清液。再在上述上清液温和搅拌过程中缓慢加入硫酸铵溶液,4℃搅拌2h后离心8500rpm50min得到沉淀,最后用dialysis buffer重悬并透析300倍。收集上清最终得到含有目的蛋白的体系。
[0096]
其中,lb培养基含amresco soy peptone10g、merck yeast extract5g、nacl 10g含卡那霉素至终浓度60ug/ml;2xyt培养基含amresco soy peptone 16g、merck yeast extract 5g、nacl 5g含卡那60ug/ml;硫酸铵溶液加入体积为0.85倍的样品体积,且硫酸铵溶液为0℃下饱和的硫酸铵溶液;dialysis buffer含20mm tris、1mm edta、5mm dtt、5%glycerol、20ug/ml pmsf、2.5ug/ml leupeptin ph7.5。
[0097]
(3)亲和纯化工艺:
[0098]
将步骤(2)得到的含有目的蛋白的体系用ph为7.5的结合平衡缓冲液稀释至体系的ph波动在
±
0.2以内以及体系的电导值波动在
±
5ms/cm以内,并上样至放置有步骤(1)得到的亲和层析填料的亲和层析柱。再采用ph为6.4的淋洗洗杂缓冲液进行清洗10个柱体积,然后采用ph为5.0的梯度洗脱缓冲液进行洗脱10个柱体积,收集得到含有目的蛋白的产物。
[0099]
其中,结合平衡缓冲液由tris、edta、nacl、dtt以及质量分数为99.7%的丙三醇混合溶于超纯水制得,tris、edta、nacl、dtt以及丙三醇在结合平衡缓冲液中的浓度分别为50mm、5mm、50mm、5mm、10%。淋洗洗杂缓冲液由磷酸二氢钾、edta、nacl以及dtt混合溶于超纯水制得,磷酸二氢钾、edta、nacl以及dtt在淋洗洗杂缓冲液中的浓度分别为45mm、1mm、300mm、5mm。梯度洗脱缓冲液由naac、edta、dtt、nacl以及质量分数为99.7%的丙三醇混合溶于超纯水制得,naac、edta、dtt、nacl以及丙三醇在梯度洗脱缓冲液中的浓度分别为50mm、1mm、10mm、3m、10%(体积浓度)。
[0100]
实施例2
[0101]
实施例2与实施例1的区别在于:在步骤(3)后,对步骤(3)洗脱后得到含有目的蛋白的产物依次进行sp sepharose fast flow阳离子层析纯化。
[0102]
sp sepharose fast flow阳离子层析纯化步骤包括:将步骤(3)得到的含有目的蛋白的产物透析于ph为7.51的阳离子层析平衡缓冲液中至体系的ph波动在
±
0.2以内以及体系的电导值波动在
±
5ms/cm以内。然后进行上样,然后采用ph为7.52的阳离子层析洗脱缓冲液进行洗脱,收集洗脱样品。
[0103]
其中,阳离子层析平衡缓冲液由tris、edta、nacl、dtt以及质量分数为99.7%的丙三醇混合溶于超纯水制得,tris、edta、nacl、dtt以及丙三醇在阳离子层析平衡缓冲液中的浓度分别为50mm、5mm、10mm、5mm、10%。阳离子层析洗脱缓冲液由tris、edta、nacl、dtt以及质量分数为99.7%的丙三醇混合溶于超纯水制得,tris、edta、nacl、dtt以及丙三醇在阳离子层析洗脱缓冲液中的浓度分别为50mm、5mm、1m、5mm、10%。
[0104]
实施例3
[0105]
实施例3与实施例1的区别在于:在步骤(3)后,对步骤(3)洗脱后得到含有目的蛋白的产物依次进行磷酸纤维素层析纯化。
[0106]
磷酸纤维素层析纯化步骤包括:将阳离子层析洗脱得到的洗脱样品透析于ph为6.5的纤维素层析平衡缓冲液中,至体系的ph波动在
±
0.2以内以及体系的电导值波动在
±
5ms/cm以内;然后进行上样,然后采用ph为6.5的纤维素层析洗脱缓冲液进行洗脱10个柱体积,收集洗脱样品。
[0107]
其中,磷酸纤维素层析平衡缓冲液由磷酸二氢钾、edta、dtt以及质量分数为99.7%的丙三醇混合溶于超纯水制得,磷酸二氢钾、edta、dtt以及丙三醇在纤维素层析平衡缓冲液中的浓度分别为10mm、0.1mm、1mm、5%。磷酸纤维素层析洗脱缓冲液由potassium磷酸二氢钾、edta、dtt以及质量分数为99.7%的丙三醇混合溶于超纯水制得,磷酸二氢钾、edta、dtt以及丙三醇在纤维素层析平衡缓冲液中的浓度分别为500mm、0.1mm、1mm、5%。
[0108]
实施例4
[0109]
实施例4与实施例1的区别在于:偶联缓冲液的ph为9.0。
[0110]
实施例5
[0111]
实施例5与实施例1的区别在于:偶联缓冲液的ph为8.0。
[0112]
实施例6
[0113]
实施例6与实施例1的区别在于:丙三醇在结合平衡缓冲液中的体积浓度为5%。
[0114]
实施例7
[0115]
实施例7与实施例1的区别在于:丙三醇在结合平衡缓冲液中的体积浓度为15%。
[0116]
对比例1
[0117]
对比例1与实施例1的区别在于:对比例1目的蛋白为天然的t7rna聚合酶。
[0118]
对比例2
[0119]
对比例2和实施例1区别在于:步骤(3)的不同。
[0120]
对比例2的步骤(3)为:依次进行high s阳离子层析、blue柱层析、阴离子q柱层析以及羟基磷灰石填料层析。
[0121]
high s阳离子层析:将含有目的蛋白的体系上样至阳离子层析柱中,将阳离子层
析层在ph为7.7的平衡流穿液中流穿;其中,平衡流穿液中具有浓度为20mm的磷酸盐二氢钠,1mm的edta、5mm的dtt、质量分数为5%的丙三醇以及2.5μg/ml的leupeptin(蛋白酶抑制剂),收集流穿样品。
[0122]
blue柱层析:对high s阳离子层析收集的流穿样品采用ph为8.0的透析平衡液进行透析2-3次共透析换液100倍,每次透析时间为4h;将透析后得到的样品上样至blue柱后,经ph为8.0的淋洗缓冲液淋洗后,采用ph为8.0的梯度洗脱液洗脱,收集洗脱样品。其中,透析平衡液具有浓度为10mm的kh2po4、200mm的nacl、质量分数为5%的丙三醇、1mm的dtt、1mm的edta、20μg/ml的pmsf(苯甲基磺酰氟)、2.5μg/ml的leupeptin;淋洗缓冲液具有浓度为10mm的kh2po4、230mm的nacl、质量分数为5%的丙三醇、1mm的dtt、1mm的edta;梯度洗脱液具有浓度为10mm的kh2po4、1.5m的nacl、质量分数为5%的丙三醇、1mm的dtt、1mm的edta。
[0123]
阴离子q柱层析:对blue柱层析收集的洗脱样品采用ph为7.9的透析液进行透析2-3次共透析换液100倍,每次透析时间为4h;将透析后得到的样品上样至阴离子q柱后,经ph为7.9的淋洗缓冲液淋洗后,采用ph为7.9的梯度洗脱液洗脱,收集洗脱样品。其中,透析液具有浓度为15mm的tris、10mm的nacl、1mm的dtt、1mm的edta、质量分数为0.5%的triton x-100(聚乙二醇辛基苯基醚);淋洗缓冲液具有浓度为20mm的tris、质量分数为0.5%的triton x-100、质量分数为5%的丙三醇、1mm的dtt、1mm的edta、30mm的nacl;梯度洗脱液具有浓度为20mm的tris、质量分数为0.5%的triton x-100、质量分数为5%的丙三醇、1mm的dtt、1mm的edta、200mm的nacl。
[0124]
羟基磷灰石填料层析:对阴离子q柱层析收集的洗脱样品采用ph为8.0的透析液进行透析2-3次共透析换液100倍,每次透析时间为4h;将透析后得到的样品上样至羟基磷灰石填料,采用ph为8.0的梯度洗脱液洗脱,收集洗脱样品。其中,透析液具有浓度为10mm的kh2po4、1mm的dtt、0.1mm的edta、质量分数为5%的丙三醇、质量分数为0.5%的np-40(乙基苯基聚乙二醇)、质量分数为0.5%的tween 20(聚氧乙烯脱水山梨醇单月桂酸酯);梯度洗脱液具有浓度为500mm的kh2po4、1mm的dtt、0.1mm的edta、质量分数为5%的丙三醇、质量分数为0.5%的np-40、质量分数为0.5%的tween 20。
[0125]
试验例1
[0126]
对实施例1步骤(3)中亲和纯化工艺得到的含有目的蛋白的产物分别进行凝胶电泳实验,结果如图1所示。对实施例2的sp sepharose fast flow阳离子层析得到的洗脱样品以及实施例3的磷酸纤维素层析纯化得到的洗脱样品分别进行凝胶电泳实验,结果分别如图2和图3所示。
[0127]
其中,图1中,标记“上样”:为柱前样品,标记“m”为marker,编号1-40为亲和层析梯度洗脱收集样品。图2中,标记“上样”:为柱前样品,编号1-14均为阳离子层析梯度洗脱收集样品。图3中,标记“m”为marker,编号1-43均为磷酸纤维素层析梯度洗脱收集样品。
[0128]
从图1可以看出,采用实施例1提供的亲和纯化工艺能够有效收集到目的蛋白(即氨基酸序列如seq id no.1所示的突变的t7rna聚合酶)。从图2和图3可以看出,在进行本技术提供后的亲和纯化工艺后,再对sp sepharose fast flow阳离子层析纯化或磷酸纤维素层析纯化,可以进一步提高对目的蛋白的收率。
[0129]
试验例2
[0130]
对实施例1-7以及对比例1-2提供的纯化方法所得到的目的蛋白的产量和纯度进
行统计,结果见表1。
[0131]
表1
[0132][0133]
从表1可以看出,实施例1-7提供纯化方法得到的目的蛋白(即氨基酸序列如seq id no.1所示的突变的t7rna聚合酶)的收率均明显高于对比例1提供的纯化方法,表明本技术的纯化工艺是针对特定氨基酸序列的t7rna聚合酶才能够实现特异性的亲和吸附,进而实现高效分离目的蛋白和杂质蛋白。
[0134]
实施例1-7提供纯化方法得到的目的蛋白的收率均明显高于对比例2提供的纯化方法,表明本技术的纯化工艺相较为对比例2中的传统四步层析,能够有效提高纯化后获得的目的蛋白的收率和纯度,且操作简单、工序少,极大程度地减少了人力物力的投入成本和时间上的成本。
[0135]
实施例2-3提供纯化方法得到的目的蛋白的收率和纯度均略高于实施例1提供的纯化方法,表明在进行本技术提供后的亲和纯化工艺后,再对sp sepharose fast flow阳离子层析纯化或磷酸纤维素层析纯化,可以进一步提高对目的蛋白的收率和纯度。
[0136]
实施例4-5提供纯化方法得到的目的蛋白的收率均略低于实施例1提供的纯化方法,表明亲和层析填料的制备过程中偶联配体和活化后的载体的ph能够影响最终目的蛋白的收率,这是因为偶联配体和活化后的载体的ph能够影响配体和活化后的载体之间的偶联率,进而影响亲和层析填料对目的蛋白的特异性亲和吸附。实施例1中偶联反应的ph为8.3时,目的蛋白的纯度和收率均较佳。
[0137]
实施例6提供纯化方法得到的目的蛋白的收率略高于实施例1,而目的蛋白的纯度略低于实施例1;实施例7提供纯化方法得到的目的蛋白的收率略低于实施例1,而目的蛋白的纯度略高于实施例1;上述实验结果表明,丙三醇在结合平衡缓冲液中体积浓度能够对目的蛋白的收率以及纯度具有影响;实施例1中的丙三醇在结合平衡缓冲液中体积浓度为10%时,目的蛋白的纯度和收率均较佳。
[0138]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1