一种电化学氧化邻氨基苯酚类似物制备吩恶嗪酮类化合物的合成方法
一种电化学氧化邻氨基苯酚类似物制备吩恶嗪酮类化合物的合成方法
发明领域
1.本发明属有机电化学领域,涉及一种电化学氧化邻氨基苯酚类似物制备吩恶嗪酮类化合物的合成方法。
2.发明背景
3.电化学合成是近年来新兴的一种合成策略,它使用电子作为清洁的氧化剂或还原剂,因而可以避免使用有毒危险的化学试剂,是今后发展“绿色化学合成工业”的重要组成部分。
4.吩恶嗪酮类生物碱是一类结构多样的天然产物,拥有广泛的生物活性,被广泛应用于抗肿瘤、抗病毒、抗炎、抗菌、抗阿尔茨海默等多种疾病模型。吩恶嗪酮类化合物也可作为染料,逐步开发为生物探针染料,用于活细胞成像。因此,化学家们开发了吩恶嗪酮的多种合成方法,其中2
‑
氨基苯酚衍生物的二聚化是最为有效的合成策略之一。在这个化学转化过程中,催化剂和氧化剂是必不可少的两类因素。目前,已报道的催化剂包括laccase(酶)、金属复合体、有机磷试剂以及异质纳米材料等,而氧化剂往往采用过氧化物、高价金属盐、高压氧气等。但是这些合成策略存在以下一个或多个问题:(1)所用的催化剂和氧化剂不易得、价格贵;(2)试剂有一定危险性;(3)会产生大量化学废弃物;(4)反应条件剧烈等。这些不利因素限制了该合成策略的应用以及新吩恶嗪酮类化合物的开发。
技术实现要素:
5.针对现有技术的不足,本发明的目的是提供一种电化学氧化邻氨基苯酚类似物制备吩恶嗪酮类化合物的合成方法。
6.为实现上述目的,本发明提供的电化学氧化邻氨基苯酚类似物制备吩恶嗪酮类化合物的合成方法,其特征在于:包括如下步骤:
7.1)准备好开反应需要的三口瓶,电极;
8.2)在三口瓶中加入磁子、电解质、催化剂和底物邻氨基苯酚类似物;
9.3)将电极固定在三口瓶上;
10.4)向三口瓶中加入反应溶剂;
11.5)反应在室温下搅拌,通上电流进行反应;
12.6)反应时间结束后,反应液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥,通过硅胶柱层析得到纯净的目标产物。
13.作为优选方案,所述步骤1)中:三口瓶容量为20ml,阳极为石墨电极、阴极为铂电极,面积尺寸为10mm
×
10mm
14.所述步骤2)中:加入的底物0.5mmol,邻氨基苯酚类似物包括邻氨基苯酚、2
‑
氨基
‑3‑ꢀ
甲基苯酚、2
‑
氨基
‑6‑
甲基苯酚、2
‑
氨基
‑6‑
氟苯酚、2
‑
氨基
‑6‑
氯苯酚、2
‑
氨基
‑6‑
溴苯酚、2
‑
氨基
‑3‑
甲氧基苯酚、3
‑
氨基
‑2‑
羟基苯甲酸甲酯;
15.所述步骤2)中:催化剂为10%mol 2,2,6,6
‑
tetramethylpiperidine
‑1‑
oxyl
(tempo);
16.所述步骤5)中:通上恒电流10ma反应3小时;
17.电化学条件下,tempo先在阳极被氧化成tempo
+
,而tempo
+
是一种强氧化剂,可以将邻氨基苯酚类似物氧化,生成2
‑
氨基苯氧基自由基。该自由基中间体随后失去一个电子和一个质子后形成关键中间体邻苯醌单亚胺,中间体邻苯醌单亚胺再与另一分子邻氨基苯酚类似物共价加成,环化芳构化生成吩恶嗪酮类化合物。
18.本发明方法的优点及有益效果如下:
19.本发明方法成功实现了在一体池中,高效率地将邻氨基苯酚类似物氧化缩合制备吩恶嗪酮类化合物;该反应在中性环境、室温下进行,反应条件温和,过程简单易操作,以价廉易处理的tempo为催化剂,以“电子”做氧化剂,相较于吩恶嗪酮类化合物已报道的合成方法,本发明方法无需采用金属催化剂和反应当量的氧化剂,从而减少了化学废弃试剂的产生,对环境更加友好。
附图说明
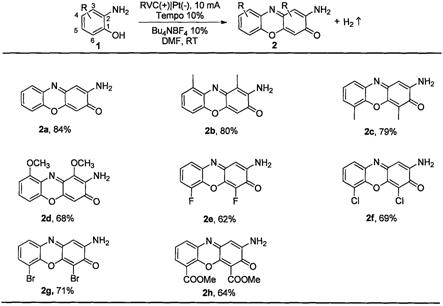
20.图1为本发明所涉及到的吩恶嗪酮类化合物的化学式结构图。
21.图2为本发明所涉及到反应机理过程示意图。
具体实施方式
22.以下结合附图与具体实施例对本发明的方案作进一步地详细阐述。
23.实施例1:2
‑
氨基
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
24.在20ml三口瓶中加入磁子,邻氨基苯酚(0.5mmol),tempo(0.05mmol)和nbu4nbf
4 (0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂 dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50ml x 3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率84%。1h nmr(500mhz,dmso):δ7.68
‑
7.37(4h,m),6.81(2h,s),6.34(2h,s);
13
c nmr(125mhz,dmso):δ180.1,148.8,148.1,147.3,141.8,133.6,128.7,127.9,125.2,115.8, 103.3,98.2;hrms(esi):calcd.for c
12
h9n2o2[m+h]
+
m/z 213.0659,found m/z 213.0661.
[0025]
实施例2:2
‑
氨基
‑
1,9
‑
二甲基
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0026]
在20ml三口瓶中加入磁子,2
‑
氨基
‑3‑
甲基苯酚(0.5mmol),tempo(0.05mmol)和 nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50ml x 3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率80%。1h nmr(500mhz,dmso):δ7.34
‑
7.20(3h,m),6.37(2h,s),6.23(1h, s),2.59(3h,s),2.22(3h,m);
13
c nmr(125mhz,dmso):δ179.5,148.7,145.8,143.6,141.8, 136.6,131.6,128.3,125.8,113.2,105.6,102.0,16.3,9.6;hrms(esi):calcd.for c
14
h
13
n2o
2 [m+h]
+
m/z 241.0972,found m/z 241.0971.
[0027]
实施例3:2
‑
氨基
‑
4,6
‑
二甲基
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0028]
在20ml三口瓶中加入磁子,2
‑
氨基
‑6‑
甲基苯酚(0.5mmol),tempo(0.05mmol)和 nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反
应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率79%。1hnmr(500mhz,dmso):δ7.46(1h,d,j=7.5hz),7.26(1h,d,j=7.5hz),7.21(1h,t,j=7.5hz),6.68(2h,s),6.26(1h,s),2.40(3h,s),2.04(3h,m);
13
cnmr(125mhz,dmso):δ180.3,148.2,147.1,145.1,140.9,133.7,130.1,126.0,125.3,124.7,111.6,98.0,14.8,8.0;hrms(esi):calcd.forc
14
h
13
n2o2[m+h]
+
m/z241.0972,foundm/z241.0976.
[0029]
实施例4:2
‑
氨基
‑
1,9
‑
二甲氧基
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0030]
在20ml三口瓶中加入磁子,2
‑
氨基
‑3‑
甲氧基苯酚(0.5mmol),tempo(0.05mmol)和nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率68%。1hnmr(400mhz,dmso):δ7.45(1h,t,j=8.4hz),7.08(1h,d,j=8.4hz),7.03(1h,d,j=8.4hz),6.30(2h,s),6.25(1h,s),3.98(3h,s),3.87(3h,s);
13
cnmr(100mhz,dmso):δ179.9,155.4,147.0,142.6,140.7,137.6,132.1,129.5,123.9,107.7,107.3,101.4,59.9,56.4;hrms(esi):calcd.forc
14
h
13
n2o4[m+h]
+
m/z273.0870,foundm/z273.0877.
[0031]
实施例5:2
‑
氨基
‑
4,6
‑
二氟
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0032]
在20ml三口瓶中加入磁子,2
‑
氨基
‑6‑
氟苯酚(0.5mmol),tempo(0.05mmol)和nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率62%。1hnmr(500mhz,dmso):δ7.55(1h,d,j=8.0hz),7.47
‑
7.44(1h,m),7.40
‑
7.23(1h,m),7.09(2h,s),6.32(1h,s);
13
cnmr(125mhz,dmso):δ172.2(d,2j
c
‑
f
=16hz),149.2(d,1j
c
‑
f
=248hz,),147.3,146.6(d,4j
c
‑
f
=2hz),138.7(d,1j
c
‑
f
=252hz),135.2,132.5(d,3j
c
‑
f
=6hz),129.5(d,3j
c
‑
f
=11hz),124.5(d,3j
c
‑
f
=7hz),123.7(d,4j
c
‑
f
=2hz),115.2(d,2j
c
‑
f
=17hz),96.4;hrms(esi):calcd.forc
12
h7f2n2o2[m+h]
+
m/z249.0471,foundm/z249.0477.
[0033]
实施例6:2
‑
氨基
‑‑
4,6
‑
二氯
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0034]
在20ml三口瓶中加入磁子,2
‑
氨基
‑6‑
氯苯酚(0.5mmol),tempo(0.05mmol)和nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率69%。1hnmr(500mhz,dmso):δ7.67(1h,d,j=8.0hz),7.61(1h,d,j=8.0hz),7.40(1h,t,j=8.0hz),7.10(2h,s),6.38(1h,s);
13
cnmr(125mhz,dmso):δ174.2,147.3,147.1,143.8,137.6,134.8,128.8,126.8,125.6,119.8,109.6,97.5;hrms(esi):calcd.forc
12
h7cl2n2o2[m+h]
+
m/z280.9879,foundm/z280.9877.
[0035]
实施例7:2
‑
氨基
‑‑
4,6
‑
二溴
‑
3h
‑
吩恶嗪
‑3‑
酮的制备
[0036]
在20ml三口瓶中加入磁子,2
‑
氨基
‑6‑
溴苯酚(0.5mmol),tempo(0.05mmol)和
nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率71%。1hnmr(500mhz,dmso):δ7.78(1h,d,j=8.0hz),7.73(1h,d,j=8.0hz),7.37(1h,t,j=8.0hz),7.13(2h,s),6.40(1h,s);
13
cnmr(125mhz,dmso):δ174.4,147.6,147.1,146.0,139.0,135.0,131.8,127.3,126.3,108.7,101.1,97.6;hrms(esi):calcd.forc
12
h7b
r2n
2o2[m+h]
+
m/z368.8869,foundm/z368.8867.
[0037]
实施例8:二甲基2
‑
氨基
‑3‑
氧代
‑
3h
‑
吩恶嗪
‑
4,6
‑
二羧酸二盐的制备
[0038]
在20ml三口瓶中加入磁子,3
‑
氨基
‑2‑
羟基苯甲酸甲酯(0.5mmol),tempo(0.05mmol)和nbu4nbf4(0.5mmol)。将石墨、铂片固定在电极夹上,然后装在三口瓶上,往三口瓶中加入反应溶剂dmf(5ml)。反应在室温下搅拌,通上恒电流10ma反应直至反应完成。反应时间结束后,反应液用乙酸乙酯(50mlx3)和水萃取,收集有机相,通过硅胶柱层析得到纯净的目标产物,产率64%。1hnmr(400mhz,dmso):δ7.96(2h,t,j=8.0hz),7.53(1h,t,j=8.0hz),7.07(2h,s),6.44(1h,s),3.91(6h,s);
13
cnmr(100mhz,dmso):δ176.6,164.1,163.3,147.0,146.3,144.9,140.0,134.3,132.5,130.5,125.1,118.7,110.2,98.4,52.3,52.2;hrms(esi):calcd.forc
16
h
13
n2o6[m+h]
+
m/z329.0769,foundm/z329.0773。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1