用于直肠癌体外诊断试剂盒及其检测方法与流程
本发明涉及癌症诊断检测用的试剂盒领域,具体为一种用于直肠癌体外诊断试剂盒及其检测方法。
背景技术:
直肠癌是最常见的恶性肿瘤之一,我国的结直肠癌每年新发病例33.1万人,发病率在全部恶性肿瘤中排名第四位;死亡率则位居癌症死亡原因第五位。健康的人群,有大量结肠息肉患者进行结直肠癌的鉴别诊断,其平均发病率达到10%。临床治疗发现,第一期直肠癌治疗后的存活率达百分之八十,零期直肠癌治疗后的存活率更接近百分之百,因此早期发现及治疗非常重要。
肿瘤标志物(tumor markers,TM)是指在肿瘤发生和增殖过程中,由肿瘤细胞本身合成、释放,或由机体对肿瘤细胞反应而产生的标志肿瘤存在和生长的一类物质。这些物质在正常成人中不存在或者是在癌症患者中出现的水平显著高于正常人。目前肿瘤标志物检测技术被认为是早期发现无症状微灶肿瘤的唯一途径,这一检测技术可先于X光片、超声、CT、MRI或PET-CT等物理检查发现肿瘤。可用于高危人群恶性肿瘤的筛查,肿瘤诊断与鉴别诊断,评估治疗的效果,预测或监视肿瘤复发或转移。目前,医院出现的直肠癌诊断试剂盒都是检测一些常见的肿瘤标记物,灵敏性及准确性都偏低。因主要是选定的肿瘤标记物单项检测往往有很大的局限性,难以满足早期快速诊断的要求。
目前,市场上还没有针对直肠癌的快速高效诊断试剂盒问世,严重影响到直肠癌早期发现及治疗。
技术实现要素:
本发明的目的是针对以上述现有直肠癌诊断存在的不足,提供一种灵敏度高、准确性强且使用方便高效的用于直肠癌体外诊断试剂盒。
本发明另一目的是提供一种用于直肠癌体外诊断试剂盒的检测方法。
为了实现本发明目的,本发明采取的技术方案是:用于直肠癌体外诊断试剂盒,包括捕获抗体,所述捕获抗体是X型胶原蛋白α1制得的单克隆抗体。
所述试剂盒还包括检测抗体,所述检测抗体为X型胶原蛋白α1制得的多克隆抗体。
所述捕获抗体为将X型胶原蛋白α1克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到相应的抗原,将所述抗原免疫哺乳动物得到的相应单克隆抗体。
所述捕获抗体的制备方法包括如下步骤:
(1)抗原的制备:把X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到抗原,此抗原也可作为标准品用;
(2)捕获抗体的制备:将上述抗原免疫哺乳动物,得到相应的单克隆抗体为捕获抗体。
所述检测抗体为将X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到相应的抗原,将所述抗原免疫哺乳动物得到的相应多克隆抗体。
所述检测抗体的制备方法包括如下步骤:
(1)抗原的制备:把X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到抗原,此抗原也可作为标准品用;
(2)检测抗体的制备:将上述抗原免疫哺乳动物,得到相应的多克隆抗体为检测抗体。
所述捕获抗体预先包被于微量滴定板的孔内,可以简化步骤,提高检测效率。
用于直肠癌体外诊断试剂盒的制备方法,其包括以下步骤:
(1) 抗原的制备:将X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到所需的抗原,其中,所述抗原也可作为标准品用;
(2)捕获抗体的制备:将上述抗原免疫哺乳动物得到相应的单克隆抗体,所述单克隆抗体作为本试剂盒的捕获抗体;
(3)检测抗体的制备:将上述抗原免疫哺乳动物得到相应的多克隆抗体,所述多克隆抗体作为本试剂盒的检测抗体;
(4)捕获抗体包被:
①.用碳酸盐/碳酸氢盐缓冲液 (pH9.6) 将浓度为 1μg/ml 的捕获抗体包被 微量滴定板的孔;②. 封盖微量滴定板并在 4℃ 下孵育过夜;③. 弃去包被液(碳酸盐/碳酸氢盐缓冲液稀释的捕获抗体),并用洗涤液洗涤微量滴定板两次,每次在微孔中加入 200 μl PBST(磷酸盐吐温缓冲液),在水槽上方轻轻甩动微量滴定板,除去洗涤液,在纸巾上轻拍微量滴定板,除去剩余的液滴,晾干放于4℃环境中备用;
(5)封闭和加样:每孔添加 200μl 封闭缓冲液(1.2%BSA/PBS),封闭包被孔中剩余的蛋白质结合位点。
用于直肠癌体外诊断试剂盒的检测方法,其包括以下步骤:
(1) 抗原的制备:将X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到所需的抗原;
(2)捕获抗体的制备:将上述抗原免疫哺乳动物得到相应的单克隆抗体,所述单克隆抗体作为本试剂盒的捕获抗体;
(3)检测抗体的制备:将上述抗原免疫哺乳动物得到相应的多克隆抗体,所述多克隆抗体作为本试剂盒的检测抗体;
(4)捕获抗体包被:
①.用碳酸盐/碳酸氢盐缓冲液 (pH9.6) 将浓度为 1μg/ml 的捕获抗体包被微量滴定板的孔;
②.封盖微量滴定板并在 4℃ 下孵育过夜;
③.弃去包被液(碳酸盐/碳酸氢盐缓冲液稀释的捕获抗体),并用洗涤液洗涤微量滴定板两次,每次在微孔中加入 200 μl PBST(磷酸盐吐温缓冲液),在水槽上方轻轻甩动微量滴定板,除去洗涤液,在纸巾上轻拍微量滴定板,除去剩余的液滴,晾干放于4℃环境中备用;
(5)封闭
①.在微量滴定板的每个孔添加 200μl 封闭缓冲液(1.2%BSA/PBS),封闭包被孔中剩余的蛋白质结合位点;
②.封盖微量滴定板并在37℃孵育1小时;
(6)加样
①.将 100 μl的样品添加到每个孔,在 37℃孵育60分钟;要得到准确的定量结果,通常做法是比较未知样品与标准曲线的信号。每个酶标板都必须测定标准品(两重测定或三重测定)和空白样,以确保准确性;
②.弃去样品,并洗涤微量滴定板三次,每次在微孔中加入 200μl PBST(磷酸盐吐温缓冲液);
③.将 100 μl 浓度为 0.5μg/ml的检测抗体添加到每个孔;
④.封盖微量滴定板并在37℃孵育1小时;
⑤.用 PBST 洗涤微量滴定板四次;
⑥.添加 100 μl 标记二抗;
⑦.封盖微量滴定板并在37℃孵育1小时;
⑧.用 PBST 洗涤微量滴定板四次;
(7)检测
①.将 TMB(3,3',5,5'-四甲基联苯胺) 溶液添加到每个孔,孵育 15-30 分钟,添加等体积的终止液,然后在450 nm 处读取光密度。
②.由系列稀释液得到的数据绘制标准曲线,浓度标在 X 轴(对数标度)上,而吸光度标在 Y轴(线性标度)上。通过内插法在此标准曲线上得出样品浓度。
本发明从众多的肿瘤标记物中,筛选出新肿瘤标记物COL10A1(X型胶原蛋白α1) 组成直肠癌快速诊断试剂盒。X型胶原蛋白α1是近年来发现的一种新型胶原,是成片层结构的胶原,它们在细胞外基质(ECM)中装配成片层结构。通常由三条 多肽链构成三股螺旋结构,在胚胎发育、组织重建、损伤修复等过程中,生长因子及分化因子对胶原蛋白基因的表达具有重要的调控作用。许多疾病与X型胶原的异常有着密切的关系。最近的研究也证实它是直肠癌的理想标记物。
与现有技术相比,本发明的有益效果如下:具有灵敏度高准确性强的特点,其灵敏度达到70%以上。
附图说明
图1是本发明用于直肠癌体外诊断试剂盒的原理图;
图2是本发明用于直肠癌体外诊断试剂盒的检测抗体最佳工作浓度的选择对比图;
图3是本发明用于直肠癌体外诊断试剂盒的对临床血清标本的诊断及鉴别诊断对比说明图;
图4是本发明用于直肠癌体外诊断试剂盒敏感性的检测对比图;
图5是本发明用于直肠癌体外诊断试剂盒特异性的检测对比图;
图6是本发明用于直肠癌体外诊断试剂盒在直肠癌治疗前后血中检测到X型胶原蛋白α1的变化对比图。
具体实施方式
以下结合附图和具体实施例对本发明用于直肠癌体外诊断试剂盒进行详细的描述说明。
用于直肠癌体外诊断试剂盒,包括捕获抗体,捕获抗体封闭缓冲液、标准品、标记抗体、洗涤液及显色液,所述标记抗体选用HRP标记二抗;所述捕获抗体是X型胶原蛋白α1制得的单克隆抗体; 其灵敏度及准确性均达到70%以上。
所述捕获抗体为将X型胶原蛋白α1克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到相应的抗原,将所述抗原免疫哺乳动物得到的相应单克隆抗体。
所述捕获抗体的制备方法包括如下步骤:
(1)抗原的制备:通过分子克隆的方法把X型胶原蛋白α1基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到抗原,此抗原也可作为标准品用;所述抗原的制备也可以使用现有常规方法制备,在此不再累赘。
(2)捕获抗体的制备:将上述抗原免疫哺乳动物,得到相应的单克隆抗体为捕获抗体;所述哺乳动物是小鼠及兔子,优选小鼠;所述捕获抗体的制备也可以使用现有常规方法制备,在此不再累赘。
所述检测抗体包括X型胶原蛋白α1制得的多克隆抗体。
所述捕检测抗体为将X型胶原蛋白α1的基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到相应的抗原,将所述抗原免疫哺乳动物得到的相应多克隆抗体。所述检测抗体的制备方法包括如下步骤:
(1)抗原的制备:通过分子克隆的方法把X型胶原蛋白α1基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到抗原,此抗原也可作为标准品用;
(2)检测抗体的制备:将上述抗原免疫哺乳动物,得到相应的多克隆抗体为检测抗体,所述哺乳动物是小鼠及兔子,优选兔子。
所述捕获抗体可以预先包被于 PVC 材质的微量滴定板的孔内,可以简化步骤,提高检测效率。
用于直肠癌体外诊断试剂盒的制备方法,其包括以下步骤:
(1)抗原的制备:通过分子克隆的方法将X型胶原蛋白α1基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到所需的抗原,其中,所述抗原也可作为标准品用;
(2)捕获抗体的制备:将上述抗原免疫哺乳动物得到相应的单克隆抗体,所述单克隆抗体作为本试剂盒的捕获抗体;
(3)检测抗体的制备:将上述抗原免疫哺乳动物得到相应的多克隆抗体,所述多克隆抗体作为本试剂盒的检测抗体;
(4)捕获抗体包被:
①.用碳酸盐/碳酸氢盐缓冲液 (pH9.6) 将浓度为 1μg/ml 的捕获抗体包被于微量滴定板的孔;
②.用粘合塑料制品封盖微量滴定板并在 4℃下孵育过夜;
③.弃去包被液(碳酸盐/碳酸氢盐缓冲液稀释的捕获抗体),并用洗涤液洗涤微量滴定板两次,每次在微孔中加入 200 μl PBST(磷酸盐吐温缓冲液),在水槽上方轻轻甩动微量滴定板,除去洗涤液,在纸巾上轻拍微量滴定板,除去剩余的液滴,晾干放于4℃环境中备用;所述洗涤液为PBS(磷酸盐缓冲液)中加入一定量的Tween 20,所述Tween 20的质量百分比浓度为0.05%;
(5)封闭
①.在微量滴定板的每孔添加 200μl 封闭缓冲液(为含1.2%BSA(牛血清白蛋白)的PBS(磷酸盐缓冲液)),用于封闭包被孔中剩余的蛋白质结合位点;
②.用粘合塑料制品封盖微量滴定板并在37℃孵育1小时;
用于直肠癌体外诊断试剂盒的检测方法,其包括以下步骤:
(1) 抗原的制备:通过分子克隆的方法将X型胶原蛋白α1基因克隆到真核表达载体,并在哺乳动物细胞中实现蛋白的表达,纯化后得到所需的抗原,其中,所述抗原也可作为标准品用;
(2)捕获抗体的制备:将上述抗原免疫哺乳动物得到相应的单克隆抗体,所述单克隆抗体作为本试剂盒的捕获抗体;
(3)检测抗体的制备:将上述抗原免疫哺乳动物得到相应的多克隆抗体,所述多克隆抗体作为本试剂盒的检测抗体;
(4)捕获抗体包被:
①.用碳酸盐/碳酸氢盐缓冲液 (pH9.6) 将浓度为 1μg/ml 的捕获抗体包被 微量滴定板的孔;
②.用粘合塑料制品封盖微量滴定板并在 4℃下孵育过夜;
③.弃去包被液(碳酸盐/碳酸氢盐缓冲液稀释的捕获抗体),并用洗涤液洗涤微量滴定板两次,每次在微孔中加入 200 μl PBST(磷酸盐吐温缓冲液,可以是含0.05%吐温-20的pH7.4的磷酸盐缓冲液),在水槽上方轻轻甩动微量滴定板,除去洗涤液,在纸巾上轻拍微量滴定板,除去剩余的液滴,晾干放于4℃环境中备用;所述洗涤液为PBS(磷酸盐缓冲液)中加入一定量的Tween 20,所述Tween 20的质量百分比浓度为0.05%;
(5)封闭
①.在微量滴定板的每个孔添加 200μl 封闭缓冲液(1.2%BSA/PBS),封闭包被孔中剩余的蛋白质结合位点;
②.用粘合塑料制品封盖微量滴定板并在37℃孵育1小时;
(6)加样
①.将 100 μl 适当稀释(稀释20倍)的样品添加到每个孔,在 37℃ 下孵育 60 分钟;要得到准确的定量结果,通常做法是比较未知样品与标准曲线的信号。每个酶标板都必须测定标准品(两重测定或三重测定)和空白样,以确保准确性;
②.弃去样品,并洗涤微量滴定板三次,每次在微孔中加入 200μl PBST(磷酸盐吐温缓冲液);
③.将 100 μl浓度为 0.5μg/ml的检测抗体添加到每个孔;
④.用粘合塑料制品封盖微量滴定板并在37℃孵育 1小时;
⑤.用 PBST 洗涤微量滴定板四次;
⑥.添加 100 μl 标记二抗,其在使用前便已在PBS中稀释10000倍(1:10000),所述标记二抗可以为HRP标记羊抗兔;
⑦.用粘合塑料制品封盖微量滴定板并在37℃孵育 1小时;
⑧.用 PBST 洗涤微量滴定板四次;
(7)检测
①.将 TMB(3,3',5,5'-四甲基联苯胺) 溶液添加到每个孔,孵育 15-30 分钟,添加等体积的终止液 (2 M H2SO4),然后用酶联免疫检测仪在450 nm 处读取光密度;
②.由系列稀释液得到的数据绘制标准曲线,浓度标在 X 轴(对数标度)上,而吸光度标在 Y轴(线性标度)上,通过内插法在此标准曲线上得出样品浓度。
本发明用于直肠癌体外诊断试剂盒把X型胶原蛋白α1升高作为诊断早中期直肠癌的标准,检测原理如图1所示;X型胶原蛋白α1下降作为直肠癌治疗效果评估的标准。可以用于临床上通过检测血中肿瘤标记物水平的高低对直肠癌的治疗效果进行动态评估。另外还可以用于临床上对直肠癌的复发转移及预后判断的应用;也可用于直肠癌诊断。
试验效果说明
双抗体夹心 ELISA最佳实验条件的选择
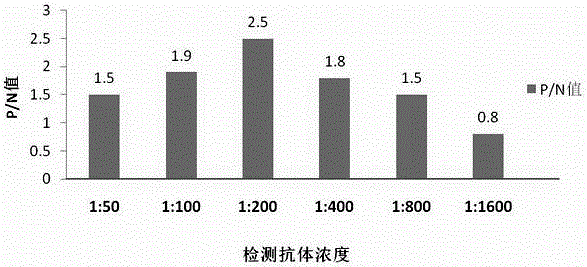
包被鼠抗X型胶原蛋白α1单抗最佳工作浓度的选择 :根据方阵法确定包被浓度为1ug/mL时,单克隆抗体的OD值为1.05,所以其最佳包被浓度为1ug/mL。如图2所示, 兔抗X型胶原蛋白α1多抗最佳工作浓度的选择:随着单抗稀释倍数的增加,待测直肠癌病例血清和正常人血清 OD值有递减的趋势,当抗体浓度为 1:200时,阳性对照 (阳性对照 OD值减去空白对照 OD值 )与正常对照 (正常对照 OD值减去空白对照 OD值 )A450nm之比 (简称 P/N值 )较高,故选择兔抗人抗体最佳工作浓度为 1:200。血清摸索的最佳工作浓度为 1:25。封闭液摸索最佳工作溶度为 1.2%BSA。
临床血清标本检测
共检测了50份血清标本,以医院经病理确诊为直肠癌患者血清为阳性对照组(34例(其中早期直肠癌15例,晚期直肠癌19例)),非直肠癌患者包括直肠息肉、正常人群血清为阴性对照组(85例(正常50例,直肠息肉35例)) ,PBST为空白对照,通过上述双抗夹心ELISA法进行定性及定量检测临床血清标本。如图2所示,以 P/N值 >2为双抗夹心ELISA阳性判定标准,以病理诊断为标准对临床血清标本进行检测, 图3说明直肠癌患者血清中X型胶原蛋白α1的水平显著高于正常人(P<0.01)。早期直肠癌结果检测灵敏性(SN)为 58%(9/15),晚期直肠癌检测灵敏性(SN)为 73%(14/19);正常人检测特异性(SP)为 72%(36/50),直肠息肉患者检测特异性(SP)为 61%(21/35)。见图4-5.
临床对直肠癌的治疗效果进行动态评估
为确定本试剂盒能否用于对直肠癌的治疗效果进行动态评估,我们收集了27份直肠癌患者治疗前后的血清。27个患者的检测结果参见图6,结果显示直肠癌患者治疗前后的血清中X型胶原蛋白α1的水平有显著差异(P<0.05)。有效治疗后血清中X型胶原蛋白α1的水平会大大下降,提示本试剂盒能用于对直肠癌的治疗效果进行动态评估。
- 还没有人留言评论。精彩留言会获得点赞!