一种基于距离检测靶标的集成化ELISA芯片及其检测方法与流程
背景技术:
酶联免疫吸附反应(Enzyme-Linked Immunosorbent Assay,ELISA)最早在1971年由Engvall和Perlmann提出。它是一种将已知抗体或抗原吸附在固相载体(如聚苯乙烯板、微孔滤膜、磁珠等)表面并保持其免疫原性,利用酶标抗原抗体间的特异性反应进行标记,根据酶催化底物显色深浅程度进行定性或定量检测的技术。该方法具有适用范围广、灵敏度高、特异性强、操作规范及易于自动化等优点,在食品安全检测、水污染防治和临床疾病诊断等领域成为备受重视并广泛应用的检测分析方法。目前,基于免疫反应的临床诊断等主要依赖于光学、电学、磁学等分析方法。然而这些检测手段一般均需大型仪器和专业操作人员,操作复杂,耗时久,且费用昂贵。为了克服这些局限性,发展新型的信号转导、简单输出方法是目前科学家们的研究热点,例如研究者们已发展了以血糖仪、时间、气味等作为信号输出方法的便携式传感器,用于快速、原位、低成本检测,然而这些方法仍然存在操作复杂、灵敏度低等、集成化程度低等问题(1.Y.J.Song,Y.Q.Zhang,P.E.Bernard,J.M.Reuben,N.T.Ueno,R.B.Arlinghaus,Y.L.Zu,L.D.Qin,Nat.Commun.2012,3,1283.;2.H.Noh,S.T.Phillips,Anal.Chem.2010,82,8071–8078.;4.H.Mohapatra,S.T.Phillips,Angew.Chem.Int.Ed.2012,51,11145–11148;Angew.Chem.2012,124,11307–11310.)。因此,发展更为高灵敏、高选择性、简单、廉价、集成化程度高的新型即时检测技术,用于生物医学分析,尤其是特定疾病的生物标志物的定量检测,成为目前生物医学亟待解决的问题。
建立ELSIA作为一个快速、廉价以及集成化的检测方法用于POCT的检测,研究者们做出了很多尝试。Vashist等尝试用一步法ELSIA降低整个实验的时间,但其整个操作过程仍然需要专业操作,以及专门的信号读出仪器(5.S.K.Vashist,E.M.Schneider,E.Lam,S.Hrapovic and J.H.T.Luong,Scientific Reports,2014,4,7.)。Yeh等将三明治ELSIA集成到一块芯片上,即使用智能手机可以将信号读出方式,但其仍然需要将样品用枪头析出然后再进行检测,不算真正意义的集成(6.Y.-T.Yeh,M.Nisic,X.Yu,Y.Xia and S.-Y.Zheng,Annals of Biomedical Engineering,2014,42,2333-2343.)。Dai-Wen Pang等人用纸芯片实现了CRP蛋白的检测,而荧光作为信号也限制了其在POCT领域的应用(7.Jiao Hu,Zhi-Ling Zhang,Cong-Ying Wen,Man Tang,Ling-Ling Wu,Cui Liu,Lian Zhu,and Dai-Wen Pang.Anal.Chem.,2016,88(12),pp 6577–6584)。所以尽管POC检测目前研究者们已经做出来大量尝试,然而建立一种真正集成化、便携、快速廉价、高灵敏的检测方法迫在眉睫。
综上所述,在未来的科学研究中,如何发展一种高灵敏、高选择性、简单、廉价、集成化程度高的新型即时检测技术,用于生物医学分析,尤其是特定疾病的生物标志物的定量检测,可应用于即时诊断的的定量检测分析方法是亟待解决的问题。
技术实现要素:
本发明针对现有高灵敏定量检测分析方法及其仪器设备价格昂贵、实验方法成本高、免疫反应操作复杂、耗时等缺点,发展了一种基于距离检测靶标的集成化ELISA芯片方法。该方法采用分子识别引入信号放大分子如酶或纳米粒子,通过信号放大分子或粒子催化底物释放出大量气体分子,实现信号放大,因而可以用于实验室中高灵敏度、高选择性的无机离子、小分子、生物大分子例如蛋白质、DNA、甚至病毒、细菌、细胞等多种靶标的高灵敏度定量。另外,将繁琐的免疫反应以及距离信号输出集成在一起,所有实验方法均在芯片内完成,不需任何外接仪器的即时检测系统,能用于集成化地、高灵敏度POC定量检测分析。
本发明的技术方案如下:
一种基于距离检测靶标的集成化ELISA芯片,其设有多个水相腔和油相腔,该水相腔和油相腔交替排列为一行,且前后的腔体互相连通,水相腔设有水相进口,油相腔设有油相进口,行末的水相腔和一染料腔连接,该染料腔另设有第三进口;染料腔和一染料气柱通道连通,染料气柱通道旁设有刻度。
在较佳的实施例中,水相腔的数量和油相腔的数量分别为5-15个。
在较佳的实施例中,水相腔中至少包括过氧化氢溶液,PtNPs溶液,链霉亲和素溶液和生物素化抗体溶液,每种溶液独立设于一水相腔内。
在较佳的实施例中,油相腔中含有矿物油。
在酶联免疫吸附法体系中,基于距离检测靶标的定量检测方法包括如下步骤:(1)根据要检测的抗原选择相对应的捕获抗体及检测抗体;(2)对信号放大分子进行修饰,使其与检测抗体分子偶联结合,或使其能够特异性的与检测抗体结合;(3)在磁珠或微球表面进行包被,加入捕获抗体使其结合于包被后的固相表面,之后进行封闭液封闭。(4)将以下试剂载入芯片:检测抗原与捕获抗体包被的磁珠,检测抗体、信号放大分子,洗去多余试剂的洗涤缓冲液,底物以及染料,其中;水相从水相进口进入水相腔;油相从油相进口进入各油相腔,染料加入染料腔,磁珠和样品加入第一个水相腔;(5)密封加样孔,磁移动,利用磁铁对磁珠拉动,将磁珠和样品从第一个水相腔拉至最后一个水相腔,完成每一步反应,信号放大分子催化底物分子,生成大量气体分子,气体推动染料前进产生距离信号;(6)根据距离信号,记录数据,进而建立标准曲线,实现未知样品中靶标分子的定量检测。
本发明一种基于距离检测靶标的集成化ELISA芯片方法,将繁琐的免疫实验步骤、清洗步骤、距离信号输出集成到一块微流控气动芯片上,利用分子识别引入信号放大分子或粒子,通过信号放大分子或粒子催化底物释放出气体分子,导致气体推动染料前进,并最终通过读取染料移动的距离,实现高灵敏定量集成化检测。
其中,所述的集成,是将繁琐的免疫反应以及距离信号输出集成在一起,所有实验方法均在芯片内完成,组成一个不需任何外接仪器的即时检测系统。
其中,基于距离的可视化定量方法是将不同浓度的待测物作为信号输入,经过特定的反应后以不同长度的有色条带作为输出信号。用户只需要通过读取条带的长度,即可实现对待测物的可视化定量检测。
其中,所述的分子识别包括,利用具有特异性识别功能的分子对所述靶标进行识别或标记,并通过将该识别分子将信号放大分子或粒子引入检测体系中。
其中,所述信号放大分子包括能够催化底物产生气体的催化剂或酶,其催化底物为受催化后产生气体分子的物质,气体分子为底物受催化后的产物。
其中,所述的信号放大分子包括过氧化氢酶、金纳米粒子、铂纳米粒子、金铂纳米粒子、锰氧化物纳米粒子或其他可以催化底物产生气体的催化剂或酶。
其中,检测探针上偶联有能够催化底物产生大量气体的信号放大分子,例如酶或纳米粒子。
其中,使用的检测探针通过化学或生物的偶联方法与信号放大分子(酶或纳米粒子)偶联,通过检测探针的特异性引入酶或纳米粒子。
本发明的优点在于:首先,该方法在设计上符合ASSURED(Martinez A.,Phillips S.,Whitesides G.,et.al.,Diagnostics for the Developing World:Microfluidic Paper-Based Analytical Devices,Analytical Chemistry[J].2010,82.3-10.)的国际标准,它灵敏度高、选择性好,检测结果可靠;其次,整个反应过程简单、快速,只需移动磁珠完成整个免疫过程,时间在2个小时内,集成化程度高;再者,将产生O2的体积量转化为距离,并与免疫反应集成在一张微流控芯片上,能用于集成化地、高灵敏度POC定量检测分析。该发明是以距离作为信号输出,ELSIA过程一体化,即将不同浓度的待测物作为信号输入,经过特定的反应后以不同长度的有色条带作为输出信号,用户只需要通过读取条带的长度,即可实现对待测物的可视化定量检测。此类芯片设计灵活,通用性强,可以针对不同靶标达到相应的动态检测范围。该方法不需任何外接仪器,检测结果不受用户个体差异和环境的影响,并且易于集成,在医疗诊断、环境监测、食品安全领域具有很大的应用价值。鉴于成本低廉,检测快速,用户友好、集成化以及基于距离检测的优势,我们提出的基于距离检测靶标的集成化ELSIA芯片方法有可能发展成为公众用于广泛的靶标定量检测工具。
本发明利用油水互不相容的原理,将水相试剂以及磁珠物理的隔开,再通过磁铁拉动磁珠完成每一步反应,实现反应的集成;利用纳米粒子催化双氧水生成大量气体,将检测靶标分子的信号转换为气体信号,实现信号放大,气体推动染料前进,并最终通过读取染料移动的距离,实现高灵敏定量集成化检测。本发明中,以具有广泛临床意义的C-反应蛋白(C-reaction protein,CRP)作为靶标,证明了该发明的可行性、适用性、及可靠性。并以通过对肿瘤标志物前列腺特异性抗原(Prostate specific antigen,PSA)的检测,证明该发明的体系通用性。
本发明方法检测灵敏度高,且具有操作简单、价格低廉、反应快速、集成化程度高,且通用性好,可用于血液、唾液等各种复杂体系中蛋白靶标的快速、高灵敏定量检测。
附图说明
图1为在室温下,不同浓度生物素化的PtNPs的距离响应情况可行性考察。
图2为在室温下,不同浓度的Tween20对磁珠滞留及免疫实验的影响考察。
图3为在室温下,气柱深度对实验灵敏度以及重现性的影响。
图4为在室温下,不同浓度生物素化的PtNPs的距离响应情况考察。
图5为在室温下,不同浓度生物素化的PtNPs的距离线性响应情况。
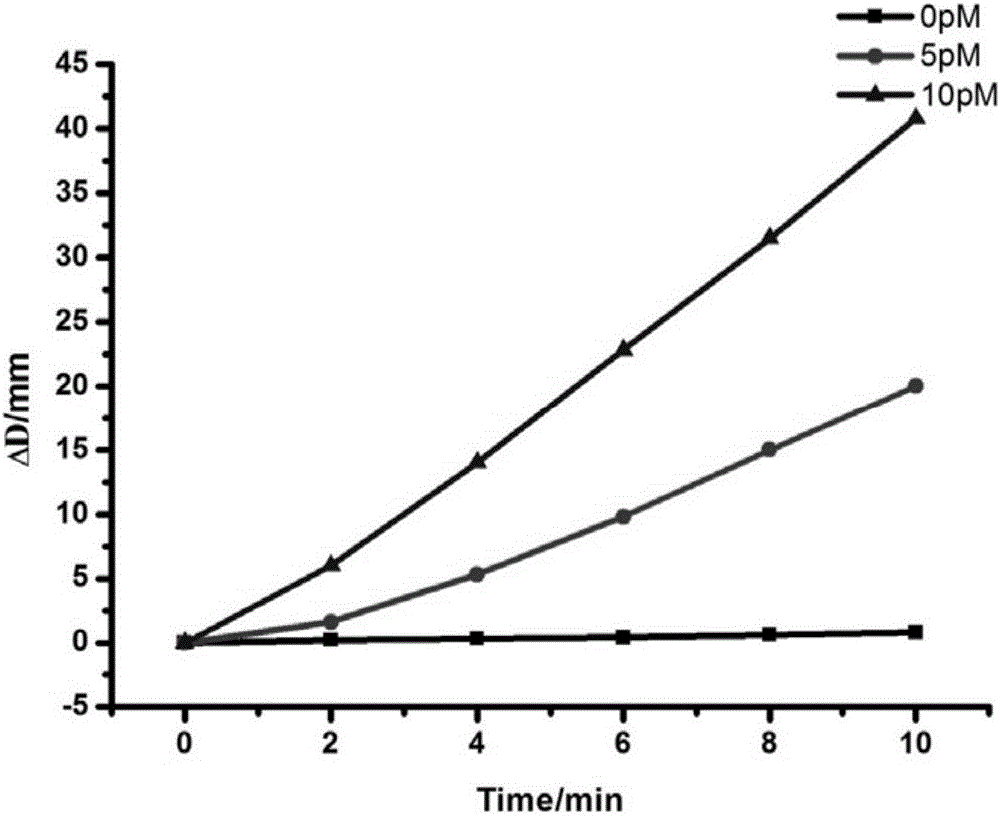
图6为在室温下,免疫体系中,信号分子为生物素化的PtNPs,在10min时间内,用于C-反应蛋白的检测,考察体系的可行性。
图7为在室温下,免疫体系中,信号分子为生物素化的PtNPs,在10min时间内,用于C-反应蛋白(CRP)的检测,进行工作标准曲线的绘制,时间为5min。
图8为在室温下,免疫体系中,以人血清白蛋白(HSA)、羊抗鼠二抗(IgG)、凝血酶(Thr)为负对照,考察该体系对C-反应蛋白(CRP)的选择性,图为对于0.05μg/ml HSA、IgG、Thr、PSA的响应,反应时间为5min。
图9为在室温下,免疫体系中,使用芯片方法,将不同浓度靶标蛋白加入到血清中排除基质效应,考察C-反应蛋白(CRP)检测的标准曲线,时间为5min。
图10为在室温下,免疫体系中,以常规免疫比浊为标准方法,将不同浓度靶标蛋白加入到血清中排除基质效应,考察C-反应蛋白(CRP)检测的标准曲线,时间为5min。
图11为在室温下,对未知临床样品进行检测,比较临床标准方法和芯片方法的准确性。
图12为在室温下,以人前列腺特异性抗原(PSA)作为靶标,考察芯片的体系通用性。
图13为芯片的结构示意图,其中A为上层结构示意图,B为中层结构示意图,C为下层结构示意图。
具体实施方式
实施例1:芯片的制作
根据计算机中Auto CAD的芯片设计,在PMMA材料上激光刻蚀产生所要的微结构与微通道,中间一层包含11个圆形孔,9个椭圆孔,以及气柱通道。上面一层为水相加入通道以及加样孔,最下层为油相加入通道。三层芯片的厚度均为2.2mm。光切割好的PMMA片利用热键和的方式将三层键合在一起。为了防止毛细作用,键合后的芯片通道用氟油孵化,过夜氟油挥发后,芯片待用。
具体的,参见图13,该芯片包括上层1、中层2和下层3,其中,中层2中间设有一行由圆形孔和椭圆形孔交替设置的腔,其中圆形孔为水相腔21,椭圆形孔为油相腔22,且这些孔是互相连通的。在最左侧的圆形孔侧面设有染料腔23,该最左侧的圆形孔和染料腔23连通。该中层设有S形弯折排列的染料气柱通道24,染料气柱通道24的侧面设刻度25.染料气柱通道24的起点和染料腔23连通,终点为出气孔26。中层的右上角设多个油相通孔27,其数量和油相腔22的数量一致或更多。
上层左上角设有多个水相进样孔12,该每个水相进样孔12分别和一水相槽11连接,每条水相槽11设于上层的下表面,起点位于水相进样孔12,终点位于中层水相腔21的对应位置。上层的右上角设有多个油相进样孔17,其位置和数量分别中层右上角的油相通孔27的位置和数量对应,数量也可更多。上层还设有连通染料腔23的第三进样孔13,用于加可视化的红色染料。
下层上表面设有多道油相槽37,每个水相槽37起点分别为中层的油相通孔27对应的位置,终点为中层的油相腔22对应的位置。
在使用时,油相从上层的各油相进样孔17进入,然后分别经过中层的油相通孔27,再经过下层的油相槽37进入各油相腔22;水相从上层的水相进样孔12进入,经过水相槽11分别进入各水相腔21。染料腔23的原料从第三进样孔13进入。
在其它的实施例中,油相槽37和水相槽11也可分别设于中层的上下表面,或是两者之一设在中层。
实施例2:biotin基团及巯基基团修饰的核酸分子的合成与纯化
以普通CPG作为固相载体,以DNA单体碱基为原料,在DNA合成仪上由3′端向5′端合成表1中的序列DNA,具体合成的序列见表1。以biotin修饰的CPG作为固相载体,以DNA单体碱基为原料,在DNA合成仪上由3′端向5′端合成,最后5′端修饰修饰巯基。合成结束后,将上述CPG转移至2mL洁净灭菌的Eppendorf管中,加入0.5mL甲胺:氨水=1:1的溶液,在65℃下氨解30min,使DNA从CPG上切割下来。氨解完毕后提取上清,并用少量超纯水清洗CPG,合并上清。向体系中加入2.5倍体积的冰冻无水乙醇和0.1倍体积的3mol/L NaCl,于-20℃冰箱进行酒精沉淀30min。酒精沉淀完毕后,在14,000rpm的转速下离心10min,弃上清。将得到的粗产物溶解在pH 8的0.1mol/L的醋酸三乙胺(TEAA)中,使用反相高效液相色谱仪进行纯化。将通过反相-HPLC纯化后的产品进行真空干燥。除巯基修饰DNA外,其余DNA溶于80%乙酸中脱DMT,反应30min后,抽干再用超纯水后溶解,使用凝胶过滤柱进行脱盐处理。使用紫外-可见分光光度计测定260nm处核酸的吸光度,根据DNA的消光系数计算出其相应的物质的量和浓度值。定量后真空浓缩。5’巯基修饰DNA在HPLC纯化后,加入pH 6.5的0.1M TEAA溶解DNA,测A260,将其稀释至A260=100,记录总体积为V;之后加入0.15V的1M AgNO3,混匀,室温反应30min;再加入0.20V的1M DTT(二硫苏糖醇),混匀,室温反应5min;离心,取上清(DTT络合物),沉淀用1V 0.1M TEAA洗涤,合并洗涤液;使用凝胶过滤柱进行脱盐处理。使用紫外-可见分光光度计测定260nm处核酸的吸光度,根据DNA的消光系数计算出其相应的物质的量和浓度值。定量后真空浓缩。
表1实施例2中所用DNA序列
实施例3:PtNPs的合成及修饰
将100μL新鲜配置的0.4M抗坏血酸溶液加至含有1mL浓度为1mM的氯铂酸溶液中,并迅速放置于80℃恒温干浴锅中反应30min,即得30nm大小的PtNPs。为将PtNPs用于后续免疫反应,需对其进行生物分子修饰。文中利用SH-PEG-biotin linker修饰PtNPs获取生物素化的PtNPs(biotin-PtNPs)。具体操作为,将10μL 1%的Tween-20和5μL 100μM的mPEG-SH(MW~5KD)加至1mL 4.5nM的PtNPs中,涡旋混匀后加入10μL 120μM的SH-PEG-biotin linker和50μL 0.2M的H3PO4溶液,涡旋混匀后于37℃条件下反应1h。反应结束后,用含有0.1%Tween-20和0.5%BSA的PBS溶液(pH7.4)在13000rpm转速下离心洗涤3次,每次4min,最后重悬在1mL上述溶液中即得终浓度为2.5nM的biotin-PtNPs,放置于4℃冰箱保存备用。
实施例4:生物素化辣根过氧化物酶(HRP)的制备
利用Biotin-NHS与蛋白-NH2之间发生酯交换反应制备生物素化的抗体(biotin-antibody)。用pH 9.0的0.1M NaHCO3缓冲液稀释抗体得1mg/mL HRP溶液,向其中缓慢滴加1/8体积的含有1mg/mL Biotin-NHS的DMF溶液,涡旋混匀后,4℃冰箱过夜反应。反应结束后,在30k大小的超滤离心管中,用含有0.1%Tween-20,pH 7.4的PBS缓冲液,14000rpm,4℃下离心洗涤3次,每次30min。最后重悬于500μL含有0.1%Tween-20,0.5%BSA,pH 7.4的PBS缓冲液中,得1mg/mL的biotin-HRP,4°C冰箱保存备用。
实施例5:试剂载入芯片
依次将可视化的红色染料、过氧化氢,PtNPs,链霉亲和素,生物素化抗体,以及洗液PBST加入到圆形孔中(可视化的红色染料通过第三进样孔13加入染料腔23,其余通过进样孔12加入,加样顺序从左至右,每个圆形孔加一种样品;在ELISA每一步之间加入一步PBST用于清洗,链霉亲和素和PtNPs之间加入两步PBST,用于彻底清洗)。然后通入矿物油至椭圆孔(油相进样孔17加入,加样顺序从左至右),;然后将样品和磁珠混合物加至最右边第一个圆形孔,最后在最右边第一个油相孔中加入矿物油。
样品和磁珠混合物的制备过程:2mg/mL的磁珠吸去上清,加入一系列浓度的CRP样品,混匀。
实施例6:磁移动及数据记录
利用直径20mm/厚1mm的超薄磁铁片,连续5-10个,将磁微珠从一个圆形孔拖到另一个圆形孔。反应时间依次为,样品反应30min,抗体反应30min,链霉亲和素反应15min,PtNPs反应15min,每一孔洗涤时间5min,用superglue粘盖玻片,保证气密性,将磁珠转移至过氧化氢孔中,产气记录数据。
其结果见图1至图13。
图1结果表明:随着产气时间的延长,不同浓度的PtNPs具有不同的距离响应。
图2结果表明:不同浓度的tween20对ELISA的结果没有影响,1%的tween20条件下,磁珠没有残留。
图3结果表明:不同高度的气柱通道条件下,气柱通道为600微米时,距离响应具有很好的稳定性和灵敏度。
图4结果表明:不同浓度的PtNPs在10min内具有不同的距离响应。
图5结果表明:不同浓度的PtNPs对距离具有良好的线性响应。
图6结果表明:0.05μg/mL的CRP在5min产气情况下,具有一定的距离响应。
图7结果表明:不同浓度的CRP对距离具有良好的线性响应。
图8结果表明:本发明方法具有良好的特异性。
图9结果表明:以血清作为基质,不同浓度的CRP对距离具有良好的线性响应。
图10结果表明:临床标准方法对CRP的检测的响应曲线。
图11结果表明:通过对16例临床标本的检测,本发明的方法和临床标准方法具有很好的一致性,
图12结果表明:通过对PSA的检测,本发明的方法具有很好的通用性。
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!