具有提高的灵敏度的免疫检定的制作方法
背景技术:
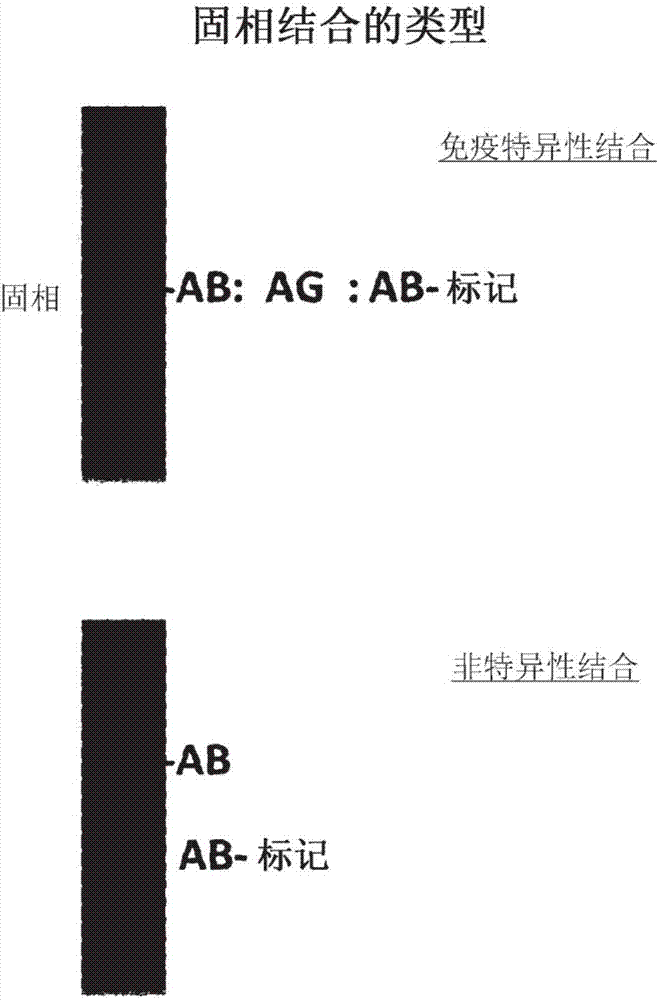
:提高免疫检定灵敏度已为发展活体外诊断性检验的长期目标。灵敏生物标记测量对于患者治疗类选法中的早期疾病检测和成本效益的益处在文献中有充分记载。随时间已在数代中提供多种临床检定,其中每一后续迭代具有改良的灵敏度的特征。肌钙蛋白i免疫检定为一个此类实例,其中高灵敏度版本代表现有技术水平。几个临床因素造成驱使采用高度灵敏的肌钙蛋白i(hstnl)检定。人们认识到正常患者具有在个位数pg/ml范围内的循环的、低含量的tni。第二,轻微的心脏病发作具有与正常值非常类似的tni含量。因此,在正常范围内检测tni的能力至关重要。apple(clin.chem.,55:1303-1306,2009)报道了hstni检定的指定重点在于用正常样品进行。图1展示hstni检定必须满足的参数。高于50%的正常值必须被检测到,并且在第99个百分位的正态分布处的不精确性必须<10%以在准则是可接受的,或为10-20%以在临床上适用。图2说明具有捕捉抗体和标记抗体的典型夹心免疫检定模式,其中将捕捉抗体固定于固相上。存在两种基本类型的通过标记抗体的结合。当标记抗体与固相上的抗原形成复合物时,免疫-特异性结合发生。因为它能够实现抗原检测,所以这为相关特异性结合。第二种类型的结合为非特异性的,其中标记抗体不经特异性抗原而与固相结合。被配置成夹心免疫检定的每一种固相具有特异性与非特异性结合的某一组合。用高灵敏度的免疫检定,在低抗原含量下特异性与非特异性结合的比率变得至关重要。因此,高灵敏度检定的开发人员力求使特异性结合最大化同时寻求使非特异性结合减到最少的方式。附图说明图1展示基于正常值高度灵敏的肌钙蛋白i(hstnl)必须满足的参数。图2说明典型固相夹心免疫检定模式。ab=抗体,ag=抗原。图3说明荧光检测系统的一个实施例,其在探针头上检测荧光。图4说明替代性的荧光检测系统。具有宽激光束和聚光透镜的数值孔径的光学器件检测液相中的洗脱标记抗体。图5说明一种检测液体样品中的分析物的方法,所述方法在直接抗体结合检定中使用荧光标记抗体和酸洗脱方案。通过从探针上的第一荧光信号读数中减去探针上的第二荧光信号读数计算洗脱物质的荧光信号。ab:抗体。图6说明一种检测液体样品中的分析物的方法,所述方法在扩增检定中使用结合对和具有多个荧光标记的高分子量聚合物。ag:抗原,ab:抗体;b-ab:生物素(biotin)-抗体;cy5-sa:cy5-抗生蛋白链菌素(streptavidin)。图7说明一种在循环扩增检定中检测液体样品中的分析物的方法,图7与图6类似,除了图7具有提高灵敏度的额外的循环扩增步骤。具体实施方式定义申请专利范围和说明书中所用的术语除了并且如下文所阐述的定义由本领域的普通技术人员根据他们的常用含义理解。如本文所用,术语“约”是指在所述值的±10%内。如本文所用,“分析物结合”分子是指能够参与与分析物分子的特异性结合反应的任何分子。实例包括但不限于,(i)抗原分子,以用于检测特异性针对其抗原的抗体的存在;(ii)抗体分子,以用于检测抗原的存在;(iii)蛋白质分子,以用于检测其蛋白质的结合伴侣的存在;(iv)配体,以用于检测结合伴侣的存在;或(v)单链核酸分子,以检测核酸结合分子的存在。形状的“纵横比”是指其较长尺寸与其较短尺寸的比率。“结合分子”是指能够结合所关注的另一分子的分子。如本文所用,“结合对”是指彼此吸引并且具体来说与彼此结合的两个分子。结合对的实例包括但不限于:抗原和针对抗原的抗体、配体和其受体、互补核酸链、生物素和抗生物素蛋白(avidin)、生物素和抗生蛋白链菌素、生物素和中性抗生物素蛋白(抗生物素蛋白的脱糖基化形式)、凝集素(lectin)和碳水化合物。优选的结合对为生物素和抗生蛋白链菌素、生物素和抗生物素蛋白、生物素和中性抗生物素蛋白、荧光素和抗荧光素、洋地黄毒苷(digoxigenin)/抗洋地黄毒苷以及dnp(dinitrophenol,二硝基苯酚)和抗dnp。如本文所用,“分支聚合物”是指具有2维或3维结构的非线性聚合物,其可为天然存在的分支聚合物或合成的交联聚合物。如本文所用,“化学发光”是指由于化学反应发射有限光发射的能量。举例来说,当鲁米诺(luminol)与过氧化氢在合适的催化剂存在下反应时,它产生呈激发态的3-氨基邻苯二甲酸,其在它衰减到较低能级时发射光。如本文所用,“电化学发光”(electrochemiluminescence,ecl)是指在溶液中电化学反应期间产生的发光。在ecl中,电化学产生的中间物经历高度放能反应以产生电子激发态并且随后发射光,ecl激发由电致物种的高能电子转移(氧化还原)反应引起。通常在将电势(几伏)施加到含有发光物种的溶液的电化学电池的电极期间观察到ecl。如本文所用,“固定”是指被固定到固体表面上的试剂。当试剂被固定到固体表面上时,它被非共价结合或共价结合到表面上。如本文所用,“单块衬底”是指单一块固体材料,如具有一种折射率的玻璃、石英或塑料。如本文所用,“探针”是指在感测面用分析物结合分子的薄膜层涂布的固相衬底。探针具有末端和近端。近端(也是指本申请案中的探针头)具有用分析物结合分子的薄层涂布的感测表面。本发明涉及一种在免疫检定中增加信背比并且因此提高检定灵敏度的方法。本发明人已发现,从固相中洗脱特异性免疫复合物的条件不同于洗脱非特异性复合物的条件。本发明人已发现洗脱条件,其优选地从固相中洗脱非特异性复合物内的特异性免疫复合物,并且随后设计提高特异性结合与非特异性结合的测量比率并且由此提高检定灵敏度的免疫检定方案。本发明通过在它结合到固相上之后测定从固相中洗脱的标记免疫复合物的信号来检测分析物。荧光检测系统本发明可使用任何合适的发光检测系统。在一个实施例中,本发明使用与在美国专利第8,492,139号(其以全文引用的方式并入本文中)中描述的类似的荧光检测系统以测量探针头上的荧光信号。所述系统包含:(a)长度与宽度的纵横比为至少5比1的探针,所述探针具有第一端和第二端,第二端具有与荧光标记结合的感测表面;(b)将激发光直接发射到探针的感测表面上的光源;(c)指向感测表面的聚光透镜;和(d)用于检测发射荧光的光检测器;其中聚光透镜收集发射荧光并且引导到光检测器上。探针可为单块衬底或光纤。探针可为任何形状,如条形、圆柱形、圆形、正方形、三角形等,其中长度与宽度的纵横比为至少5比1,优选的是10比1。因为在免疫检定期间探针浸渍于样品溶液和一种或多种检定溶液中,期望具有纵横比为至少5比1的长探针以使探针头浸没到溶液中。探针的感测表面用分析物结合分子涂布并且与荧光标记结合。对于荧光标记可发射适当激发光的任何光源适用于本发明。优选光源为可发射具有适于荧光标记的波长的光的激光。举例来说,针对cy5荧光染料激光中心波长优选为649nm。用于检测发射光的合适光检测器为光电倍增管(photomultipliertube,pmt)、电荷耦合器件(chargecoupleddevice,ccd)或光电二极管。光源和包括聚光透镜的光检测器安放在探针头表面的相同面(感测表面)上。如果感测表面朝下,那么它们两者都安放在尖端表面下方。如果感测表面朝上,那么它们两者都安放在尖端表面上方。它们比探针的另一端更靠近感测表面。感测表面始终在聚光透镜的数值孔径内。探针可以但并不需要与聚光透镜中心对齐。图3说明测量探针头上的荧光信号的荧光检测系统的一个实施例。图4说明替代性的光学检测配置。具有宽激光束和聚光透镜的数值孔径的光学器件检测流体相中的洗脱标记抗体。这种设计有几个优点。在探针头处测量荧光需要选择具有低背景荧光的探针材料。在这种替代性配置中,荧光呈液相。因为探针不再在测量步骤中,所以它为探针提供固相材料的更多选择。此外,宽束激光和广泛范围的荧光收集对光学器件对齐的要求没有那么严格,这使得成本更低并且仪器更稳定。直接抗体结合检定在第一方面,本发明是针对一种检测液体样品中的分析物的方法,所述方法使用发光标记抗体和酸洗脱方案。在一个实施例中,通过从探针上的第一发光信号中减去探针上的第二发光信号计算洗脱物质的发光信号。所述方法包含以下步骤:(a)将探针头浸渍到含有样品溶液的样品容器中以使分析物(如果存在)与探针头上的第一抗体结合,其中探针具有固定于探针的尖端的针对分析无的第一抗体;(b)将探针头浸渍到含有试剂溶液的试剂容器中,所述试剂溶液包含针对分析无的第二抗体,所述第二抗体与发光标记缀合以在探针头上在分析物、第一抗体和第二抗体当中形成免疫复合物;(c)将探针头浸渍到含有洗涤溶液的洗涤容器中;(d)将探针头浸渍于读取容器中并且测量结合于探针头上的物质的第一发光信号;(e)将探针头浸渍到ph为2.0-5.0的洗脱液中以从探针头中洗脱物质;(f)将探针头浸渍于读取容器中并且测量结合于探针头上的物质的第二发光信号;(g)通过从第一发光信号中减去第二发光信号计算洗脱物质的发光信号,并且测定分析物的量。在图5中说明所述方法。在本发明方法中,在检定之前用针对分析无的抗体固定探针。将第一抗体固定到固相(探针头的感测表面)上的方法在免疫化学中很普遍,并且涉及固相与抗体之间的共价键、疏水键或静电键的形成。第一抗体,由于其捕捉分析物的能力也被称为捕捉抗体,可通过此项技术中已知的各种方法直接固定于感测表面上。举例来说,通过吸附到固体表面上或通过与固体表面上涂布的氨丙基硅烷共价结合可直接固定第一抗体。或者,第一抗体可通过结合对间接固定于感测表面上。举例来说,第一抗体可通过已知技术(参见wilchek和bayer,(1988)anal.biochem.171:1-32)标记有生物素,并且随后间接固定于用抗生蛋白链菌素涂布的感测表面上。由于他们的强结合亲和力,生物素和抗生蛋白链菌素为优选的结合对,其在本发明方法的再生步骤期间并不解离。当在免疫反应之后使探针感测表面再生以去除结合到感测表面上的免疫复合物时,固定于感测表面上的捕捉抗体必须能够经受住变性条件。固定于感测表面上的捕捉抗体不得失去大量活性或从固相中显著分离,因此免疫检定性能受到影响。在一个实施例中,本发明方法使用具有小尖端的探针以用于结合分析物。尖端具有直径≤5mm、优选≤2mm或≤1mm的较小表面积。探针头的小表面使它具有几个优点。在固相免疫检定中,具有小表面积是有利的,因为它具有较低非特异性结合并且因此产生较低背景信号。此外,由于尖端的小表面积,探针头上携带的试剂或样品极少。这种特征使探针头容易洗涤,并且使洗涤溶液中的污染可忽略,因为洗涤溶液的体积较大。在方法的步骤(a)中,将探针头浸渍到样品容器(或样品腔室或样品阱)中并且培育一段时间,以使分析物与探针头上的第一抗体结合。培育时间优选为较短的一段时间(≤5或10分钟),例如,为5秒到5分钟、10秒到2分钟、30秒到2分钟、10秒到1分钟或30秒到1分钟。在步骤(a)之后,将探针在含有水性洗涤溶液的洗涤容器(或洗涤腔室或洗涤阱)中任选地洗涤1-5次,优选1-3次。如果携载的溶液最少,那么可能不需要这一洗涤步骤。洗涤溶液通常含有缓冲液和表面活性剂,如吐温20(tween20)。在方法的步骤(b)中,将探针头浸渍到试剂容器(或试剂腔室或试剂出售)中以使试剂与探针头上的分析物结合。培育时间优选为较短的一段时间(≤5或10分钟),例如,为5秒到5分钟、10秒到2分钟、30秒到2分钟、10秒到1分钟或30秒到1分钟。试剂溶液包含发光标记的第二抗体(信号抗体)。任何合适的发光标记(如荧光标记或化学发光)可用于这一方法。适用于本发明的荧光标记的分子量<5,000、优选<2,000,如500-2000或100-2000道尔顿。在一个实施例中,荧光染料选自由以下组成的组:花青(cyanine)、香豆素(coumarin)、呫吨(xanthene)和其衍生物。举例来说,荧光染料为cy5(分子量mw792)、alexafluor647、dylight350(mw874)、dylight405(mw793)、dylight488(mw71011)、dylight550(mw982)、dylight594(mw1078)、dylight633(mw1066)、dylight650(mw1008)、dylight680(mw950)、dylight755(mw1092)、dylight800(mw1050)、玉色(oyster)荧光染料、irdye或包含与稀土金属(如镧系(eu、th、sm或dy)螯合的多个环的有机化合物。荧光标记的一个实例为芳基磺酸酯花青(arylsulfonatecyanine)荧光染料,如mujumdar等人(1993)bioconjugatechemistry,4:105-111,southwick等人(1990)cytometry,11:418-430;和美国专利第5,268,486号中所描述。cy5为优选的芳基磺酸酯花青荧光染料,因为它具有高消光系数和良好的量子产率;它还具有大多数生物材料和塑料的自发荧光波长之外的范围(500nm到750nm)内的荧光发射光谱。另外,cy5在水中的溶解度良好,并且具有低非特异性结合特征。其它发光标记可替换荧光标记并且可用于本发明。举例来说,发光标记可为化学发光标记,如鲁米诺(mw177)和吖锭酯(acridiniumester)(9[[4-[3-[(2,5-二氧代-1-吡咯烷基)氧基]-3-氧代丙基]苯氧基]羰基]-10-甲基-吖锭三氟甲烷磺酸酯,mw632)。发光标记也可为电化学发光标记,如钌(ii)三联吡啶(mw1057)。使用如科学和专利文献中所描述的常规缀合化学方法,发光标记可通过多个部分(包括二硫基、羟苯基、氨基、羧基、吲哚或其它官能团)与第二抗体共价结合。将芳基磺酸酯花青荧光染料标记与抗体和其它蛋白质结合的示例性技术描述于美国专利第5,268,486号;第5,650,334号中;其内容以引用的方式并入本文中。将优选的cy5荧光标记连接到抗体上的技术描述于鉴定为目录号a25000,biologicaldetectionsystems,inc.,pittsburgh,pa出版的技术公报中。在步骤(c)中,将探针在含有洗涤溶液的第一洗涤容器中洗涤1-5次、优选1-3次。洗涤溶液通常含有缓冲液和表面活性剂,如吐温20。在步骤(d)中,将探针移到读取容器中,并且通过如上文所描述的发光检测系统(例如参见图3)检测结合于探针头上的免疫复合物的发光信号,其中光源和检测器安放在探针感测表面的同一面(近端面)。或者,可通过其它合适的发光检测系统检测发光信号。读取容器含有水溶液,如水。用于在样品培育之后洗涤探针的洗涤容器也可用作读取容器。在步骤(e)中,通过使用解离物质(如与探针结合的免疫复合物)的变性条件洗脱结合于探针上的免疫复合物。一般来说,ph为约1.5到约5.5或约2.0到5.5的酸或酸性缓冲液可有效地洗脱结合于探针上的免疫复合物。举例来说,盐酸、硫酸、硝酸、乙酸或酸性缓冲液可用于洗脱。视分析物和检定而定,最佳ph可为约ph2.0-3.0、3.0-4.0、3.5-4.5或4.0-5.0。在洗脱步骤(e)之后,将探针头浸渍于读取容器中,并且在步骤(f)中测量其发光信号(第二发光信号)。在步骤(g)中,通过从第一发光信号中减去第二发光信号计算洗脱物质的发光信号,并且通过对洗脱物质的发光信号对照校准曲线(标准曲线)进行定量来测定分析物的量。通常在检定样品之前预先建立校准曲线。在步骤(a)中样品结合之前,探针头的发光信号通过读取容器中的同一发光检测系统任选地预读取。读取容器含有水溶液,如水或缓冲液。预读取建立探针头的任何电势背景发光的基线。在以上步骤中,反应可通过在容器中搅拌或混合溶液来加速。举例来说,在一个或多个反应容器(包括样品容器、试剂容器、洗涤容器和/或洗脱容器)中可引发溶液流(侧流或轨道流)过探针头以加速结合反应、解离。举例来说,反应容器可安放在定轨振荡器上,并且定轨振荡器以至少50rpm、优选是至少200rpm或至少500rpm(如50-200或500-1,500rpm)的速度旋转。此外,探针头可以0.01到10mm/秒的速度上下移动并且垂直于轨道流的平面,以引发探针头上方和下方的溶液的额外的混合。在直接抗体结合检定的一替代性实施例中,使用不同光学系统从液相中的洗脱物质的发光信号中直接测定分析物的量。所述方法包含以下步骤:(a)将探针头浸渍到含有样品溶液的样品容器中以使分析物(如果存在)与探针头上的第一抗体结合,其中探针具有固定于探针的尖端的针对分析物的第一抗体;(b)将探针头浸渍到含有试剂溶液的试剂容器中,所述试剂溶液包含针对分析物的第二抗体,所述第二抗体与发光标记缀合以在探针头上在分析物、第一抗体、第二抗体当中形成免疫复合物;(c)将探针头浸渍到含有洗涤溶液的洗涤容器中;(d)将探针头浸渍到含有ph为2.0-5.0的洗脱液的洗脱容器中以从探针头中洗脱物质;(e)从洗脱容器中去除探针头;(f)测量洗脱容器中的洗脱物质的发光信号;并且测定分析物的量。在这一替代性实施例中,步骤(a)-(e)与在第一实施例中上文所描述的步骤相同。在步骤(e)之后,去除探针并且探针不再在测量步骤中。使用如上文所描述的发光检测系统(例如参见图4)从洗脱容器中的液相中直接测量洗脱物质的发光信号。扩增检定在第二方面,本发明是针对一种检测液体样品中的分析物的方法,所述方法使用结合对和具有多个发光标记的高分子量聚合物。在第一实施例中,通过从探针上的第一发光信号读数中减去探针上的第二发光信号读数计算洗脱物质的发光信号。所述方法按次序包含以下步骤:(a)将探针头浸渍到含有样品溶液的样品容器中以使分析物(如果存在)与探针头上的第一抗体结合,其中探针具有固定于探针的尖端的针对分析物的第一抗体;(b)将探针头浸渍到含有试剂溶液的试剂容器中,所述试剂溶液包含针对分析物的第二抗体的试剂,所述第二抗体与结合对的第一成员缀合以使试剂与分析物结合;(c)将探针头浸渍到含有第一洗涤溶液的第一洗涤容器中以洗涤探针头;(d)将探针头浸渍到含有扩增溶液的扩增容器中,所述扩增溶液包含分子量为至少1百万道尔顿并且与结合对的第二成员的至少5个分子和至少25个发光标记缀合的交联多醣以在探针头上形成分析物、第一抗体、第二抗体以及结合对的第一成员和第二成员的免疫复合物;(e)将探针头浸渍到含有第二洗涤溶液的第二洗涤容器中;(f)将探针头浸渍于读取容器中并且测量结合于探针头上的物质的第一发光信号;(g)将探针头浸渍到ph为2.0-5.0的洗脱液中以从探针头中洗脱物质;(h)将探针头浸渍于读数容器中并且测量结合于探针头上的物质的第二发光信号;(i)通过从第一发光信号中减去第二发光信号计算洗脱物质的发光信号,并且测定分析物的量。在图6中说明这一检定方案。第二实施例与第一实施例类似,除了它具有提高灵敏度的额外的循环扩增步骤。第二实施例的方法进一步包含在步骤(f)之后和(g)之前的步骤(f′)。步骤(f′)为重复步骤(b)到(e)1-10次。在图7中说明这一检定方案。扩增检定的每一步骤的细节与上文对于直接抗体结合检定所描述的那些类似,除了步骤(b)和(d),它们使用结合对和扩增聚合物。结合对通常为半抗原和其抗体、配体和其受体、互补核酸链、或凝集素和碳水化合物。举例来说,结合对为生物素和抗生蛋白链菌素、生物素和抗生物素蛋白、生物素和中性抗生物素蛋白、荧光素和抗荧光素、洋地黄毒苷/抗洋地黄毒苷以及dnp(二硝基苯酚)和抗dnp。举例来说,结合对的第一成员为生物素,并且结合对的第二成员为抗生蛋白链菌素。扩增溶液包含与结合对的第二成员的至少5个分子和至少25个发光标记缀合的聚合物。聚合物的分子量为至少500,000,优选为1百万道尔顿。聚合物可为多醣(例如或葡聚糖)、聚核苷酸、树枝状聚合物(dendrimer)、多元醇或聚乙二醇。聚合物优选为具有2维或3维结构的分支链。聚合物优选包含5-50个或5-100个结合分子以及25-100个或25-500个发光分子。当结合分子为多肽或蛋白质时,使用如科学和专利文献中所描述的常规缀合化学方法,发光标记可通过多个部分(包括二硫基、羟苯基、氨基、羧基、吲哚或其它官能团)与它共价结合。步骤(f′)为通过重复步骤(c)-(f)1-10次、优选1-5次或2-3次循环扩增。每一循环由以下组成:将探针放回同一试剂容器、同一第一洗涤容器、同一扩增容器、和同一第二洗涤容器。对于循环扩增,表面积较小的探针为优选的,因为它的结合能力较小。因此,当探针头浸没在试剂溶液中时,试剂的结合并不消耗大量试剂。试剂浓度有效地不变。洗涤溶液的可忽略的污染和试剂的较小消耗使试剂和洗涤溶液被再使用多次,例如3-10次。在扩增检定的一替代性实施例中,使用不同光学系统由读取液相中的洗脱物质的发光信号直接测定分析物的量。替代性方法按次序包含以下步骤:(a)将探针头浸渍到含有样品溶液的样品容器中以使分析物(如果存在)与探针头上的第一抗体结合,其中探针具有固定于探针的尖端的针对分析物的第一抗体;(b)将探针头浸渍到含有试剂溶液的试剂容器中,所述试剂溶液包含针对分析物的第二抗体的试剂,所述第二抗体与结合对的第一成员缀合以使试剂与分析物结合;(c)将探针头浸渍到含有第一洗涤溶液的第一洗涤容器中以洗涤探针头;(d)将探针头浸渍到含有扩增溶液的扩增容器中,所述扩增溶液包含分子量为至少1百万道尔顿并且与结合对的第二成员的至少5个分子和至少25个发光标记缀合的交联多醣以在探针头上形成分析物、第一抗体、第二抗体以及结合对的第一成员和第二成员的免疫复合物;(e)将探针头浸渍到含有第二洗涤溶液的第二洗涤容器中;(f)将探针头浸渍到含有ph为2.0-5.0的洗脱液的洗脱容器中以从探针头中洗脱物质;(g)从洗脱容器中去除探针头;(h)测量洗脱容器中的洗脱物质的发光信号;并且测定分析物的量。在这一替代性实施例中,步骤(a)-(f)与在第一实施例中上文所描述的步骤相同。在步骤(f)之后,去除探针并且探针不再在测量步骤中。使用如上文所描述的发光检测系统(例如参见图4)从洗脱容器中的液相中直接测量洗脱物质的发光信号。为提高灵敏度,以上方法可进一步包含在步骤(e)之后和在步骤(f)之前的步骤(e′)。循环扩增步骤(e′)重复步骤(b)到(e)1-10次。通过以下实例进一步说明本发明,所述实例并不视为将本发明的范畴限制于其中所述的特定程序。实例实例1-12说明本发明的一个实施例,即,使用结合对和用荧光染料高度标记的交联聚合物用循环扩增洗脱检定。实例13说明本发明的另一实施例,即,使用直接标记有荧光染料的抗体的洗脱检定。实例1:制备具有固定的第一抗体(抗肌钙蛋白)的探针按照制造商的方案使用化学气相沉积法(yieldengineeringsystems,1224p)将石英探针(直径为1mm并且长度为2cm)用氨丙基硅烷涂布。随后将探针头浸没在ph7.4的鼠单克隆抗荧光素(biospacific)(10μg/ml)于pbs(phosphate-bufferedsaline,磷酸盐缓冲盐水)中的溶液中。使抗体吸附到探针上20分钟之后,在pbs中洗涤探针头。将这些涂有抗体的探针用于实例1-12中。捕捉从biospacific中获得的肌钙蛋白i(tni)、il-6的抗体,并且降钙素原(hytest)通过标准方法标记有荧光素。通常,每个抗体有约4个荧光素取代。涂有抗荧光素的探针浸没在荧光素标记捕捉抗体溶液(5μg/ml)中5分钟,随后在pbs中洗涤。实例2.制备交联400-spdp向2ml的在pbs中的20mg/ml的400(sigma/aldrich)中添加10μl在dmf(n,n-二甲基甲酰胺)中的50mg/ml下的spdp(6-[3-[2-吡啶二硫代]-丙酰胺]己酸丁二酰亚胺酯,invitrogen),所述400被胺化成每ficoll400kd含有88个胺(skoldtechnology)。spdp与ficoll的分子偶合比(mcr)为15。混合物在室温下反应1小时,并且随后透析。通过标准方法,硫醇并入估计为每ficoll400kd有5.5个。实例3.制备cy5-抗生蛋白链菌素在30℃下使32μl的在dmf中的5mg/mlcy5-nhs(gehealthcare)与1ml的在ph为9.5的0.1m碳酸钠缓冲液中的2.4mg/ml抗生蛋白链菌素(scrippslabs)反应。将混合物应用于pd10管柱(pharmacia)中,去除非缀合cy5,频谱分析表明每个抗生蛋白链菌素分子连接2.8个cy5。实例4.制备cy5-抗生蛋白链菌素-交联在室温下使5.8μl的在dmf中的10mg/mlsmcc(4-[n-顺丁烯二酰胺甲基]环己烷-1-甲酸丁二酰亚胺酯)piercechemical)与2mg的在ph为7.4的1mlpbs中的cy5-抗生蛋白链菌素(实例2)反应1小时。将混合物应用于pd10管柱中,去除未结合的smcc。通过在室温下将30μl的38mg/mldtt添加到1mg的在1mlpbs中的交联400-spdp中并反应1小时,随后加pd10管柱以纯化交联400-sh,交联400-spdp上的硫醇(实例1)被去保护。在室温下使cy5-抗生蛋白链菌素-smcc与400-sh混合并且反应过夜。在室温下随后添加10μl的12.5mg/mlnem(aldrich)并且反应1/2小时。缀合物随后在琼脂糖4bcl管柱上纯化。估计缀合物携载约20到30个抗生蛋白链菌素每个(2百万道尔顿)和2-3个cy5每个抗生蛋白链菌素。实例5:循环扩增洗脱检定方案和试剂本实例遵循示于图7中的常用循环扩增方案。表1展示为肌钙蛋白(tni)、白细胞介素-6(il-6)和降钙素原(pct)采用的检定方案。使20μl样品与检定缓冲液(100μlpbs,5mg/mlbsa,0.05%吐温20,ph7.4)混合并且将探针浸入。洗涤缓冲液为200μlpbs,0.05%吐温20,tni(hytest)、il-6(biospacifie)和pct(hytest)的抗体用标准方法被生物素标记(b-ab)并且以约5μg/ml在120μl中用于在检定中。以约10μg/ml在120μl中使用cy5-抗生蛋白链菌素-表1实例6:2.0-4.0的洗脱ph的影响实例6说明按照实例5的方案,酸性缓冲液对洗脱的影响。不同酸缓冲液如下:10mm甘氨酸/hclph2.0;10mm甘氨酸/hclph3.0;100mm乙酸na/乙酸ph4.0。结果概述于表2-4中。读数1为在酸洗脱之后荧光读数。“洗脱”为从读数1中减读数2的荧光读数,以间接估计从探针中洗脱的荧光物质的量,s=荧光信号,b=背景荧光信号。s/b表示特异性信号与非特异性背景信号的比率。尤其以低分析物含量改良s/b提高了水平。表2.ph2表3.ph3表4.ph4表2-4的结果展示随着ph从4降到2,洗脱量增加。取tni信号并且除以负(0)信号确定信背比(s/b)。结果展示洗脱的s/b(6.0)比在ph4.0洗脱下以10pg/ml含量的读数1的s/b(1.8)要好约三倍。此外,在ph4下的洗脱的s/b(6.0)比以10pg/ml含量在ph2下的s/b(2.4)更佳。实例7实例7说明按照实例5的方案,ph4到5.5的酸性缓冲液对洗脱的影响。不同酸缓冲液如下:100mm乙酸na/乙酸ph4.0;100mm乙酸na/乙酸ph5.0;100mm乙酸na/乙酸ph5.5。表5.ph4表6.ph5表7.ph5.5表5-7展示洗脱的s/b全部在读数1的s/b内经改良。ph约为4.0似乎对于肌钙蛋白的循环扩增检定的s/b最佳。实例8:肌钙蛋白检定的检测极限坯料极限(limitofblank,lob)定义为平均坯料+1.645×(sd板料)检测极限(limitofdetection,lod)定义为lob+1.645×(sd坯料)sd为标准差。(david等人,clin.biochem.rev.29:s49-52)按照用实例5的ph4.0酸处理的肌钙蛋白的洗脱方案,lod通过读数1(尽有一个读数,没有酸洗脱)和读数2(用酸洗脱的洗脱检定)确定。lod通过读数1为2.9pg/ml,并且通过洗脱检定经改良为1.3pg/ml。实例9:在正常样品中检测肌钙蛋白按照在ph4下的实例5的肌钙蛋白的洗脱方案,通过直接检定(读数1,无酸洗脱)和洗脱检定(读数2,有酸洗脱)针对肌钙蛋白含量测量来自39个表观正常个体的39个肝素血浆样品。用洗脱检定检测到39个正常样品的100%的肌钙蛋白含量,而用读数1仅检测到46%。结果展示本发明的洗脱检定的益处适用于检测正常范围内的tni。实例10:hstni指定按照实例8的肌钙蛋白的洗脱方案,针对肌钙蛋白含量检测611个正常血清样品。洗脱方案检测到在被检验的611个正常血清样品中的91%,其处于第2代hstni指定。第99个百分位为在10%的runcv之间的36pg/ml,其根据tnl指定指南(参见图1)为可接受的。实例11:il-6检定il-6为需要高灵敏度测量的另一种分析物。表8展示使用ph4.0酸洗脱,遵循实例6的方案的il-6的数据。表8表8中的结果展示洗脱方案与无洗脱相比产生约2倍的s/b比率的提高,并且洗脱方案检测到il-6检定中的25pg/ml含量。实例12:降钙素原检定、替代性光学检测配置表9展示使用ph4.0酸洗脱的pct检定的方案。荧光信号用替代性光学检测配置测量。具有宽激光束和聚光透镜的数值孔径的光学器件直接检测流体相中的洗脱标记抗体。表9表10展示pct检定的剂量反应结果。表10pct浓度(ng/ml)荧光信号(v)01280.58421.116872.331444.65721实例13.c-反应蛋白(crp)的直接抗体检定实例13说明本发明的另一实施例,即,使用直接标记有荧光染料的抗体并且无循环扩增的洗脱检定。检定遵循如图5所示的常用方案。具有固定第一抗体(抗crp)的探针的制备按照制造商的方案使用化学气相沉积法(yieldengineeringsystems,1224p)将石英探针(直径为1mm并且长度为2cm)用氨丙基硅烷涂布。探针头随后浸没在ph7.4的磷酸盐缓冲盐水(pbs)中的10μg/ml抗生蛋白链菌素(sigma-aldrich)溶液中。使蛋白质吸附到探针上5分钟之后,在pbs中洗涤探针头。探针头随后浸没在含有在pbs中的10μg/ml生物素标记的抗crp(hytest)的溶液中。10分钟后,探针头在pbs中洗涤。抗体通过标准方法被生物素标记。生物素标记的抗体特指为“捕捉抗体”。制备cy5标记抗体在30℃下使在1ml0.1m碳酸钠ph9.5中的3.2mg/ml抗crp(hytest)与10.6μl的在dmf中的10mg/mlcy5-nhs(gehealthcare)混合并且使其反应1/2小时。混合物随后在pd10管柱(gehealthcare)上纯化。cy5标记抗体特指为“信号抗体”。crp检定方案示于表11中。表11crp结果示于表12中。表12结果展示洗脱方案在1mg/l的crp含量下将信背比从6提高到70。本发明和制备和使用它的方式和方法现描述于这些完全、清楚、简洁和精确术语中,以便使它涉及的所属领域的技术人员制备并且使用其。应了解,前文描述本发明的优选实施例并且在不脱离如申请专利范围中所阐述的本发明的范畴的情况下可在其中进行修改。为特别指出并且清楚地主张视为本发明的主题,以下申请专利范围总结本说明书。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1