PD‑L1、CDK5和CTLA4中的至少一种在制备肿瘤诊断试剂盒中的用途的制作方法
本发明涉及pd-l1、cdk5和ctla4的用途,具体涉及pd-l1、cdk5和ctla4中的至少一种在制备肿瘤诊断试剂盒中的用途。
背景技术:
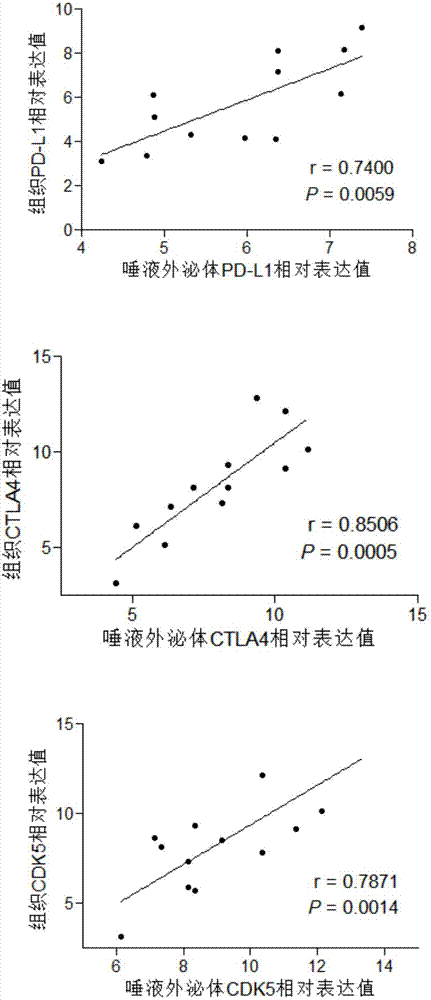
:癌症是人类头号杀手,以往癌症予人感觉为不治之症,但随着医学的发展,通过手术、放射治疗、化疗及标靶药物治疗等均能有效延长病人寿命。不过,以上治疗方法始终各有限制,成效有限,且伴随着不同的副作用。为使癌症病人在对抗癌魔之余,亦不至元气大伤,医学界开始积极研究对抗肿瘤的新方法,终于有了新进展。针对pd-1/pd-l1和ctla4的免疫疗法是当前全世界备受瞩目、广为研究的新一类抗癌免疫疗法,让普通患者战胜癌症不再遥不可及。程序性死亡分子1及其配体(programmeddeath-1,简称pd-1)是t细胞上的一种跨膜受体,最早是在凋亡的t细胞杂交瘤中利用消减法得到的。因其参与t细胞凋亡,故被命名pd-1。在肿瘤患者体内,pd-l1的高表达能够增强肿瘤的转移能力、导致患者死亡率上升,因此可以作为患者愈后的标志。pd-1/pd-l1免疫疗法,是除手术、放射治疗、化疗和标靶治疗常用癌症治疗方案之外的新一代疗法,是针对癌细胞懂得逃逸免疫系统攻击以及不会自我凋亡的特性,利用人体自身的免疫系统抵御癌症,pd-1抑制剂能够与配体pd-l1、pd-l2相互作用,抑制t细胞增殖。针对pd-1的单克隆抗体能够阻断pd-1与配体的结合,而抗pd-l1的单克隆抗体可阻断pd-l1与pd-1、cd80的相互作用,从而恢复t细胞功能。重启t细胞免疫系统重新识别肿瘤,继而展开攻击。除pd-1/pd-l1之外,ctla4也是重要的免疫检查点。此外研究发现cdk5能够调节pd-l1等免疫检查点。目前针对pd-1/pd-l1和ctla4等免疫检查点的免疫疗法是通过阻断pd-1/pd-l-1和ctla4信号通路,激活肿瘤特异性淋巴细胞来杀灭肿瘤细胞,具有治疗多种类型肿瘤的潜力,有望实质性改善患者的总生存期。鉴于肿瘤的异质性,需要筛选合适的肿瘤病人进行针对pd-l1等免疫检查点的相应的免疫疗法。目前主要是检测pd-1/pd-l1和ctla4的表达水平。所应用的标本是肿瘤病人的组织标本。但是组织标本在临床应用中有较大的局限性,不能多次和动态的获得标本,不能有效地用来指导临床用药。液体活检技术可以解决这一问题。其中一个技术是外泌体的检测。外泌体是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的一种直径约30~120nm的膜性囊泡。t细胞、b细胞、血小板、树突细胞、肥大细胞等血细胞及上皮细胞、肿瘤细胞等其他非血源性细胞都会分泌外泌体,被分泌出的外泌体会进入血液、唾液、尿液、及乳汁等体液中,通过循环系统到达其他细胞与组织,产生远程调控作用。这种普遍存在于机体内的被膜结构参与细胞间的物质交换和信息交流,影响细胞的生理状态,并与多种疾病的发生与进程密切相关。已有研究表明,肿瘤细胞相对于正常细胞会制造更多的外泌体,且外泌体能够影响临近的肿瘤细胞或远处的正常细胞,促进肿瘤的发生发展,以及远处转移。利用外泌体检测以及监控肿瘤有望成为一种有效临床手段,来早期发现癌症,指导治疗方案,进行精准化个体化治疗,目前已有大量文献支持并验证这一观点。而且,相较于最近较为热门的循环肿瘤细胞,由于其来源更丰富且更利于分离,外泌体将更适用于未来的液体诊断。目前针对pd-1/pd-l1和ctla4的检测仍以肿瘤组织或手术组织活检,往往需要采用穿刺或者外科手术的方法从患者上获取肿瘤组织的检材。不但不方便,效率低而且会对患者造成人体伤害,往往会延误治疗的最佳时期。现有技术的缺点:手术或内镜检测费用昂贵,创伤大,不方便反复多次取材,效率较低,无法动态观测病人治疗效果。侵入式检查往往使得患者依从性差。肿瘤组织中存在一定的异质性,组织病理检测可能会造成诊断结果的偏倚,局限性也非常大,不适合在常规体检时使用,这些手段难以进行重复活检和动态检测。技术实现要素:本发明的目的在于克服现有技术存在的不足之处而提供了一种肿瘤诊断试剂盒,本发明还提供了pd-l1基因、cdk5基因和ctla4基因中的至少一种在制备肿瘤诊断试剂盒中的用途。为实现上述目的,所采取的技术方案:一种肿瘤诊断试剂盒,所述肿瘤诊断试剂盒包括检测pd-l1基因表达产物、cdk5基因表达产物和ctla4基因表达产物中的至少一种的试剂。优选地,所述pd-l1基因表达产物包括pd-l1mrna和/或pd-l1蛋白;所述cdk5基因表达产物包括cdk5mrna和/或cdk5蛋白;所述ctla4基因表达产物包括ctla4mrna和/或ctla4蛋白。优选地,所述检测pd-l1表达产物的试剂包括检测pd-l1mrna的探针或者扩增pd-l1mrna的引物;所述检测cdk5表达产物的试剂包括检测cdk5mrna的探针或者扩增cdk5mrna的引物;所述检测ctla4表达产物的试剂包括检测ctla4mrna的探针或者扩增ctla4mrna的引物。更优选地,所述扩增pd-l1mrna的引物由序列如seqidno:11的正向引物和序列如seqidno:12的反向引物组成。所述扩增cdk5mrna的引物由序列如seqidno:7的正向引物和序列如seqidno:8的反向引物组成,或所述扩增cdk5mrna的引物由序列如seqidno:9的正向引物和序列如seqidno:10的反向引物组成。所述扩增ctla4mrna的引物由序列如seqidno:1的正向引物和序列如seqidno:2的反向引物组成,或所述扩增ctla4mrna的引物由序列如seqidno:3的正向引物和序列如seqidno:4的反向引物组成,或所述扩增ctla4mrna的引物由序列如seqidno:5的正向引物和序列如seqidno:6的反向引物组成。优选地,所述pd-l1基因表达产物、cdk5基因表达产物和ctla4基因表达产物中的至少一种来自唾液外泌体。本发明在唾液外泌体中发现了pd-l1基因表达产物、cdk5基因表达产物和ctla4基因表达产物,且都与组织具有较高的一致性。优选地,所述肿瘤诊断试剂盒包括提取唾液外泌体的试剂、提取唾液外泌体rna的试剂和rna反转录试剂。优选地,所述肿瘤为食管癌、肺癌、乳腺癌、膀胱癌、胃癌、肝癌、脑胶质细胞瘤、胰腺癌、前列腺癌或头颈部肿瘤。本发明提供了pd-l1基因、cdk5基因和ctla4基因中的至少一种在制备肿瘤诊断试剂盒中的用途。本发明提供了pd-l1基因的表达产物、cdk5基因表达产物和ctla4基因表达产物中的至少一种在制备肿瘤诊断试剂盒中的用途。本发明提供了检测pd-l1基因的表达产物、cdk5基因表达产物和ctla4基因表达产物中的至少一种的试剂在制备肿瘤诊断试剂盒中的用途。本发明提供了检测pd-l1基因表达水平、cdk5基因表达水平和ctla4基因表达水平中的至少一种的试剂在制备肿瘤诊断试剂盒中的用途。本发明的有益效果在于:1、目前液体活检正在不断发展中,由此开发的检测肿瘤来源的外泌体pd-l1、cdk5和ctla4中的至少一种的试剂盒,是一种具有非侵袭性、高敏感性高特异性、适用于普查筛查大样本调查的液体诊断监控技术。2、通过检测肿瘤来源的外泌体pd-l1、cdk5和ctla4中的至少一种的表达,提供一种能够利用体液等生物样本进行肿瘤的检测,稳定性高、定量精确的试剂盒和系统,并由于其无创,易于检测,便于反复多次取样,有助于实时反映动态检测癌患者的疾病状态,有助于临床医生迅速掌握患者病情,从而及时制定更具有个体化的治疗措施。附图说明图1为本发明实施例1实验步骤5中荧光定量检测唾液外泌体中pd-l1、cdk5、ctla4在食管癌病人与正常人中的表达情况;图2为本发明实施例1实验步骤5中荧光定量检测pd-l1、cdk5、ctla4在唾液外泌体中与组织表达的情况;图3为本发明实施例1实验步骤5中免疫检查点分子(pdl-1、cdk5、ctla4、pd-1)在肿瘤病人唾液外泌体中的表达情况。具体实施方式为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。实施例1实施步骤1唾液的收集于早晨8-10点,采用非刺激性滴取法于安静舒适的环境下,对满足下列条件受试者进行全唾液收集:1.空腹,未进行剧烈运动;2.至少刷牙一小时以上;3..近期未进行口腔护理。嘱咐受试者用清水漱口2-3次,每次约30-40ml左右清水,以清除口腔内食物等残渣,吐尽残留液体,头部微下垂,静坐5分钟后待唾液自然流出。收集其非刺激性全唾液于无菌平板培养皿中,以唾液铺满培养皿为宜,约500-700μl,而后迅速分装至无菌1.5mlep管,立即置-80℃保存待用。实施步骤2唾液外泌体提取取等体积实验步骤1所得唾液如500μl(所需唾液量至少可为250μl).(未进行离心处理的唾液),2500-5000g/分钟离心15min。用移液器将离心所得上清移至新的1.5ml的ep管中,约450-470μl澄清上清,加入等量的外泌体沉淀溶液混匀,4℃静置孵育过夜,10000g4℃离心1h后弃上清,收集沉淀,将外泌体白色沉淀物用适量1x外泌体悬浮液重悬得到外泌体重悬液。实施步骤3唾液外泌体中rna提取在上述实施步骤2中最后得到的外泌体白色沉淀中,加入250-500μl的rna提取液,反复吹打后,室温裂解7-14min,混合均匀后加入相应mirna的外参cel-mir-39用以后续分析标准化。加入60μl的rna除杂液,涡旋充分混匀后,室温静置4-14min,离心10000-13000g4-14min,转上层水相到另一个新管,加入等体积的rna沉淀液,上下颠倒混匀后室温静置4-14min,或者-20℃沉淀。离心10000-13000g4-14min后,弃去上清液,加入250-500μl-20℃预冷的rna洗涤液洗涤沉淀,震荡混匀,12000g/5min,弃乙醇液体,超净台静置充分晾干沉淀。所得沉淀用rna富集液溶解沉淀运用nanodorp2000紫外分光光度计检测纯度及浓度,所得rna封口膜密封,-80摄氏度保存。上述所述试剂成分如下表1示。表1试剂成分表实施步骤4唾液外泌体rna反转录合成cdna以总rna为模板,反转录合成cdna,反应步骤如下:根据各自rna浓度计算统一的rna含量(20μl)体系。按照下述表2的比例配成10μl体系加入pcr管中:表2rna配置体系rnaxμl(含1ng至5μgrna)depc水10-xμltotal10μl加入如下表3的体系:表3反转录体系按表3配成20μl体系,体系混匀后,将配置的20μl体系的pcr管置于bio-rads1000温度循环变温器(聚合酶链式反应仪)按表4设定步骤进行表4反应程序25℃10min37℃120min85℃5min4℃forever反应完成后将反应所得的cdna放置-20℃冰箱保存即可。实施步骤5唾液外泌体中cdna的q-pcr采用特异性外泌体pd-l1引物上游引物primers15'-tgccgactacaagcgaattactg-3'以及pd-l1下游引物primers25'-ctgcttgtccagatgacttcgg-3'按以下条件进行realtimepcr反应。按照表5的比例配成25μlrealtimepcr反应体系加入pcr管中:表5realtimepcr反应体系mix(2*)10μl正向引物0.2μl反向引物0.2μlcdna2μl灭菌超纯水7μltotal25μl将按照上述方式配置的20μl体系的pcr管置于abi7500中按如下设定步骤进行,realtimepcr反应条件如表6:表6realtimepcr反应条件使用abi7500进行实时荧光定量pcr检测,其中从步骤3到步骤4持续40个循环。选用汕头大学附属肿瘤医院100例食管癌患者唾液以及汕头市老年大学的40例正常人唾液。采用上述步骤,对唾液外泌体中pd-l1、cdk5、ctla4进行荧光定量检测,结果如图1所示,唾液外泌体中pd-l1、cdk5、ctla4在食管癌病人比正常人高并有显著的统计学差异(***p<0.001),说明检测唾液外泌体pd-l1、cdk5、ctla4能够作为区分食管癌病人和正常人的标志物。在100例病人中随机选取12例,运用荧光定量分别检测pd-l1、cdk5、ctla4在唾液外泌体中与组织表达一致性,结果如图2所示,说明唾液外泌体能够较好反应组织中pd-l1、cdk5、ctla4的表达。在100例病人例随机选取5例运用荧光定量检测唾液外泌体pd-1、pd-l1、cdk5、ctla4,将定量产物用2%的琼脂糖胶跑电泳,结果如图3所示,说明了免疫检查点分子(pd-l1、pd-1、cdk5、ctla4)在肿瘤病人唾液外泌体中的表达高。pcr检测方法中涉及到的引物:ctla4(人)f1(正向引物):5’-ggaatatgacggtgatcaca-3’(seqidno:1)ctla4(人)r1(反向引物):5’-cattgaggctgtcaataaga-3’(seqidno:2)ctla4人)f2(正向引物):5’-gggatcagcggtcttattga-3’(seqidno:3)ctla4(人)r2(反向引物):5’-ggcgcagaagcaagataaac-3’(seqidno:4)pd-1(人)f(正向引物):5’-gacagcggcacctacctctgtg-3’(seqidno:5)pd-1(人)r(反向引物):5’-gacccagactagcagcaccagg-3’(seqidno:6)cdk5(人)f1(正向引物):5’-ctccgggagatctgcctact-3’(seqidno:7)cdk5(人)r1(反向引物):5’-agcacattgcggctatgaca-3’(seqidno:8)cdk5(人)f2(正向引物):5’-cgcaatgtgctacacaggga-3’(seqidno:9)cdk5(人)r2(反向引物):5’-cattgccgggaaaaagaggc-3’(seqidno:10)。pd-l1(人)f(正向引物):5'-tgccgactacaagcgaattactg-3'(seqidno:11)pd-l1(人)r(反向引物):5'-ctgcttgtccagatgacttcgg-3'(seqidno:12)。实施本发明通过检测唾液pd-l1、cdk5、ctla4基因的表达水平,可以简单、方便且准确地检测患者pd-l1、cdk5、ctla4的表达水平,从而指导临床应用pd1/pd-l1免疫疗法以及其他疗法的应用。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。序列表<110>汕头大学<120>pd-l1、cdk5和ctla4中的至少一种在制备肿瘤诊断试剂盒中的用途<130>2017<160>12<170>patentinversion3.3<210>1<211>20<212>dna<213>人工序列<400>1ggaatatgacggtgatcaca20<210>2<211>20<212>dna<213>人工序列<400>2cattgaggctgtcaataaga20<210>3<211>20<212>dna<213>人工序列<400>3gggatcagcggtcttattga20<210>4<211>20<212>dna<213>人工序列<400>4ggcgcagaagcaagataaac20<210>5<211>22<212>dna<213>人工序列<400>5gacagcggcacctacctctgtg22<210>6<211>22<212>dna<213>人工序列<400>6gacccagactagcagcaccagg22<210>7<211>20<212>dna<213>人工序列<400>7ctccgggagatctgcctact20<210>8<211>20<212>dna<213>人工序列<400>8agcacattgcggctatgaca20<210>9<211>20<212>dna<213>人工序列<400>9cgcaatgtgctacacaggga20<210>10<211>20<212>dna<213>人工序列<400>10cattgccgggaaaaagaggc20<210>11<211>23<212>dna<213>人工序列<400>11tgccgactacaagcgaattactg23<210>12<211>22<212>dna<213>人工序列<400>12ctgcttgtccagatgacttcgg22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1