深层细胞超分辨率成像的方法、系统及棱镜光薄片装置与流程
本申请是申请日为2014年11月20日、申请号为201410669870.8、发明名称为《深层细胞超分辨率成像的方法、系统及棱镜片薄片装置》的分案申请。
本发明涉及光学显微技术和生物细胞成像技术领域,尤其涉及一种深层细胞超分辨成像方法及棱镜光薄片装置。
背景技术:
超分辨率(super-resolution)定位显微术可提供近分子级别的分辨率。这一技术的发展极大地推进了人们对细胞内结构的理解。但是,在本质上这一技术依赖于对单个荧光标记分子的成像和精确定位,并且需极高的图像snr(signaltonoiseratio,信噪比)来保证定位的精度。定位显微术(localizationmicroscopy,lm)通常使用全内反射(totalinternalreflection,tirf)或近全内反射(near-tirf)方法,通过限制照明区域的深度来降低背景噪音,因此该方法的成像区域受限于样品载玻片表面以上几微米以内。
目前,对于高自发荧光或结构密集的细胞或者组织的深层成像仍然依赖于其他技术如共聚焦显微镜(confocallaserscanningmicroscope,clsm)。在另一方面,近期开发的超分辨率光学波动显微术(localizationmicroscopy,lm)通过应用计算高阶相关度来分析每个荧光标记分子的信号波动,从而减小每个分子的点扩散函数(pointspreadfunction),并以此来提高分辨率。此技术的分辨率和高阶相关运算的阶次开方成正比,因此理论上可通过提高运算阶次来进一步增加分辨率,但是在现实中其分辨率极限为100纳米。另外,由于荧光标记物的信号只和自身相关,和其他层面分子所产生的背景信号并无相关性,该方法所使用的高阶相关运算可有效的消除背景噪音,从而实现光学切片成像。
目前切片成像技术在生物学研究中扮演着重要角色。扫描共聚焦显微镜(以及转盘共聚焦)作为主要的切片成像手段已经存在了25年。这一技术利用小孔来滤除非成像平面的背景信号。目前已有的受激辐射损耗显微技术就是基于扫描共聚焦显微镜开发而成的超分辨率显微技术。其分辨率可达50纳米。这一技术的局限在于所拍摄样品必须能够承受极高的激光照射因此限制了可供拍摄样品的种类。
利用光片技术从样品的侧向照明同样可实现切片成像,和共聚焦技术相比,该方法可在很大程度上减小细胞所承受的光强。另外已有文献声称结合定位显微术和光片技术实现超分辨率成像并取得40纳米的分辨率。但是目前受限于由于照明与探测的几何结构问题,这一技术仍然很难被应用于拍摄更普遍的生物样品。
综上可知,现有技术在实际使用上显然存在不便与缺陷,所以有必要加以改进。
技术实现要素:
针对上述的缺陷,本发明的目的在于提供深层细胞超分辨率成像的方法、系统及棱镜光薄片装置,其能够在不改变现有显微镜结构的基础上,实现深层细胞超分辨率成像。
本发明提供的第一种深层细胞超分辨率成像的方法,应用于超分辨率定位显微镜中,所述方法包括步骤有:
将荧光标记物连接待观察的样品,并将所述样品浸泡在成像缓冲液中;
获取所述样品深层的荧光标记分子闪烁的荧光信号;
通过超分辨率光学波动显微算法消除所述荧光信号的背景噪音;
通过超分辨率定位显微算法计算经降噪处理的所述荧光信号的位置;
根据所述荧光信号的位置构建所述样品的深层细胞超分辨率图像。
根据本发明所述的方法,所述通过超分辨率光学波动显微算法消除所述荧光信号的背景噪音的步骤包括:
通过二阶或高阶相关度分析算法处理所述荧光信号,以去除所述荧光信号中非关联的所述背景噪音;
所述通过超分辨率定位显微算法计算经降噪处理的所述荧光信号的位置的步骤包括:
通过高斯拟合、最大相似度或者寻找质量中心算法计算经降噪处理的所述荧光信号的中心位置。
根据本发明所述的方法,所述通过超分辨率光学波动显微算法消除所述荧光信号的背景噪音的步骤进一步包括:
将所述荧光信号记录成动画;
将所述动画重组为一系列的动画组,每个所述动画组包含预定个数的帧;
通过所述超分辨率光学波动显微算法对每个所述动画组进行二阶相关度运算,以去除所述荧光信号中非关联的所述背景噪音;
将经降噪处理的所述动画组重组为新动画;
所述通过超分辨率定位显微算法计算经降噪处理的所述荧光信号的位置的步骤进一步包括:
对所述新动画中的每一帧进行分析,通过与预定的点扩散函数相匹配的尺寸定位图像来识别非重叠的所述荧光信号;
获得每个所述荧光信号的峰位置,构建相应的分辨率定位显微图像;
根据所述超分辨率定位显微算法定位出每个所述荧光信号的中心位置;
所述根据荧光信号的位置构建所述样品的深层细胞超分辨率图像的步骤包括:
将每个所述荧光信号的中心位置叠加以构建所述样品的深层细胞超分辨率图像。
本发明还提供一种深层细胞超分辨率成像的系统,应用于超分辨率定位显微镜中,所述系统包括有:
信号获取模块,用于获取所述样品深层的荧光标记分子闪烁的荧光信号,所述样品预先与荧光标记物连接并浸泡在成像缓冲液中;
sofi模块,用于通过超分辨率光学波动显微算法消除所述荧光信号的背景噪音;
lm模块,用于通过超分辨率定位显微算法计算经降噪处理的所述荧光信号的位置;
成像模块,用于根据所述荧光信号的位置构建所述样品的深层细胞超分辨率图像。
根据本发明所述的系统,所述sofi模块用于通过二阶或高阶相关度分析算法处理所述荧光信号,以去除所述荧光信号中非关联的所述背景噪音;
所述lm模块用于通过高斯拟合、最大相似度或者寻找质量中心算法计算经降噪处理的所述荧光信号的中心位置。
根据本发明所述的系统,所述sofi模块进一步包括:
记录子模块,用于将所述荧光信号记录成动画;
第一重组子模块,用于将所述动画重组为一系列的动画组,每个所述动画组包含预定个数的帧;
运算子模块,用于通过所述超分辨率光学波动显微算法对每个所述动画组进行二阶相关度运算,以去除所述荧光信号中非关联的所述背景噪音;
第二重组子模块,用于将经降噪处理的所述动画组重组为新动画;
所述lm模块进一步包括:
识别子模块,用于对所述新动画中的每一帧进行分析,通过与预定的点扩散函数相匹配的尺寸定位图像来识别非重叠的所述荧光信号;
第一构建子模块,用于获得每个所述荧光信号的峰位置,构建相应的分辨率定位显微图像;
定位子模块,用于根据所述超分辨率定位显微算法定位出每个所述荧光信号的中心位置;
所述成像模块用于将每个所述荧光信号的中心位置叠加以构建所述样品的深层细胞超分辨率图像。
本发明还提供第二种深层细胞超分辨率成像的方法,包括步骤有:
将棱镜光薄片装置设置于倒置显微镜的顶部,通过物理手段消除非关联的背景噪音;
在对样品进行定位显微时,通过超分辨率定位显微算法计算荧光标记分子的位置,并根据所述荧光标记分子的位置构建所述样品的深层细胞超分辨率图像;
所述棱镜光薄片装置包括:
一第一准直正透镜;
一负透镜;
一第二准直正透镜;
一柱面镜;
一照明物镜;以及
一安装在所述照明物镜上的棱镜。
根据本发明所述的系统,所述棱镜光薄片装置与水平方向的样品平台之间存在一预定角度;和/或
所述棱镜使所述照明物镜改变方向,并压缩所述照明物镜的厚度。
本发明还提供一种棱镜光薄片装置,所述棱镜光薄片装置设置于倒置显微镜的顶部,包括有:
一第一准直正透镜;
一负透镜;
一第二准直正透镜;
一柱面镜;
一照明物镜;以及
一安装在所述照明物镜上的棱镜。
根据本发明所述的棱镜光薄片装置,所述棱镜光薄片装置与水平方向的样品平台之间存在一预定角度;和/或
所述棱镜使所述照明物镜改变方向,并压缩所述照明物镜的厚度。
本发明的第一种技术方案结合了超分辨率光学波动显微术(super-resolutionopticalfluctuationmicroscopy,sofi)和超分辨率定位显微术(localizationmicroscopy,lm),能够通过计算机运算消除非关联的背景噪音来获取细胞深层的超分辨率图像,可以直接应用于普通的荧光显微镜并且无需修改其原有的光学结构。本发明的第二种技术方案使用棱镜光薄片装置加载与倒置显微镜上,通过物理手段减少背景噪音并通过定位显微术来得到细胞深层的超分辨率图像,可以直接加载于传统的倒置荧光显微镜。
附图说明
图1是本发明第一种深层细胞超分辨率成像的方法流程图;
图2是本发明第一种深层细胞超分辨率成像的优选方法流程图;
图3是本发明第一种深层细胞超分辨率成像的系统结构示意图;
图4是本发明第二种深层细胞超分辨率成像的方法流程图;
图5是本发明棱镜光薄片装置的结构示意图;
图6a~图6b是本发明使用sofi来消除背景的仿真结果的示意图;
图7a~图7i是本发明bshsy-5y细胞中线粒体外膜的层析成像;
图8a~图8f是本发明超分辨率定位显微镜对烟草by-2细胞中mvbs成像和用超分辨率定位显微镜与sofi结合成像结果的比较示意图;
图9a是本发明棱镜光薄片显微镜的结构图;
图9b是本发明加入棱镜后光薄片的弯折角度和压缩系数的仿真结果示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明第一种技术方案结合了超分辨率光学波动显微术(super-resolutionopticalfluctuationmicroscopy,sofi)和超分辨率定位显微术(localizationmicroscopy,lm),能够通过计算机运算由于离焦的荧光分子产生的非相干背景,来获取细胞深层的超分辨率图像,该技术可直接应用于普通的荧光显微镜并且无需修改其原有的光学结构。
本发明第二种技术方案使用棱镜光薄片照明的方法,光薄片照明方法可从物理角度去除离焦的荧光分子信号,因此与超分辨率定位显微术结合适用于深层细胞超分辨率成像。这一照明结构同样可直接加载于传统的倒置荧光显微镜。这些方法可扩大超分辨率定位显微术的适用范围,使其从细胞表面几微米的范围扩大到细胞深层几百微米,并且获知细胞结构和蛋白的位置的能力可达到tem(transmissionelectronmicroscope,透射电子显微镜)相近的范围,但与tem相比更简单容易实现。
图1是本发明第一种深层细胞超分辨率成像的方法流程图,所述方法应用于超分辨率定位显微镜中,包括步骤有:
步骤s101,将荧光标记物连接待观察的样品,并将样品浸泡在成像缓冲液中。
优选的是,使用普通免疫荧光标记方法将荧光标记物连接需要观察的生物样品,再将样品浸泡在成像缓冲液中,所述免疫荧光标记方法优选使用alexa647或者alexa750荧光团标记样品;所述成像缓冲液成分优选包括:三(2-羧乙基)膦盐,葡萄糖氧化酶,葡萄糖,过氧化氢酶,以及环辛四烯。
步骤s102,获取样品深层的荧光标记分子闪烁的荧光信号。
步骤s103,通过sofi算法消除荧光信号的背景噪音。
优选的是,通过二阶或高阶相关度分析算法处理荧光信号,以去除荧光信号中非关联的背景噪音。
步骤s104,通过lm算法计算经降噪处理的荧光信号的位置。
优选的是,通过高斯拟合、最大相似度或者寻找质量中心算法计算经降噪处理的荧光信号的中心位置。所述荧光信号的中心位置即荧光标记分子的精确位置。
步骤s105,根据荧光信号的位置构建样品的深层细胞超分辨率图像。
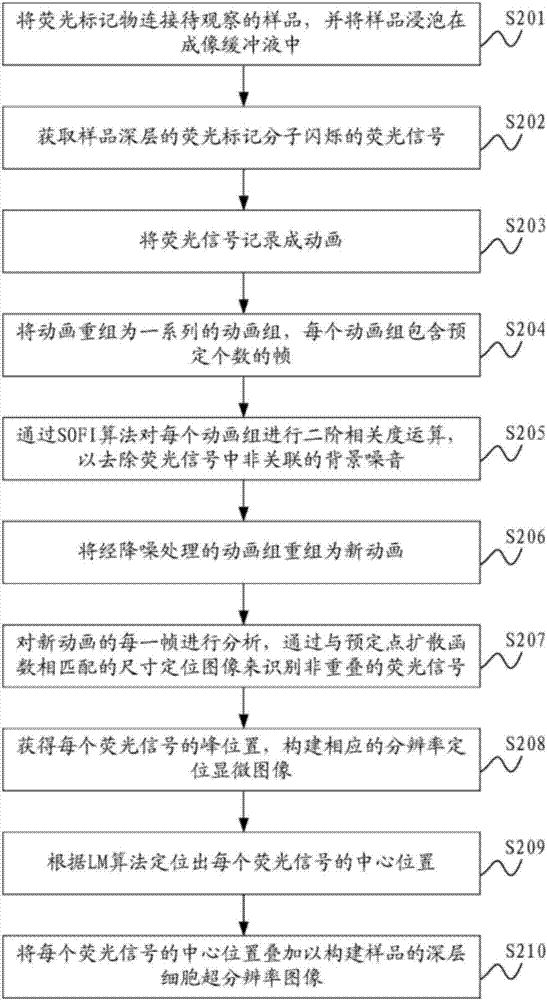
图2是本发明第一种深层细胞超分辨率成像的优选方法流程图,所述方法应用于超分辨率定位显微镜中,包括步骤有:
步骤s201,将荧光标记物连接待观察的样品,并将样品浸泡在成像缓冲液中。
步骤s202,获取样品深层的荧光标记分子闪烁的荧光信号。
步骤s203,将荧光信号记录成动画。
步骤s204,将动画重组为一系列的动画组,每个动画组包含预定个数的帧。
步骤s205,通过sofi算法对每个动画组进行二阶相关度运算,以去除荧光信号中非关联的背景噪音。
步骤s206,将经降噪处理的动画组重组为新动画。
步骤s207,对新动画中的每一帧进行分析,通过与预定的点扩散函数相匹配的尺寸定位图像来识别非重叠的荧光信号。
步骤s208,获得每个荧光信号的峰位置,构建相应的分辨率定位显微图像。
步骤s209,根据lm算法定位出每个荧光信号的中心位置。所述荧光信号的中心位置即荧光标记分子的精确位置。
步骤s210,将每个荧光信号的中心位置叠加以构建样品的深层细胞超分辨率图像。
这是一种基于软件的方法,不需对于现有的lm镜有其他硬件方面的改动。
图3是本发明第一种深层细胞超分辨率成像的系统结构示意图,所述系统100应用于超分辨率定位显微镜中,包括有:
信号获取模块10,用于获取样品深层的荧光标记分子闪烁的荧光信号,样品预先与荧光标记物连接并浸泡在成像缓冲液中。优选的是,使用普通免疫荧光标记方法将荧光标记物连接需要观察的生物样品,再将样品浸泡在成像缓冲液中,所述免疫荧光标记方法优选使用alexa647或者alexa750荧光团标记样品;所述成像缓冲液成分优选包括:三(2-羧乙基)膦盐,葡萄糖氧化酶,葡萄糖,过氧化氢酶,以及环辛四烯。
sofi模块20,用于通过sofi算法消除荧光信号的背景噪音。优选的是,所述sofi模块20用于通过二阶或高阶相关度分析算法处理荧光信号,以去除荧光信号中非关联的背景噪音。
lm模块30,用于通过lm算法计算经降噪处理的荧光信号的位置。优选的是,所述lm模块30用于通过高斯拟合、最大相似度或者寻找质量中心算法计算经降噪处理的荧光信号的中心位置。所述荧光信号的中心位置即荧光标记分子的精确位置。
成像模块40,用于根据荧光信号的位置构建样品的深层细胞超分辨率图像。
优选的是,所述sofi模块20进一步包括:
记录子模块21,用于将荧光信号记录成动画。
第一重组子模块22,用于将动画重组为一系列的动画组,每个动画组包含预定个数的帧。
运算子模块23,用于通过sofi算法对每个动画组进行二阶相关度运算,以去除荧光信号中非关联的背景噪音。
第二重组子模块24,用于将经降噪处理的动画组重组为新动画。
优选的是,所述lm模块30进一步包括:
识别子模块31,用于对新动画中的每一帧进行分析,通过与预定的点扩散函数相匹配的尺寸定位图像来识别非重叠的荧光信号。
第一构建子模块32,用于获得每个荧光信号的峰位置,构建相应的分辨率定位显微图像。
定位子模块33,用于根据lm算法定位出每个荧光信号的中心位置。所述荧光信号的中心位置即荧光标记分子的精确位置。
所述成像模块40,用于将每个荧光信号的中心位置叠加以构建样品的深层细胞超分辨率图像。
图4是本发明第二种深层细胞超分辨率成像的方法流程图,包括步骤有:
步骤s401,将棱镜光薄片装置设置于任何现有的倒置显微镜的顶部,通过物理手段消除非关联的背景噪音。
步骤s402,在对样品进行定位显微时,通过lm算法计算荧光标记分子的位置,并根据所述荧光标记分子的位置构建所述样品的深层细胞超分辨率图像。
如图5所示,所述棱镜光薄片装置包括:
一第一准直正透镜101;
一负透镜102;
一第二准直正透镜103;
一柱面镜104;
一照明物镜105;以及
一安装在所述照明物镜上的棱镜106。
优选的是,所述棱镜光薄片装置与水平方向的样品平台之间存在一预定角度。
更好的是,所述棱镜106使照明物镜105改变方向,并压缩照明物镜105的厚度。方向改变的角度和压缩程度都可通过调整棱镜106的方向来调节。
实例一:sofi+lm:在实施定位显微时,首先用较强的激发光使样品上的荧光标记分子开始闪烁,并且用具有电子倍增功能的ccd(chargecoupleddevice)相机记录将这些闪烁的信号记录成动画。然后定位软件通过以下步骤对动画的每一帧进行分析:(1)通过用与期望的点扩散函数相容的尺寸定位图像来识别非重叠的闪烁分子,根据系统的点扩散函数识别单分子的荧光信号;(2)使用高斯拟合或其他方法获得每个闪烁的荧光标记分子的峰位置,从中构建lm图像,对识别出的荧光信号进行高斯拟合并找到信号的中心从而定位出每一个荧光标记分子的精确位置。将这些位置叠加便可得到最终重构出的超分辨率图像。但是,当进行细胞深层成像时,来自其他层面的荧光信号(背景噪音)的强度会等于或大所探测层面的单分子荧光,从而改变焦平面单荧光分子图像的形状,导致算法在步骤(1)时无法找到需定位的区域,致使最终重构出的图像稀疏而不连续。
为了解决这一问题,将记录有闪烁荧光信号的动画重组为一系列的组,每个组包含5到15帧(帧数由信号强度和闪烁速度决定),然后用sofi对每个组进行二阶相关运算。这一运算可有效的去除或减少随机且不相关的背景信号。然后所有经过处理的图像重组为新的动画,并送入定位程序进行分析。原则上在lm处理的步骤(1)中可识别更多闪烁的荧光信号,并且将在步骤(2)中进一步被定位到纳米级精度,从而得到细胞深层超分辨率的切片图像而无需特殊的光学设置。这种方法基本上被应用于sofi以在lm算法前去除背景,将该方法称为sofi+storm。
首先,将通过数值模拟证实sofi的背景去除能力。在matlab程序(美国mathworks公司出品的商业数学软件)中,首先在焦平面生成20个随机闪烁的发光点,然后在离焦区域(1.5微米至4微米范围)随机生成30000个点光源。每个发光点的平均发光时间为2帧,一共生成10帧。这一模拟很好的重现了使用明场荧光显微时的环境。第一步,直接用定位程序处理这10帧图像。第二步,先使用sofi对图像进行降噪再使用定位软件进行处理。结果显示,对于未经sofi处理的图像,如图6a,离焦信号严重干扰了定位程序,因此每帧最多只有一个位置可被检测出。作为对比,通过sofi进行降噪处理,程序可识别并定位更多的位置,如图6b。而且sofi+lm能在对厚样品的超分辨率成像中提供更高的效率。
在实验中,对两种样品进行了测试:(1)shsy-5y(人神经母细胞瘤)细胞系中的线粒体外膜和(2)烟草根by-2细胞中的多泡体。两种样品都用alexa-647进行荧光标记,并浸泡于标准的定位显微缓冲液中。首先使用共聚焦显微镜对某一区域进行拍照用来和sofi+lm方法进行对比。对于线粒体样品,扫描层面为样品表面向上12微米,10微米和8微米处。对于多泡体样品,扫描层面为细胞表面内15微米深。所有的共聚焦显微图片由蔡司lsm7duo显微镜拍摄。然后,用自制的定位显微镜对以上区域层面进行拍摄。自制显微镜建于一个配有大数值孔径镜头倒置的荧光明场显微镜(优选尼康ti-e),所述大数值孔径镜头优选包括60倍cfiplanflour(平场荧光物镜)以及100倍cfiapotirf(尼康物镜)。所配滤镜组为:荧光滤镜:semrockff01-440/521/607/700-25,分束镜:semrockff410/504/582/669-25-36。所使用相机为:andorixon3emccd。激光照明由一台656纳米固体激光器提供(照明强度为0.5-0.8千瓦每平方厘米)以及一台405纳米半导体激光器(照明强度为8瓦每平方厘米)。激光强度为恰好时每个染料分子的发光时间为大约两帧。对于样品(1),使用100倍镜头并以20赫兹的频率进行记录,一共记录30000帧。对于样品(2),实验使用60倍镜头从而使焦平面达到15微米的深度。同样用30赫兹的频率记录40000帧。实验所使用的sofi以及定位算法来自于localizer(一种开源程序)。
图7a~7i对比了共聚焦显微镜(confocal),sofi+lm以及单独使用lm所得的不同层面线粒体外膜图像。这些图像清楚的展示了sofi+lm的分层能力以及对分辨率的提高。相较于共聚焦显微镜和lm,在12微米(um)深的层面,sofi+lm明显的展示了其成像质量的优势。即便是在背景较弱的8微米深的层面,sofi+lm依旧胜过了lm。在更潜的层面,lm由于使用了全内反射来去除背景,其成像质量终于胜过了sofi+lm。
为了进一步展示sofi+lm的性能,用其成像在烟草by-2型细胞内15微米的深处的多泡体。由于这一结构具有较大尺寸和较强的自发荧光,人们很难使用定位显微对其成像。图8a和8b展示了共聚焦显微镜(confocal)生成的多泡体结构的共聚焦图像。由于横向和纵向分辨率的限制,从其中并不能看出细小的结构。图8e展示了单独使用lm所得到的图像。正如数值模拟中的情形,由于背景的缘故,这一方法的探测效率被大大限制,从而不能重建出任何有意义的图像。与之形成对比的是,当使用sofi+lm对同样的原始数据进行处理,如图8f所示,所最终重建出的图像质量有了本质的提高,并且可清晰的看到多泡体横截面的环状结构。更为重要的是,对比于免疫金标记的电子显微镜图像,sofi+lm所提供的图像与之一致,且更连续稳定的体现了标记物所处的位置。如图8c所示,由金颗粒所标记的多泡体表面(图中黑点)和sofi+lm的图像完全一致。图8c表明sofi+lm的分辨率已达40纳米。总而言之,sofi+lm这一方法已经将定位显微术的使用范围从细胞表面几微米扩展到几十微米的区域。这一手段可用更简单的器材取得近似电子显微镜的分辨率来解析细胞内结构和蛋白分布,无需复杂的样品制备手段,并且有着实施活体成像的可能性。
实例二:棱镜光薄片显微镜:本专利的第二部分为一种产生光薄片照明的新型方法,这种方法可简单的配置在任何倒置显微镜上。如图9a所示,通过在照明物镜之前加入一个棱镜,不仅可改变照明光的方向,使其垂直于探测物镜并提供一个大的照明视场,并且可进一步使光片的厚度下降。而且,与lsbm相比,本发明的方法可与商用显微镜更好的结合在一起,所以应用起来更加简单,成像分辨率可通过使用一个大数值孔径的油浸物镜来得到进一步的提高。图9b是本发明加入棱镜后光薄片的偏折角度。图9c为理论计算的结果,其中压缩率为光路中没有棱镜时光薄片的厚度与有棱镜时厚度之比,在入射角度为70度时,压缩率为2倍。通过进一步的提高入射角度数并且调整棱镜的位置,可引入一个非常薄的光薄片照明,理论上可达到一微米以下,照明的方向平行于显微镜平台,所以可用现有的检测物镜来观测样品。这种结构在对较厚的样品进行单分子超分辨率成像中非常有用。在倒置显微镜中加入这种装置,并使用垂直方向移动的压电陶瓷,可较容易的实现深层细胞光学层析。将棱镜光薄片照明系统与奥林巴斯倒置显微镜结合的系统,可利用光纤引入照明光,需注意的是这种棱镜的结构可使光薄片非常靠近样品。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员当可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!