一种小麦成熟籽粒总蛋白双向电泳方法与流程
本发明属于生物技术领域,具体涉及一种针对小麦成熟籽粒总蛋白的双向电泳方法专利申请事宜。
背景技术:
小麦是我国两大口粮作物之一,能被加工成面条、馒头、面包、饼干、蛋糕等各式各样的食物,满足人们的消费需求。小麦的这种良好的加工品质主要取决于面筋蛋白。根据蛋白含量和面筋强度,可将小麦分为强筋小麦、中筋小麦和弱筋小麦。强筋小麦蛋白含量高、面筋强度大,是制作面包的必需原料,也是生产主食产品饺子、面条、馒头等专用粉的主要原料;弱筋小麦蛋白含量少、面筋强度小,是制作饼干的必需原料;中筋小麦蛋白含量和面筋强度介于两者之间,用于制作面条、馒头等中国主食产品。因此,小麦籽粒蛋白成分的鉴定和相关基因的分离对小麦品质改良尤为重要。
小麦籽粒蛋白可分为面筋蛋白和非面筋蛋白,面筋蛋白占面粉总蛋白含量的80-85%,由醇溶蛋白和麦谷蛋白组成的。醇溶蛋白与麦谷蛋白以一定的比例与数量相互作用,共同影响着小麦的品质性状;非面筋蛋白主要由球蛋白和清蛋白组成,占面粉总蛋白含量的15-20%。由于面筋蛋白在面粉形成面团时参与面筋的形成,是决定小麦加工品质的主要因素,因此,面筋蛋白基因的鉴定和利用是小麦优质育种的关键,具有重要的应用前景。
蛋白双向电泳技术是结合等电点和蛋白质大小分离蛋白质的一种有效方法,是目前质组学主要的研究方法之一。利用蛋白双向电泳技术,通过比较不同类型小麦成熟籽粒蛋白差异,筛选出影响小麦面筋品质的关键基因,开发出相应的分子标记,可为优质小麦育种提供技术。
但是,利用现有的蛋白质双向电泳技术在分离不同类型小麦成熟籽粒差异表达蛋白时,存在双向电泳图谱蛋白点少、分辨率不高、重复性较差的问题,因而极有必要加以改进。
技术实现要素:
本发明目的在于提供一种针对小麦成熟籽粒总蛋白的双向电泳方法,利用该方法可为小麦成熟籽粒总蛋白成分分析、品质相关基因分离、优质小麦品种培育等研究工作提供技术支持。
本发明所采取的技术方案详述如下。
一种小麦成熟籽粒总蛋白双向电泳方法,具体包括如下步骤:
(1)提取小麦成熟籽粒总蛋白;
具体例如采用TCA-丙酮法或直接提取法,优选采用直接提取法(直接裂解法)制备小麦成熟籽粒总蛋白的蛋白液;
(2)第一向等电聚焦;
将步骤(1)中所提取小麦成熟籽粒总蛋白进行第一向等电聚焦,采用17cm的 IPG预制胶条时,胶条pH=3~10,优选胶条pH=4~7,进一步优选胶条pH=5~8;
蛋白上样量设置为250~750μg,优选上样量为500μg;
(3)第二向SDS-PAGE电泳;
将步骤(2)中等电聚焦后胶条进行平衡后,进行第二向SDS-PAGE电泳;
(4)凝胶染色;
对步骤(3)中电泳结束后胶条采用考马斯亮蓝进行染色;
(5)图像扫描与分析;
对步骤(4)中染色后电泳胶条进行扫描获得电泳图谱,并进行分析;对胶条进行扫描时具体例如可采用Pharos FX Plus Molecular Imager仪器及QuantityOne软件进行处理,对扫描图谱分析具体例如可采用PDQuest软件进行分析处理。
总体而言,本申请以郑麦366品种的成熟小麦籽粒为例,对其成熟籽粒总蛋白的双向电泳体系进行了优化分析,结果表明:用直接提取法提取成熟小麦籽粒蛋白,使用17cm的pH=5-8的IPG预制胶条、上样量为500μg时,可获得清晰、蛋白点多且蛋白点分辨率高的双向电泳图谱。进一步在其他小麦品种实验中,证明了这一优化电泳体系的重复性及普适性。通过该双向电泳体系的建立,可为小麦籽粒蛋白质组学、小麦品质相关基因、优质小麦品种的培育等研究提供相应的技术支撑,因而具有较好的研究应用价值。
附图说明
图1为不同提取方法所提取的郑麦366籽粒蛋白质的双向电泳图,其中A:TCA-丙酮法;B:直接裂解法;
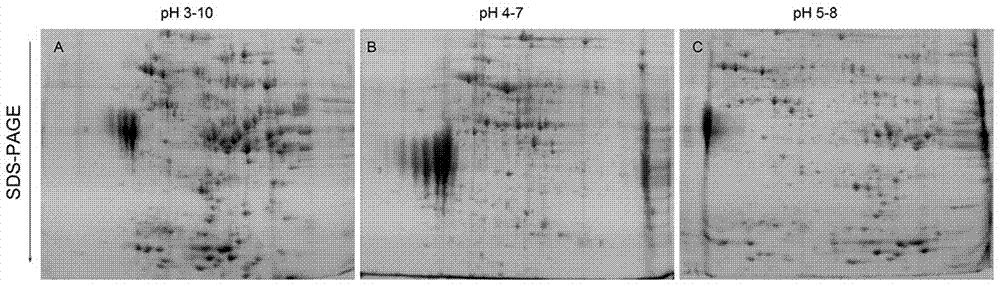
图2为不同pH的IPG预制胶条的小麦籽粒蛋白双向电泳图,其中A:pH=3-10的IPG胶条;B:pH=4-7的 IPG胶条;C:pH=5-8 的IPG胶条;
图3为不同上样量的小麦籽粒蛋白双向电泳图,其中A: 250μg;B: 500μg;C: 750μg;
图4为不同品种小麦籽粒蛋白双向电泳图,其中A:济南17;B:新麦18;C:新麦26。
具体实施方式
下面结合实施例对本申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中涉及部分物料、实验材料等情况简要介绍如下。
生物材料:
郑麦366,取自河南省农业科学院原阳基地2016年所收获郑麦366成熟籽粒;
济南17、新麦18及新麦26,由河南省农业科学院小麦研究所提供;
实验试剂:
Tris、甘氨酸、丙烯酰胺购于北京索莱宝科技有限公司;
乙酸、乙醇、磷酸、盐酸、硫酸铵购于上海国际集团试剂有限公司;
甘油、PVP(聚乙烯吡咯烷酮)、TEMED、SDS、尿素、硫脲、两性电解质(pH=3~10)、胰蛋白酶抑制剂、考马斯亮蓝G-250、溴酚蓝等购于上海生工生物工程有限公司;
IPG预制胶条、矿物油购于北京伯乐生命科学发展有限公司;
实验仪器:
等电聚焦仪(PROTEAN i12 TEF Cell)、图像扫描仪(Pharos FX Plus Molecular Imager)购于北京伯乐生命科学发展有限公司;
冷却水循环机购于北京长流科学仪器公司;
微量分光光度计ND2000c购于Thermo SCIENTIFIC公司。
实施例1
本申请所提供的小麦成熟籽粒总蛋白双向电泳方法,具体包括:1.提取小麦成熟籽粒总蛋白、2.第一向等电聚焦、3.第二向SDS-PAGE电泳、4.凝胶染色、5.图像扫描与分析等步骤。
由于本申请目的之一在于对小麦成熟籽粒总蛋白的双向电泳的整个操作体系进行适当优化,因而对于其中部分实验操作方法、操作参数进行了优化探讨,详细实验过程介绍如下。
一、小麦成熟籽粒总蛋白的提取
现有小麦成熟籽粒总蛋白常用提取方法主要为TCA-丙酮法和直接提取法,为确定哪种蛋白提取方法更适于进行双向电泳操作,发明人分别采用两种提取方法提取制备了小麦成熟籽粒总蛋白。具体介绍如下。
(1)TCA-丙酮法所制备的小麦成熟籽粒总蛋白,具体操作步骤如下:
①称取0.1g小麦成熟籽粒材料,加入10%PVP,加入液氮研成粉末;
②移入 2mL的离心管中,加入 0.7mL预冷的 10%的TCA丙酮(内含 0.07% β-巯基乙醇),充分涡旋后-20℃过夜,然后4℃、15000×g 条件下离心30min,弃上清;
③加入0.7mL预冷丙酮(含 0.07%β-巯基乙醇),涡旋混匀,-20℃沉淀 2 小时,期间每隔一定时间振荡一次,4℃、15000×g 条件下离心30min,弃上清;
④加入0.7mL的80%冷丙酮(含 0.07%β-巯基乙醇),涡旋混匀,-20℃沉淀 2 小时,4℃、15000×g 条件下离心30min,弃上清;将沉淀冷冻干燥成粉末,即为所制备的小麦成熟籽粒总蛋白,-20℃保存备用。
(2)直接裂解法所制备的小麦成熟籽粒总蛋白的蛋白液,具体操作步骤如下:
①用液氮将研钵与研棒预冷,然后在预冷后研钵中加入0.3g小麦成熟籽粒材料,加入10%PVP,用液氮研磨15分钟;
②将研磨好的小麦粉盛入预冷过的2mL离心管中,加入1mL裂解液(7 mol/L 尿素,3 mol/L 硫脲,质量分数4% CHAPS,0.1%蛋白酶抑制剂,0.5% 的pH=3-10的两性电解质),震荡10分钟,充分混匀,使其呈透明粘稠液体状;
③用液氮冻结,37℃水溶解,反复冻融3次(期间充分涡旋);
④最后室温13000rpm离心30分钟,取上清,即为所制备的小麦成熟籽粒总蛋白的蛋白液,保存备用,用于后续双向电泳分析。
对于所制备的小麦成熟籽粒总蛋白,在进行下一步试验前,首先要测定蛋白浓度,具体方法为:
利用生工Bradford试剂盒,参考其说明书,用1mg/mL BSA(牛血清蛋白)作为标准蛋白液制作标准曲线,然后依据标准曲线测定所制备小麦成熟籽粒总蛋白浓度。采用微量分光光度计ND2000c中的Bradford模式对蛋白液浓度进行测量。按照下表制作标准曲线所用的溶液及测得的吸光度:
。
根据标准曲线测稀释过的蛋白液的吸光度,将吸光度代入y=0.0026x+0.1683(R²=0.9943)的y中,得到的x值就是稀释过的浓度,将其换算成稀释前的浓度即可得蛋白液浓度,经计算后蛋白液浓度见下表:
注:蛋白液浓度对应的为图1~4中不同方式所制备蛋白液电泳前的蛋白液浓度。
从上述图1中蛋白液浓度数据可以看出,采用直接提取法所制备蛋白液浓度较高,表明蛋白质提取较为充分和全面,因此有可能更适宜于作为后续分析用样品。
二、第一向等电聚焦
具体操作步骤如下:
(1)从-20℃冰箱中取出水化上样缓冲液(7 mol/L 尿素,2 mol/L 硫脲,4% CHAPS,0.001%溴酚蓝),加入65mmol/L DTT,0.2%的两性电解质,备用;
(2)同时,从-20℃冰箱取出17cm的 IPG预制胶条,室温放置10分钟;
(3)取步骤一中采用不同方法所制备的小麦成熟籽粒总蛋白(TCA-丙酮法所制备的小麦成熟籽粒总蛋白,或者直接裂解法所制备的小麦成熟籽粒总蛋白的蛋白液,采用蛋白液时,蛋白总量与TCA-丙酮法所制备的小麦成熟籽粒总蛋白相等),用上述水化上样缓冲液补齐至500μL,充分混匀;
(4)沿着聚焦盘或水化盘中槽的边缘从左至右线性加入样品;
(5)分清胶条的正负极,轻轻地将IPG预制胶条胶面朝下置于聚焦盘中的样品溶液上;对好正、负极,盖上盖子;设置等电聚焦程序如下:
。
三、第二向SDS-PAGE电泳
(1)胶条平衡:
1)提前配制胶条平衡母液、胶条平衡缓冲液I、胶条平衡缓冲液II如下:
胶条平衡母液:6 mol/L尿素,2% SDS,0.375 mol/L的Tris-HCl(pH=8.8),20%
甘油;
胶条平衡缓冲液I:胶条平衡母液+0.02%DTT;
胶条平衡缓冲液II:胶条平衡母液+0.025%碘乙酰胺。
2)将步骤二中等电聚焦结束后胶条立即进行胶条平衡(如无法立即进行胶条平衡,则将胶条置于样品水化盘中-70℃保存备用),具体胶条平衡操作步骤如下:
将步骤二中等电聚焦结束后胶条移至溶胀盘中,倒入胶条平衡缓冲液I,将溶胀盘放在水平摇床上缓慢摇晃15分钟;
然后,将胶条转移至另一个溶胀盘中,倒入胶条平衡缓冲液II,再缓慢摇晃15分钟,平衡结束后用滤纸吸去多余的缓冲液,进行第二向SDS-PAGE电泳。
(2)第二向SDS-PAGE电泳的具体处理过程如下所述:
1)配制10%的丙烯酰胺凝胶液,将凝胶液倒入制胶槽中,静置,等待凝胶凝固;
2)将琼脂糖封胶液(0.5%低熔点琼脂糖,25mmol/L Tris,192mmol/L甘氨酸,0.1% SDS,0.001%溴酚蓝)进行加热溶解;
3)待凝胶凝固后,在凝胶的上方加入低熔点琼脂糖封胶液;
4)用镊子、压舌板或是平头的针头,轻轻地将胶条放入低熔点琼脂糖封胶液中,使之与聚丙烯酰胺凝胶胶面完全接触;
5)注意不要在胶条下方产生任何气泡;放置5分钟,使低熔点琼脂糖封胶液彻底凝固;
6)在低熔点琼脂糖封胶液完全凝固后。将凝胶转移至电泳槽中;
7)在电泳槽加入电泳缓冲液后,接通电源,起始时用的低电流(5mA/gel/17cm)或低电压,待样品在完全走出IPG胶条,浓缩成一条线后,再加大电流(或电压)(20mA/gel/17cm,),待溴酚蓝指示剂达到底部边缘时即可停止电泳。
四、凝胶染色
凝胶染色采用考马斯亮蓝染色,具体方法如下:
(1)电泳结束后,将凝胶立即置于托盘上,倒入固定液(40%乙醇,10%乙酸),置于摇床上固定2个小时;
(2)之后将固定液倒掉,加入考马斯亮蓝染液(20%甲醇,1.6%磷酸,8%硫酸铵,0.08%考马斯亮蓝G-250),在摇床上轻晃染色,过夜;染色后,用水脱去凝胶的背景色,更换水数次,直至背景脱净。
五、图像扫描与分析
使用仪器Pharos FX Plus Molecular Imager及软件QuantityOne进行对步骤(4)中染色后胶条进行扫描,然后利用PDQuest对扫描获得图像进行分析。
(1)不同蛋白提取方法所获得蛋白分析结果差异
按照上述步骤,对TCA-丙酮法和直接裂解法所分别提取的小麦成熟籽粒总蛋白进行双向电泳分析(步骤二中的蛋白上样量为500μg,IPG预制胶条的pH=5~8),电泳结果如图1所示。
从图1可以看出,PDQuest软件分析结果表明,TCA-丙酮法(图1A)所得蛋白点有206个,而直接提取法(图1B)所得蛋白点有642个,即直接裂解法获得的蛋白点远多于TCA-丙酮法。结合用直接提取法所制备蛋白液浓度较高的结果,后续蛋白分析时,均采用直接裂解法制备小麦成熟籽粒的总蛋白。
(2)不同胶条pH范围对蛋白分析结果影响
对直接裂解法所制备小麦成熟籽粒总蛋白(步骤二中的蛋白上样量为500μg),选择pH=3-10、pH=4-7、pH=5-8三种不同pH范围的IPG预制胶条,分别进行电泳分析,电泳图谱如图2所示。
从图2可以看出,PDQuest软件分析结果表明,pH=3-10胶条(图2A)所得蛋白点599个,pH=4-7胶条(图2B)所得蛋白点541个,pH=5-8胶条(图2C)所得蛋白点642个。这一结果表明:pH=3-10的胶条蛋白点集中,不易分辨;pH=4-7的胶条和pH=5-8的胶条蛋白点较分散,而pH=4-7的胶条左侧蛋白点明显比较集中且蛋白点数量少于pH=5-8的胶条。因此,pH=5-8的IPG预制胶条更适用于小麦成熟籽粒总蛋白的双向电泳。
(3)蛋白上样量对于蛋白分析结果影响
选用17cm的 pH=5-8 的IPG预制胶条,步骤二中的蛋白(直接裂解法所制备小麦成熟籽粒总蛋白)上样量分别设置我250μg、500μg、750μg三个不同的上样量进行实验,电泳图谱如图3所示。
从图3可以看出,PDQuest软件分析结果表明,上样量为250μg(图3A)时有398个蛋白点,上样量为500μg(图3B)时有642个蛋白点,上样量为750μg(图3C)时有651个蛋白点,与上样量为500μg时相差无几,但竖条纹变多,因此可确定最佳上样量为500μg。
就蛋白提取方法而已,由于样品材料不同,所适用蛋白提取方法也有一定差异。成熟小麦籽粒中因其淀粉含量高,因而制备蛋白质样品时,需要将淀粉去除干净,才能确保蛋白分析结果。由于丙酮能有效去除酚类色素等干扰物质、TCA可抑制蛋白降解,因而TCA-丙酮法是提取植物蛋白的最常用方法。但TCA-丙酮法通常较适合提取幼嫩组织蛋白,而不太适用于淀粉含量较高的小麦成熟籽粒总蛋白的提取,利用这个方法所提取的蛋白粉直接与水化上样缓冲液混合并用于双向电泳时,蛋白质丢失情况较为严重。而用直接裂解法处理小麦籽粒时,则可以较好地将淀粉杂质沉淀并除去,且所制备的蛋白液中蛋白浓度高,当采用蛋白液与水化上样缓冲液混合时,蛋白质不易丢失,双向电泳获得的蛋白点多且图谱清晰。
就IPG预制胶条的pH梯度选择而已,理论而言,pH梯度范围越窄的胶条分辨率越高,但由于在植物不同组织中所含蛋白的等电点有所不同,过窄的pH梯度范围可能导致蛋白的丢失,所以梯度过窄并非适用于任何蛋白分析,应根据所提取目的蛋白的pH范围选择适当的pH梯度范围的胶条。pH=3-10及pH=4-7的IPG预制胶条是双向电泳中最为常用的pH范围,但上述实验表明,使用pH=5-8的IPG胶条能使小麦成熟籽粒蛋白双向电泳图谱分辨率较高。
就蛋白上样量而言,上样量的多少与图谱的完整性与分辨率息息相关,上述实验表明,以17cm的 IPG预制胶条(pH=5~8)为例,上样量过少(250μg)时,检测到的蛋白点少,电泳图谱不完整,但上样量过多(750μg)时,不仅无法增加蛋白点,相反容易增加横竖条纹,进而影响图谱分辨率,因而合适上样量确定也是十分重要的。
总体而言,就小麦成熟籽粒总蛋白的双向电泳而言,采用直接提取法制备的蛋白液能够较好减少杂质干扰,配合17cm的 pH=5-8的IPG预制胶条时,上样量为500μg时能够获得较好的蛋白分析效果。
实施例2
在实施例1基础上,为确定实施例1所提供电泳方法对其他小麦材料的成熟籽粒总蛋白的电泳方法是否同样适用,发明人对济南17、新麦18及新麦26品种小麦成熟籽粒总蛋白进行了提取及双向电泳实验,简要介绍如下。
按照实施例1所提供操作方法,采用直接裂解法分别提取了济南17、新麦18及新麦26品种小麦成熟籽粒总蛋白,然后采用17 cm的 pH=5-8 的IPG预制胶条,按照500μg蛋白上样量标准,进行了双向电泳分析。电泳图谱如图4所示。
PDQuest软件分析结果表明,济南17(图4A)有669个蛋白点,新麦18(图4B)有675个蛋白点,新麦26(图4C)中有671个蛋白点。这一结果表明,实施例1中的电泳方法在其它小麦材料成熟籽粒总蛋白双向电泳实验中也同样适用,具有广适性。
- 还没有人留言评论。精彩留言会获得点赞!