肾素浓度的免疫学测定方法与流程
本发明是有关于一种对活性型肾素显示特异性的抗体、利用该抗体的肾素浓度的免疫学测定方法、包含该抗体的药剂、及包含该药剂的试剂盒。
背景技术:
肾素是一种经由肾素-血管紧张素-醛固酮系统来进行血压调节的蛋白质,其活性在高血压或原发性醛固酮增多症等的诊断中为重要的指标。
因此,用来测定肾素活性或肾素浓度的方法的开发持续进行,目前在日本,检测利用血浆中的肾素使血管紧张素原分解所生成的血管紧张素-i的肾素活性测定方法已成主流(非专利文献1)。然而,此方法有肾素活性需取决于血浆中的血管紧张素原的浓度的问题。
另一方面,作为不受血管紧张素原浓度的影响的方法,亦有人利用检测活性型肾素的方法。活性型的成熟肾素是由肾素原(prorenin)所生成;而肾素原存在有封闭结构(日语:クローズ構造)与开放结构(日语:オープン構造)此2种方式,其中开放结构为活性型。因此,在活性型肾素的测定中,亦有人开发出能以免疫学方式测定成熟肾素与开放结构肾素原此两者的方法(非专利文献1)。
然而,此等使用于免疫学手法的抗体,甚而连因与肾素抑制剂结合而呈非活性化的成熟肾素或肾素原皆可识别(非专利文献2、3),因此,在测定给药肾素抑制剂的患者的活性型肾素时,有测得的肾素浓度与肾素活性不显示相关性的问题。
[现有技术文献]
[非专利文献]
[非专利文献1]campbelldjetal.clinchem.2009may;55(5):867-77
[非专利文献2]campbelldj.hypertension.2008jan;51(1):15-8
[非专利文献3]derkxfh.clinchem.1996jul;42(7):1051-63
技术实现要素:
发明所要解决的技术问题
本发明鉴于此种情况而完成,其目的在于提供一种方法,其为以免疫学方式测定肾素浓度的方法,即使在肾素抑制剂的存在下,测得的肾素浓度仍与肾素活性显示相关性。又,本发明亦以提供一种用于该测定的活性型肾素特异性抗体、包含该活性型肾素特异性抗体的药剂、及包含该药剂的试剂盒为目的。
用于解决问题的技术方案
本案发明人等为解决前述课题,而建构出以免疫学方式测定肾素抑制剂存在下的肾素浓度的系统,并针对选出的抗体,利用该系统来评定添加肾素抑制剂时的肾素浓度的测定值与肾素活性的关系。其结果,终于由所评定的多个抗体中成功鉴定出在肾素抑制剂存在下测定出的肾素浓度与肾素活性极相关的多个抗体。
所鉴定的抗体不仅在添加肾素抑制剂之一的阿利吉仑(aliskiren)时,在添加其他的肾素抑制剂-肾素抑制剂iii或vtp-27999时,测得的肾素浓度亦与肾素活性显示强相关性。此事实意味着:取得的抗体对未与肾素抑制剂结合而具有活性的肾素显示高反应性,另一方面对结合肾素抑制剂而呈非活性的肾素的反应性大幅降低。又,显示此种反应性的抗体可识别肾素上的共同的表位。
另外,就市售的抗体,如以往报导所述,对结合肾素抑制剂而呈非活性的肾素亦显示高反应性,而完全未看出测得的肾素浓度与肾素活性的相关性。
如此,本申请的发明人等于世界上首次成功开发出一种无论有无肾素抑制剂存在,对活性型肾素皆显示特异反应性的抗体,并成功利用该抗体,建构出测得的肾素浓度与肾素活性显示强相关性的免疫学测定方法,终至完成本发明。
亦即,本发明是有关于一种对活性型肾素显示特异性的抗体、利用该抗体的肾素浓度的免疫学测定方法、包含该抗体的药剂、及包含该药剂的试剂盒,更详细而言,提供以下方案:
[1]一种抗体,其与非活性型肾素相比,对活性型肾素显示更高的反应性。
[2]如[1]的抗体,其与包含序列编号:1所记载的氨基酸序列的第30位至第86位的氨基酸序列的肽结合。
[3]一种使用抗体来测定试样中的肾素浓度的方法,其中,该抗体为如[1]或[2]的抗体。
[4]一种试剂盒,其为用于如[3]的方法的试剂盒,其至少包含如[1]或[2]的抗体。
[5]一种药剂,其为用来检测试样中的肾素的药剂,其包含如[1]或[2]的抗体。
发明的效果
根据本发明,在肾素抑制剂的存在下,亦可与在其未存在下同样地获得与肾素活性有关的肾素浓度的测定值。因此,对于给药肾素抑制剂的患者亦可进行确实的诊断。又,本发明的方法也没有像以血管紧张素原的由肾素所分解的产物的血管紧张素-i为指标的肾素活性的测定方法般,测定值会受到血浆中的血管紧张素原浓度的影响的问题。因此,本发明在原发性醛固酮增多症等与肾素活性有关的疾病的诊断等中极为有用。
附图说明
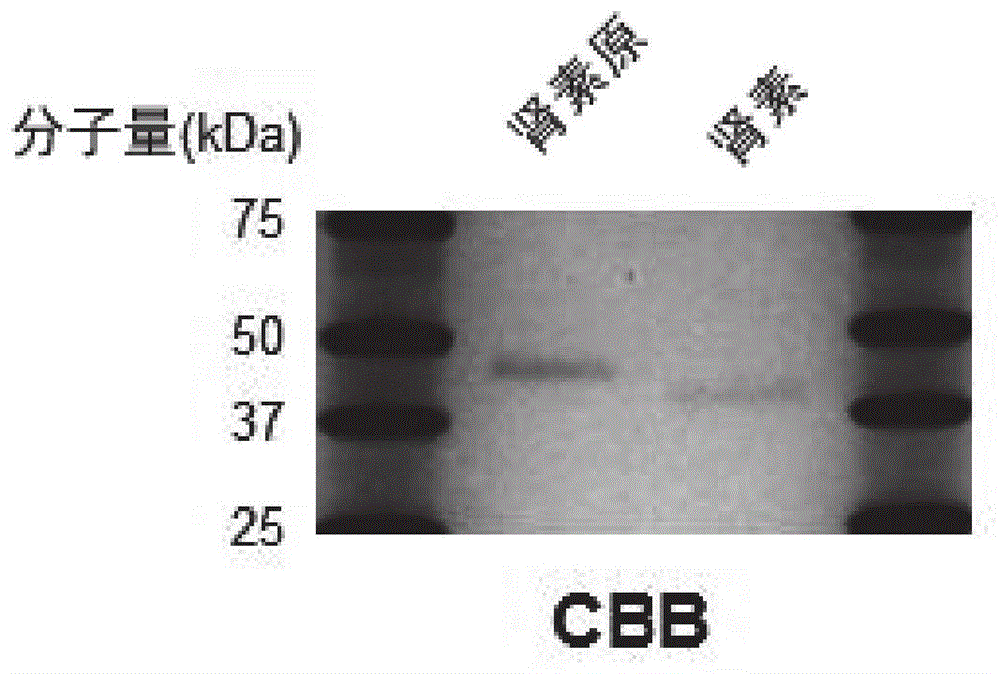
图1为表示利用sds-page分析来检测重组肾素原及重组成熟肾素的结果的照片。
图2为表示制作的各抗成熟肾素抗体对成熟肾素及肾素原的反应性的图。
图3为表示各市售抗体对成熟肾素及肾素原的反应性的图。
图4为表示根据使用市售抗体12-12与11-6的组合的夹心elisa(sandwichelisa,夹心酶联免疫吸附法)的添加阿利吉仑时的肾素浓度与肾素活性的相关性的图。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图5为表示根据使用本公司抗体rren33h11与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度与肾素活性的相关性的图。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图6为表示各本公司抗体及各市售抗体在添加阿利吉仑时及未添加时对成熟肾素的反应性的图。
图7为表示根据使用本公司抗体rren-i-115与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度与肾素活性的相关性的图。于上图,直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。于下图,图中的横轴取相对肾素活性、纵轴取肾素浓度(abs.450nm)而表示。
图8为表示根据使用本公司抗体rren63a8与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度与肾素活性的相关性的图。作为阴性对照组,是使用市售抗体12-12与11-6的组合。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图9为表示根据使用市售抗体12-12与11-6的组合的夹心elisa的添加肾素抑制剂iii时的肾素浓度与肾素活性的相关性的图。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图10为表示根据使用本公司抗体rren-i-115或者rren33h11与rren21e10-19的组合的夹心elisa的添加肾素抑制剂iii时的肾素浓度与肾素活性的相关性的图。作为阴性对照组,使用市售抗体12-12与11-6的组合。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图11为表示根据使用本公司抗体rren-i-115与rren21e10-19的组合的夹心elisa,来测定添加阿利吉仑时及未添加时对肾素原的反应性的结果的图。图中的横轴取添加的肾素原浓度、纵轴取测得的肾素原浓度(abs.450nm)而表示。
图12为表示使用于表位分析的肾素片段的图。
图13为表示利用蛋白质印迹法来鉴定本公司抗体rren63a8的表位的结果的照片。
图14为表示本公司抗体(rren-d-104-1、rren-i-115、rren63a8)的竞争性抑制实验的结果的图。
图15为表示根据使用本公司抗体rren-i-115或者rren33h11与rren21e10-19的组合的夹心elisa的添加vtp-27999时的肾素浓度与肾素活性的相关性的图。作为阴性对照组,使用市售抗体12-12与11-6的组合。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图16为表示根据使用本公司抗体rren-d-104-1与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度与肾素活性的相关性的图。直方图表示肾素活性,折线图表示肾素浓度。图中的横轴取阿利吉仑浓度、纵轴取相对肾素活性(左)与肾素浓度(右)而表示。
图17为表示根据使用本公司抗体的组合、或市售抗体的组合的夹心elisa,来检测添加阿利吉仑时及未添加时对人类血浆所含的成熟肾素的反应性的结果的图。
具体实施方式
本发明提供一种与非活性型肾素相比、对活性型肾素显示更高的反应性的抗体(以下称为“本发明的活性型肾素特异性抗体”)。又,本发明提供一种使用抗体来测定试样中的肾素浓度的方法,其中该抗体为本发明的活性型肾素特异性抗体。
本发明中所称“肾素”,是指成熟肾素及作为其前体的肾素原。肾素原是包含封闭结构肾素原与开放结构肾素原。其中,成熟肾素及开放结构肾素原原本即具有将血管紧张素原分解而生成血管紧张素-i的活性,封闭结构肾素原则原本不具有此活性。然而,结合肾素抑制剂时,成熟肾素及开放结构肾素原会成为非活性。从而,本发明中的“活性型肾素”是包含:上述肾素当中,未结合肾素抑制剂的成熟肾素及开放结构肾素原;“非活性型肾素”则包含:上述肾素当中,原本不具有活性的封闭结构肾素原、以及结合肾素抑制剂而呈非活性的成熟肾素及开放结构肾素原。
作为本发明中的“肾素抑制剂”,可举出例如阿利吉仑、肾素抑制剂iii或者vtp-27999;只要可结合于肾素而抑制其活性,则非限于此等。此外,阿利吉仑(aliskiren)是作为高血压治疗药(商品名rasilez),由novartispharmaceuticals公司于市面贩卖。又,肾素抑制剂iii(renininhibitoriii)为具有人类肾素抑制活性的肽(woodj.etal.hypertension.7,797(1985)),由karebaybiochem公司于市面贩卖。又,vtp-27999为由vitaepharmaceuticals公司所开发的具有人肾素抑制活性的烷胺化合物(lanqijiaetal.acsmed.chem.lett.2,747(2011)),由chemscene公司于市面贩卖。在本发明的活性型肾素特异性抗体对肾素的反应性的评定中,亦可利用此等市售品。
本发明的活性型肾素特异性抗体,只要与非活性型肾素相比,对活性型肾素显示更高的反应性,则不特别限制。所称“与非活性型肾素相比,对活性型肾素显示更高的反应性”,是指至少与非活性型成熟肾素相比,对活性型成熟肾素显示更高的反应性的意思。较佳的是,进一步意指与非活性型肾素原相比,对活性型肾素原显示更高的反应性的意思。
此处所称“更高的反应性”,是指较佳为1.5倍以上,更佳为2倍以上(例如3倍以上、4倍以上、5倍以上)的反应性。对非活性型成熟肾素及活性型成熟肾素的反应性可例如以依循本实施例6所记载的方法(成熟肾素浓度100ng/ml)所测得的450nm的吸光值为基准来评定。又,对非活性型肾素原及活性型肾素原的反应性可例如以依循本实施例11所记载的方法(肾素原浓度100ng/ml)所测得的450nm的吸光值为基准来评定。
就本发明的活性型肾素特异性抗体的特佳方式,为与包含序列编号:1所记载的氨基酸序列的第30位至第86位的氨基酸序列的肽结合的抗体(于人类成熟肾素的氨基酸序列的第30位至第86位的氨基酸序列具有表位的抗体)。该抗体更佳为不与包含序列编号:1所记载的氨基酸序列的第58位至第170位的氨基酸序列的肽结合的抗体。作为具体的抗体,可举出本实施例所记载的“rren63a8”、“rren-i-115”、及“rren-d-104-1”。“rren63a8”及“rren-i-115”,与结合肾素抑制剂的成熟肾素相比,对未结合肾素抑制剂的成熟肾素分别显示约2倍及约5倍的反应性(图6)。“rren-i-115”,进而与结合肾素抑制剂的肾素原相比,对未结合肾素抑制剂的肾素原显示约2倍的反应性(图11)。“rren-d-104-1”对活性型成熟肾素显示与“rren-i-115”同等的特异性(图17)。因此,利用此等抗体所测得的肾素浓度,可与肾素活性显示较强的相关性(图7、8、10、15、16)。又,由于可识别与“rren63a8”、“rren-i-115”、或者“rren-d-104-1”相同的表位的其他抗体亦可认为具有同样的特性,故于本发明中有用。
就使用于本发明的测定的“试样”,只要为可存在肾素的试样则不特别限制。以测定与肾素活性的异常有关的疾病的诊断基础的肾素浓度为目的,一般是使用血液检体。血液检体较佳为血清或血浆。
作为使用本发明的活性型肾素特异性抗体而以免疫学方式测定肾素浓度的方法,可举出例如使用放射性同位素作为标记的ria法(放射免疫测定方法)、使用化学发光性化合物作为标记的clia法(化学发光免疫测定方法)、使用酶作为标记的cleia法(化学发光酶免疫测定方法)或eia法(酶免疫测定方法)、乳胶凝聚法、免疫色谱法等,但不限于此等。免疫学测定可为非竞争性测定方法或竞争性测定方法。
在免疫学手法中所使用的抗体可为例如igg、igm、iga、igd、ige、igy等任一种同种型。此类抗体又可为多克隆抗体或单克隆抗体(例如嵌合抗体、人源化抗体、人抗体)、这些的抗体片段。抗体片段可举出例如f(ab')2、fab'、fab、fv、单链抗体、双价抗体等,但不限定于此等。抗体较佳为单克隆抗体。单克隆抗体可使用利用杂交瘤法或重组dna法等周知的方法制成。
在用于本发明的单克隆抗体的制作中,是如本实施例所记载,首先,制作针对成熟肾素的单克隆抗体,选出对成熟肾素具有高反应性、对肾素原的反应性较低的单克隆抗体。其次,只要从选出的单克隆抗体当中选出无论有无肾素抑制剂存在,测定值皆与肾素活性显示相关性的抗体即可。又,一旦获得本发明的活性型肾素特异性抗体时,亦可确定其表位,利用包含该表位的肽作为抗原,来有效地获得目标的活性型肾素特异性抗体。
作为杂交瘤法,代表性者可举出科勒及米尔斯坦的方法(kohler&milstein,nature,256:495(1975))。使用于此方法中的细胞融合步骤的抗体产生细胞为以抗原(靶蛋白质、其部分肽、或表达此等物质的细胞等)进行免疫的动物(例如小鼠、大鼠、仓鼠、兔子、猿猴、山羊、绵羊、驴子、骆驼、羊驼、鸡)的脾脏细胞、淋巴节细胞、末梢血白血球等。亦可使用使抗原在培养基中对从未经免疫的动物中预先分离出来的上述的细胞或淋巴球等进行作用而得到的抗体产生细胞。作为骨髓瘤细胞,可使用周知的各种细胞株。抗体产生细胞及骨髓瘤细胞,只要这些可融合,则亦可为源于不同动物物种,较佳为源于同一动物物种。就杂交瘤而言,例如,通过由以抗原进行免疫的小鼠所得的脾脏细胞与小鼠骨髓瘤细胞之间的细胞融合而产生,再利用其后的筛选,可获得可产生对靶蛋白具有特异性的单克隆抗体的杂交瘤。针对靶蛋白的单克隆抗体可利用培养杂交瘤,此外从给药杂交瘤的哺乳动物的腹水中取得。
重组dna法是一种将编码上述抗体的dna从杂交瘤或b细胞等进行克隆,重组到适当的载体,并将其导入宿主细胞(例如哺乳类细胞株、大肠菌、酵母细胞、昆虫细胞、植物细胞等),而使其产生重组抗体的手法(例如p.j.delves,antibodyproduction:essentialtechniques,1997wiley;p.shepherdandc.deanmonoclonalantibodies,2000oxforduniversitypress;vandammea.m.etal.,eur.j.biochem.192:767-775(1990))。在编码抗体的dna的表达中,可将编码重链或轻链的dna各自载入表达载体而转化宿主细胞,也可将编码重链及轻链的dna载入单一表达载体而转化宿主细胞(参照wo94/11523号公报)。重组抗体可通过培养上述宿主细胞并从宿主细胞内或培养液中分离、纯化,而以实质上为单纯且均匀的方式取得。抗体的分离、纯化可使用一般多肽的纯化所使用的方法。只要利用转基因动物制作技术,来制作重组有抗体基因的转基因动物(牛、山羊、绵羊或猪等),亦可由该转基因动物的乳汁中大量地取得源自抗体基因的单克隆抗体。
作为使用于本发明的测定的活性型肾素特异性抗体,可使用结合有标记物质的抗体。作为标记物质,只要是可使其结合于抗体而检测出来者则不特别限制,可举出例如125i等的放射性同位素、碱性磷酸酶(alp)、辣根过氧化酶(hrp)、β-半乳糖苷酶(β-gal)等的酶、异硫氰酸荧光素(fitc)或罗丹明异硫氰酸盐(ritc)等的荧光色素、别藻蓝蛋白(apc)或藻红素(r-pe)等的荧光蛋白质、抗生物素蛋白、生物素、乳胶、金粒子等。
使用酶作为标记物质时,就底物而言,可利用添加发色底物、荧光底物、或者化学发光底物等,而根据底物来进行各种检测。
除使用结合有标记物质的活性型肾素特异性抗体来直接检测肾素的方法以外,亦可利用:未将标记物质结合于本发明的活性型肾素特异性抗体,而是利用结合有标记物质的二抗等来间接地检测的方法。此处所称“二抗”,是指对本发明的活性型肾素特异性抗体显示反应性的抗体。例如,以小鼠抗体形式调制本发明的活性型肾素特异性抗体时,作为二抗可使用抗小鼠igg抗体。对于源自兔子、山羊、小鼠等各种生物物种的抗体,可使用的标记二抗是于市面贩卖,可依据本发明的活性型肾素特异性抗体所来源的生物物种,选择适当的二抗使用。亦可使用结合有标记物质的蛋白g或蛋白a等来替代二抗。
本发明的活性型肾素特异性抗体与标记物质的结合亦可利用生物素-抗生物素蛋白系统。于方法中,例如使本发明的活性型肾素特异性抗体进行生物素化,并使经抗生物素蛋白化的标记物质与其作用,利用生物素与抗生物素蛋白的相互作用,而使标记物质结合于本发明的活性型肾素特异性抗体上。
就用于本发明的免疫学测定方法的检测原理而言,基于可建构高灵敏度的检测系统的观点,较佳为夹心法。于夹心法中,是以经固相化的捕捉用抗体捕捉检测对象物质,使其识别为结合有标记物质的检测用抗体,洗涤后,依据标记物质的种类进行检测。作为固相,可使用例如磁性粒子或乳胶粒子等粒子、塑料板等平板、或者硝基纤维素等纤维状物质。
捕捉用抗体可直接固定于固相,亦可间接地固定于其上。举例而言,利用将结合于捕捉用抗体的物质固定于固相,并使捕捉用抗体结合于该物质,可将捕捉用抗体间接地固定于固相。作为结合于捕捉用抗体的物质,可举出例如上述的二抗、蛋白g、蛋白a等,但不限于此等。又,捕捉用抗体经生物素化时,可利用经抗生物素蛋白化的固相。
于本发明中,可将活性型肾素特异性抗体作为捕捉用抗体使用,亦可将其作为检测用抗体(标记抗体)使用。从而,利用夹心法时,不一定需要标记本发明的活性型肾素特异性抗体,也可标记另一抗体。另一抗体,可以是至少对未结合肾素抑制剂的成熟肾素显示反应性者,则亦可为对结合肾素抑制剂的成熟肾素显示反应性者。再者,亦可对肾素原显示反应性。例如,较佳使用:无论有无肾素抑制剂存在,对所有的肾素皆显示高反应性的抗体(本实施例的rren21e10-19等)、或对肾素原的反应性虽不高,但无论有无肾素抑制剂存在,对成熟肾素皆显示高反应性的抗体(本实施例的11-6等)(图3、6)。就夹心法而言,例如较佳为属clia法的一方式的夹心clia法、属于cleia法的一方式的夹心cleia法、属于ria法的一方式的irma法(免疫放射定量法)。
由所得测定值确定肾素浓度时,一般可利用与各浓度的标准肾素试剂的测定值比较来进行。此时,例如,可利用探讨实际的测定值定位于基于标准肾素试剂的测定值所作成的标准曲线上的哪一个位置,来求出试样中的肾素浓度。
根据本发明所测得的试样中的肾素浓度,与试样中的肾素活性显示相关性。从而,本发明的方法可利用于与肾素活性的异常有关的疾病的诊断(罹患或其风险的评定)。此处“与肾素活性的异常有关的疾病”是意指包含起因于肾素活性的异常的疾病及因疾病的发病而使肾素活性变为异常的疾病此两者。与肾素活性的异常有关的疾病中,作为肾素活性显示高值的疾病,可举出例如恶性高血压、嗜铬细胞瘤、原发性选择性低醛固酮症、肾血管性高血压、肾实质性高血压、慢性心衰竭、肾病综合症、肝硬化、脱水、addison病、bartter综合症、gitelman综合症、产肾素肿瘤、高肾素性原发性高血压等;作为肾素活性显示低值的疾病,可举出例如原发性醛固酮增多症、低肾素性原发性高血压、间质性肾炎、糖尿病肾病、肾盂肾炎、11β-水解酶缺乏症、17α-水解酶缺乏症、ame综合症、doc产生肿瘤、liddle综合症、假多醛固酮症、先天性肾上腺酶缺乏症、低肾素性选择性低醛固酮症、醣皮质素反应性多醛固酮症、特发性多醛固酮症等。
又,本发明是提供一种药剂,其为用来检测试样中的肾素的药剂,其是包含本发明的活性型肾素特异性抗体。本发明的药剂所含的活性型肾素特异性抗体是如上述,可为结合有标记物质者。本发明的药剂中,除抗体成分外,亦可视需求包含杀菌水、生理盐水、缓冲剂、保存剂等其他的成分。
再者,本发明是提供一种用于上述本发明的方法的试剂盒。本发明的试剂盒是至少包含本发明的活性型肾素特异性抗体作为抗体标准品,惟可进一步组合标准肾素试剂(各浓度)、对照试剂、试样的稀释液、稀释用匣体、洗涤液等。利用酶标记时,可包含标记的检测所需的底物或反应停止液等。以夹心法为检测原理时,可包含例如经固相化的肾素捕捉用抗体或者固定有结合于肾素捕捉用抗体的物质的固相。又,未标记一次抗体时,例如,可使对结合于该一次抗体进行标记的物质包含于试剂盒中。又,本发明的活性型肾素特异性抗体生物素化时,例如,可使经抗生物素蛋白化的标记物质包含于试剂盒中。本发明的试剂盒可进一步包含该试剂盒的使用说明书。
本发明的药剂或试剂盒可例如作为体外诊断用医药品,而利用于与上述肾素活性的异常有关的疾病的诊断基础的肾素浓度的测定。
[实施例]
以下,基于实施例对本发明更具体地加以说明,惟本发明不限定于以下实施例。
[实施例1]重组成熟肾素的调制
(1)重组肾素原的纯化
将his标签标记肾素原表达cho细胞,使用高密度培养用单元ad1000在无血清培养基bdselect(bdbiosciences)中培养1周。回收培养上清液,以4℃、1000rpm、10分进行离心,回收上清液。将上清液通入his标签纯化用的亲和柱(talonmetalaffinityresin(clontech))中。以磷酸缓冲生理盐水(pbs)洗涤后,以150mm咪唑溶液使其洗脱,每次1ml地回收洗脱液达10级分(fraction)。对回收的级分实施sds-page分析,确认肾素原洗脱后,汇集全部的级分,以pbs实施透析一夜。翌日,回收透析后的溶液,使用超滤柱(amiconultra10k)进行浓缩,回收肾素原溶液。
(2)重组成熟肾素的纯化
对(1)中经纯化的重组肾素原,以重量比1:50的方式添加胰蛋白酶(sequencinggrademodifiedtrypsin,promega)溶液(0.1mg/ml,50mmacetate),于4℃使其反应1小时,以15000rpm,rt,5分钟进行离心,并回收上清液。对回收的上清液,以20mmtris-hcl(ph7.0)溶液利用凝胶渗透色谱法(柱:superdex7510/300)进行纯化。利用sds-page进行级分分析,回收包含成熟肾素的级分。对回收的溶液,以pbs进行透析一夜。翌日,回收透析后的溶液,使用超滤柱(amiconultra10k)进行浓缩。
(3)重组肾素原及重组成熟肾素的sds-page分析
对调整为20μg/ml的重组成熟肾素溶液及重组肾素原溶液添加等量的包含100mmdtt的2×sds-pagesamplebuffer(2×laemmlisamplebuffer,biorad),以95℃,5分钟进行变性。将制备的试样以10μl/lane添加于sds-page用的预制胶(mini-proteanpgxprecastgel4-20%)。将胶装设于电泳裝置,以恒定、200v进行电泳24分钟。将胶以超纯水洗涤后,添加gelcodebluesafeproteinstain(thermoscientific)于室温进行染色2小时左右。以超纯水使经染色的胶脫色,并加以拍摄。其结果,確认重组肾素原及重组成熟肾素经纯化(图1)。
[实施例2]成熟肾素特异性抗体的取得
(1)小鼠免疫
对7-8周大balb/c小鼠及icr小鼠(母)给药50μg/body的重组成熟肾素与弗氏完全佐剂的等量乳液至腹腔。此后每隔2周,给药50μg/body的重组成熟肾素与弗氏不完全佐剂的等量乳液至腹腔2-5次直到確认抗体效价上升为止。
(2)抗成熟肾素抗体产生杂交瘤的制作
对确认抗体效价充分上升的小鼠给药50μg/body的重组成熟肾素溶液至腹腔。3-4日后摘出小鼠脾脏,使用脾脏细胞、此前以rpmi1640所培养的骨髓瘤细胞p3u1与peg来实施融合。将融合后经7-14日后的培养上清液添加于抗小鼠免疫球蛋白抗体经固相化且经洗涤的试验板,进行一次反应。以pbs-t洗涤3次后,添加市售的以生物素化试剂(sulfo-nhs-lcbiotin,thermoscientific)进行生物素化的重组肾素溶液(1μg/ml)或者生物素化肾素原溶液,进行二次反应。以pbs-t洗涤3次后,添加pod标记的链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次后,添加abts或者tmb,进行发色反应。添加1.5m草酸水溶液或者0.5mh2so4而停止发色反应,测定405nm或者450nm的吸光度。选择对肾素的反应较高的殖株,经过利用有限稀释的克隆而确立单克隆抗体产生杂交瘤。
(3)抗成熟肾素抗体的纯化
将杂交瘤在无血清培养基中培养约1-2周,回收其培养上清液。将培养上清液通入proteing柱中,使抗体与其结合。使用pbs洗涤后,以洗脱液(0.2mglycine-hcl,ph2.5)使抗体洗脱,添加中和液(1mtris-hcl,ph9.0)加以中和。对抗体溶液以pbs进行透析一夜,以超滤柱进行浓缩。
(4)对生物素化成熟肾素及生物素化肾素原的反应性的探讨
将以pbs稀释的2μg/ml的抗小鼠免疫球蛋白抗体溶液添加于化验平板,进行固相化。以pbs-t洗涤3次后,将1%bsa-pbs添加于化验平板,进行封闭。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的抗成熟肾素抗体溶液,进行一次反应。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的1μg/ml的生物素化肾素及生物素化肾素原,进行二次反应。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的pod标记的链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次后,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。其结果,多个殖株对生物素化成熟肾素显示高特异性(图2)。
[实施例3]市售抗体的反应性探讨
将以pbs稀释的2μg/ml的抗小鼠免疫球蛋白抗体溶液添加于化验平板,进行固相化。以pbs-t洗涤3次后,将1%bsa-pbe添加于化验平板,进行封闭。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的1μg/ml的各市售抗体及本公司抗体,进行一次反应。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的1μg/ml的生物素化肾素及生物素化肾素原,进行二次反应。以pbs-t洗涤3次后,添加以1%bsa-pbs稀释的pod标记的链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次后,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。其结果,市售抗体11-6对成熟肾素显示高特异性(图3)。
[实施例4]根据使用市售抗体的组合的夹心elisa的添加阿利吉仑时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的市售抗体12-12添加于化验平板,进行固相化。以pbs-t洗涤3次,将1%bsa-pbe添加于化验平板,进行封闭。以pbs-t洗涤3次,将以pbs稀释的1μg/ml的重组成熟肾素溶液与200,40,8,1.6,0.32ng/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记市售抗体11-6添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与阿利吉仑溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,就市售抗体12-12与11-6的组合夹心elisa,添加阿利吉仑时肾素浓度与肾素活性未显示相关性(图4)。
[实施例5]根据使用本公司抗体rren33h11与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的本公司抗体rren33h11溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的1μg/ml的重组成熟肾素溶液与200,40,8,1.6,0.32ng/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与阿利吉仑溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,就以对成熟肾素的特异性为指标而确立的本公司抗体rren33h11与rren21e10-19的组合夹心elisa,添加阿利吉仑时肾素浓度与肾素活性亦未显示相关性(图5)。
[实施例6]添加阿利吉仑时的利用生物素化肾素捕捉能力的筛选法的确立及活性型肾素特异性抗体的取得
(1)阿利吉仑添加时的生物素化肾素捕捉能力的测定
将以pbs稀释的2μg/ml的抗肾素抗体溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,添加以pbs稀释的1μg/ml的生物素化成熟肾素溶液与200ng/ml的阿利吉仑溶液各以等量混和者,进行一次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行二次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
其结果,利用测定添加阿利吉仑时的生物素化成熟肾素捕捉能力,可建构出以阿利吉仑存在时对成熟肾素的反应性为指针的筛选系统。又,可获得添加阿利吉仑时对成熟肾素的反应性显著减少的殖株(图6)。
[实施例7]根据使用本公司抗体rren-i-115与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的本公司抗体rren-i-115溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的1μg/ml的重组成熟肾素溶液与200,40,8,1.6,0.32ng/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与阿利吉仑溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,就以阿利吉仑存在下对成熟肾素的反应性为指标而选出的本公司抗体rren-i-115与rren21e10-19的组合夹心elisa,肾素浓度与肾素活性显示强相关性(图7)。
[实施例8]根据使用本公司抗体rren63a8与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的本公司抗体rren63a8溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的1μg/ml的重组成熟肾素溶液与200,40,8,1.6,0.32ng/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与阿利吉仑溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,与rren-i-115相同,就使用以阿利吉仑存在时对成熟肾素的反应性为指标而选出的殖株rren63a8所组成的夹心elisa,肾素浓度与肾素活性显示相关性(图8)。
[实施例9]根据使用市售抗体12-12与11-6的组合的夹心elisa的添加肾素抑制剂iii时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的市售抗体12-12添加于化验平板,进行固相化。以pbs-t洗涤3次,将1%bsa-pbe添加于化验平板,进行封闭。以pbs-t洗涤3次,将以pbs稀释的200ng/ml的重组成熟肾素溶液与2000,400,80,16,3.2ng/ml的肾素抑制剂iii溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记市售抗体11-6添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与肾素抑制剂iii溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,市售抗体的组合,在添加肾素抑制肽时亦未显示肾素浓度与肾素活性的相关性(图9)。
[实施例10]根据使用本公司抗体rren-i-115或者rren33h11与rren21e10-19的组合的夹心elisa的添加肾素抑制剂iii时的肾素浓度的测定
(1)肾素浓度的测定
将以pbs稀释的2μg/ml的本公司抗体rren-i-115或者rren33h11溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的200ng/ml的重组成熟肾素溶液与2000,400,80,16,3.2ng/ml的肾素抑制剂iii溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板。接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical),进一步添加将20μl的重组成熟肾素溶液与肾素抑制剂iii溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,与添加阿利吉仑时相同,rren33h11的组合未显示与肾素活性的相关性;而rren-i-115的组合则显示与肾素活性的强相关性(图10)。
[实施例11]根据使用本公司抗体rren-i-115与rren21e10-19的组合的夹心elisa的添加阿利吉仑时的肾素原浓度的测定
将以pbs稀释的2μg/ml的本公司抗体rren-i-115或者rren33h11溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的200,50,8,0.4ng/ml的重组肾素原溶液与10μg/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
其结果,就使用rren-i-115与rren21e10-19的组合的夹心elisa,确认亦未测得与阿利吉仑结合的肾素原(图11)。
[实施例12]表位的鉴定
(1)肾素切断片段的制作
将全长的肾素基因序列适当地片段化(图中的a,b,c,d,e,a3,a13,a23),制成末端附加有限制酶切位点的肾素片段序列(图12)。对gst表达载体,使用限制酶导入此等肾素片段序列,制成gst融合于n末端的肾素切断片段表达载体。将制作的表达载体进行基因导入至大肠菌dh5α,来进行质粒的扩增。将所得质粒导入于大肠菌bl21,以lb培养基振荡培养一夜。其后,将菌液以lb培养基稀释10倍,振荡培养1小时。以1mmiptg进行表达诱导,进一步振荡培养3小时。以15000rpm、室温、1分钟进行离心并回收菌体。对菌体添加300μl的含有0.01%tween20的pbs,将悬浮液进行超音波震碎15分钟。将超音波震碎液以15000rpm、室温、10分钟进行离心并回收上清液,而调成切断片段液。
(2)利用蛋白质印迹法的表位鉴定
对切断片段液添加半量的3×sds-page试样缓冲液,于96℃进行加热变性5分钟。将调制的试样以7.5μl(25μlculture的量)添加于sds-page用胶(miniproteantgxprecastgel,4-20%,biorad),以恒定200v进行电泳30分钟。将sds-page用胶使用i-blot(thermoscientific)转印于pvdf膜,将此pvdf膜浸渍于含有1%脱脂乳的pbs来进行封闭。将pvdf膜浸渍于包含1μg/ml的rren63a8及抗gst抗体(gst2-1)的含有1%脱脂乳的pbs并进行振荡,来进行一次反应。将pvdf膜用pbs-t以5分钟洗涤3次,浸渍于以含有1%脱脂乳的pbs稀释1000倍的pod标记抗小鼠抗体液并进行振荡,来进行二次反应。将pvdf膜用含有tween20的pbs以5分钟洗涤3次,对pvdf膜添加发光底物(eclprime,gehealthcare),去除多余的液体后以las500(gehealthcare)确认发光。
其结果,rren63a8可识别ren-a、a13、a23、a3各者,但无法识别ren-b、c、d、e(图13)。由于rren63a8可识别ren-a3,而表示可识别肾素氨基酸序列的第30號至第86號的57氨基酸的範圍。再者,由于无法识别ren-d,亦暗示可识别肾素氨基酸序列第30位至第57位的28氨基酸的范围的可能性。
(3)抗体彼此的抑制試验
将以pbs稀释成2μg/ml的3种本公司抗体(rren-d-104-1、rren-i-115、rren63a8)添加于化验平板,进行固相化。以pbs-t洗涤3次,将1%bsa-pbe添加于化验平板,进行封闭。以pbs-t洗涤3次,将以1%bsa-pbs稀释的200ng/ml的肾素与以1%bsa-pbs稀释的800μg/ml的3种本公司抗体或者1%bsa-pbs各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的1μg/ml的生物素化rren21e10-19,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记的链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
其结果,以3种抗体所有组合,可利用与抗原共同添加的阻害抗体来抑制反应(图14)。藉此,其表示rren-d-104-1及rren-i-115可识别与rren63a8相同的表位。
[实施例13]根据本公司抗体rren-i-115或者rren33h11与rren21e10-19的组合夹心的添加有vtp-27999的肾素浓度的测定
(1)肾素浓度测定
将以pbs稀释的2μg/ml的本公司抗体rren-i-115或者rren33h11溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的200ng/ml的重组肾素溶液与100,20,4,0.8,0.16,0nm的vtp-27999溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板,接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical)。进一步添加将20μl的重组肾素溶液与vtp-27999溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,与添加阿利吉仑时相同,rren33h11的组合未显示与肾素活性的相关性,但rren-i-115的组合显示与肾素活性的强相关性(图15)。
[实施例14]根据本公司抗体rren-d-104-1与rren21e10-19的组合夹心的添加有阿利吉仑的肾素浓度的测定
(1)肾素浓度测定
将以pbs稀释的2μg/ml的本公司抗体rren63a8溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,将以pbs稀释的400ng/ml的重组肾素溶液与200,40,8,1.6,0.32ng/ml的阿利吉仑溶液各以等量混和后添加于化验平板,进行一次反应。以pbs-t洗涤3次,将以1%bsa-pbs稀释的生物素化标记rren21e10-19添加于化验平板,进行二次反应。以pbs-t洗涤3次,添加以1%bsa-pbs稀释的pod标记链霉亲和素溶液,进行三次反应。以pbs-t洗涤3次,添加tmb,进行发色反应。添加0.5mh2so4而停止发色反应,测定450nm的吸光度。
(2)肾素活性的测定
将160μl的试验缓冲液(50mmtris,0.1mnacl,10mmedta)添加于白色平板,接着,添加20μl的20μm肾素荧光底物(dmso,caymanchemical)。进一步添加将20μl的重组肾素溶液与阿利吉仑溶液各以等量混和者(与使用于浓度测定者相同的试样)及肾素浓度校正液。于37℃使其反应1小时,检测490nm的荧光(激发光:340nm)。
其结果,与rren-i-115相同,就使用以阿利吉仑存在时对肾素的反应性为指标而选出的殖株rren-d-104-1所组成的夹心elisa,肾素浓度与肾素活性显示相关性(图16)。
[实施例15]添加有阿利吉仑的检体的肾素浓度测定
将以pbs稀释的5μg/ml的市售抗体12-12、或本公司抗体rren-i-115、rren33h11、或者rren-d-104-1溶液添加于化验平板,进行固相化。以pbs-t洗涤3次,添加1%bsa-pbs,进行封闭。以pbs-t洗涤3次,对所含成熟肾素值既已确定的2种市售人类血浆添加阿利吉仑而成为1000nm,于室温静置约1小时后以检体稀释液(fujirebio公司制)稀释5倍而添加于化验平板,进行一次反应。以洗涤液(fujirebio公司制)洗涤3次,将以包含2%bsa的tris缓冲液稀释成1μg/ml的生物素化标记11-6或者生物素化标记rren21e10-19添加于化验平板,进行二次反应。以洗涤液(fujirebio公司制)洗涤3次,添加以包含2%bsa的tris缓冲液稀释成0.01μg/ml的alp标记链霉亲和素溶液,进行三次反应。以洗涤液(fujirebio公司制)洗涤3次,添加底物液(fujirebio公司制),于37℃使其反应5分钟后,检测化学发光。
其结果,与对重组肾素添加阿利吉仑时相同,市售抗体12-12与11-6的组合、或本公司抗体rren33h11与rren21e10-19的组合,添加阿利吉仑时的肾素浓度几无变化;而就包含rren-i-115或rren-d-104-1的组合,添加阿利吉仑时肾素浓度减少(图17)。
由此显示,rren-i-115及rren-d-104-1不识别结合阿利吉仑而不具活性的肾素。
[产业上可利用性]
如以上所说明,根据本发明,可使用活性型肾素特异性抗体有效率地测定与肾素活性有关的活性型肾素浓度。由于肾素活性与原发性醛固酮增多症等的疾病有关,因此,本发明不仅对于研究上的利用,对于疾病的诊断亦可贡献极大。
序列表
<110>富士瑞必欧株式会社(fujirebioinc.)
<120>肾素浓度的免疫学测定方法
<130>fr/p1093(wo)
<150>jp2016-206957
<151>2016-10-21
<160>1
<170>patentinversion3.5
<210>1
<211>340
<212>prt
<213>智人(homosapiens)
<400>1
leuthrleuglyasnthrthrserservalileleuthrasntyrmet
151015
aspthrglntyrtyrglygluileglyileglythrproproglnthr
202530
phelysvalvalpheaspthrglyserserasnvaltrpvalproser
354045
serlyscysserargleutyrthralacysvaltyrhislysleuphe
505560
aspalaseraspsersersertyrlyshisasnglythrgluleuthr
65707580
leuargtyrserthrglythrvalserglypheleuserglnaspile
859095
ilethrvalglyglyilethrvalthrglnmetpheglygluvalthr
100105110
glumetproalaleuprophemetleualaglupheaspglyvalval
115120125
glymetglypheilegluglnalaileglyargvalthrproilephe
130135140
aspasnileileserglnglyvalleulysgluaspvalpheserphe
145150155160
tyrtyrasnargaspsergluasnserglnserleuglyglyglnile
165170175
valleuglyglyseraspproglnhistyrgluglyasnphehistyr
180185190
ileasnleuilelysthrglyvaltrpglnileglnmetlysglyval
195200205
servalglyserserthrleuleucysgluaspglycysleualaleu
210215220
valaspthrglyalasertyrileserglyserthrserserileglu
225230235240
lysleumetglualaleuglyalalyslysargleupheasptyrval
245250255
vallyscysasngluglyprothrleuproaspileserphehisleu
260265270
glyglylysglutyrthrleuthrseralaasptyrvalpheglnglu
275280285
sertyrserserlyslysleucysthrleualailehisalametasp
290295300
ileproproprothrglyprothrtrpalaleuglyalathrpheile
305310315320
arglysphetyrthrglupheaspargargasnasnargileglyphe
325330335
alaleualaarg
340
- 还没有人留言评论。精彩留言会获得点赞!