跨染色及多生物标记方法与流程
本发明关于癌症检测与诊断的技术领域,尤指一种应用于协助症癌诊断的跨染色及多生物标记方法。
背景技术:
乳癌是由乳腺管细胞或腺泡细胞经不正常分裂所形成的恶性肿瘤。乳癌肿瘤除了会感染局部的乳房区域,也可能经由淋巴结转移到其他器官组织。常见的乳癌可分为:乳管原位癌(duodenalcarcinomainsitu,dcis)、乳腺管上皮不典型增生(atypicalductalhyperplasia,adh)、与乳腺癌(basal-likebreastcarcinoma,bc)。就乳癌的治疗而言,必须先基于病理学从至少一组织切片的影像之中有效地辨识乳管原位癌(dcis)、乳腺癌(bc)与/或乳腺管上皮不典型增生(adh),接着医生才能够拟定适合的乳癌治疗方式。
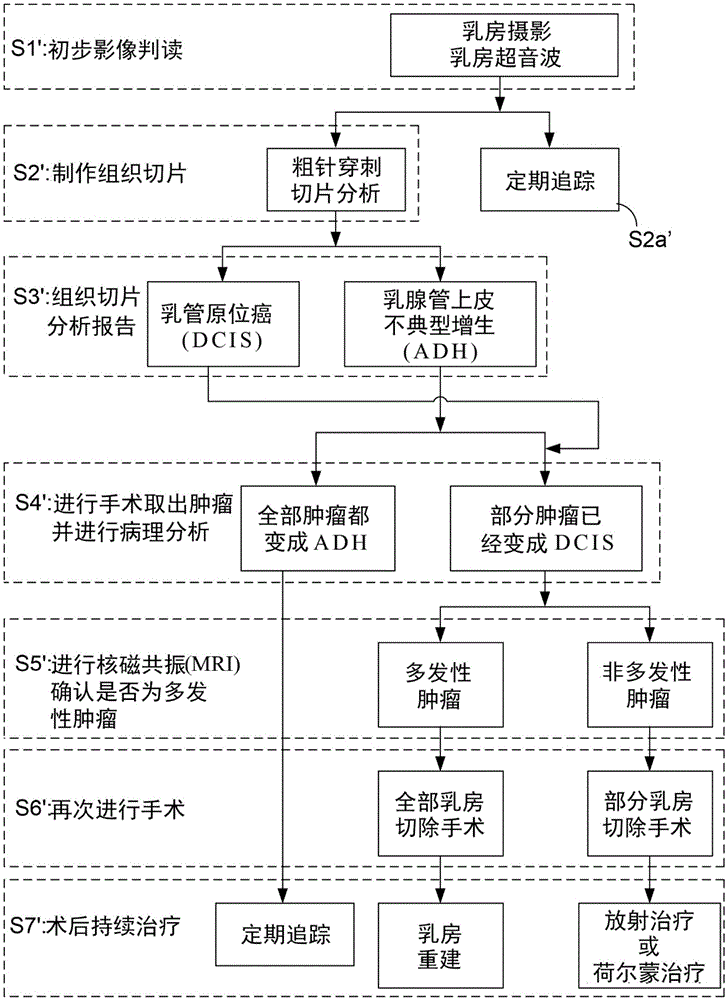
图1为显示乳癌治疗的流程图。临床上,医生对于乳癌患者所提出的乳癌治疗流程通常包括多个步骤。于步骤s1’中,根据患者的乳房的x光摄影或超音波检查的影像,医生必须根据其临床经验判读患者的乳房是否有肿瘤或囊肿。若检测结果显示乳房状况正常,则只需后续定期追踪即可(步骤s2a’)。然而,若检测结果显示乳房具有肿瘤或囊肿,则医生会接着替患者进行粗针穿刺(coreneedlebiopsy)以制作组织切片(步骤s2’)。于步骤s3’中,根据组织切片的染色影像分析的结果,医生便可以判断乳癌的种类是dcis还是adh。若乳癌的是adh,则必须直接进行手术取出肿瘤(步骤s4’)。并且,于步骤s4’中,若取出的肿瘤很幸运地在通过病理分析之后判断皆为adh,则术后患者仅需进行定期追踪即可(步骤s7’)。
相反地,若取出的肿瘤不幸地在通过病理分析之后判断其部分已经是dcis,则患者必须进一步地接受核磁共振(mri)以确认是否为多发性肿瘤(步骤s5’)。若为多发性肿瘤,则患者必须接受全部乳房切除手术(步骤s6’)。较幸运地,若为非多发性肿瘤,则患者只切除部分乳房。最终,于步骤(s7’)的术后持续治疗过程中,乳房已经完全切除的患者可以考虑接受乳房重建手术。必须加以强调的是,对于部分乳房切除的患者而言,其仍旧必须持续地接受放射治疗或者贺尔蒙治疗。
由图1可知,若医生通过组织切片的染色影像的判读诊断患者的乳癌类型是adh,则在经由手术摘除肿瘤之后,患者只需要接着进行术后的定期追踪即可。但是,若组织切片的染色影像指出患者的乳癌类型是dcis,医生则必须根据dcis的病灶多寡判断是否为多发性肿瘤。简单地说,「组织切片的病理分析的正确性」会严重地影响后续的步骤s4’至步骤s7’的治疗方案的选择。有鉴于此,影像对准(alignment)或注册(registration)技术被广泛地应用于组织切片的染色影像的判读。例如,美国专利号us9,818,190揭示一种完整载片图像配准与交叉图像注释系统(wholeslideimageregistrationandcross-imageannotationsystem),可应用于多张组织切片的染色影像特征比对。其中一张定义为来源影像且一张定义为目标影像,两张影像内容可在同一坐标系统下进行影像特征分析。
例如,根据美国专利号us9,818,190的揭示内容,经h&e染色的组织切片影像可以被定义为来源影像,且经ihc染色的组织切片影像可以被定义为目标影像。接着,用户只要在h&e染色的组织切片影像之中选择或标记一特征区域,则系统会在ihc染色的组织切片影像之上自动地选择或标记同一块特征区域。简单地说,通过所述完整载片图像配准和交叉图像注释系统的辅助,医生能够快速且准确地自组织切片的染色影像的判读诊断患者的乳癌类型。
可惜的是,所述完整载片图像配准和交叉图像注释系统无法根据ihc染色的组织切片影像与/或h&e染色的组织切片影像的颜色而自行判读患者的乳癌类型、肿瘤大小与病灶多寡。严格地说,该图像配准系统仅协助医生储存多张影像、进行任两张影像的对准、以及标注特征影像,并无法协助医生进行精准的癌症类型诊断。
有鉴于此,本案的发明人系极力加以研究创作,而终于研发完成本发明的一种应用于协助癌症诊断的跨染色及多生物标记方法。
技术实现要素:
本发明的主要目的在于提供一种跨染色及多生物标记方法,应用于协助癌症诊断。此方法的主要技术特征在于,先将组织切片的影像分组为h&e染色组织影像与ihc染色组织影像,再接着将不同组别的ihc染色组织影像与h&e染色组织影像执行一跨染色影像注册与融合处理,进以获得多帧跨染色组织影像。进一步地,便可以利用特别设计的生物标记的表现辨识流程,对所获得的该多帧跨染色组织影像执行一肿瘤辨识与定量分析,最终能够自动地辨识该组织检体所患有的癌症的癌细胞类型及其比率。可想而知,在搭配使用本发明的情况下,医生不需要以人工辨识的方式辨别组织检体中所患有的癌症之类型,是以能够避免人工辨识造成任何可能的判断错误。
为了达成上述本发明之主要目的,本案发明人提供所述应用于协助癌症诊断的跨染色及多生物标记方法的一实施例,包括以下步骤:
(1)取得一组织检体,并将其制作成多张组织切片;
(2)将该多张组织切片分成多个染色组织切片群组,且该多个染色组织切片群组至少包括:一苏木素-伊红染色(h&estain)群组与至少二免疫组织染色(immunohistochemistrystain,ihcstain)群组;
(3)对该苏木素-伊红染色群组内的组织切片进行一苏木素-伊红染色处理以获得多张h&e染色组织切片,并对该免疫组织染色群组内的组织切片进行一免疫组织染色处理以获得多张ihc染色组织切片;
(4)将该多张h&e染色组织切片与该多张ihc染色组织切片转换成多帧h&e染色组织影像与多帧ihc染色组织影像;
(5)对该些h&e染色组织影像与该些ihc染色组织影像进行一跨染色影像注册与融合;
(6)重复该步骤(5),直至所有的ihc染色组织影像与所有的h&e染色组织影像皆完成所述跨染色影像注册与融合,进而获得多帧跨染色组织影像;以及
(7)对所获得的该多帧跨染色组织影像执行一肿瘤辨识与定量分析,进而自动地辨识该组织检体所患有的癌症的癌细胞类型及其比率。
附图说明
图1为显示乳癌治疗的流程图;
图2a与图2b为显示本发明的一种跨染色及多生物标记方法的流程图;
图3a与图3b为显示本发明的跨染色及多生物标记方法的示意性工艺图;以及
图4为显示影像注册与融合的执行过程图;
图5a至图5e为显示步骤s7的详细步骤流程图。
其中附图标记为:
s1-s4步骤
s5-s7步骤
s71-s73、s78步骤
s74、s75a、s75b步骤
s76-s77步骤
s79、s7aa、s7ab步骤
s7b-s7c步骤
<现有>
s1’步骤
s2a’步骤
s2’-s7’步骤
具体实施方式
为了能够更清楚地描述本发明所提出的一种应用于协助癌症诊断的跨染色及多生物标记方法,以下将配合图式,详尽说明本发明的较佳实施例。
请参阅图2a与图2b,显示本发明的一种跨染色及多生物标记方法的流程图。本发明的跨染色及多生物标记方法主要是应用于协助癌症类型的辨识与诊断。请同时参阅图3a与图3b,显示本发明的跨染色及多生物标记方法的示意性工艺图。根据图2a,本发明的方法于流程上首先执行步骤s1,用以取得一组织检体,并将其制作成多张组织切片。由图3a可知,在取得所述组织检体之后,必须先将该组织检体制作成一蜡块;接着,对该蜡块执行一切片处理(sectioningprocess)之后,便可以获得多张组织切片。值得注意的是,对这些组织切片进行染色处理之前,必须先对每一张组织切片执行一固定处理(fixationprocess)。
接着,步骤s2之中,将该多张组织切片分成多个染色组织切片群组,且该多个染色组织切片群组至少包括:一苏木素-伊红染色(h&estain)群组与至少二免疫组织染色(immunohistochemistrystain,ihcstain)群组。就乳癌类型的检测而言,医师会依据参考至少一种蛋白质图谱以选择含有对应的至少一种蛋白质的组织切片;其中,所述蛋白质包括但不限于:e-钙粘蛋白(e-cadherin)、肿瘤蛋白p63、平滑肌肌动蛋白(smoothmuscleactin,sma)、高分子量细胞角蛋白(highmolecularweightcytokeratin,hmck)、细胞角蛋白ck14、细胞角蛋白ck7、细胞角蛋白ck5/6、与细胞角蛋白ck8/18。简单地说,根据医师想要观测的蛋白质生物标记反应,免疫组织染色群组的数量必定在两组以上。
继续地,于步骤s3之中,对该苏木素-伊红染色群组内的组织切片进行一苏木素-伊红染色处理以获得多张h&e染色组织切片,并对该免疫组织染色群组内的组织切片进行一免疫组织染色处理以获得多张ihc染色组织切片。例如,图3a即显示一组苏木素-伊红染色群组以及两组免疫组织染色群组。特别地,其中一组免疫组织染色群组的ihc染色组织切片为ck18染色组织切片,另一组免疫组织染色群组的ihc染色组织切片则为hmck染色组织切片。继续地,参考图2a与图3b,本发明的方法继续执行步骤s4,用以将该多张h&e染色组织切片与该多张ihc染色组织切片转换成多帧h&e染色组织影像与多帧ihc染色组织影像。
继续地参阅图2b与图3b。于步骤s5之中,对该些h&e染色组织影像与该些ihc染色组织影像进行一跨染色影像注册与融合。图4为显示影像注册与融合的执行过程图。参考图3b与图4,一帧h&e染色组织影像、一帧ck18染色组织影像与一帧hmck染色组织影像被取出。其中,该ck18染色组织影像与h&e染色组织影像被进行影像注册与融合,且该hmck染色组织影像与h&e染色组织影像也被进行影像注册与融合。于此,必须特别强调的是,基于一来源影像(sourceimage)对一目标影像(targetimage)进行影像对准(alignment)或注册(registration)的类似技术已经被广泛地应用于组织切片的染色影像的判读。类似的技术包括leastsquares、unwarpj、bunwarpj、elastic、cwr、clahe+bunwarpj、trakem2等方法。然而,于本发明的方法的步骤s5非常要求来源影像与目标影像的影像对准的精准度,因此建议使用文献一所提出的影像注册技术。于此,文献一指的是:wanget.al,“robustimageregistrationofbiologicalmicroscopicimages”,nature-scientificreports4:6050(sci,jcr2015(7/63)inmultidisciplinarysciences,if=5.228)。
图4显示ck18染色组织影像基于h&e染色组织影像进行影像注册,且hmck染色组织影像基于h&e染色组织影像进行影像注册。但是,为了令影像辨识系统可以更容易地进行肿瘤辨识与定量分析,最佳的是hmck染色组织影像也必须基于ck18染色组织影像进行影像注册。简单地说,基于包含第一生物标记的ihc染色组织影像对包含第二生物标记的ihc染色组织影像执行一影像注册。完成来源影像与目标影像的影像对准或注册之后,如图4所示,ck18染色组织影像与h&e染色组织影像可以通过影像融合技术而被组合成一帧跨染色组织影像;同样地,hmck染色组织影像与h&e染色组织影像也是通过影像融合技术而被组合成一帧跨染色组织影像。完成步骤s5之后,本发明的方法接着执行步骤s6,进而重复该步骤s5,直至所有的ihc染色组织影像皆与一帧h&e染色组织影像完成所述跨染色影像注册与融合,进而获得多帧跨染色组织影像。
如图2b与图3b所示,最终,本发明的方法执行步骤s7,对所获得的该多帧跨染色组织影像执行一肿瘤辨识与定量分析,进而自动地辨识该组织检体所患有的癌症的癌细胞类型及其比率。以乳癌为例,癌症的类型可以利用生物标记的方式来提高辨识准确率。举例而言,可以同时通过辨识四种生物标记的免疫化学反应而自动地辨识该组织检体所患有的癌症的癌细胞类型及其比率。图5a至图5e为显示步骤s7的详细步骤流程图。并且,由图5a至图5e可以得知,在示范性的方法流程中使用e-钙粘蛋白(e-cadherin)、肿瘤蛋白p63、细胞角蛋白ck14、与细胞角蛋白ck5/6这四种生物标记。
在正常乳腺组织中,e-cadherin在肌上皮中呈颗粒状膜阳性,在dcis细胞上则呈线状膜阳性。根据这个基础特征,步骤s71被设计用以判断是否该注册影像之中的e-钙粘蛋白(e-cadherin)呈阳性反应,若是,则方法流程便接着执行步骤s72。值得注意的是,若步骤s71的判断结果为“否”,则表示制作e-cadherin的ihc染色组织切片的过程可能有问题,导致对e-cadherin的免疫染色的结果无法呈阳性。故此,方法流程便无法继续执行下去,必须在此结束步骤执行。
另一方面,肿瘤蛋白p63被认为是一个抑癌基因,在乳腺癌的发生、发展过程中起着重要的作用,因此其免疫检测的结果为乳腺癌早期诊断的重要依据。因此,于步骤s72中,判断是否该跨染色组织影像之中的肿瘤蛋白p63呈阳性反应,若是,则接着执行步骤s73。步骤s73用以判断该跨染色组织影像之中的细胞角蛋白ck14是否呈阳性反应,其意义在于检测检体组织是否有乳腺管的细胞增生现象发生。因此,若步骤s73的判断结果为“是”,则必须接着执行步骤s74以判断该跨染色组织影像之中的细胞角蛋白ck5/6是否呈阳性反应。必须特别说明的是,与普通乳腺管增生(usualductalhyperplasia,udh)相比,不典型乳腺管增生(atypicalductalhyperplasia,adh)之中细胞角蛋白ck5/6表现明显减少。值得一提的是,在dcis中,细胞角蛋白ck5/6的阳性基因表现基本上消失。可想而知,若步骤s74的判断结果为“否”,则判定该组织检体含有类型为乳腺管上皮不典型增生(adh)的乳癌(步骤s75b)。相反地,若步骤s74的判断结果为“是”,则判定该组织检体为正常(步骤s75a)。简单地说,组织检体被检测出的乳腺管增生为普通型,属正常。
重复说明的是,步骤s73用以判断该跨染色组织影像之中的细胞角蛋白ck14是否呈阳性反应;因此,若步骤s73的判断结果为“否”,则本发明的方法流程会接着执行步骤s76,用以判断该跨染色组织影像之中的细胞角蛋白ck5/6是否呈阳性反应。若步骤s76的判断结果为“是”,则判定该组织检体含有类型为乳腺管上皮不典型增生(adh)的乳癌(步骤s75b)。相反地,若步骤s76的判断结果为“否”,则判定该组织检体含有乳管原位癌(dcis)(步骤s77),原因在于在低级别的dcis中,细胞角蛋白ck5/6的阳性基因表现基本上消失。
继续地参阅图5a至图5e的流程图。若步骤s72的判断结果为“否”,则方法流程接着执行步骤s78,用以判断该跨染色组织影像之中的细胞角蛋白ck14是否呈阳性反应。若步骤s78的判断结果为“是”,则方法流程接着执行步骤s79,判断该跨染色组织影像之中的细胞角蛋白ck5/6是否呈阳性反应。接着,根据步骤s79的判断结果,步骤s7aa与步骤s7ab会分别判定该组织检体含有第一型式或第二型式的肿瘤。简单地说,在e-钙粘蛋白表现为阳性(+)、肿瘤蛋白p63表现为阴性(-)且细胞角蛋白ck14表现为阳性(+)的情况下,若细胞角蛋白ck5/6表现为阴性(-)则判定该组织检体含有第一型式的肿瘤(exceptionalcase1)。相反地,若细胞角蛋白ck5/6表现为阳性(+)则判定该组织检体含有第二型式的肿瘤(exceptionalcase2)。
另一方面,若步骤s78的判断结果为“是”(图5a),则方法流程接着执行步骤s79(图5d),用以判断该跨染色组织影像之中的细胞角蛋白ck5/6是否呈阳性反应,若否,则判定该组织检体含有第一型式的肿瘤(步骤s7aa)。相反地,若步骤s7b的判断结果为“否”,则判定该组织检体含有乳腺癌(bc)(步骤s7c)。基于图5a至图5e的流程图,吾人可将乳癌类型的分类方式整理于下表(1)之中。
表(1)
参考表(1)之后可以发现,步骤s7的14个细部执行步骤是可能被调整或变化的。简单地说,虽然本发明通过图5a至图5e示范了使用藉由辨识e-钙粘蛋白(e-cadherin)、肿瘤蛋白p63、细胞角蛋白ck14、与细胞角蛋白ck5/6这四种生物标记来辨识该组织检体所患有的癌症的癌细胞类型及其比率,但并非以此限制步骤s7的细部执行步骤的组成。举例而言,细胞角蛋白ck14、ck8、ck18皆可以用来表达乳腺中间细胞的增生,因此以ck8或ck18取代ck14作为生物标记是可能的。另一方面,平滑肌肌动蛋白(sma)与细胞角蛋白ck5/6同样皆可以用来表达肌上皮前体细胞的增生,因此以sma取代ck5/6作为生物标记也是可能的。
同时,通过上述说明吾人亦可进一步地得知,将本发明的跨染色及多生物标记方法应用于辨识乳癌以外的其他癌症也是可能的,包括:卵巢癌、胰脏癌、肝癌、肺癌、大肠直肠癌、胃癌、或食道癌。就前述所列最常发生的癌症而言,组织切片的病理分析配合特定蛋白或细胞(亦即生物标记)免疫组织染色处理经常被用来协助医生确诊癌症的类型。可预见的,在使用本发明的情况下,医生可以很容易地就对包含上述任一种癌症的组织检体做出以下项目:
(1)肿瘤的诊断和鉴别;
(2)对癌症的肿瘤细胞进行病理分型;
(3)明确肿瘤的正确组织学分类;
(4)确认病灶多寡;以及
(5)为医生的癌症治疗方案提供有力的支持。
如此,上述已完整且清楚地说明本发明的一种应用于协助癌症诊断的跨染色及多生物标记方法;并且,经由上述可知本发明具有下列的优点:
(1)现有的载片图像配准与交叉图像注释系统只可以协助医生储存多张组织切片的影像、进行任两张影像的对准、以及标注影像内的特征区域,并无法协助医生进行精准的癌症类型诊断。有鉴于此,本发明提出一种跨染色及多生物标记方法。此方法的主要技术特征在于,先将组织切片的影像分组为h&e染色组织影像与ihc染色组织影像,再接着将不同组别的ihc染色组织影像与h&e染色组织影像执行一跨染色影像注册与融合处理,进以获得多帧跨染色组织影像。进一步地,便可以利用特别设计的生物标记的表现辨识流程,对所获得的该多帧跨染色组织影像执行一肿瘤辨识与定量分析,最终能够自动地辨识该组织检体所患有的癌症的癌细胞类型及其比率。可想而知,在搭配使用本发明的情况下,医生不需要以人工辨识的方式辨别组织检体中所患有的癌症的类型,是以能够避免人工辨识造成任何可能的判断错误。
(2)并且,本发明的跨染色及多生物标记方法可与市售任何一种图像配准与交叉图像注释系统进行结合以应用于协助癌症诊断,例如:徕卡的leicabiosystems或polaris所提出的vectra全自动定量病理成像系统。
必须加以强调的是,上述的详细说明针对本发明可行实施例的具体说明,惟该实施例并非用以限制本发明的专利范围,凡未脱离本发明技艺精神所为的等效实施或变更,均应包含于本案的专利范围中。
- 还没有人留言评论。精彩留言会获得点赞!