检测IFI44L蛋白的试剂在制备试剂盒中的用途的制作方法
本发明涉及生物领域,具体涉及用于诊断病毒性感染发热的试剂盒及检测ifi44l蛋白的试剂在制备试剂盒中的用途。
背景技术
目前,发热的病因繁多,可达200多种,临床上分为感染性发热和非感染性发热两大类,而以前者多见。感染性发热以病毒引起者占绝大多数,另外还有细菌、支原体、螺旋体、真菌和寄生虫等。发热性疾病的早期鉴别诊断,一直是儿科临床关注的重点。当前,使用抗菌剂而非处方药的经验性发热治疗非常普遍,其加剧抗生素药物耐药问题;因此,迫切需要临床医生对发热患者的致病源进行精确地诊断、区分,以达到正确指导患者使用抗菌药物,并降低患者不必要的开支。
传统的辅助医生正确处方抗生素的方案的诊断主要是包括培养分离,酶联免疫法,核酸扩增检测技术。培养分离法被认为是诊断病原体感染的标准方法。该方法也是对于细菌发热病原体检测常用的方法,其能直观的证实病原体的感染情况,但该法被认为低敏感性,且有效性是有限的,研究表明在国外某地区大量临床标本中,培养法敏感性仅为64%,特异性为97%,无法对早期的感染进行有效的诊断,耗时长,成本较高,不属于快速诊断的方法。酶联免疫吸附法操作简单,所需时间短,灵敏度高,不需要特殊的仪器,尤其适合大批样品血清学检测,但该方法检测结果的特异性受包被的抗原或抗体纯度的影响较大,存在交叉感染,不属于快速检测。核酸检测技术主要包括基因芯片法和实时荧光pcr法,基因芯片本身具备高灵敏的、高通量筛查,并快速地检测出相关发热病原体,但价格相对昂贵,且需对扩增产物进行分析。实时荧光pcr法是对特定病原体的靶基因进行特异性的扩增验证,由于引起小儿发热的致热病毒种类众多,多重pcr扩增时,经常会出现引物与引物,探针与引物之间的干扰,引物探针序列数越多,扩增越容易受影响,另一方面受限于检测仪器,不能把所有致热病原体一次性检测出来。
因此,提供简单、快速、准确鉴定是否病毒性感染的方法有待研究。
技术实现要素:
本申请是基于发明人对以下事实和问题的发现和认识作出的:
2009年,zaas等确定了宿主基因反应标签作为诊断呼吸道感染的新策略。他们分析了在健康实验感染志愿者、鼻病毒(hrv),呼吸道合胞体病毒(rsv)和甲型流感病毒组志愿者中血液基因表达谱,确定“呼吸道病毒感染密切相关基因标签”,这些基因包括rsad2,ifi44l和lamp3。2010年,statnikova等发表的文章中指出,人宿主基因ifi44l,rsad2,id3和fcgr1b广泛参与了对病毒感染的免疫应答。2016年,jaherberg等利用转录表达谱分析方法,发现由病毒感染引起的发热,会激活宿主血液白细胞干扰素诱导蛋白44类基因(interferoninducedprotein44-likegene,ifi44l)表达水平的显著增加,正常人血液白细胞中,该基因则处于相对稳定的表达水平。基于上述研究背景和发现,发明人利用基因ifi44l在白细胞中的基因表达水平这特点,作为研究人病毒性感染发热标志物,惊喜地发现,病毒感染的人宿主基因ifi44l在白细胞中的蛋白表达水平量与正常人宿主基因ifi44l在白细胞中的蛋白表达水平量呈现极显著差异;且基因ifi44l在白细胞中表达出的蛋白可用免疫反应简单、快速的检测出;因此,人宿主基因ifi44l在白细胞中的蛋白表达水平结合免疫反应可作为早期诊断是否为病毒性感染的可靠指标。
为此,在本发明的第一方面,本发明提出了检测ifi44l蛋白的试剂在制备试剂盒中的用途,所述试剂用于检测基因ifi44l蛋白表达水平,所述试剂盒用于确定对象的异常状态,所述异常状态为病毒性感染发热。发明人通过实验发现,人宿主基因ifi44l蛋白表达水平在有无病毒性感染情况下具有显著的差异,其在病毒性感染发热发生的早期诊断中有较好的诊断价值,用于检测基因ifi44l蛋白表达水平的试剂制备的试剂盒可有效用于诊断病毒性感染引起的发热,能快速、准确鉴定发热是否为病毒性感染引起,具有敏感性高、特异性强的特点,以协助医生作出更好的诊断及更精确的治疗,同时降低患者接受不必要的药物治疗而引起细菌耐药的可能性。
根据本发明上述实施例,上述用途还可以进一步包括如下附加的技术特征:
根据本发明的实施例,所述试剂盒对所述对象的外周血白细胞进行检测,以便确定所述基因ifi44l的蛋白表达水平。
根据本发明的实施例,确定所述基因ifi44l蛋白表达水平,包括:
从所述对象采集外周血白细胞;
将所述外周血白细胞加入所述试剂进行免疫反应,以获得基因ifi44l蛋白表达水平结果。
根据本发明的实施例,还包括向所述外周血加入红细胞裂解液进行裂解获取外周血白细胞;所述红细胞裂解液包括:80mmol/l-200mmol/l的nh4cl,0.5mmol/l-3.0mmol/l的khco3,0.03mmol/l-1.0mmol/l的edta,所述红细胞裂解液的ph值为7.0-7.5。
根据本发明的实施例,还包括向所述外周血加入白细胞裂解液进行裂解获取外周血白细胞;所述白细胞裂解液包括:10mmol/l-100mmol/l的tris-hcl,10mmol/l-300mmol/l的nacl,体积百分比为0.2%-5.0%的np-40裂解液,所述白细胞裂解液的ph值为5-9。
根据本发明的实施例,所述试剂用于检测基因ifi44l蛋白抗体或抗原。
根据本发明的实施例,所述试剂盒用于诊断早期的病毒性感染发热。
本发明的第二方面,本发明提出了一种用于确定异常状态的试剂盒,其包含试剂,所述试剂用于检测基因ifi44l蛋白表达水平,所述异常状态为病毒性感染发热。发明人通过实验发现,人宿主基因ifi44l蛋白表达水平在有无病毒性感染情况下具有显著的差异,其在病毒性感染发热发生的早期诊断中有较好的诊断价值,用于检测基因ifi44l蛋白表达水平的试剂制备的试剂盒可有效用于诊断病毒性感染引起的发热,能快速、准确鉴定发热是否为病毒性感染引起,具有敏感性高、特异性强的特点,以协助医生作出更好的诊断及更精确的治疗,同时降低患者接受不必要的药物治疗而引起细菌耐药的可能性。
根据本发明的实施例,上述试剂盒还进一步包括如下附加技术特征:
根据本发明的实施例,所述试剂盒用于诊断早期的病毒性感染发热。
根据本发明的实施例,所述试剂用于检测基因ifi44l蛋白抗体或抗原。
附图说明
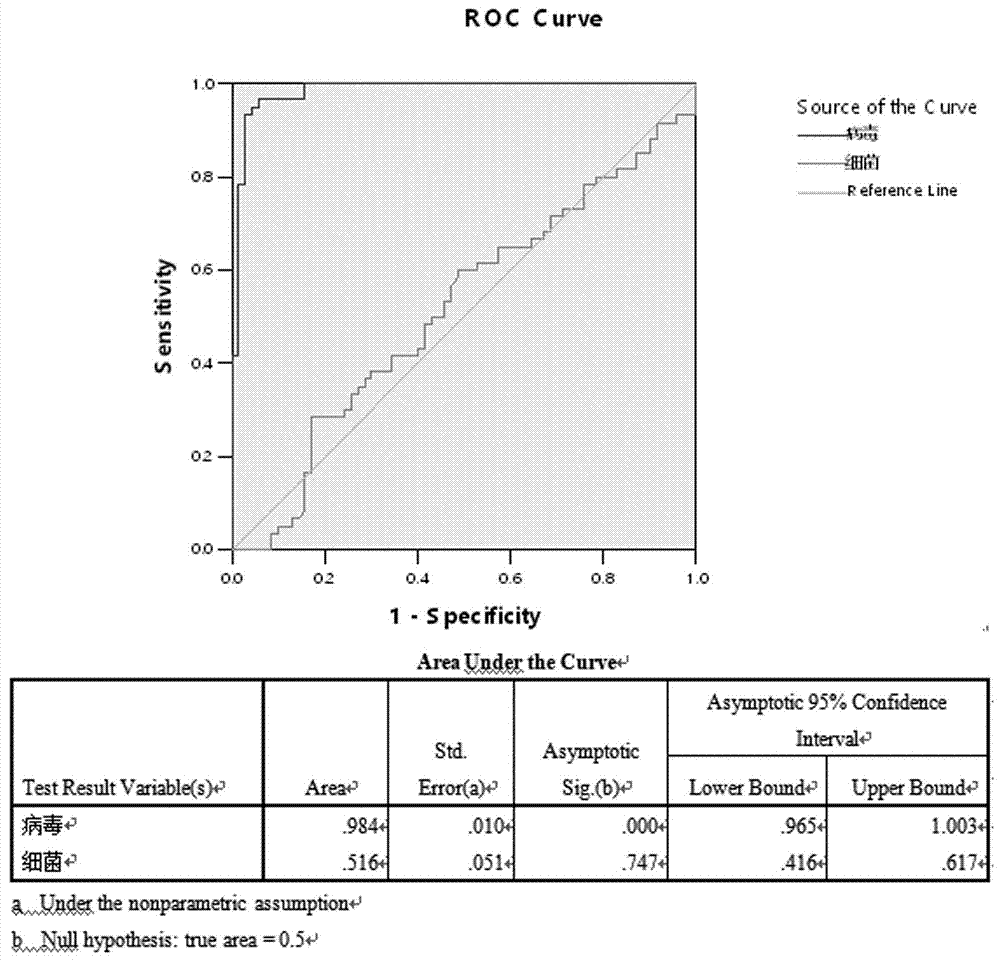
图1为根据本发明实施例一的ifi44l基因mrna扩增结果的roc曲线分析图;
图2是根据本发明实施例二的elisa检测ifi44l蛋白表达水平的结果分析图;
图3是根据本发明实施例三的试剂卡的结构示意图;
图4是根据本发明实施例三的荧光免疫层析检测ifi44l蛋白表达水平的结果分析图;
图5是根据本发明实施例四的ifi44l基因mrna检测ct值的换算值x与荧光免疫层析检测值相关性分析图。
具体实施方式
以下通过特定的具体实例和附图说明本发明的技术方案。应理解,本发明提到的一个或多个方法步骤并不排斥在所述组合步骤前后还存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤;还应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
为了更好的理解上述技术方案,下面将参照附图更详细地描述本发明的示例性实施例。虽然附图中显示了本发明的示例性实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
以下实施例中的ifi44l蛋白抗体1、ifi44l蛋白的抗体2和链霉亲和素、生物素均可从市面上购买到。
实施例一检测ifi44l基因mrna扩增结果分析
s1、设计合成用于检测ifi44l基因mrna的特异性引物和探针,其中以β-actin基因作为内参,并设计相应特异性引物和探针。
s2、随机选取70例病毒性感染发热的小儿新鲜抗凝全血样本,60例细菌性感染发热的小儿新鲜抗凝全血样本以及60例正常新鲜抗凝全血样本(对照组)。
s3、利用trizol试剂提取步骤s2中各样本的全血总rna(trizol及即相关提取试剂为现有商品化试剂)。
s4、对步骤s3获得的全血提取产物中靶rna进行pcr扩增验证,pcr最佳反应体系及扩增条件见表1和表2。
表1pcr最佳反应体系
表2pcr扩增条件
数据处理与分析:
roc曲线是根据一系列不同的二分类方式(分界值或决定阈),以真阳性率(灵敏度)为纵坐标,假阳性率(1-特异度)为横坐标绘制的曲线。roc曲线面积(areaunderthecurve,auc)大于0.5的情况下,auc越接近于1,说明诊断效果越好。auc在0.5~0.7时有较低准确性,auc在0.7~0.9时有一定准确性,auc在0.9以上时有较高准确性。选定置信水平95%,约登指数越大,说明筛查实验的效果越好,真实性越大。
病毒感染因子:x=log2ct(ifi44l基因)-log2ct(β-actin基因)
样本ifi44l基因mrna检测值换算x值数据汇总见表3。
表3样本x值数据汇总
结果分析:对ifi44l基因mrna检测数据分析获得的x值,进行roc曲线分析,见图1。由图1可知病毒性感染组曲下面积(auc)为0.984,asymptoticsig.(b)=0.000<0.001,即病毒性感染组和对照组验证结果呈现极显著性差异,说明试剂具有诊断意义。病毒组roc曲线分析约登指数最大值时,对应的灵敏度和特异性分别为93.3%和96.0%,此时实验验证获得的数据具较高的准确性。而细菌性感染组下面积(auc)为0.516,asymptoticsig.(b)=0.747>0.05,即病毒感染组和对照组验证结果呈现无显著性差异,说明试剂无诊断意义。
实施例二elisa(酶联免疫吸附)检测全血样本ifi44l蛋白表达水平
检测样本:随机选取50例病毒性小儿发热新鲜抗凝全血样本和50例正常新鲜抗凝全血样本(对照组)。使用外周血抗凝全血样本,采集完的样本应尽快进行检测验证,如不能及时检测,2℃-8℃下保存小于4h。
实验准备:
包被液:0.05mol/l碳酸盐缓冲液(ph=9.6),配制方法为:0.75g碳酸钠,1.46g碳酸氢钠,加去离子水定容至500ml,用时加质量百分比0.1%的bsa。
0.02mol/l磷酸盐缓冲液(pbs,ph=7.4):0.2g磷酸二氢钾,2.90g磷酸氢二钠,8g氯化钠,加去离子水定容到1000ml。
洗涤液:体积百分比0.05%的tween-20,用pbs缓冲液定容1000ml。
封闭液:质量百分比2%的bsa,用洗涤液定容至100ml。
终止液:2mol/l的h2so4溶液。
操作方法
1)白细胞分离、裂解
s1、每个样本各取一支1.5ml离心管,加入200μl-300μl新鲜的抗凝全血样本,再加入5倍体积红细胞裂解液,上、下颠倒混匀后,室温放置5min-10min;
s2、将步骤s1的离心管在14℃下,1500rpm离心5min,弃上清,收集白细胞沉淀;
s3、向各离心管分别加入400μl-600μl的红细胞裂解液,上、下颠倒混匀后,1500rpm离心5min,弃上清,收集白细胞沉淀;
s4、步骤s3获得的向白细胞沉淀加入100μl的白细胞裂解液,充分裂解,得外周血白细胞裂解液(备注:使用白细胞裂解液前,每份样本向裂解液加10~30μl的proteaseinhibitor,混匀后使用)。
2)总蛋白浓度测定
用超微量分光光度计测定上述获得的各样本外周血白细胞裂解液中总蛋白的含量,并将各样本裂解液总蛋白用白细胞裂解液稀释成相同浓度总蛋白裂解液,用于elisa检测分析。
3)elisa检测分析
s1、用包被液将ifi44l蛋白抗体1稀释成0.5μg/ml-20μg/ml,向对应酶标板孔加0.1ml的ifi44l蛋白抗体1稀释液,4℃包被过夜利用;
s2、步骤s1的酶标板孔用洗涤液洗涤3-5次后,向每孔加入200μl-250μl封闭液,37℃下静置60min-120min,而后弃封闭液,用洗涤液洗涤3-5次;
s3、按孔位顺序依次向步骤s2的酶标板加入30μl-50μl待检样本(即病毒性小儿发热新鲜抗凝全血样本和正常新鲜抗凝全血样本),设定空白对照孔(不加样本),室温孵育30min-90min;
s4、将步骤s3的酶标板各孔用洗涤液洗涤3-5次,加入辣根过氧化物酶标记的ifi44l蛋白抗体2,于37℃下孵育30min-60min;
s5、将步骤s4的酶标板用洗涤液洗涤3-5次,加0.1ml的tmb底物溶液,室温避光反应15min-30min,充分变色;
s6、向s5的酶标板各孔加40μl-80μl终止液终止反应;
s7、用酶标仪测od450值,以空白对照孔调零后计算各样本od值,检测结果见表4。
s8、利用spssstatistics软件进行ifi44l蛋白elisa检测od值独立样本t检验,详见表5。
表4全血样本ifi44l蛋白elisa检测值
表5ifi44l蛋白elisa检测od值独立样本t检验
结果分析:对不同组别样本ifi44l蛋白elisa检测获得的数据进行独立样本t检验分析,详见表5,由表5可知,sig.(双侧)=0.000<0.01,即病毒组和正常组中样本ifi44l蛋白表达量呈现极显著性差异。对不同组别样本ifi44l蛋白elisa检测获得的数据进行多重比对分析,详见图2,由图2可以清晰看出病毒组样本中ifi44l蛋白表达量明显高于正常组样本中ifi44l蛋白表达量。
结合实施例一的ifi44l基因mrna扩增结果的roc曲线分析和ifi44l蛋白的elisa检测分析,说明ifi44l不管是从基因水平还是蛋白水平,都表现出一致的规律,即病毒性感染人群和正常人相比,基因水平/蛋白水平均表现出极显著差异性,因此可将全血样本中ifi44l蛋白作为检测对象,开发新型检测试剂,以达到快速鉴定病毒性感染引起的发热。
实施例三荧光检测试剂盒检测全血样本ifi44l蛋白表达水平
荧光检测试剂盒中试剂卡的制备:
ifi44l蛋白抗体1偶联荧光微球和生物素偶联荧光微球的制备:
选取10mg荧光微球加入1ml的0.01mol/l的ph=7.4的pbs溶液(含5%戊二醛)中反应1h,12000转5min离心去上清液,而后再加入1mg的ifi44l蛋白抗体1均匀混合,于4℃反应12h,12000转5min离心后去上清液,接着用1ml的0.01mol/l的ph=7.4的pbs重悬,形成ifi44l蛋白抗体1偶联荧光微球;以同样方法,选用取10mg荧光微球加入1ml的0.01mol/l的ph=7.4的pbs溶液(含5%戊二醛)中反应1h,12000转5min离心去上清液,而后再加入1mg生物素混合,于4℃反应12h,12000转5min离心后去上清液,接着用1ml的0.01mol/lph=7.4的pbs重悬,形成生物素偶联荧光微球;最后,将上述获得的ifi44l蛋白抗体1偶联荧光微球和生物素偶联荧光微球按体积比1:1混合,并用0.01mol/l的pbs(含质量百分比为1%的ph=7.4的bsa)稀释至工作浓度(100-5000倍稀释,根据实际实验的荧光强度及线性趋势调整)。
样品垫喷膜:
通过划膜喷金仪将稀释至工作浓度的ifi44l蛋白抗体1偶联荧光微球和生物素偶联荧光微球喷在玻璃纤维素膜上,将该喷膜后的玻璃纤维素膜于45℃下烘干2h。
t线包被液的配制:
用ph=7.4,0.01mol/l的pbs稀释液将ifi44l蛋白抗体2稀释至工作浓度0.5mg/ml-5mg/ml(据实际实验调整),于2℃-8℃备用。
c线包被液的配制:
用ph=7.4,0.01mol/l的pbs稀释液将亲和素稀释至工作浓度0.5mg/ml-5mg/ml(据实际实验调整),于2℃-8℃备用。
t线和c线包被:
通过划膜喷金仪将t线包被液和c线包被液同时包被在nc膜上,形成t线、c线,将该包被后的nc膜于45℃下烘干2h。
按照图3所示将玻璃纤维膜和烘干的包被后的nc膜、吸水纸依次粘贴组装,组装完成后用切条机切成每条宽度为4mm的试条,装进试条卡,压卡,制备成检测卡。干燥环境下避光备用。试剂卡详见图3,其中①为样品垫,所述材料为玻璃纤维膜;②为抗体承载膜,所述材料为硝酸纤维膜;③为吸水纸,④为t线所在位置;⑤为c线所在位置;⑥为带粘合剂的pvc底板。
检测样本:随机选取50例病毒性小儿发热新鲜抗凝全血样本和50例正常抗凝新鲜全血样本(对照组)。使用外周血抗凝全血样本,采集完的样本应尽快进行检测验证,如不能及时检测,2℃-8℃保存小于4h。
检测条件:
仪器:免疫荧光分析仪;
工作环境:室温,室内湿度45%-80%;
试剂盒恢复室温,试剂卡现测现拆袋,避免受潮。
检测方法:
1)白细胞分离、裂解
s1、每个样本各取一支1.5ml离心管,加入200μl-300μl新鲜的抗凝全血样本,再加入5倍体积红细胞裂解液,上、下颠倒混匀后,室温放置5min-10min;
s2、将步骤s1的离心管在14℃下,1500rpm离心5min,弃上清,收集白细胞沉淀;
s3、向各离心管分别加入400μl-600μl的红细胞裂解液,上、下颠倒混匀后,1500rpm离心5min,弃上清,收集白细胞沉淀;
s4、步骤s3获得的向白细胞沉淀加入100μl的白细胞裂解液,充分裂解,得外周血白细胞裂解液。
2)总蛋白浓度测定
用超微量分光光度计测定上述获得的各样本外周血白细胞裂解液中总蛋白的含量,并将各样本裂解液总蛋白用白细胞裂解液稀释成相同浓度总蛋白裂解液,用于免疫荧光层析检测。
3)免疫荧光层析检测
吸取80μl待检总蛋白裂解液,滴加到检测卡的加样口上,将检测卡插入荧光免疫检测仪器,按仪器显屏上的标准检测,记录所有样本对应的荧光检测值,全血样本ifi44l蛋白免疫层析检测荧光值统计详见表6。
表6全血样本ifi44l蛋白荧光免疫层析检测值
结果分析:对不同组别样本ifi44l蛋白免疫层析检测获得的荧光值进行独立样本t检验分析,全血样本ifi44l蛋白免疫层析荧光值统计见表7,由表可知,sig.(双侧)=0.000<0.01,即病毒性感染组和正常组中样本ifi44l蛋白表达量呈现极显著性差异。对不同组别样本ifi44l蛋白elisa检测获得的数据进行多重比对分析,详见图4,由图4可以清晰看出病毒组样本中ifi44l蛋白表达量明显高于正常组样本,验证结果与该蛋白的elisa检测分析保持高度一致性,因此可将人全血样本ifi44l蛋白的表达水平作为检测对象,根据ifi44l蛋白检测荧光强度值,以实现诊断病毒性感染发热。
表7全血样本ifi44l蛋白免疫层析荧光值统计
实施例四全血样本中ifi44l基因转录水平和蛋白表达水平相关性分析
基于中心法则原理,蛋白的表达需要先经过dna转录后翻译的过程,但是并非所有基因转录后都会最终翻译出蛋白质。蛋白表达量越多,说明dna转录水平越高(即获得的mrna浓度越高),基因的mrna的pcr扩增获得的ct值越小,反之成立。依此,ifi44lmrna的ct值的换算值x应与ifi44l蛋白的荧光免疫层析检测值呈负相关性,因此提供实施例四以对该结论进行验证分析。
检测样本:随机选取50例病毒性小儿发热新鲜抗凝全血样本和50例正常新鲜抗凝全血样本(对照组)。通过荧光pcr验证获得各样本mrna的检测ct值,并按实施例一的数据处理方式获得各样本的x值,然后,利用荧光免疫层析检测分别获得各样本的荧光免疫层析检测值(实验验证过程详见实施例三),得样本验证数据统计表,数据详见下表8。
以x值为横坐标,以log2(荧光免疫层析检测值)的值为纵坐标,分析其相关性。全血样本中ifi44l基因转录水平和蛋白表达水平相关性分析结果详见图5,由图5可知,ifi44l基因转录水平和蛋白表达水平相关系数r2达到0.979,且呈现出直线负相关性,即x与
ifi44l蛋白的荧光免疫层析检测值呈直线负相关性。
表8样本验证数据统计表
综上,结果表明,人宿主基因ifi44l蛋白表达水平在有无病毒性感染情况下具有显著的差异,其在病毒性感染发热发生的早期诊断中有较好的诊断价值,用于检测基因ifi44l蛋白表达水平的试剂制备的试剂盒可有效用于诊断病毒性感染引起的发热,能快速、准确鉴定发热是否为病毒性感染引起,具有敏感性高、特异性强的特点,以协助医生作出更好的诊断及更精确的治疗,同时降低患者接受不必要的药物治疗而引起细菌耐药的可能性。
在本说明书的描述中,参考术语一个“实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不应理解为必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。此外,本领域的技术人员可以将本说明书中描述的不同实施例或示例进行接合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!