一种单采血小板制品中残留细胞的检测方法与流程
本发明涉及血小板制品检测领域,特别涉及一种单采血小板制品中残留细胞的检测方法。
背景技术:
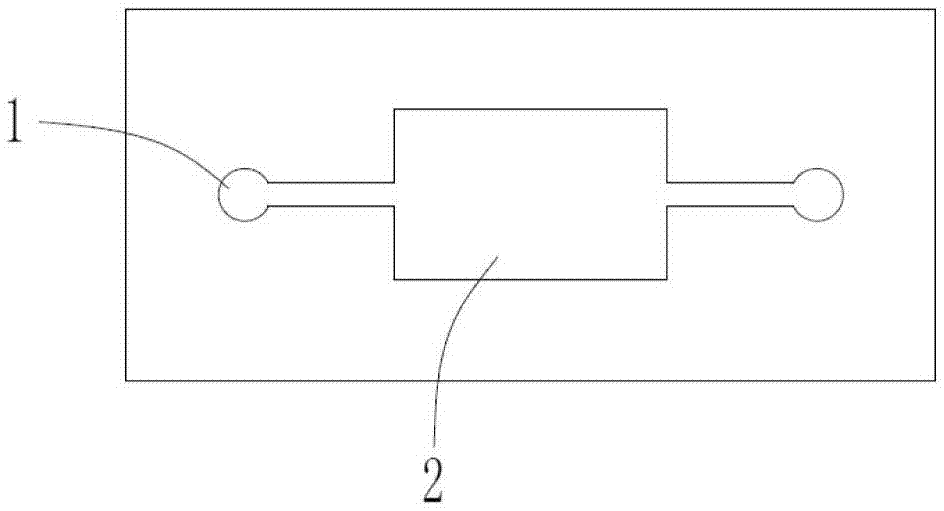
目前,血小板输血是目前血小板减少症和多种疾病的最主要治疗手段之一,已发展成为仅次于红细胞输血的临床第二大成分输血。但是,血小板输注无效事件仍频频发生,血液病人一般需要多次输注血小板,多次输注血小板后很容易出现输注无效,究其原因主要是产生了同种异型的抗体,研究表明,大部分血小板输注无效病人体内存在hla抗体、hpa抗体和abh抗体,其中80%患者存在hla抗体。抗体产生的主要原因很大可能是由多次及不同供血者供应的血小板中残留的白细胞及红细胞刺激病人免疫系统产生的。因此,从源头提高血小板制品的质量,对血小板制品实施严格的质量监测,尤其是对血小板中白细胞残留量进行严格检测,避免白细胞及红细胞残留引起的输血无效,保证血小板制品的安全性,成为临床亟待解决的首要问题。血小板制品的质量控制,国际以及国内标准均有明确需求,依据标准gb18469-2012全血及成分血质量要求,去白细胞单采血小板中白细胞混入量要求低于5×106个/袋,红细胞混入量低于8×109个/袋,这是血站日常质控项目之一。现有血小板制品中的混入细胞检测方法主要参考标准wst550-2017全血及成分血质量监测指南及《全国临床检验操作规程》要求。混入红细胞计数仍使用经典的显微镜法,而白细胞同样可采用经典的血细胞计数盘或者运用血细胞分析仪计数。近年来,虽然有些血站采用更为精准的流式细胞仪分析,但流式技术相对的样本制备繁琐,并且对操作人员的要求较高,价格高昂,因此不具有普遍适用性。当前残留细胞检测方法问题较多,局限性较大。基于大容量nageotte血细胞计数盘的人工计数方式,其误差大、重复性差、无原始记录,不符合现代对记录保存及证据链的要求。市场上的常规血细胞计数仪很难做到对单采血小板产品中相关指标特别是残留白细胞及红细胞进行精确计数。常用细胞计数方法(如血细胞计数仪、流式细胞仪等)的检测底限一般在104个/ml左右,无法对去白单采血小板中残留细胞进行快速、有效的检测。技术实现要素:针对现有技术中的不足之处,本发明提供了一种单采血小板制品中残留细胞的检测方法,以期通过细胞染色标记、荧光成像相结合的方法,实现对多类细胞的同时精确检测,如若再结合细胞成像与数据处理,可实现血小板制品中残留白细胞、残留红细胞及血小板含量的一次性高速精准判读。为实现上述目的,本发明的技术方案如下:一种单采血小板制品中残留细胞的检测方法,其包括:步骤1)取细胞样本,加入染色抗体试剂,完成细胞特异性标记;步骤2)将细胞样本平铺后,通过荧光显微镜进行观察计数;其中,所述染色抗体试剂包括有:实现对血小板染色的以alexa488标记的cd41和cd61;实现对白细胞染色的以alexa594标记的cd45;以及实现对白细胞核染色的细胞核染料。优选的是,所述的检测方法,其中,cd41和cd61的浓度比为1∶6.7-6.9。优选的是,所述的检测方法,其中,cd41和cd61的浓度比为1∶6.8。优选的是,所述的检测方法,其中,所述细胞核染料的结构式为:优选的是,所述的检测方法,其中,所述细胞核染料中,r1为cooet或ch3或h。优选的是,所述的检测方法,其中,所述细胞核染料中,r2为ch3或ch2ch3或h。优选的是,所述的检测方法,其中,所述细胞核染料中,r3为ch3或ch2ch3或h。优选的是,所述的检测方法,其中,所述细胞核染料中,r1为cooet;r2为ch3;r3为ch2ch3。本发明的有益效果是:本案通过采用细胞染色标记与荧光成像相结合的手段,可实现残留白细胞、红细胞和血小板的同时检测;后期可适配荧光显微镜与软件计算,实现自动检测与计数;操作简单,效率高。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为用于荧光检测的微孔载体芯片的结构示意图。图2为实施例1的细胞大小图。图3为实施例1的血小板荧光成像图。图4为实施例1的白细胞荧光成像图。图5为实施例1的白细胞核荧光成像图。图6为对比例1的白细胞核荧光成像图。具体实施方式下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。实施例一、材料1.细胞样本;2.荧光染料:cd41(genetex公司,货号gtx113758),cd61(武汉博欧特,货号orb86360),cd41和61均用alexa488(thermofisher公司)标记;cd45(上海研卉,货号11-0451-82),用alexa594(thermofisher公司)标记;细胞核染料:r1为cooet或ch3或h;r2为ch3或ch2ch3或h;r3为ch3或ch2ch3或h。其合成方法如下(以r1为cooet;r2为ch3;r3为ch2ch3为例):总收率:17.5%。1hnmr(400mhz,氘代dmso):δ8.41(s,1h,arh),7.91(s,1h,arh),7.59(s,1h,arh),7.23(s,2h,arh),7.21(s,2h,arh),4.38(m,2h,nhch2),4.30(m,2h,cooch2ch3),4.01(s,1h,nhch2),3.90(m,1h,c=nh),3.76(m,1h,hcl),3.35(m,2h,nch2ch3),3.01(s,3h,nch3),1.29(s,3h,cooch2ch3),1.12(s,3h,nch2ch3)。3.细胞固定液:4%pfa:4%多聚甲醛(pbs溶解):其为细胞固定剂,用于防裂解。或者用戊二醛或甲醛或冰乙醇(-20℃预冷)的pbs溶液替代;4.细胞膜通透剂:0.1-0.5%tritonx100,便于细胞核染料进入细胞;5.5%小牛血清,用于封闭抗体非特异性结合位点;甘油:细胞膜稳定剂,1-10%;6.细胞湿润剂:1%bsa(牛血清白蛋白)溶液(pbs溶解)。二、实验步骤1.取细胞样本于600rpm离心,pbs洗涤2次。2.向细胞沉淀中加入1ml细胞固定液,37℃孵育10min。600rpm离心5min,去除上清。3.细胞沉淀用1ml0.1%tritonx100(pbs溶解)重悬,室温、孵育5-15min。600rpm离心5min,去除上清。4.细胞沉淀用1ml5%小牛血清加1%甘油,封闭30min,室温。600rpm离心5min,去除上清。5.细胞沉淀用0.5mlpbs重悬,加入5ul0.5mg/ml的alexa488-cd41/61抗体(cd41和cd61的浓度比为1∶6.7-6.9)和alexa594-cd45抗体,室温作用15-30min。6.加入细胞核染料,终浓度0.1ug/ml,室温作用15-30min。pbs洗涤2次。7.细胞沉淀用1%bsa溶液(pbs溶解),以防止细胞团聚。8.微孔载体芯片,结构如图1所示,进样池1直径约2mm,观测池2深度100μm,观测池2长宽约5-10mm,进样池1与观测池2之间的连接通道的内径约1mm。样品经虹吸作用,进入观测池2,观测池2结构导致细胞平铺于观测池2,便于观察。将标记完成的细胞样本加入进样池1,通过虹吸作用进入观测池2,细胞平铺后,通过荧光显微镜进行观察计数。可拍照,通过自动计数软件计数。本案识别细胞的依据:基于细胞标记的荧光颜色和细胞大小,实现细胞的区分。cd41和cd61是血小板共同抗原,可用于标记分析血小板数量;cd45为白细胞共同抗原,可标记白细胞;本案设计的细胞核染料是细胞核特异性标记染料,白细胞有细胞核,血小板和红细胞没有细胞核。cd41和cd61抗体用染料alexa488标记,可实现血小板染色,荧光显微成像为绿色。cd45抗体用alexa594标记,可实现白细胞染色,荧光成像为红色。本案设计的细胞核染料为特异性细胞核染料,荧光成像为蓝色,可实现白细胞核染色。血小板大小(人的血小板平均直径约2~4微米):明显小于红细胞(6—9微米)和白细胞(7-20微米)。基于三种血细胞大小差异,结合细胞核染料,可用于红细胞数量分析。因此,基于上述标志物荧光成像及白光成像分析,即可实现残留白细胞、红细胞、血小板数量的精准成像计数,见表1。表1虽然在现有技术中,有人采用dapi(4',6-二脒基-2-苯基吲哚)作为细胞核染料,但它存在以下缺陷:1)强致癌物,对操作者风险高;2)与cd41、cd61和cd45联用时,非特异性结合增加;3)与alexa488和alexa594共存时,dapi产生的荧光颜色受到干扰,颜色偏蓝黑色,与背景色接近,不易观察计数。为此本案重新设计了细胞核染料的结构式:该化学式中右侧的部分插入到dna双链的小沟处,通过与之连接的可空间自由旋转的-nh-ch2-链,可外接含富π电子基团,在空间上形成位阻效应,来有效改善与细胞核的特异性结合,同时左侧的又可使荧光波长增加,使其颜色偏亮蓝色,易于观察计数。为进一步说明,将本案设计的化合物与使用dapi作为细胞核染料来进行比对。配置细胞标准液:血小板白细胞红细胞浓度2×106个/μl2.5×103个/μl3.5×104个/μl以上述实施例作为模板,分别采用dapi和本案的化合物作为细胞核染料:测试结果如下:细胞核染料血小板白细胞红细胞实施例1化合物(i)1.95×106个/μl2.45×103个/μl3.40×104个/μl实施例2化合物(ii)1.83×106个/μl2.40×103个/μl3.22×104个/μl实施例3化合物(iii)1.85×106个/μl2.42×103个/μl3.15×104个/μl对比例1dapi1.82×106个/μl1.22×103个/μl3.12×104个/μl图2为实施例1的细胞大小图(白光10x成像),其结果为通过细胞大小,可分辨出血小板,通过计算约为1.91×106个/μl,但是不能准确区分白细胞与红细胞数量。图3为实施例1的血小板荧光成像图(488nm波长,10x成像),其可通过荧光图谱,准确计算血小板数量,结果为1.95×106个/μl,与细胞标准溶液数量基本相符;图4为实施例1的白细胞荧光成像图(590nm波长,10x成像),其结果白细胞数量为2.46×103个/μl;图5为实施例1的白细胞核荧光成像图(350nm波长,10x成像),其结果为2.45×103个/μl,结合图4白细胞荧光成像结果,可准确确定白细胞数量为2.45×103个/μl(白细胞数量略高,可能是存在微量的非特异性结合);图6为对比例1的白细胞核荧光成像图(350nm波长,10x成像),其白细胞计数结果为1.22×103个/μl,从计数值来看是明显少于本发明细胞核染料的计数结果,与图4结果结合判断,会造成白细胞计数量严重失真,而由图5和图6对比可知,图6中存在的荧光点较多,但最终计数结果却较低,说明dapi导致非特异性结合增加,且形成的荧光点颜色较暗,与背景融合在一起不易被观察计数。而采用本案设计的细胞核染料所获得的结果更接近真实值,非特异性结合少,荧光点清晰明亮,易于观察计数。红细胞的计数方法为:通过细胞的白光成像,依据细胞大小,可明显分辨出血小板,红细胞与白细胞,但不能准确计算白细胞与红细胞数量,可计算红细胞与白细胞总数。图2为实施例1的细胞大小图(白光10x成像),结合图3血小板计数结果,可准确计算红细胞与白细胞总数结果为3.647×104个/μl;白细胞数量通过白细胞荧光成像与细胞核成像对比,可精确计数,图4与图5为实施例1白细胞计数结果,数量为2.45×103个/μl;进一步,可计算出红细胞数量为3.402×104个/μl,与细胞标准液数量基本一致。尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1