基于吸电子基取代的1,8-萘酰亚胺类化合物作为氟离子的显色试剂的用途的制作方法
本发明涉及到一类基于吸电子基取代的1,8-萘酰亚胺类化合物作为氟离子的显色试剂的用途,属于比色探针技术领域。
背景技术:
氟离子广泛存在于自然界和生物体中,在化学、医学、生物学及环境领域具有重要的作用,但是阴离子的过量存在又会带来生物体的危害以及环境的污染。因此,发展用于专一选择性识别阴离子的化学传感器越来越受到人们的关注。
化学传感器可通过将有机分子识别的化学信号转换成易被肉眼感知的颜色信号,因此,在最近几十年里,人们已经设计、合成了多种具有潜在应用价值的阴离子化学传感器。这些化学传感器在介质溶液中,能够选择性的识别一些重要的阴离子,可在医学、生物学和环境科学等领域达到识别阴离子的应用。其对环境及生物细胞中阴离子的检测(如氟离子),具有选择性好、检测灵敏度高、外界因素干扰性小等优点,被广泛应用在生物医学、细胞生物学和分析化学等相关领域。
由于1,8-萘酰亚胺衍生物具有结构稳定、色彩鲜艳、易于合成、光电特性优良(吸收和发射波长在可见区、较大的斯托克红移、较高的光稳定性)等优点。因此,可作为一种潜在的荧光/发色团应用于识别阴离子的探针设计,也可以应用于医药、荧光染料、颜料等工业领域。传统的1,8-萘酰亚胺衍生物主要通过萘酐的酐头进行酰胺化衍生,以及通过4-溴-1,8-萘酐的溴原子与相应的供电子官能团(如氨基、羟基)发生一些取代反应进而衍生一些4-位含nh或oh等基团的萘酰亚胺类化合物。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供一类基于吸电子基取代的1,8-萘酰亚胺类化合物作为氟离子的显色试剂的用途。该类1,8-萘酰亚胺类化合物作为氟离子显色试剂,其灵敏度高,在生物和环境等系统中检测低浓度的氟离子分析等方面具有潜在的应用价值。
本发明中,通过在1,8-萘酰亚胺上引入一个或多个吸电子官能团(如-no2、-cf3、-cn),让吸电子官能团与1,8-萘酰亚胺上的双酰基发生协同作用,使得发色团严重缺电子,从而和带电子的阴离子相互作用,来达到识别阴离子的目的。该种基于单取代或多取代吸电子基团的1,8-萘酰亚胺衍生物的探针,至今尚未报道其对阴离子的识别。该显色试剂合成简单,且检测氟离子选择性好、灵敏度高。
本发明提供的技术方案具体介绍如下。
一类基于吸电子基取代的1,8-萘酰亚胺类化合物作为氟离子的显色试剂的用途,其结构式如下式所示:
其中:r为直链或支链的c1-c10烷基;ewg为3-硝基、4-硝基、4-溴-3-硝基、4-三氟甲基-6-溴、4-氰基、3,6-二硝基、4-硝基-6溴、4-三氟甲基、4-硝基-5-溴或4,5-二硝基。
优选的,r为c1-c6直链烷基。
优选的,其通过紫外光谱或裸眼检测。
本发明中,上述的基于吸电子基取代的1,8-萘酰亚胺类化合物的合成方法的合成步骤包括以下几种:
一、以1,8-萘酐为起始原料,经硝化和酰胺化反应来制备n-r-3-硝基-1,8萘酰亚胺类化合物;
二、以4-溴-1,8萘酐为起始原料,经酰胺化和亲核取代反应来制备n-r-4-三氟甲基-1,8萘酰亚胺类化合物;
三、以4-溴-1,8萘酐为起始原料,经酰胺化和亲核取代反应来制备n-r-4-氰基-1,8萘酰亚胺类化合物;
四、以苊为起始原料,经硝化、氧化和酰胺化反应来制备n-r-4-硝基-1,8萘酰亚胺类化合物;
五、以苊为起始原料,经硝化、氧化、酰胺化和溴化反应来制备n-r-4-硝基-6-溴-1,8萘酰亚胺类化合物;
六、以4-溴-1,8萘酐为起始原料,经酰胺化、亲核取代和溴化反应来制备n-r-4-三氟基-6-溴-1,8-萘酰亚胺类化合物;
七、以4-溴-1,8萘酐为起始原料,经酰胺化和硝化反应来制备n-r-4-溴-3-硝基-1,8萘酰亚胺类化合物;
八、以1,8-萘酐为起始原料,经硝化和酰胺化反应来制备n-r-3,6-二硝基-1,8萘酰亚胺类化合物;
九、以苊为起始原料,经硝化、氧化、酰胺化反应和硝化来制备n-r-4,5-硝基-1,8-萘酰亚胺类化合物;
十、以苊为起始原料,经溴化、硝化、氧化和酰胺化反应来制备n-r-4-溴-5-硝基-1,8-萘酰亚胺类化合物;
具体的,以n-r-3-硝基-1,8-萘酰亚胺类化合物、n-r-4-氰基-1,8-萘酰亚胺类化合物和n-r-4-三氟甲基-6-溴-1,8-萘酰亚胺类化合物为例,其合成路线分别如下所示:
路线一:
路线二:
路线三:
如下为各路线的具体合成步骤:
(1)在合成路线一中,首先以1,8-萘酐为起始原料,将1,8-萘酐与硝酸在溶剂1中,0-5℃的温度下进行硝化反应,得到3-硝基-1,8-萘酐;其次将3-硝基-1,8-萘酐与烷基取代胺在溶剂2中,回流的温度下进行酰胺化反应,得到n-r-3-硝基-1,8-萘酰亚胺类化合物;
(2)在合成路线二中,首先以4-溴-1,8-萘酐为起始原料,将4-溴-1,8-萘酐与烷基取代胺在溶剂2中,回流的温度下进行酰胺化反应,得到n-r-4-溴-1,8-萘酰亚胺类化合物;其次将n-r-4-溴-1,8-萘酰亚胺类化合物与氰根盐在溶剂3中,135~145℃的温度下进行酰胺化反应,得到n-r-4-氰基-1,8-萘酰亚胺类化合物;
(3)在合成路线三中,首先以n-r-4-溴-1,8-萘酰亚胺类化合物为起始原料,将n-r-4-溴-1,8-萘酰亚胺类化合物与氟代磺酰二氟乙酸甲酯在溶剂3中,在催化剂碘化亚铜的催化作用下,100-120℃的温度下进行取代反应,得到n-r-4-三氟甲基-1,8-萘酰亚胺类化合物;其次将n-r-4-三氟甲基-1,8-萘酰亚胺类化合物与n-溴代丁二酰亚胺nbs在溶剂1中,0-5℃的温度下进行溴化反应,得到n-r-4-三氟甲基-6-溴-1,8-萘酰亚胺类化合物;
和现有技术相比,本发明的有益效果在于:
本发明的基于吸电子基取代的1,8-萘酰亚胺类化合物具有识别阴离子的功能,特别是对氟离子具有超高的灵敏性和选择性。特别地,探针n-正丁基3-硝基-1,8-萘酰亚胺化合物在检测氟离子时能实现颜色从无色到红色的裸眼检测,因此,该基于吸电子基取代的1,8-萘酰亚胺类化合物可作为检测氟离子的显色试剂进而取得实际应用。
由于1,8-萘酰亚胺类化合物在染料及药物等领域广泛应用及硝基和氰基可有效地进行官能团的变换,本发明所得的基于吸电子基取代的1,8-萘酰亚胺类化合物,可通过官能团转变,进而发展用于合成含有氨基、羧酸和酰氯类复杂的染料分子中间体。
本发明的基于吸电子基取代的1,8-萘酰亚胺类化合物以工业易得的1,8-萘酐和4-溴-1,8-萘酐或苊为原料合成,合成过程只涉及常规的取代反应,合成路线简单、过程容易控制,最终产物收率高。
附图说明
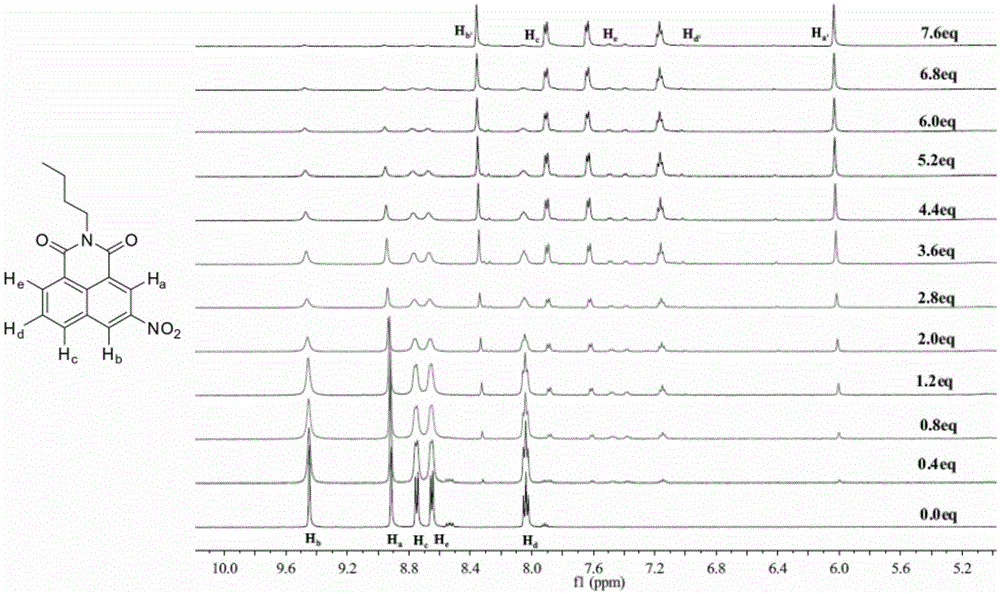
图1、应用实施例1中,实施例2所得的n-正丁基-3-硝基-1,8-萘酰亚胺与氟离子的核磁滴定谱图。
图2、应用实施例2中,实施例2所得的n-正丁基-3-硝基-1,8-萘酰亚胺与氟离子连续滴定作用所得的n-正丁基-3-硝基-1,8-萘酰亚胺的纯乙腈溶液的紫外滴定图谱。
图3、应用实施例3中,n-正丁基-3,6-二硝基-1,8-萘酰亚胺与氟离子连续滴定作用所得的n-正丁基-3,6-二硝基-1,8-萘酰亚胺的纯乙腈溶液的紫外滴定图谱。
图4、应用实施例4中,实施例2所得的n-正丁基-3-硝基-1,8-萘酰亚胺与氟离子连续滴定作用所得的n-正丁基-3-硝基-1,8-萘酰亚胺的纯乙腈溶液的选择性滴定图谱。
图5、应用实施例5中,实施例2所得的n-正丁基-3-硝基-1,8-萘酰亚胺与氟离子连续滴定作用所得的n-正丁基-3-硝基-1,8-萘酰亚胺的纯乙腈溶液的竞争性滴定图谱。
具体实施方式
下面通过具体的实施例并结合附图对本发明进一步阐述,但并不限制本发明。
本发明各实施例中所用的各种原料的名称、规格及生产厂家的信息见表1。
表1
本发明的各实施例中所用的硅胶柱的型号及生产厂家为长45cm,直径45mm,北京联华玻璃仪器有限公司生产的硅胶柱。
实施例1
一种3-硝基-1,8-萘酐化合物,其结构式如下所示:
其中,ewg为硝基;
其合成过程的反应方程式如下所示:
其制备方法的具体步骤如下:
在250ml的单口瓶中,首先将5.0g(25.00mmol)的1,8-萘酐和50ml的浓硫酸加入到反应器中,在冰水浴中,温度控制在0-5℃,待反应体系的温度降到0-5℃,再加入(2.32g,25.00mml)的浓硝酸的浓硫酸溶液10ml,用tlc检测反应进程,反应1.5h后停止反应。
反应完毕后,将反应液倒入冰水浴中,搅拌一段时间,然后静止一段时间后,进行抽滤,用水进行洗涤,将所得到的滤饼进行干燥,然后用冰醋酸进行重结晶,最终得到淡黄色的目标产物(6.02g,收率为89%)。
上述所得的淡黄色固体粉末产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,dmso),δ9.54(d,j=2.0hz,1h),8.95(d,j=2.0hz,1h),8.84(d,j=8.5hz,1h),8.71(d,j=7.0hz,1h),8.10(t,j=7.5hz,1h);
通过上述所得的淡黄色固体粉末产品的核磁共振谱数据分析,结果表明,上述所得的淡黄色固体粉末产品为3-硝基-1,8-萘酐。
实施例2
一种n-正丁基-3-硝基-1,8-萘酰亚胺类化合物,其结构式如下所示:
其中,r为正丁基,
ewg为3-硝基;
其合成过程的反应式如下所示:
其制备方法的具体步骤如下:
在250ml的单口瓶中,加入3-硝基-1,8-萘酐(5.00g,20.39mmol)以及50ml的乙酸溶剂,室温下搅拌10min,随后向单口瓶中逐渐滴入正丁胺(7.46g,101.95mmol),缓慢升温至回流状态。回流反应2h后tlc点板追踪,3-硝基-1,8-萘酐反应完全;
反应完毕后,撤去油浴,将反应液逐渐冷却至室温,向上述反应液中缓慢加入水,用nahco3溶液调至中性,然后用乙酸乙酯进行萃取,合并的有机相用300ml的饱和食盐水洗涤3次,用无水硫酸钠干燥洗涤后的有机相,减压蒸去乙酸乙酯溶剂,硅胶拌样柱层析(洗脱剂为pe:ea=10:1)得到淡黄色固体n-正丁基-3-硝基-1,8-萘酐(4.51g,75%)。
上述所得的淡黄色固体产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,dmso),δ9.43(d,j=2.0hz,1h),8.91(d,j=2.0hz,1h),8.73(d,j=8.0hz,1h),8.64(d,j=7.0hz,1h),8.03(t,j=7.5hz,1h),4.04(t,j=7.5hz,2h),1.65-1.59(m,2h),1.39-1.32(m,2h),0.92(t,j=7.0hz,3h);
通过上述所得的淡黄色固体产品的核磁共振谱分析,结果表明,上述所得的淡黄色固体产品为n-正丁基-3-硝基-1,8-萘酰亚胺。
实施例3
一种n-正丁基-4-溴-1,8-萘酰亚胺类化合物,其结构式如下所示:
其中,r为正丁基;
其合成过程的反应式如下所示:
其制备方法的具体步骤如下:
在100ml的单口瓶中,加入4-溴-1,8-萘酐(4.12g,14.90mmol)以及50ml的乙酸溶剂,室温下搅拌10min,随后向单口瓶中逐渐滴入正丁胺(6.50g,85.00mmol),缓慢升温至回流状态。回流反应1.5h后tlc点板追踪,4-溴-1,8-萘酐反应完全;
反应完毕后,撤去油浴,将反应液逐渐冷却至室温,有大量针状晶体析出,用布氏漏斗抽滤之,滤饼用100ml的无水乙醇洗涤2次,烘干,称量得到灰黄色针状晶体n-正丁基-4-溴-1,8-萘酰亚胺(3.76g,76%)。
上述所得的灰黄色晶体产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,cdcl3),δ8.58(d,j=7.0hz,1h),8.49(d,j=8.5hz,1h),8.34(d,j=7.5hz,1h),7.97(d,j=7.5hz,1h),7.77(t,j=7.5hz,1h),4.10(t,j=7.5hz,2h),1.68–1.61(m,2h),1.42-1.34(m,2h),0.91(t,j=7.0hz,3h);
通过上述所得的灰黄色晶体产品的核磁共振谱数据分析,结果表明,上述所得的灰黄色晶体产品为n-正丁基-4-溴-1,8-萘酰亚胺。
实施例4
一种n-正丁基-4-氰基-1,8-萘酰亚胺类化合物,其结构式如下所示:
其中,r为正丁基;
ewg为4-氰基。
其合成过程的反应方程式如下所示:
其制备方法的具体步骤如下:
在50ml的单口瓶中,加入n-正丁基-4-溴-1,8-萘酰亚胺(219mg,0.66mmol)、氰化铜(200mg、2.23mmol)以及5ml的dmf溶剂,搅拌状态下,缓慢升温至140℃。反应14h后tlc点板追踪,n-正丁基-4-溴-1,8-萘酰亚胺反应完全;
反应完毕后,撤去油浴,将反应液逐渐冷却至室温,把反应液倒入100ml的水中,然后用乙酸乙酯进行萃取,合并的有机相用100ml的饱和食盐水洗涤3次,用无水硫酸钠干燥洗涤后的有机相,减压蒸去乙酸乙酯溶剂,硅胶拌样柱层析(洗脱剂为pe:dcm=1:1,v/v)得到淡黄色固体n-正丁基-4-氰基-1,8-萘酰亚胺(94mg,51%)。
上述所得的淡黄色固体产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,cdcl3),δ8.71(d,j=7.0hz,1h),8.63(d,j=7.5hz,1h),8.57(d,j=8.0hz,1h),8.16(d,j=7.5hz,1h),7.98(t,j=7.5hz,1h),4.18(t,j=7.0hz,2h),1.71(m,2h),1.45(m,2h),0.98(t,j=7.0hz,3h);
通过上述所得的淡黄色固体产品的核磁共振谱数据分析,结果表明,上述所得的淡绿色晶体产品为n-正丁基-4-氰基-1,8-萘酰亚胺。
实施例5
一种n-正丁基-4-三氟甲基-1,8-萘酰亚胺类化合物,其结构式如下所示:
其中,r为正丁基;
ewg为4-三氟甲基。
其合成过程的反应方程式如下所示:
其制备方法的具体步骤如下:
在50ml的单口瓶中,首先将n-正丁基-4-溴-1,8-萘酰亚胺(2.0g,6.04mmol)、碘化亚铜cui(1.72g(9.06mmol)以及40ml有机溶剂dmf加入到反应器中,再加入氟代磺酰二氟乙酸甲酯(2.54g,12.08mmol)。磁力搅拌下保持温度100-120℃反应20h,得到上述n-正丁基-4-三氟甲基-1,8-萘酰亚胺类化合物;
反应完毕后,先过滤除去不溶物,在滤液中加入乙酸乙酯,再用大量的水、饱和食盐水洗涤有机相三次后用无水硫酸钠干燥,然后过硅胶柱进行层析处理,处理过程用洗脱剂进行洗脱(pe:ea=100:1),最终得白色固体粉末产品(1.16g,60.1%)。
上述所得的白色固体粉末产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,cdcl3),δ8.70(d,j=7.0hz,1h),8.65(d,j=7.5hz,1h),8.52(d,j=8.5hz,1h),8.12(d,j=7.5hz,1h),7.95–7.85(m,1h),4.19(t,j=7.5hz,2h),1.78–1.66(m,2h),1.52–1.39(m,2h),0.98(t,j=7.5hz,3h);
通过上述所得的白色固体粉末产品的核磁共振谱数据分析,结果表明,上述所得的白色固体粉末产品为n-正丁基-4-三氟甲基-1,8-萘酰亚胺。
实施例6
一种4-三氟甲基-6-溴-1,8-萘酰亚胺类化合物,其结构式如下所示:
其中,r为正丁基;
x为溴;
ewg为4-三氟甲基。
其合成过程的反应式如下所示:
其制备方法的具体步骤如下:
在50ml的单口瓶中,将n-正丁基-4-三氟甲基-1,8-萘酰亚胺(1.0g,3.11mmol)以及20ml的浓硫酸加入到反应器中。冰浴下再加入0.55g(3.11mmol)的n-溴代丁二酰亚胺(nbs)并搅拌10min,撤去冰浴室温下继续搅拌反应1h,反应过程用tlc点板追踪至反应完全;
反应完毕后,将反应液倒入冰水中,用乙酸乙酯萃取,然后分别用碳酸氢钠饱和溶液、水和饱和食盐水洗涤有机相,再用无水硫酸钠干燥。最后通过硅胶柱层析分离,分离过程洗脱所用的洗脱剂为石油醚(pe:ea=15:1),最终得白色固体粉末产品(1.13g,90.8%)。
上述所得的白色固体粉末产品通过核磁共振仪器(brukeravanceiii500mhz)进行氢谱测定,数据如下所示:
1hnmr(500mhz,cdcl3),δ8.76(d,j=1.5hz,1h),8.64(d,j=3.5hz,1h),8.63(d,j=1.5hz,1h),8.13(d,j=8.0hz,1h),4.18(t,j=7.5hz,2h),1.74-1.68(m,2h),1.48-1.40(m,2h),0.98(t,j=7.5hz,3h);
通过上述所得的白色固体粉末产品的核磁共振谱数据分析,结果表明,上述所得的白色固体粉末产品为n-正丁基-4-三氟甲基-6-溴-1,8-萘酰亚胺。
上述仅以n-正丁基-3-硝基-1,8-萘酰亚胺、n-正丁基-4-氰基-1,8-萘酰亚胺、n-正丁基-4-三氟甲基-1,8-萘酰亚胺以及n-正丁基-4-三氟甲基-6-溴-1,8-萘酰亚胺进行举例,本领域技术人员可以根据上述的实施例的方法,通过调整吸电子取代基的数量以及位置,得到n-正丁基-4-硝基-1,8-萘酰亚胺、n-正丁基-4-硝基-6-溴-1,8-萘酰亚胺、n-正丁基-3-硝基-4溴-1,8-萘酰亚胺、n-正丁基-4-硝基-5-溴-1,8-萘酰亚胺、n-正丁基-3,6-二硝基-1,8-萘酰亚胺以及n-正丁基-4,5-二硝基-1,8-萘酰亚胺等。
应用实施例1
核磁滴定实验:称取4.47mg的实施例2所得到的n-正丁基-3-硝基-1,8-萘酰亚胺于核磁管中,用移液枪加入0.5ml的氘代氯仿,通过加热震荡使其完全溶解,配成30.0mm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液。称取39.18mg的tbaf(四丁基氟化铵)与于2ml的样品瓶中,用移液枪加入0.5ml的氘代氯仿配成299.70mm的f-溶液。在测试时,每次滴加20μl(相当于0.4eq)的f-溶液,测出核磁谱图。谱图分析:随着f-浓度的增加,当f-的浓度达到7.6eq时,核磁滴定到饱和状态,ha-hb的信号完全消失,相应的出现了ha'-hb'信号,通过核磁的分析,ha'-hb'的出现是由于ha-hb向高场移动的结果,这表明氟离子作用于缺电子的芳香环,使得苯环上的氢全部移动到高场。
应用实施例2
紫外滴定实验:称取15.10mg的实施例2所得到的n-正丁基-3-硝基-1,8-萘酰亚胺的固体于10ml的容量瓶中,乙腈定容至10ml配成5062.052μm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液。量取98.774μl5000μm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液于25ml的容量瓶中,乙腈定容至25ml配成25ml20μm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液。将25ml20μm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液倒入100ml的广口锥形瓶中,每次滴加20μl5000μm(0.2eq)的f-溶液后测定紫外-可见吸收光谱图。将多次滴加的图谱叠加即得到图2,从图2中可以看出,随着f-的加入,当f-的浓度达到3.6eq时,滴定达到饱和状态,在528nm波长处有新的吸收峰并且吸收强度持续增强,这表明n-正丁基-3-硝基-1,8-萘酰亚胺分子与f-发生了anion-π作用,生成了络合物,进而影响了探针即n-正丁基-3-硝基-1,8-萘酰亚胺的颜色由无色变成了红色。
应用实施例3
紫外滴定实验:称取17.15mg的n-正丁基-3,6-二硝基-1,8-萘酰亚胺的固体于10ml的容量瓶中,乙腈定容至10ml配成5000μm的n-正丁基-3,6-二硝基-1,8-二萘酰亚胺溶液。量取100μl5000μm的n-正丁基-3,6-二硝基-1,8-二萘酰亚胺溶液于25ml的容量瓶中,乙腈定容至25ml配成25ml20μm的n-正丁基-3,6-二硝基-1,8-二萘酰亚胺溶液。将25ml20μm的n-正丁基-3,6-二硝基-1,8-二萘酰亚胺溶液倒入100ml的广口锥形瓶中,每次滴加20μl5000μm(0.2eq)的f-溶液后测定紫外-可见吸收光谱图。将多次滴加的图谱叠加即得到图3,从图3中可以看出,随着f-的加入,当f-的浓度达到1.2eq时,滴定达到饱和状态,在528nm波长处有新的吸收峰并且吸收强度持续增强,这表明n-正丁基-3,6-二硝基-1,8-二萘酰亚胺分子与f-发生了anion-π作用,生成了络合物,进而影响了探针即n-正丁基-3,6-二硝基-1,8-二萘酰亚胺的颜色由无色变成了深红色。
应用实施例4
选择性实验:称取15.10mg的实施例2所得到的n-正丁基-3-硝基-1,8-萘酰亚胺的固体于10ml的容量瓶中,乙腈定容至10ml配成5000μm的n-正丁基-3-硝基-1,8-萘酰亚胺溶液。量取400μl5000μm的探针溶液于100ml的容量瓶中,乙腈定容至100ml配成100ml20μm的乙腈溶剂的探针溶液。将20μm的乙腈溶剂的探针溶液分别倒入12支15ml的试管中,每支5ml,第一支作空白对照,向其余试管中分别加入64μl5000μm的不同阴离子(空白,f-,cn-,aco-,cl-,br-,i-,hso4-,h2po4-,bf4-,no3-,clo4-)溶液,分别测定紫外-可见吸收光谱图。将多次滴加的图谱叠加即得到图4,从图4中可以看出,该探针只对氟离子有较高的选择性。
应用实施例5
竞争性实验:将应用实施例4的选择性实验结束后,将滴定有其他阴离子的每支试管中分别再加入等当量的氟离子,测定相应波长处的吸光度,并和测定选择性的吸光度一起绘成图5。左边柱子代表加入氟离子前,右边柱子代表加入氟离子后。乙腈溶剂中,从1到10分别是cn-,aco-,cl-,br-,i-,hso4-,h2po4-,bf4-,no3-,clo4-;实验结果表明:在纯溶剂中,其他离子的存在不会对探针即n-正丁基-3-硝基-1,8-萘酰亚胺和氟离子作用产生任何影响。
综上所述,本发明提供的一种基于吸电子基取代的1,8-萘酰亚胺类化合物可作为氟离子的高选择的检测探针,特别地,该类探针能给出基于吸电子基取代的1,8-萘酰亚胺类化合物溶液从无色到红色的裸眼检测,因此,该基于吸电子基取代的1,8-萘酰亚胺类化合物可作为检测氟离子的比色试剂进而取得实际应用。
以上所述内容仅为本发明构思下的基本说明,而依据本发明的技术方案所作的任何等效变换,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!