用于检测分析物的方法与流程
相关申请的交叉参考
本申请要求2017年3月7日提交的美国临时申请第62/468114号的优先权的益处,其全部内容通过参考结合至本文中。
公开领域
本公开涉及用于检测和测量样品中的分析物的方法。本公开还涉及固相的制备,固相包含具有其上固定的抗体的容器,抗体针对至少两种不同的分析物。例如,本公开的方法可用于检测样品中的分析物及其测量。
背景
用于确定样品中特定分析物的存在和量的目前定量方法和测定(比如免疫测定)限于每个固相单一抗原(分析物)的识别。通常,这种定量方法限于使用固相,比如含有微孔的板或其上仅固定一种特定抗体的膜。参见us2016/0289308、us2016/0297893。一般地,在这种测定中使用的抗体以使其一旦结合样品中的抗原即可检测(或不可检测)的方式标记(例如荧光、放射性、发光、二抗)。因此,为了定量检测样品中的一种以上分析物,目前的测定采用单独的固相组分,每种固相组分具有对其上固定的一种特定分析物特异性的单一抗体。
先前利用单一固相检测多种分析物的尝试已涉及使用侧流测定(参见例如us2016/0289308、us2016/0297893和us2010/061377)。侧流测定需要测试样品沿着吸水或非吸水多孔固相(比如膜)以色谱方式流动。在典型的侧流测定中,将样品在第一位置(即应用区)应用于固相并穿过固相直至样品到达固相上的第二离散位置(第一测试区),其包含对第一分析物特异性的第一抗体。然后分析第一测试区以确定样品中第一分析物的存在或量。然后样品必须流动直至其到达固相上的第三离散位置(第二测试区),其包含对另一种分析物特异性的另一抗体。在侧流测定中,然后分析第二测试区以确定样品中分析物的存在或量。在侧流测定中确定分析物的存在需要在固相上的每个离散位置(测试区)处的可检测信号,其然后通过仪器比如荧光计读取。然而,为了辨别在每个区中检测到的每种分析物的量,一般地使用不同标记,比如不同波长的光、不同的荧光染料标记或不同的标记二抗。因此,侧流检测测定昂贵,技术复杂并且容易出现基于操作者的错误。
固相分析物免疫测定通常能够“检测”样品中多种分析物的存在,但仅能以定性方式。在一些情况下,包括其上固定多种分析物的固相的固相分析物免疫测定可为定量的,但这些限于竞争性测定。例如,在固相分析物免疫测定中,非抗体的分析物与固相结合。结合的分析物与样品中存在的分析物竞争结合对目标分析物特异性的标记抗体。在这些测定中,与含有全部与可检测抗体结合的所固定分析物的固相(即对照)相比较,在洗涤步骤中去除样品(和与其结合的抗体),导致信号丧失。因此,当与对照相比较时,从减少信号推导出样品中分析物的存在。如上所述,使用单一固相检测多种分析物需要差异标记的抗体,并且需要将样品和特异性抗体应用和重新应用于固相。这种应用所需的多种标记抗体的应用和随后的洗涤步骤使得竞争性固相测定效率低,劳动强度大且成本高。另外,竞争性测定对非复合的标记抗体敏感,所述非复合的标记抗体与样品中存在的“免疫反应性”多肽种类而不是目标分析物结合,并因此易于产生假阳性。
通过使用其上连接多种抗体的固相来检测多种分析物的固相免疫测定通常为定性的。例如,当将样品提供给结合多种抗体的固相时,其每种对不同目标抗原特异性的抗体与样品接触;如果样品含有任何目标抗原则会产生信号。然而,该测定在没有不同的不同标记和用于检测每种不同标记的方法的情况下不能在样品中存在的许多目标抗原之间进行辨别。进一步地,在这种测定中获得的信号为由所有不同的结合抗原产生的信号的复合信号。因此,目前的方法在没有使用针对每种目标分析物的单独固相的情况下不能定量确定样品中存在多少特定目标抗原。
鉴于上述情况,产生对测定的每种分析物特异性的单独固相组分的要求使得多分析物测定不精确、昂贵、技术复杂且耗时。因此,需要能够使用单一固相定量检测样品中的多种分析物的方法。
公开概述
本文提供的方法利用包含多个容器的单一固相。每个容器具有至少两种其上附着的抗体(捕获抗体)。每种捕获抗体识别抗原(分析物),并且至少两种捕获抗体识别至少两种不同的目标抗原(分析物)。因此,本文提供的方法助于使用单一固相检测多种分析物。使用单一固相检测多种分析物消除了与产生用于检测每种特定目标分析物的单独固相相关的成本。使用单一固相检测样品中的多种分析物也需要较少的消耗品(例如试剂和缓冲液)并且使得能够更有效地使用自动化测定仪器内的内部空间。本公开的方法还通过经简化已知的实验程序和减少检测样品中的多种分析物所需的组分的量来限制用户出错的可能性,从而提高效率。另外,本方法利用具有相同可检测标记的标记的检测抗体。这通过减少对差异可检测标记以及用于定量检测多种信号的方法的需要进一步简化多种分析物的检测。
在第一方面,本公开提供用于检测样品中目标分析物的存在的方法。方法包括提供包含容器的固相,容器各自包被有抗体,抗体结合(捕获)样品中至少两种不同的目标分析物(如果存在的话)。每个容器包含两种或更多种固定于其表面的不同的捕获抗体,其中至少两种固定的抗体各自识别不同的分析物(即至少两种固定的抗体识别至少两种不同的分析物)。
在一些实施方案中,分析物为包含目标表位或氨基酸序列的任何多肽。在某些实施方案中,多肽(蛋白)分析物可从细胞分离、合成产生或重组产生。在一个实施方案中,分析物为由细胞产生的蛋白或其片段。在某些实施方案中,分析物为存在于细胞膜的最外表面上的蛋白。在一个实施方案中,存在于细胞膜的最外表面上的蛋白具有抗体可及的抗原或表位。在仍然其他的实施方案中,分析物为由细胞分泌的蛋白或其片段。
在某些示例性的实施方案中,分析物为胰岛素样生长因子结合蛋白7(igfbp7)、其衍生物、类似物或同系物。在其他示例性的实施方案中,分析物为基质金属蛋白酶的抑制剂、其衍生物、类似物或同系物。在某些实施方案中,分析物为金属蛋白酶的组织抑制剂(timp)。
在一些实施方案中,本公开的分析物包含至少2种、至少3种、至少4种、至少5种、至少6种或更多种不同的蛋白或多肽。在具体的实施方案中,本公开的分析物包含两种不同的多肽或蛋白。在一个实施方案中,本公开的方法用于检测样品中timp2和igfp7的存在和/或量。
在一些实施方案中,固定于固相容器的抗体识别至少两种不同的抗原或表位(分析物)。在本方法的某些实施方案中,固相容器包含固定于其表面的2、3、4、5、6、7、8、9、10或更多种不同的抗体。在具体的实施方案中,捕获抗体结合两种不同的目标分析物。在另一个实施方案中,固定于固相的每个容器的捕获抗体对timp2和igfp7具有特异性。在一些实施方案中,抗体为对timp2和igfbp7特异性的单克隆抗体。在某些实施方案中,固定于固相的每个容器的捕获抗体为对timp2和igfbp7特异性的小鼠单克隆抗体。在一个具体的实施方案中,对timp2特异性的捕获抗体为小鼠单克隆抗体6e2.1,和对igfbp7特异性的捕获抗体为小鼠单克隆抗体1d6。
在某些实施方案中,捕获抗体可直接或间接地附着于容器的表面。例如,捕获抗体可通过捕获抗体的一部分和固相表面上的官能团之间的化学键直接共价结合于固相。或者,通过使抗体与接头共价结合并使接头与固相结合,捕获抗体可间接地共价结合于固相。在一些实施方案中,捕获抗体通过抗体与容器的非共价缔合或吸附直接非共价结合于固相。
在一些实施方案中,可包被固相的容器表面以助于捕获抗体的连接。在其他实施方案中,容器包含结合于容器材料的官能团。在某些实施方案中,容器的表面包被有亲和素和捕获抗体与生物素缀合,或反之亦然。在一个实施方案中,在用聚苯乙烯包被之后,通过吸附使捕获抗体固定于容器表面。
在一些实施方案中,本方法中使用的固相由聚苯乙烯组成。在某些实施方案中,固相的容器由聚苯乙烯组成。在一个具体的实施方案中,固相的容器由白色聚苯乙烯组成。
固相可采用多种形式,其可包括例如膜;芯片;吸管;套管;载玻片;柱;中空的固体、半固体;凝胶;纤维和基质。
在一些实施方案中,固相包含密封的吸管或套管中的两个或更多个容器。容器的非限制性实例包括杯、孔、管、毛细管、小瓶和能够容纳溶液、样品或其一部分的任何其他容器、凹槽或凹口。容器可包含在固相中,比如包含至少两个容器的吸管、套管、条带、板、载玻片等的一部分。在一些实施方案中,固相包含密封的吸管或套管中的两个或更多个容器。在一个实施方案中,用于本方法的固相包含具有从上部到底部逐渐变细的垂直侧壁的容器,使得容器底部的宽度小于容器上部的宽度。
在本方法的一些实施方案中,固相包含多个容器。在某些实施方案中,固相包含至少2个容器、至少3个容器、至少4个容器、至少5个容器、至少6个容器、至少7个容器、至少8个容器、至少9个容器、至少10个容器、至少15个容器、至少20个容器、至少25个容器或者更多。在一个实施方案中,本方法中使用的固相包含至少2个容器。在其他实施方案中,固相包含至少2个锥形容器。
方法进一步包括向每个容器提供样品或其一部分,使得样品与固定于每个容器的捕获抗体接触。当样品含有被固定的捕获抗体识别的分析物(例如目标蛋白或其片段)时,样品中的分析物与容器中存在的特定抗体结合。
在某些实施方案中,样品可从受试者获得,或者可从其他材料获得。在一些情况下,产生样品以确定其中某些分析物的存在。在具体的实施方案中,用于本方法的样品为从受试者(比如患者)获得的体液样品。在一些实施方案中,本公开的样品包括血液、泪液、血清、血浆、脑脊液、尿液、唾液、痰液和胸腔积液。在一个具体的实施方案中,样品为从受试者(比如人)获得的尿液样品。在一些情况下,本方法将使用单一样品的多个部分。
在某些实施方案中,样品为尿液,和提供给每个容器的尿液量为5µl-100µl、10µl-100µl、20µl-100µl、30µl-100µl或40µl-100µl。在其他实施方案中,提供给每个容器的尿液量为20µl-80µl、25µl-80µl、30µl-80µl、35µl-80µl或40µl-80µl。在仍然其他的实施方案中,提供给每个容器的尿液样品的量为约20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl、80µl或者更多。在一些实施方案中,提供给每个容器的尿液样品的量准确地为20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl或80µl。在一个具体的实施方案中,提供给每个容器的尿液样品的量为20µl或35µl。在一个实施方案中,提供给每个容器的尿液样品的量为80µl。
可通过个体或自动化装置(比如自动化免疫诊断装置)将样品或其一部分给予容器。在其中本方法全部或部分地通过自动化免疫诊断装置进行的实施方案中,首先将样品提供给指定的储库,并且随后将样品的一部分分配至已提供给自动化免疫诊断装置的固相的一个或多个容器。在一个实施方案中,本公开的方法在以下自动化免疫诊断装置之一中进行:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600或orthoclinicaldiagnosticsvitros®5600。
在一些实施方案中,将样品提供给每个容器并温育一段时间以助于样品中存在的任何目标分析物与固相的每个容器上存在的相应捕获抗体的结合。
本公开的方法还包括向每个容器提供包含可检测元件的抗体(检测抗体)。提供给每个容器的检测抗体对于目标分析物之一具有特异性。更具体地讲,本方法包括向固相的第一容器提供一定量的识别第一目标分析物的检测抗体,和单独向固相的另一个容器提供一定量的识别不同目标分析物的另一种检测抗体。提供给每个孔的检测抗体均产生相同的可检测信号。本方法的这一方面通过减少用户获得具有差异可检测标记的检测抗体以及用于检测多种不同信号的方法的需要来简化多种分析物的检测。
在本方法的一些实施方案中,检测抗体为单克隆抗体、多克隆抗体、其片段或其任何组合。在具体的实施方案中,本公开的检测抗体均为单克隆抗体,其各自识别不同的目标分析物。在其他实施方案中,本公开的检测抗体均为多克隆抗体,其各自识别不同的目标分析物。在仍然另一个实施方案中,本公开的检测抗体为单克隆抗体和多克隆抗体的组合,其每种对不同的目标分析物具有特异性。
在本方法的一些实施方案中,检测抗体分别对timp2和igfp7具有特异性。在某些实施方案中,本公开的检测抗体为分别对timp2和igfbp7特异性的单克隆抗体。在具体的实施方案中,对timp2特异性的检测抗体为兔单克隆抗体40h2-40k3,和对igfbp7特异性的检测抗体为小鼠单克隆抗体6d2.1。
在一个实施方案中,与检测抗体缔合的可检测标记为直接可检测的。在某些实施方案中,直接可检测标记为荧光部分(染料)、电化学标记、电化学发光标记、金属螯合物或胶体金属颗粒。
在其他实施方案中,可检测标记为间接可检测标记,比如在其进行化学或酶促反应之后可检测的分子,或由本身提供可检测信号的分子结合的分子。在一些实施方案中,可检测标记为酶,比如辣根过氧化物酶(hrp)或碱性磷酸酶。
在一些实施方案中,可检测标记连接于检测抗体。在具体的实施方案中,可检测标记与检测抗体缀合。在某些实施方案中,可检测标记为与每种检测抗体缀合的染料或酶。在本方法的一个实施方案中,辣根过氧化物酶用作与每种特定检测抗体的缀合物。
检测抗体可直接分配至容器中,或在包含所需浓度的检测抗体的溶液中预混合并作为这种预混合溶液的等分试样提供。
在一些实施方案中,提供给每个容器的检测抗体的量为约0.02µg-约1.2µg。在一个实施方案中,提供给每个容器的检测抗体的量为0.02µg-1.2µg。在一个具体的实施方案中,提供给每个容器的检测抗体的量为0.075µg或1.2µg。
检测抗体或包含检测抗体的溶液的给予可通过个体或自动化装置(比如自动化免疫诊断装置)进行。用于分配检测抗体和将固相与检测抗体接触的方法可包括手动移液或将所需量的检测抗体置于容器中,和/或通过机器人或自动化分配机械。在其中本方法全部或部分地通过自动化免疫诊断装置进行的实施方案中,首先将检测抗体提供给指定的储库,并且随后将检测抗体的等分试样分配至已提供给自动化免疫诊断装置的固相的一个或多个容器。
在一个实施方案中,本公开的方法在以下自动化免疫诊断装置之一中进行:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600或orthoclinicaldiagnosticsvitros®5600。
在一些实施方案中,将检测抗体分配至容器中并温育长达40分钟。在一个具体的实施方案中,将检测抗体分配至容器中并温育约4、5、6、7、8、9或10分钟。在其他实施方案中,将检测抗体在容器中温育8分钟。
在某些实施方案中,在将样品和检测抗体混合物给予容器之前,将样品与检测抗体预混合。在一个实施方案中,将样品和检测抗体混合物温育1-60分钟、1-50分钟、1-40分钟、1-30分钟、1-20分钟或1-10分钟(包括端值)。在另一个实施方案中,将样品和检测抗体混合物温育1-8分钟(包括端值)。
通过在固相的每个容器中存在的检测抗体产生可检测信号。可检测信号可例如通过荧光计产生,该荧光计采用在空间上与固相分离的激发光源传感器,其将激发光引导至被分析的每个孔以在孔中产生可检测波长的光,这可通过光学检测器测量。
在仍然其他的实施方案中,还可采用基于抗体的生物传感器来确定与容器中存在的检测抗体结合的分析物的存在或量。
在一个具体的实施方案中,每种检测抗体与相同的可检测标记(比如辣根过氧化物酶)缀合,并且例如通过向每个孔提供底物(比如发光底物)使得hrp酶氧化发光底物,然后发出可检测信号(光)来产生可检测信号。
在某些实施方案中,向发光底物(例如鲁米诺、其衍生物和过酸盐)提供电子转移剂(增强剂,比如取代的乙酰苯胺),以放大由底物发出的光信号以及延长自容器的信号发射。在一些实施方案中,发光底物以包含增强剂溶液的溶液提供。在其他实施方案中,以第一溶液将发光底物提供给容器,和以第二溶液将增强剂提供给容器。
在某些实施方案中,将发光底物和电子转移剂提供给容器并温育约1-20分钟、1-15分钟、1-10分钟、1-9分钟、1-8分钟、1-7分钟、1-6分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或不到1分钟。在一个具体的实施方案中,将发光底物和电子转移剂提供给容器并温育4-5分钟。
本文提供的方法进一步包括检测每种目标分析物的存在。通常,检测步骤通过测量向其提供样品的每个容器产生的信号的量来进行。
本方法可经配置用于使用单一固相同时或连续检测两种或更多种不同分析物,其具有高灵敏度和来自其他分析物的最小干扰。通常,在将样品应用于固相之后由检测抗体直接或间接产生的信号可视觉检测或通过装置(分析仪器,比如反射计、荧光计或透射光度计)获得。
在一些实施方案中,当产生并检测到信号(指示样品中存在分析物)时,然后测量并量化信号。在具体的实施方案中,将每个容器中测量到的信号的量量化并作为单一值提供。在其他实施方案中,每个容器中测量到的信号的量与样品中存在的分析物的量相关。
在一些实施方案中,可将检测到的信号与在本方法中使用对照样品之后产生的信号进行比较。这种比较可助于量化样品中检测到的分析物的量。在一种情况下,对于定量测量,使用改良的四参数或五参数log-logistic软件程序来拟合校准曲线,例如orthoclinicaldiagnostics,assaydatadisk(在vitros®3600immunodiagnosticsystem、vitros®5600integratedsytem上)或磁卡(在vitros®eciq装置上)。
在某些实施方案中,可提供单一值,其量化样品中存在的所有目标分析物的总量。在一个实施方案中,将第一容器中检测到的第一分析物的量乘以第二容器中检测到的第二分析物的量并然后将总数除以1000。
在本公开的某些方面,提供用于实施本文所述方法的试剂盒。合适的试剂盒包含足以实施本公开的方法的试剂以及用于实施所述方法的说明书。本文描述可作为测定试剂盒的一部分提供的另外任选元件。
在某些实施方案中,用于实施本方法的试剂提供在试剂盒中。试剂盒的试剂包括以下中的一种或多种:固相、抗体、缓冲溶液、发光底物、电子转移剂和用于实施本公开的方法的说明书。
试剂盒包含固相,固相具有多个包被有至少2种捕获抗体的容器。在具体的实施方案中,试剂盒中提供的固相的每个容器具有其上固定的至少两种不同的捕获抗体,使得至少两种不同捕获抗体的每一种识别不同的抗原或表位(分析物)。
在一个实施方案中,试剂盒中提供的固相包含多个锥形容器,比如vitros®microwells。在另一个实施方案中,提供包含至少20个vitros®microwells的吸管或套管的固相。在另一个实施方案中,提供包含至少25个vitros®microwells的吸管或套管的固相。在一个具体的实施方案中,固相包含密封的吸管中的25个vitros®microwells。
在一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有至少10个锥形容器的吸管或套管。在另一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有至少20个锥形容器的吸管或套管。在仍然另一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有25个锥形容器的吸管或套管。在一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有25个vitros®microwells的吸管或套管。
在一些实施方案中,试剂盒包含至少两种不同的检测抗体,其中至少两种不同的检测抗体的每一种识别不同的目标分析物。在一些实施方案中,至少两种不同的检测抗体的每一种包含相同的或产生相同的可检测信号的可检测标记。
在一些实施方案中,检测抗体为单克隆抗体、多克隆抗体、其片段或其任何组合。在具体的实施方案中,检测抗体全部为单克隆抗体,其各自识别不同的目标分析物。在其他实施方案中,检测抗体全部为多克隆抗体,其各自识别目标分析物。在仍然另一个实施方案中,提供的检测抗体包括单克隆抗体和多克隆抗体的组合,其各自对不同的目标分析物具有特异性。
在一些实施方案中,试剂盒包含分别对timp2和igfp7特异性的抗体。在某些实施方案中,本公开的检测抗体为分别对timp2和igfbp7特异性的单克隆抗体。在具体的实施方案中,对timp2特异性的检测抗体为单克隆抗体40h2-40k3,和对igfbp7特异性的检测抗体为单克隆抗体6d2.1。
在具体的实施方案中,试剂盒包含至少两种不同的检测抗体,其各自识别不同的目标分析物并与可检测标记缀合。在一个实施方案中,试剂盒包含至少两种不同的检测抗体,其各自识别不同的目标分析物并且各自与辣根过氧化物酶(hrp)缀合。
在本公开的一些实施方案中,试剂盒包含底物,比如发光底物。用于本方法和试剂盒的发光底物及其增强剂为本领域的普通技术人员已知的。因此,酶、底物和增强剂的具体组合不旨在为限制性的。在某些实施方案中,试剂盒中提供的发光底物为鲁米诺或其衍生物和过酸盐。在一些实施方案中,试剂盒包含电子转移剂(增强剂),比如取代的乙酰苯胺,其能够放大由可检测标记产生的信号。
在一些实施方案中,本公开的试剂盒包含参考溶液(校准溶液),其包含已知量的特定目标分析物。在一个实施方案中,参考溶液可包含一个或多个已知量的至少2种目标分析物。在另一个实施方案中,可为这种试剂盒检测的每种相应分析物提供参考溶液。
在某些实施方案中,本公开的试剂盒包含一种或多种溶液或缓冲液。例如,试剂盒可含有以下一种或多种:磷酸盐缓冲液、检测抗体溶液(例如timp2检测抗体缀合物溶液、igfbp7检测抗体缀合物溶液)和水(例如去离子或无菌的)。
附图简述
图1.本公开的示例性固相容器的示意图。所示的固相包含具有其上固定(结合)的两种不同捕获抗体的容器。每种捕获抗体对不同的分析物,即抗原(分析物1、分析物2,其任何一个在样品中可能存在也可能不存在)具有特异性。该示意图显示将样品提供给容器时捕获抗体结合样品中存在的特定抗体的能力,并进一步描绘在使用本方法进一步引入本公开的检测抗体之后捕获抗体-分析物-检测抗体复合物的形成。
图2.用于检测样品中多种分析物的本方法的示例性实施方案的示意图。该示意图显示用于检测样品中的第一和第二分析物的方法,方法包括提供容纳至少两个容器的固相,每个容器具有固定于每个容器表面的两种不同的捕获抗体。所描绘的方法显示,当将样品提供给每个容器时,还提供与可检测标记缀合的特定检测抗体。尽管与所示的每种检测抗体缀合的标记相同,提供给容器1的检测抗体仅识别第一分析物,但是提供给容器2的检测抗体识别与第一分析物不同的第二分析物。通过测量每个孔中存在的检测抗体产生的可检测信号来检测样品中存在的每种分析物的量。这使得能够量化样品中两种目标分析物的每一种所测量的量。在此,样品中存在的第一分析物的量与容器1中检测到的信号量成正比,和样品中存在的第二分析物的量与第二容器中检测到的信号量成正比。
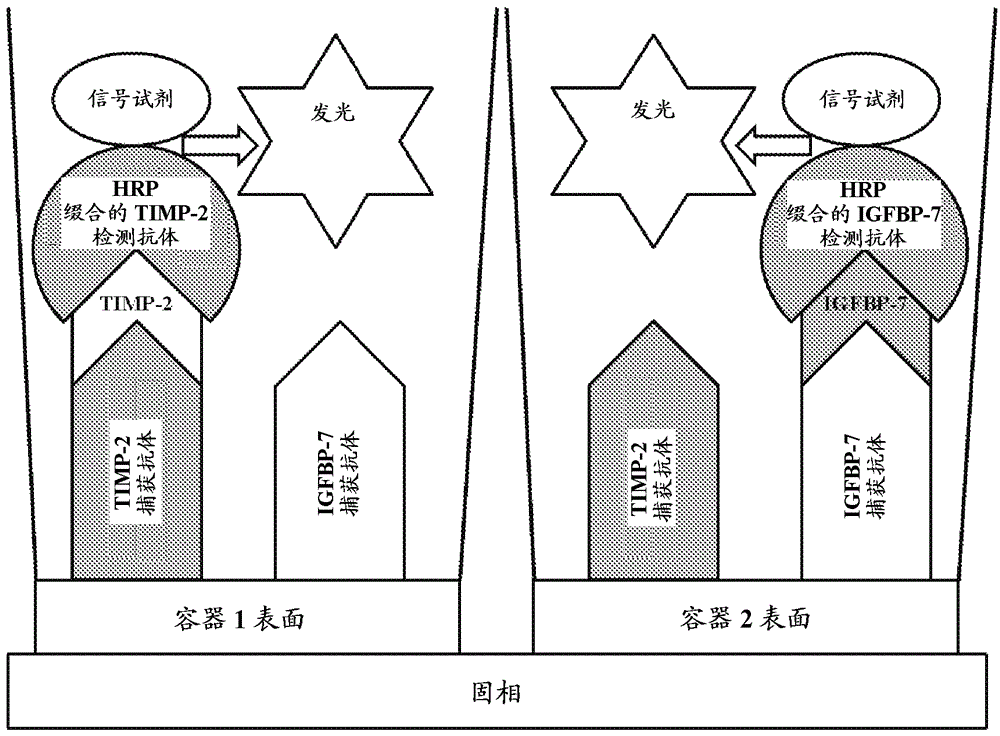
图3.用于检测样品中多种分析物的本方法的第二示例性实施方案的示意图。所示方法显示使用具有锥形容器(容器1,容器2)的固相检测两种分析物(timp2,igfbp7),每个容器具有固定于其内表面的对timp2特异性的捕获抗体和对igfbp7特异性的捕获抗体。将样品分配至容器1中,和将timp2-辣根过氧化物酶(hrp)缀合的检测抗体分配至容器1中。将样品分配至容器2中,和将igfbp7-hrp缀合的检测抗体分配至容器2中。将容器1和容器2的内容物在37℃下温育并洗涤每个容器。该示意图还描绘本方法的一个实施方案,其中在于每个容器中形成捕获抗体-分析物-检测抗体复合物之后向每个容器提供信号试剂,这有助于在孔中可检测信号的发射。在此,将包含发光底物和信号增强剂的信号试剂添加至每个容器中,并使用发光计测量从每个容器发出的光量来检测来自每个容器的光发射(发光)。在每个容器中检测到的光信号的量与样品中存在的timp2和igfbp7的浓度成正比。
详述
本文提供的方法利用包含多个容器的单一固相,每个容器具有其上固定的至少两种抗体。抗体(即捕获抗体)识别至少两种不同的目标分析物。因此,本文提供的方法有助于使用单一固相检测和测量多种分析物。使用单一固相检测多种分析物消除与产生用于定量检测每种特定目标分析物的单独固相相关的成本。本公开的方法还通过经简化测定和减少检测样品中的多种分析物所需的组分的量来限制用户出错的可能性,从而提高效率。另外,本方法利用具有相同可检测信号的标记的检测抗体。这通过减少对差异可检测标记的需求,从而减少对用于检测多种信号的方法的需求,进一步简化多种分析物的定量检测。
在第一方面,本公开提供用于检测样品中目标分析物的存在的方法。方法包括提供包含容器的固相,容器各自包被有抗体,当与样品或其一部分接触时,抗体结合(捕获)样品中的目标分析物(如果存在)。每个容器包含固定于其表面的至少两种不同的抗体,其中至少两种固定的抗体识别不同的分析物。将样品提供给每个容器,使得样品或其一部分与固定于每个容器的捕获抗体接触。当样品含有被固定的抗体识别的分析物(例如目标蛋白或其片段,或目标受体)时,样品中的分析物与容器中存在的相应的捕获抗体结合。本公开的方法还包括向每个容器提供包含可检测标记的抗体(检测抗体)。提供给每个容器的检测抗体对目标分析物之一具有特异性。然而,提供的每种特定检测抗体产生相同的可检测信号。本文提供的方法还包括检测每种目标分析物的存在。
本文使用的术语“分析物”为可被抗体识别的任何分子(例如抗原、另一种抗体或其部分)。在一些实施方案中,分析物为多肽。本文使用的“多肽”为通过相邻氨基酸残基的羧基和氨基之间的肽键键合在一起的氨基酸的单个聚合物链。术语“蛋白”包括多肽。术语“蛋白”也可用于描述具有多个结构域(比如β折叠、接头和α-螺旋)的多肽。因此,术语“蛋白”还意指包括具有四级结构、三级结构的多肽及由至少一种多肽组成的其他复杂大分子。如果蛋白由一个以上彼此物理缔合的多肽组成,则本文使用的术语“蛋白”是指物理偶联并作为离散单元一起起作用的多个多肽。在其中分析物为另一种抗体的实施方案中,分析物-抗体为能够与捕获抗体结合的与捕获抗体不同的任何抗体。
在本方法的实施方案中,分析物为包含目标表位或氨基酸序列的任何多肽。这种多肽可存在于体液或固体样品中。在一些情况下,分析物为存在于生物体(例如哺乳动物、细菌、病毒)上、内或由其产生的多肽或抗体。在一些实施方案中,分析物为存在于细胞上、内或由其产生的多肽或抗体。在仍然其他的实施方案中,分析物为使用本领域普通技术人员已知的方法合成产生或重组产生的多肽或抗体。
例如,分析物可使用最初由merrifield,j.am.chem.soc.(1963)85pp.2149-2154描述的用于产生多肽的固相合成技术制备。其他多肽合成技术可见于m.bodanszky,etal.peptidesynthesis,johnwiley&sons,2ded.,(1976)和本领域技术人员易于获得的其他参考文献。多肽合成技术的概述可见于j.stuartandj.d.young,solidphasepeptidesynthesis,piercechemicalcompany,rockford,ill.,(1984)。分析物也可通过如theproteins,vol.ii.3ded.,neurath,h.etal.,eds.,pp.105-237,academicpress,newyork,n.y.(1976)所述的溶液方法进行合成。在上述文本中以及在j.f.w.mcomie,protectivegroupsinorganicchemistry,plenumpress,newyork,n.y.(1973)中描述了用于不同肽合成的合适的保护基。本公开的分析物也可通过从蛋白或多肽的较大部分的化学或酶促切割来制备。
在一些实施方案中,本方法的分析物为已由细胞产生的蛋白或抗体或其片段。在某些实施方案中,分析物为存在于细胞膜的最外表面上的蛋白。在一个实施方案中,存在于细胞膜的最外表面上的蛋白具有抗体可及的抗原或表位。在仍然其他的实施方案中,分析物为已由细胞分泌的蛋白或其片段。
通过固定多种抗体以捕获和检测样品中的多种抗原的本文公开的形式/方法可以相反形式设计。因此,在某些实施方案中,在样品中待检测的分析物为抗体或其片段的情况下,可提供固相,其包含各自包被有多种抗原(例如肽)容器,当与样品或其一部分接触时,该抗原结合(捕获)样品中的目标抗体(即分析物)(如果存在)。例如,每个容器包含至少两种不同的固定于其表面的抗原或肽,其中至少两种固定的抗原各自识别不同的抗体分析物。将样品提供给每个容器,使得样品或其一部分与固定于每个容器的抗原接触。当样品含有被固定的抗原识别的分析物(例如目标抗体或其片段)时,样品中的抗体与容器中存在的相应捕获剂(即抗原)结合。这种方法还包括向每个容器提供包含可检测标记的抗体(检测抗体)。提供给每个容器的检测抗体对目标分析物(抗体)或其一部分之一具有特异性。然而,提供的每种特定检测抗体产生相同的可检测信号。
另外,本公开的肽(分析物)也可通过本领域普通技术人员已知的重组技术来制备。参见例如currentprotocolsinmolecularcloningausubeletal.,1995,johnwiley&sons,newyork;sambrooketal.,1989,molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,newyork;和coliganetal.(1994)currentprotocolsinimmunology,johnwiley&sonsinc.,newyork,n.y。技术人员理解,广泛种类的表达系统中的任何一种均可用于提供重组肽。所使用的精确宿主细胞对本方法并不重要。然而,举例来说,本公开的分析物可在原核宿主(例如大肠杆菌(e.coli))、真核宿主(例如酿酒酵母(s.cerevisiae))或哺乳动物细胞(比如cos1、cho、nih3t3和jeg3细胞)或节肢动物(例如草地贪夜蛾(s.frugiperda))的细胞中产生。
在某些示例性的实施方案中,分析物为胰岛素样生长因子结合蛋白7(igfbp7)、其衍生物、类似物或同系物。在某些实施方案中,igfbp7为衍生自例如以登记号np_001240764.1、aah66339、aar89912或aap35300阐述的胰岛素样生长因子结合蛋白7前体的任何多肽。在其他实施方案中,分析物为包含可被抗体识别的表位的igfbp7蛋白的任何多肽片段。
在其他示例性的实施方案中,分析物为基质金属蛋白酶的抑制剂、其衍生物、类似物或同系物。在某些实施方案中,分析物为金属蛋白酶的组织抑制剂(timp)。在某些实施方案中,timp分析物为衍生自例如以登记号np_003246.1、np_035724.2、daa18186.1或np_068824.1阐述的金属蛋白酶抑制剂2(timp2)前体的任何多肽。在其他实施方案中,分析物为包含可被抗体识别的表位的timp2蛋白的任何多肽片段。
术语“同系物”意指与例如人、大鼠、小鼠、兔、牛、犬或鸡的氨基酸序列基本上同源的另一种脊椎动物物种的相应多肽。术语“类似物”意指涵盖相差一个或多个氨基酸的多肽。比如包含氨基酸取代、添加或缺失的多肽,其不消除抗体识别多肽的能力。
在一些实施方案中,本公开的分析物为至少2种、至少3种、至少4种、至少5种、至少6种或更多种不同的蛋白或多肽。在具体的实施方案中,本公开的分析物包含至少两种不同的多肽或蛋白。在一个实施方案中,本公开的分析物准确地包含两种不同的多肽或蛋白。在另一个实施方案中,本公开的方法用于检测样品中timp2和igfbp7(分析物)的存在或量。
在其他实施方案中,待通过本方法检测的分析物选自以下非限制性的多肽列表:前列腺特异性抗原(psa)、与psa形成复合物的分子(例如α2-抗胰凝乳蛋白酶、α1-蛋白酶抑制剂(api)或α2-巨球蛋白)、β-淀粉样肽(aβ、βap、aβp或β/a4)、β淀粉样前体蛋白(app)、τ微管蛋白、磷酸化τ蛋白(例如在氨基酸181处磷酸化的τ蛋白)、其同工型、同系物、突变体形式或部分。在一些实施方案中,采用本公开的方法来检测以下分析物对的存在或量:psa和复合psa;aβ(或其突变体或部分)和τ蛋白;及τ蛋白和磷酸化τ蛋白。
一旦确定目标分析物,选择对每种分析物特异性的抗体以用于本公开的方法。
本文使用的术语“抗体”是指由一种或多种免疫球蛋白基因编码的免疫球蛋白分子或其衍生物,其具有与特定抗原或表位结合的能力。参见例如fundamentalimmunology,3rdedition,w.e.paul,ed.,ravenpress,n.y.(1993);wilsonetal.,j.immunol.methods(1994)175:267-273。举例来说,免疫球蛋白分子的重链和轻链的可变区含有与抗原相互作用和结合的结合结构域(抗原结合部分),因为已经证明抗体的抗原结合功能可通过全长抗体的片段,即“抗原结合片段”或“抗原结合部分”来进行。术语“抗体”中涵盖的抗原结合部分或抗原结合片段的实例包括(但不限于):(i)fab片段,一种由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,一种包含两个在铰链区通过二硫键连接的fab片段的二价片段;(iii)由vh和chi结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(例如参见wardetal.,nature(1989)341pp.544-546);和(vi)分离的互补决定区(cdr)。与完整抗体分子一样,抗原结合部分可为单特异性或多特异性的(例如双特异性的)。术语“抗体”也包括单链抗体。术语抗体还包括单克隆抗体和多克隆抗体。
因此,在一些实施方案中,本公开的抗体可为单克隆的、多克隆的、其片段及其任何组合。在具体的实施方案中,本公开的抗体均为单克隆抗体,其各自识别目标分析物。在其他实施方案中,本公开的抗体均为多克隆抗体,其各自识别目标分析物。在仍然另一个实施方案中,本公开的抗体为单克隆抗体和多克隆抗体的组合,其各自对不同的目标分析物具有特异性。
在一些实施方案中,本公开的抗体包括至少2种、至少3种、至少4种、至少5种、至少6种或更多种不同的抗体。在本方法的某些实施方案中,固相包含2、3、4、5、6、7、8、9、10或更多种识别不同分析物的不同抗体。在一些实施方案中,固相包含两种或更多种仅对两种不同分析物特异性的不同抗体。在具体的实施方案中,固相包含两种不同的抗体,其各自识别两种不同的抗原或表位(分析物)。
在另一个实施方案中,本公开的抗体分别对timp2和igfp7具有特异性。在一些实施方案中,本公开的抗体为分别对timp2和igfbp7特异性的单克隆抗体。在其他实施方案中,抗体为小鼠单克隆抗体、人单克隆抗体或兔单克隆抗体。在某些实施方案中,抗体为对timp2和igfbp7特异性的小鼠或兔单克隆抗体。在一个具体的实施方案中,对timp2特异性的抗体为小鼠单克隆抗体6e2.1,和对igfbp7特异性的抗体为小鼠单克隆抗体1d6。
在其他实施方案中,用于本方法的抗体选自以下非限制性的抗体列表:特异性识别τ蛋白的任何单克隆或多克隆抗体(例如ht7和at270单克隆抗体;识别正常和异常磷酸化τ蛋白的抗体(例如alz50(ghanbarietal.,1990)、ht7(merckenetal.,1992)和at120(vandermeerenetal.,1993));识别psa或其结合伴侣的任何抗体(例如美国专利第5501983号所述的2e9、2h11和5a10,其全部内容通过参考结合至本文中);结合aβ或其一部分的任何抗体(比如美国专利第7700309号所述的那些,其全部内容通过参考结合至本文中);以及本领域普通技术人员已知的其他抗体(例如美国专利第9174097号公开的那些,其全部内容通过参考结合至本文中)。
通常,用于本方法的抗体,不管其识别的分析物如何,分为两类:(i)捕获抗体,和(ii)检测抗体。本文使用的术语“捕获抗体”为可附着(固定)于固相容器的一部分或表面的抗体,其当与存在于分析物之上或之内的相应表位接触时能够结合(捕获)目标分析物。例如,使捕获抗体附着于固相的容器,使得抗体的抗原结合部分以允许与抗原(如果存在)结合的方式存在于容器内。
本文使用的术语“检测抗体”意指当与存在于分析物之上或之内的表位接触时能够与目标分析物结合并连接(例如缀合或连结)于可检测标记的抗体。“可检测标记”或“检测元件”本文可互换使用,意指任何一种或多种直接可检测的分子(例如荧光部分、电化学标记、电化学发光标记、金属螯合物、胶体金属颗粒)以及一种或多种可通过产生可检测的反应产物而间接检测的分子(例如酶,比如辣根过氧化物酶、碱性磷酸酶等),一种或多种可通过识别与检测抗体特异性结合的分子(比如与检测抗体结合的标记抗体、生物素、地高新、麦芽糖、寡聚组氨酸、2,4-二硝基苯、苯胂酸、核酸(例如ssdna、dsdna)等)来检测的分子。在具体情况下,可检测标记为辣根过氧化物酶。
在固相容器的表面上提供用于本方法的捕获抗体。在某些实施方案中,将本公开的捕获抗体的第一部分附着于容器的表面,使得捕获抗体的抗原结合部分经定位,使得抗体的抗原结合部分可被提供给它的抗原接触。
可以本领域普通技术人员已知的多种方式将捕获抗体附着于固相上或固相内存在的容器。例如,捕获抗体可与容器共价或非共价结合。在某些情况下,捕获抗体可直接或间接连接于容器的表面。例如,捕获抗体可通过捕获抗体的一部分与固相容器表面上的官能团之间的化学键直接共价结合于容器。或者,通过使抗体与接头共价结合并使接头与固相容器结合,捕获抗体可间接地共价结合于固相容器。在一些情况下,捕获抗体通过抗体与固相容器的非共价缔合或吸附直接非共价结合于固相容器。在其他情况下,捕获抗体间接地非共价结合于固相容器,使得抗体共价结合于接头或其他中间剂,后者然后与固相容器形成非共价键。在所有情况下,捕获抗体与容器的缔合应以使得暴露抗体的抗原结合部分并且不影响或限制捕获抗体的特异性,即当目标分析物提供给捕获抗体时不降低捕获抗体结合目标分析物的能力的方式,将捕获抗体固定于固相容器或其一部分。
可用于使抗体共价连接于固相容器的多种化学反应为本领域的技术人员众所周知的。可用于使捕获抗体共价连接于容器的官能团的说明性实例包括烷基、si-oh、羧基、羰基、羟基、酰胺、胺、氨基、醚、酯、环氧化物、氰酸酯、异氰酸酯、硫氰酸酯、巯基、二硫化物、氧化物、重氮基、碘、磺酸基或者具有化学或潜在化学反应性的类似基团。在一个具体的实施方案中,本公开的捕获抗体通过吸附直接固定于容器。
抗体可非共价结合于固相容器,比如通过吸附或包被于容器上,或者通过与本身非共价结合或固定于容器的接头或结合剂的共价或非共价缔合。可用于使抗体与固相缔合的接头或结合剂的说明性实例包括蛋白、有机聚合物(例如peg及其衍生物)和小分子。可用于将本公开的抗体固定于固相的接头的更具体实例包括人血清白蛋白(has)、牛血清白蛋白(bsa)、链霉亲和素、亲和素、生物素、peg和抗体或抗体片段。
在一个非限制性实例中,可使捕获抗体共价缀合于结合剂比如hsa或bsa,并然后可将所得缀合物用于包被容器。在另一个实施方案中,抗体可与链霉亲和素、生物素或亲和素之一共价缀合,然后缀合的抗体可与固定于容器的不同链霉亲和素、生物素或亲和素分子结合。
在一些实施方案中,固相容器的表面可被修饰以助于捕获抗体稳定连接(固定)于容器。通常,技术人员可使用常规方法以助于将抗体固定于其表面的方式修饰容器。以下为可应用的修饰的非限制性实例。
固相容器的表面可被包被以助于抗体的连接。通常,包被为与抗体的一部分互补的包被。容器的表面可通过使表面甲硅烷基化而被酰胺化,比如用三烷氧基氨基硅烷。硅烷处理的容器也可用同型双官能和异型双官能接头衍生化。容器表面可被衍生化,使得容器包含羟基、氨基(例如烷基胺)、羧基、n-羟基-琥珀酰亚胺酯、可光致活化的基团、巯基、酮或可用于反应的其他官能团。可用于使抗体非共价连接于固相容器的分子的说明性实例包括能够与抗体结合的试剂,比如(但不限于)葡萄球菌a蛋白或g蛋白。
在其他实施方案中,固相容器包含结合于容器材料的官能团。可用于使抗体共价连接于容器的官能团的说明性实例包括烷基、si-oh、羧基、羰基、羟基、酰胺、胺、氨基、醚、酯、环氧化物、氰酸酯、异氰酸酯、硫氰酸酯、巯基、二硫化物、氧化物、重氮基、碘、磺酸基或者具有化学或潜在化学反应性的类似基团。
在一个示例性的实施方案中,比如图1所示,捕获抗体通过吸附固定于固相容器的表面。更具体地讲,将具有多个容器的固相各自包被有聚苯乙烯并进行照射。
适当的照射量可由普通技术人员确定,使得提供给固相的照射量使捕获抗体的吸附最大化。在某些实施方案中,可将固相的容器照射至1.0mrad-3.5mrad(包括端值)。在其他实施方案中,将容器照射至约1.0mrad、约1.5mrad、约2.0mrad、约2.5mrad、约3.0mrad或约3.5mrad。在一个具体的实施方案中,容器已被照射至约1mrad。照射至约1mrad的容器显示出将单克隆捕获抗体固定于所照射表面的能力提高。
捕获抗体包被溶液,其包含例如磷酸盐、氯化钠和处于已被优化以阻止抗体变性的ph(例如约5.5-9.0的ph,或者更具体地讲约6.0-7.0的ph)的缓冲液以及至少两种不同的捕获抗体,被分配于固相的每个容器中,使得每个容器的最内表面与抗体包被溶液接触。然后温育固相容器以助于溶液中捕获抗体的吸附。然后洗涤固相容器以从容器去除未连接的抗体。洗涤可发生1、2、3、4或更多次。然而,使洗涤量最小化将减少产生固相的时间和成本。在一些情况下,洗涤固相两次足以从容器去除所有多余的抗体。将包含例如tris/hcl、蔗糖、nacl和血清白蛋白的后包被溶液分配于每个容器中,使得每个容器的包被抗体的表面与后包被溶液接触。与后包被溶液一起温育之后,比如通过抽吸去除后包被溶液,将容器干燥并储存以备将来使用。如图1所示,上述内容导致将多种捕获抗体固定于固相容器的表面,使得抗体以暴露其抗原结合区的方式定向。
本文使用的术语“固相”是指可包含两个或更多个容器的任何固体或半固体材料。举例来说,固相提供可将容器附着和从中分配的材料。合适的固相材料为本领域已知的。固相可由单一材料或多种材料组成,包括(但不限于)天然或合成的聚合物、树脂、金属、硅酸盐或其组合,只要固相中的材料或材料组合不禁止容器的附着或包含,或者不干扰本文所提供方法的任何步骤。
用于固相的合适材料的非穷举性列表包括琼脂糖;纤维素(比如羧甲基纤维素);葡聚糖(比如sephadex®);聚丙烯酰胺;聚苯乙烯;聚乙二醇;树脂;硅酸盐;二乙烯基苯;甲基丙烯酸酯;聚甲基丙烯酸酯;玻璃;陶瓷;纸;金属;类金属;polyacryloylmorpholidse;聚酰胺;聚(四氟乙烯);聚乙烯;聚丙烯;聚(4-甲基丁烯);聚(对苯二甲酸乙二酯);人造丝;尼龙;聚(丁酸乙烯酯);聚偏二氟乙烯(pvdf);硅酮;聚甲醛;醋酸纤维素;硝化纤维素;或者上述任何两种或更多种的组合。
在一些实施方案中,用于本方法的固相由聚苯乙烯组成。
固相可具有多种形式,其可包括例如膜;芯片;板;吸管;套管;载玻片;柱;中空的固体、半固体的含孔或腔的颗粒(比如珠粒);凝胶;包含光纤材料的纤维;和基质。在某些实施方案中,固相包括芯片;板;吸管;套管;载玻片;柱;或基质,其包含多个容器。在某些实施方案中,固相包括包含至少2个容器的吸管或套管。
术语“容器”用于定义固相的一个子集,其能够接收和含有一定体积的溶液、样品或其他材料。容器的非限制性实例包括杯、孔、管、毛细管、小瓶以及能够容纳溶液、样品或其一部分的任何其他容器、凹槽或凹口。容器可包含在固相中,比如吸管、套管、条带、板、载玻片、柱、基质等的一部分。具体地讲,可在固相中或之上包含多个容器,比如包含杯或孔的吸管或条带、多孔板、微孔板等,其可用于自动化免疫诊断装置。
在一个实施方案中,用于本方法的固相包含具有从上部到底部逐渐变细的垂直侧壁的容器,使得容器底部的宽度小于容器上部的宽度。例如,锥形容器为圆锥形或杯形的。锥形容器,比如图2所示的那些,通过例如减少温育的持续时间和整个本方法中使用的材料(例如溶液、抗体、样品)的量来提高本方法的效率。在一个具体的实施方案中,用于本方法的固相包含多个vitros®microwells。
在本方法的一些实施方案中,固相包含多个容器。在某些实施方案中,固相包含至少2个容器、至少3个容器、至少4个容器、至少5个容器、至少6个容器、至少7个容器、至少8个容器、至少9个容器、至少10个容器、至少15个容器、至少20个容器、至少25个容器或者更多。在一个实施方案中,用于本方法的固相包含至少2个容器。在其他实施方案中,固相包含至少2个锥形容器。在仍然另一个实施方案中,固相包含至少两个vitros®microwells的吸管或套管。
在本方法的某些实施方案中,固相包含2-100个容器、2-90个容器、2-80个容器、2-70个容器、2-50个容器、2-60个容器、2-50个容器、2-40个容器、2-30个容器、2-20个容器或2-10个容器(包括端值)。在一些实施方案中,固相包含2-100、2-75、2-50、2-25、2-15、2-10或2-5个容器。在其他实施方案中,固相包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个容器。在一个实施方案中,固相包含25个锥形容器。在具体的实施方案中,固相包含吸管或套管中的25个容器。在一个具体的实施方案中,固相包含密封的吸管中的25个vitros®microwells。
如本文所述,取决于通过本方法检测的分析物的数量,两种或更多种捕获抗体与固相支持物的每个容器的表面缔合。在某些实施方案中,固相的每个容器具有其上固定的至少2种、至少3种、至少4种、至少5种、至少6种或更多种不同的捕获抗体。在本方法的某些实施方案中,固相的每个容器具有其上固定的2、3、4、5、6、7、8、9、10或更多种不同的捕获抗体。在具体的实施方案中,固相的每个容器具有其上固定的至少两种不同的捕获抗体,使得至少两种不同的捕获抗体的每一种识别不同的抗原或表位(分析物)。在实施方案中,比如图1和图2所示,固相的每个容器准确地具有固定于其表面的两种不同类型的捕获抗体,使得每种类型的捕获抗体识别不同的分析物。
在其他实施方案中,用于本方法的捕获抗体选自以下非限制性的抗体列表:特异性识别τ蛋白的任何单克隆或多克隆抗体(例如ht7和at270单克隆抗体;识别正常和异常磷酸化τ蛋白的抗体(例如alz50(ghanbarietal.,1990)、ht7(merckenetal.,1992)和at120(vandermeerenetal.,1993));识别psa或其结合伴侣的任何抗体(例如如美国专利第5501983号所述的2e9、2h11和5a10,其全部内容通过参考结合至本文中);结合aβ或其一部分的任何抗体(比如美国专利第7700309号所述的那些,其全部内容通过参考结合至本文中);以及本领域普通技术人员已知的其他抗体(例如美国专利第9174097号公开的那些,其全部内容通过参考结合至本文中)。
在一些实施方案中,固定于固相的捕获抗体中的至少一种为单克隆抗体、多克隆抗体或其片段。在一些实施方案中,固定于固相的捕获抗体为多克隆抗体或其片段。在其他实施方案中,捕获抗体为单克隆抗体。
在图1所示的示例性的实施方案中,每个容器具有多种识别第一分析物的捕获抗体和多种识别第二抗体的捕获抗体。在一个具体的实施方案中,比如图3所示,每个容器具有固定于其表面的至少1种识别timp2分析物的捕获抗体和至少1种结合igfbp7分析物的捕获抗体。在某些具体的实施方案中,timp2和igfbp7捕获抗体为单克隆抗体或其片段。在某些实施方案中,固定于固相的每个容器的捕获抗体为对timp2和igfbp7特异性的小鼠单克隆抗体。在一个具体的实施方案中,对timp2特异性的捕获抗体为小鼠单克隆抗体6e2.1,和对igfbp7特异性的捕获抗体为小鼠单克隆抗体1d6。
在本方法的某些实施方案中,将样品或其一部分提供给其中包含多个容器的固相,其中固相的每个容器包含至少2种捕获抗体,其各自能够结合不同的分析物。
不管分析物的数量或用于获得目标分析物的方法如何,将分析物提供给样品或包含在样品内,该样品可易于应用于固相。在某些实施方案中,样品可从受试者获得,或者可从其他材料获得。本文使用的术语“受试者”是指人或非人生物体。因此,本文所述的方法可应用于人类和兽医领域二者。进一步地,尽管受试者优选地为活生物体,但是本文所述的方法也可用于验尸分析中。作为人类的受试者可为“患者”,如本文所用,是指正在接受或可接受疾病或病症的医疗处理的活的人类。
在一些情况下,产生样品以确定其中某些分析物的存在。例如,样品可从已知包含或不包含目标分析物的细胞培养物、流体或组织获得。在其他情况下,通过将合成或重组产生的肽添加至易于储存和分配的溶液中来产生样品。
在具体的实施方案中,用于本方法的样品为从受试者(比如患者)获得的体液样品。在一些实施方案中,本公开的样品包括血液、泪液、血清、血浆、脑脊液、尿液、唾液、痰液和胸腔积液。本领域的技术人员将认识到,某些样品在处理例如分级分离或纯化后将更易于分析。例如,将从受试者获得的全血分级分离成血清和/或血浆组分。因此,样品可原样使用,或者可进行处理以产生用于检测分析物的最终样品。例如,可将样品液化、浓缩、干燥、稀释、冻干、提取、分级分离、进行色谱法、纯化、酸化、还原、降解、进行酶处理或者以本领域普通技术人员已知的其他方式进行处理,以释放目标分析物。如果需要,样品可为例如从个体或从制造过程获得的样品的组合(池)。
样品可处于多种物理状态,比如液体、固体、乳液或凝胶。样品可以惯常处理以保持分析物的完整性。处理可包括使用适当的缓冲剂和/或抑制剂,比如某些生物酶的抑制剂。鉴于目标分析物和样品的性质,本领域的普通技术人员将能够确定合适的条件。
在一个具体的实施方案中,分析的样品为从受试者获得的尿液样品。在一个实施方案中,分析的样品为从受试者获得的人类尿液样品。
在一些情况下,本方法将使用单一样品的多个部分。例如,样品(例如血液、尿液或其他体液)作为初始体积从受试者获得。然后可将初始样品体积分成一个或多个等分试样,使得可使用本文公开的方法处理、加工、储存和/或分析每个单个等分试样。
不管用于本方法的样品类型如何,将一定量的样品提供给固相的每个容器,使得样品与固定于每个容器表面的捕获抗体接触。如图2所示,固相的容器1和2包含附着(固定)于每个容器的第一捕获抗体和第二捕获抗体。图2所示的方法还显示,当与其他捕获抗体相比较时,每种捕获抗体识别并结合不同的目标分析物(例如分析物1和分析物2)。接下来,图2显示,当将样品的一部分给予每个容器,使得含有(或不含)目标分析物的样品与每个容器表面上存在的相应捕获抗体接触时,样品中存在的抗原(分析物)结合该特定的捕获抗体。
本领域的普通技术人员可易于确定提供给每个容器的样品的适当量。在具体的实施方案中,分配至每个容器的样品量可以不同或相同。确定要沉积于每个容器中的样品量取决于各种因素,比如样品的类型、目标分析物的类型、容器的类型和形状、采用的检测方法和/或使用的抗体类型。
例如,提供给容器的液体样品的量可为1-10ml、1-5ml、1-4ml、1-3ml、1-2ml或少于2ml的样品。在一些实施方案中,液体样品的量为1-100µl、1-50µl、1-40µl、1-30µl、1-20µl、1-10µl、1-5µl或更少的样品。在某些实施方案中,提供给每个容器的样品量为5µl-100µl、10µl-100µl、20µl-100µl、30µl-100µl或40µl-100µl。在其他实施方案中,提供给每个容器的样品量为10µl-80µl、20µl-80µl、25µl-80µl、30µl-80µl、35µl-80µl或40µl-80µl。在一个具体的实施方案中,提供给容器的样品量为10µl-80µl(包括端值)。
在仍然其他的实施方案中,提供给每个容器的液体样品的量为约10µl、20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl、80µl或更多。在一些实施方案中,提供给每个容器的样品量准确地为20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl或80µl。在一个具体的实施方案中,提供给每个容器的液体样品的量为20µl或35µl。在一个实施方案中,提供给每个容器的样品量为80µl。
在一些实施方案中,提供给每个容器的液体样品的量为约1µl、2µl、3µl、4µl、5µl、6µl、7µl、8µl、9µl、10µl、11µl、12µl、13µl、14µl、15µl、16µl、17µl、18µl、19µl、20µl、21µl、22µl、23µl、24µl、25µl、26µl、27µl、28µl、29µl、30µl、31µl、32µl、33µl、34µl、35µl、36µl、37µl、38µl、39µl、40µl、41µl、42µl、43µl、44µl、45µl、46µl、47µl、48µl、49µl、50µl、51µl、52µl、53µl、54µl、55µl、56µl、57µl、58µl、59µl、60µl、61µl、62µl、63µl、64µl、65µl、66µl、67µl、68µl、69µl、70µl、71µl、72µl、73µl、74µl、75µl、76µl、77µl、78µl、79µl、80µl或更多。
在某些实施方案中,样品为尿液(例如人类尿液),并且提供给每个容器的尿液量为5µl-100µl、10µl-100µl、20µl-100µl、30µl-100µl或40µl-100µl。在其他实施方案中,提供给每个容器的尿液量为20µl-80µl、25µl-80µl、30µl-80µl、35µl-80µl或40µl-80µl。在仍然其他的实施方案中,提供给每个容器的尿液样品的量为约20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl、80µl或更多。在一些实施方案中,提供给每个容器的尿液样品的量准确地为20µl、25µl、30µl、35µl、40µl、45µl、50µl、55µl、60µl、65µl、70µl、75µl或80µl。在一个具体的实施方案中,提供给每个容器的尿液样品的量为20µl或35µl。在一个实施方案中,提供给每个容器的尿液样品的量为80µl。
可通过本领域普通技术人员已知的任何方法将样品或其一部分给予容器。给予样品的方式的非限制性实例包括通过例如将样品或其一部分注入、喷雾或倾入容器来进行分配。用于分配样品并使固相与样品接触的方法可包括手动移液、洗涤、机器人或自动化分配机械,或者本领域普通技术人员已知的其他方法。本领域的普通技术人员应理解给予样品的方法中的常规处理,比如使用无菌技术或其他方法来保持样品的完整性。
样品或其一部分的给予可通过个体或自动化装置(比如自动化免疫诊断装置)进行。在其中本方法全部或部分地通过自动化免疫诊断装置进行的实施方案中,首先将样品提供给指定的储库,并且随后将样品的一部分分配至已提供给自动化免疫诊断装置的固相的一个或多个容器。用于本方法的合适的自动化免疫诊断装置为本领域已知的。例如,某些自动化免疫诊断装置描述于美国专利第7312084、6143576、6113855、6019944、5985579、5947124、5939272、5922615、5885527、5851776、5824799、5679526、5525524和5480792号以及theimmunoassayhandbook,davidwild,ed.stocktonpress,newyork,1994中,其每一个特此通过参考以其全部结合。
在具体的实施方案中,自动化免疫诊断装置为:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600、orthoclinicaldiagnosticsvitros®5600、beckmanaccess®、abbottaxsym®、rocheelecsys®或dadebehringstratus®装置。
在一个实施方案中,本公开的方法在以下自动化免疫诊断装置之一中进行:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600或orthoclinicaldiagnosticsvitros®5600。
可将样品单独或以包含检测抗体的混合物提供给固相的容器。
不管提供给容器样品的类型、形式、数量或方式如何,将样品或其一部分在容器中温育,以使固定于容器表面的捕获抗体能够与可能存在于样品中的任何相应的分析物结合。具体地讲,一旦含有目标分析物的样品被提供给每个容器,如图2所示,每个容器将含有与第一目标分析物(分析物1)结合的第一捕获抗体和与不同的目标分析物(分析物2)结合的第二捕获抗体,产生多种附着于每个容器的捕获抗体-分析物复合物。在其中提供的样品中仅存在一种类型的目标分析物的情况下,针对该特定分析物的捕获抗体将不与样品结合。
在一些实施方案中,将样品提供给容器并温育一段时间以助于样品中存在的任何目标分析物与每个容器上存在的相应捕获抗体的结合。温育期可由本领域的普通技术人员易于确定,并且可基于各种因素而变化,比如样品的类型、目标分析物的类型、容器的类型和形状、采用的检测方法和/或使用的抗体类型。
在某些实施方案中,将样品在不存在检测抗体的容器中温育约1-60分钟、1-50分钟、1-40分钟、1-30分钟、1-20分钟、1-15分钟、1-10分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或少于1分钟。在一个实施方案中,将样品在不存在检测抗体的情况下分配至容器中并温育1-5分钟(包括端值)。在其他实施方案中,将样品在容器中温育1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60分钟。在另一个实施方案中,将样品在不存在检测抗体的情况下分配至容器中并温育1、2、3、4或5分钟。
在某些实施方案中,将样品与检测抗体一起分配至容器中,并将混合物温育约1-60分钟、1-50分钟、1-40分钟、1-30分钟、1-20分钟、1-15分钟、1-10分钟、1-8分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或少于1分钟。在一个实施方案中,将分配至容器中的样品和检测抗体混合物温育1-10分钟(包括端值)。在另一个实施方案中,将分配至容器中的样品和检测抗体混合物温育1-8分钟(包括端值)。在其他实施方案中,样品与检测抗体在容器中混合并温育1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60分钟。在仍然其他的实施方案中,将分配至容器中的样品和检测抗体混合物温育1、2、3、4、5、6、7、8、9或10分钟。在一个具体的实施方案中,将分配至容器中的样品和检测抗体混合物温育8分钟。
本公开的方法还包括向固相的每个容器单独提供检测抗体。更具体地讲,本方法包括向固相的第一容器提供一定量的识别第一目标分析物的检测抗体和向固相的另一个容器提供一定量的识别不同的目标分析物的另一种检测抗体。无论如何,提供给固相的每个容器的检测抗体仅对应于样品中存在(或不存在)的目标分析物之一,并且每种检测抗体包含产生相同可检测信号的可检测标记。
如图2所示,固相的容器1和2包含附着(固定)于每个容器的第一捕获抗体和第二捕获抗体。当与另一种捕获抗体相比较时,每种捕获抗体识别并结合不同的目标分析物(例如分析物1和分析物2)。当将样品给予每个容器,使得样品与存在于每个容器表面上的捕获抗体接触时,样品中的抗原(分析物)(如果存在)与对分析物特异性的相应捕获抗体结合。这产生固定于每个容器的多种捕获抗体-分析物复合物。在其中提供的样品中仅存在一种类型的目标分析物的情况下,不存在但被测定的分析物的捕获抗体将不与样品结合。然后向每个容器提供一定量的仅对目标分析物之一(即分析物1或分析物2)特异性的检测抗体。这产生多种固定于每个容器的捕获抗体-分析物-检测抗体复合物,其中在每个孔中仅可检测地标记一种特定分析物(例如分析物1或分析物2)。例如,如图2所示,容器1仅包含捕获抗体-分析物1-检测抗体复合物,和第二容器仅包含捕获抗体-分析物2-检测抗体复合物。
在本方法的一些实施方案中,检测抗体为单克隆抗体、多克隆抗体、其片段或其任何组合。在具体的实施方案中,本公开的检测抗体均为单克隆抗体,其各自识别目标分析物。在其他实施方案中,本公开的检测抗体均为多克隆抗体,其各自识别目标分析物。在仍然另一个实施方案中,本公开的检测抗体为单克隆抗体和多克隆抗体的组合,其各自对不同的目标分析物具有特异性。
在本方法的一些实施方案中,检测抗体分别对timp2和igfbp7具有特异性。在某些实施方案中,本公开的检测抗体为分别对timp2和igfbp7特异性的单克隆抗体。在某些实施方案中,提供给固相的容器的检测抗体为对timp2特异性的单克隆抗体(比如兔单克隆40h2-40k3),和提供给固相的另一个容器的检测抗体为对igfbp7特异性的小鼠单克隆抗体(比如6d2.1)。
在其他实施方案中,用于本方法的检测抗体选自以下非限制性的检测抗体列表:特异性识别τ蛋白的任何单克隆或多克隆抗体(例如ht7和at270单克隆抗体;识别正常和异常磷酸化τ蛋白的抗体(例如alz50(ghanbarietal.,1990)、ht7(merckenetal.,1992)和at120(vandermeerenetal.,1993));识别psa或其结合伴侣的任何抗体(例如美国专利第5501983号所述的2e9、2h11和5a10,其全部内容通过参考结合至本文中);结合aβ或其一部分的任何抗体(比如美国专利第7700309号所述的那些,其全部内容通过参考结合至本文中);以及本领域普通技术人员已知的其他抗体(例如美国专利第9174097号公开的那些,其全部内容通过参考结合至本文中)。
如本文所述,用于本方法的检测抗体包含相同的可检测标记或产生相同可检测信号的可检测标记。本方法的这一方面通过减少用户获得具有差异可检测标记的检测抗体以及用于检测多种不同信号的方法的需要,简化多种分析物的检测。
可检测标记为本领域普通技术人员已知的,正如将这种标记与抗体缀合的方法。在一些实施方案中,与检测抗体缔合的可检测标记为直接可检测的。在某些实施方案中,直接可检测标记为荧光部分(染料)、电化学标记、电化学发光标记、金属螯合物或胶体金属颗粒。在其他实施方案中,可检测标记为间接可检测标记,比如在其进行化学或酶促反应之后可检测的分子,或者由本身提供可检测信号的分子结合的分子。在一些实施方案中,可检测标记为酶,比如辣根过氧化物酶或碱性磷酸酶,其可接触底物(例如化学发光底物(发光底物,比如5-氨基-2,3-二氢酞嗪-1,4-二酮(鲁米诺))、发色底物(例如3,3’,5,5’-四甲基联苯胺(tmb)、3,3'-二氨基联苯胺(dab)、2,2'-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(abts))并氧化底物以提供可检测信号。
在一些实施方案中,可检测标记连接于检测抗体。在具体的实施方案中,可检测标记与检测抗体缀合。在某些实施方案中,可检测标记为与每种检测抗体缀合的染料或酶。在本方法的一个实施方案中,辣根过氧化物酶(hrp)用作与每种特定检测抗体的缀合物。这种缀合物的制备可使用多种已知技术来实现。例如,yoshitakeetal,eur.j.biochem.,101,395,1979和kondo等人的美国专利第5106732号所述的方法,其两者的全部内容通过参考结合至本文中。如图3所示,本公开的检测抗体对不同的分析物(timp2和igfp7)具有特异性,并且各自与辣根过氧化物酶(可检测标记)缀合。然后可使hrp酶与底物(比如发光底物)接触,其与底物反应(例如氧化)并在每个孔中提供可检测信号(例如光、发光)。
不管用于本方法的检测抗体如何,将一定量的每种相应的检测抗体提供给固相的每个容器,使得检测抗体的抗原结合部分与已被相应捕获抗体结合的样品部分中的相应抗原(如果存在)接触。
本领域的普通技术人员可易于确定提供给每个容器的检测抗体的适当量。在具体的实施方案中,分配至每个容器的检测抗体的量可以不同或相同。确定要沉积于每个容器中的检测抗体的量取决于各种因素,比如样品的类型、目标分析物的类型、容器的类型和形状、采用的检测方法和/或使用的检测抗体类型。
可将检测抗体直接分配至容器中或在包含所需浓度的检测抗体的溶液中预混合,并作为这种预混合溶液的等分试样提供。用于稀释抗体储备溶液的方法为本领域普通技术人员已知的。
在一些实施方案中,提供给每个容器的检测抗体的量为约0.02µg-约1.2µg。在一个实施方案中,提供给每个容器的检测抗体的量为0.02µg-1.2µg。在具体的实施方案中,提供给每个容器的检测抗体的量为0.02µg、0.025µg、0.03µg、0.035µg、0.04µg、0.045µg、0.05µg、0.055µg、0.06µg、0.065µg、0.07µg、0.075µg、0.08µg、0.085µg、0.09µg、0.095µg、0.1µg、0.15µg、0.2µg、0.25µg、0.3µg、0.35µg、0.4µg、0.45µg、0.5µg、0.55µg、0.6µg、0.65µg、0.7µg、0.75µg、0.8µg、0.85µg、0.9µg、0.95µg、1.0µg、1.05µg、1.1µg、1.15µg、1.2µg、1.25µg或更多。在一个具体的实施方案中,提供给每个容器的检测抗体的量为0.075µg或1.2µg。
在其他实施方案中,提供给容器的检测抗体的量可为每个容器1-10µg/ml、1-5µg/ml、1-4µg/ml、1-3µg/ml、1-2µg/ml或更少的检测抗体。在某些实施方案中,检测抗体的量为约0.5µg/ml-约2.0µg/ml。在具体的实施方案中,检测抗体的量为每个容器0.5µg/ml或2.0µg/ml。
可通过本领域普通技术人员已知的任何方法将检测抗体给予容器。给予检测抗体的方式的非限制性实例包括通过例如将检测抗体注入、喷雾或倾入容器来进行分配。本领域的普通技术人员应理解给予检测抗体的方法中的常规处理,比如使用无菌技术或其他方法来防止污染。
检测抗体或包含检测抗体的溶液的给予可通过个体或自动化装置(比如自动化免疫诊断装置)来进行。用于分配检测抗体和将固相与检测抗体接触的方法可包括手动移液或将所需量的检测抗体置于容器中,和/或通过机器人或自动化分配机械。
在其中本方法全部或部分地通过自动化免疫诊断装置进行的实施方案中,首先将检测抗体提供给指定的储库,并且随后将检测抗体的等分试样分配至已提供给自动化免疫诊断装置的固相的一个或多个容器。用于本方法的合适的自动化免疫诊断装置为本领域已知的。例如,某些自动化免疫诊断装置描述于美国专利第7312084、6143576、6113855、6019944、5985579、5947124、5939272、5922615、5885527、5851776、5824799、5679526、5525524和5480792号以及theimmunoassayhandbook,davidwild,ed.stocktonpress,newyork,1994中,其每一个特此通过参考以其全部结合。
在具体的实施方案中,自动化免疫诊断装置为:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600、orthoclinicaldiagnosticsvitros®5600、beckmanaccess®、abbottaxsym®、rocheelecsys®或dadebehringstratus®装置。
在一个实施方案中,本公开的方法在以下自动化免疫诊断装置之一中进行:orthoclinicaldiagnosticsvitros®eciq、orthoclinicaldiagnosticsvitros®3600或orthoclinicaldiagnosticsvitros®5600。
不管向容器提供检测抗体的类型、数量或方式如何,将检测抗体在容器中进行温育。温育允许检测抗体的抗原结合部分识别并结合样品中的相应抗原(分析物)。检测抗体与样品中目标分析物的结合导致在容器内形成捕获抗体-分析物-检测抗体复合物。温育期可由本领域的普通技术人员易于确定,并且可基于各种因素(比如样品类型、抗体类型、目标分析物的类型、容器的类型和形状、和/或采用的检测方法)而变化。
温育可持续大于1秒的任何时间。在一个实施方案中,将检测抗体分配至容器中并温育至少1分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟、至少8分钟、至少9分钟、至少10分钟或更长时间。在一个具体的实施方案中,将检测抗体提供给容器并温育至少5分钟。在一个具体的实施方案中,将检测抗体提供给容器并温育至少8分钟。
在某些实施方案中,将检测抗体提供给容器并温育约1-40分钟、1-30分钟、1-20分钟、1-15分钟、1-10分钟、1-9分钟、1-8分钟、1-7分钟、1-6分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或少于1分钟。在一些实施方案中,将检测抗体提供给容器并温育5-10分钟、6-10分钟、7-10分钟、8-10分钟或9-10分钟。在其他实施方案中,将检测抗体提供给容器并温育4-9分钟、4-8分钟、4-7分钟、4-6分钟或4-5分钟。在其他实施方案中,将检测抗体提供给容器并温育5-9分钟、5-8分钟、5-7分钟或5-6分钟。在其他实施方案中,将检测抗体提供给容器并温育6-9分钟、6-8分钟或6-7分钟。在仍然其他的实施方案中,将检测抗体提供给容器并温育7-9分钟或7-8分钟。
在某些实施方案中,将检测抗体作为溶液分配至容器中并温育1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40分钟。在具体的实施方案中,将检测抗体分配至容器中并温育4、5、6、7、8、9或10分钟。在其他实施方案中,将检测抗体在容器中温育8分钟。
在某些实施方案中,将样品与检测抗体预混合,然后将样品和检测抗体混合物给予容器。在这种实施方案中,将样品和检测抗体混合并温育约1-40分钟、1-30分钟、1-20分钟、1-15分钟、1-10分钟、1-8分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或少于1分钟,然后将混合物或其一部分给予容器。在一个实施方案中,将样品和检测抗体混合物温育1-10分钟(包括端值)。在另一个实施方案中,将样品和检测抗体混合物温育1-8分钟(包括端值)。在仍然其他的实施方案中,将样品和检测抗体混合物温育1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40分钟。温育期可由本领域的普通技术人员易于确定,并且可基于各种因素而变化。因此,考虑更长或更短的温育期。
从可检测标记产生可检测信号可使用本领域众所周知的各种光学、声学和电化学方法进行。检测模式的实例包括荧光、放射化学检测、反射率、吸光度、电流测定法、电导率、阻抗、干涉法、椭圆光度法等。
在一些实施方案中,可检测信号由荧光计产生,该荧光计采用空间上与固相分开的激发光源传感器,其将激发光引导至被分析的每个孔以在孔中产生可检测波长的光,其可通过光学检测器测量。
在仍然其他的实施方案中,还可采用基于抗体的生物传感器来确定与容器中存在的检测抗体结合的分析物的存在或量。
在一个实施方案中,与每种检测抗体缀合的可检测标记为酶(比如过氧化物酶)。在某些实施方案中,与每种检测抗体缀合的可检测标记为辣根过氧化物酶(hrp)或其合适的同工酶。辣根过氧化物酶的合适的同工酶包括可得自例如sigmachemical的vi型和ix型。例如,通过将底物(比如发光底物)提供给每个孔,使得hrp酶氧化发光底物,其然后发出可检测信号(光)来产生可检测信号。
用于与hrp酶一起使用的发光底物及其增强剂为本领域普通技术人员已知的。用于本实例的发光底物的非限制性实例包括鲁米诺(即2,3-二氢-1,4-酞嗪二酮)或取代的鲁米诺和过硼酸盐(在水性溶剂中),如美国专利第5846756和5705357号所述,其每一个的全部内容通过参考结合至本文中。
在其他实施方案中,缀合于检测抗体的碱性磷酸酶和amppd化学发光底物以及emerald增强剂(tropix)用于产生可检测信号,如c.vigo-pelfreyetal.jneurochem(1994)61:1965-1968所述,其全部内容明确地通过参考结合至本文中。因此,酶、底物和增强剂的具体组合不旨在为限制性的。
在某些实施方案中,比如图3所示的示例性实施方案,发光底物(例如鲁米诺、其衍生物和过酸盐)与电子转移剂(增强剂,比如取代的乙酰苯胺)一起提供,以放大由底物发出的光信号以及延长从容器的信号发射。
在本方法中,可使用可助于电子经过氧化物酶从酶(例如过氧化氢(衍生自过硼酸盐)转移至鲁米诺的任何增强剂。例如,当鲁米诺与过氧化氢之间的反应在存在合适的增强剂的情况下由过氧化物酶引起时,该增强剂增加经酶的氧化速率。用于本方法的增强剂的非限制性实例包括美国专利第4842997号和美国专利第5279940号所述的那些增强剂,其每一个的全部内容通过参考结合至本文中。合适的增强剂包括4-碘苯酚、4-溴苯酚、4-氯苯酚、4-苯基苯酚、2-氯-4-苯基苯酚、6-羟基苯并噻唑、4-41-(21-甲基)噻唑基苯酚、4-21-(41-甲基)噻唑基苯酚、4-(21-苯并噻唑基)苯酚、3-(10-吩噻唑基)-正丙基磺酸盐和3-氯,4-羟基乙酰苯胺。
发光底物和电子转移剂的温育助于底物的氧化和发光信号的放大。温育可持续大于1秒的任何时间。温育期可由本领域的普通技术人员易于确定,并且可基于各种因素而变化。因此,考虑更长或更短的温育期。
在一个实施方案中,将发光底物和电子转移剂分配至容器中并温育至少1分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟、至少8分钟、至少9分钟、至少10分钟或更长时间。在一个具体的实施方案中,将发光底物和电子转移剂提供给容器并温育至少4分钟。在一个具体的实施方案中,将发光底物和电子转移剂提供给容器并温育至少5分钟。
在某些实施方案中,将发光底物和电子转移剂提供给容器并温育约1-20分钟、1-15分钟、1-10分钟、1-9分钟、1-8分钟、1-7分钟、1-6分钟、1-5分钟、1-4分钟、1-3分钟、1-2分钟或少于1分钟。在其他实施方案中,将检测抗体提供给容器并温育4-9分钟、4-8分钟、4-7分钟、4-6分钟或4-5分钟。在一些实施方案中,将发光底物和电子转移剂提供给容器并温育3-9分钟、3-8分钟、3-7分钟、3-6分钟或3-5分钟。在其他实施方案中,将发光底物和电子转移剂提供给容器并温育2-6分钟、2-5分钟、2-4分钟或2-3分钟。在一个具体的实施方案中,将发光底物和电子转移剂提供给容器并温育4-5分钟。
在一些实施方案中,将发光底物和电子转移剂分配至容器中并温育1、2、3、4、5、6、7、8、9、10、11、12、13、14或15分钟。在具体的实施方案中,将发光底物和电子转移剂分配至容器中并温育3、4、5或6分钟。在其他实施方案中,将发光底物和电子转移剂在每个容器中温育4分钟。在一个实施方案中,将发光底物和电子转移剂在每个容器中温育5分钟。
温育的温度可由本领域的普通技术人员易于确定,并且可基于各种因素而变化。在某些非限制性的实例中,将发光底物和电子转移剂分配至容器中,并在32℃-37℃、33℃-37℃、34℃-37℃、35℃-37℃或36℃-37℃之间(包括端值)的温度下温育。在一个具体的实施方案中,将发光底物和电子转移剂分配至容器中并在约37℃的温度下温育。在一个实施方案中,将发光底物和电子转移剂分配至容器中并在37℃的温度下温育。
在本方法的一个实施方案中,将发光底物和电子转移剂分配至容器中,并在约37℃的温度下温育约5分钟。在本方法的另一个实施方案中,将发光底物和电子转移剂分配至容器中并在37℃下温育4-5分钟。
本方法可经配置以用于使用单一固相同时或连续检测两种或更多种不同的分析物,其具有高灵敏度和来自其他分析物的最小干扰。通常,在将样品应用于固相之后由检测抗体直接或间接产生的信号可通过本领域普通技术人员已知的任何方法来检测。用于检测的方法(包括自动化方法)为本领域普通技术人员众所周知的。例如,信号可被视觉检测或通过装置(分析仪器,比如反射计、荧光计或透射光度计)获得。
在某些非限制性的实例中,机器人仪器(即自动化免疫诊断装置),其包括(但不限于)orthoclinicaldiagnosticsvitros®3600、orthoclinicaldiagnosticsvitros®eciq装置、orthoclinicaldiagnosticsvitros®5600、beckmanaccess®、abbottaxsym®、rocheelecsys®、dadebehringstratus®系统,与本方法结合使用以测量可检测信号。然而,可利用能够检测在本方法中使用的特定信号的任何自动化免疫诊断装置。仅举例来说,任何荧光计可用于检测荧光标记,任何光度计可检测发出一定波长的光的标记,和反射计可用于检测吸收光的标记。
在某些实施方案中,连续检测多种分析物。在此,测量在第一容器中产生的可检测信号,然后测量由另一个容器产生的可检测信号,直至已经测量每个被分析的容器。连续检测来自不同容器的信号的存在提高效率,并且消除对多个荧光计、光度计或反射计的需要,而这是同时检测由多个孔产生的信号所需要的。进一步地,连续检测分析物使得能够使用发出具有重叠波长(光谱)或吸收(颜色)的可检测信号的可检测标记。
例如,在将每个容器从固相移出之后,将第一容器温育预定时间并推入包含例如反射计、光度计、静电计的读取站并进行读取。一旦记录了测量,就可丢弃容器。接下来,将第二容器传递到读取站并进行读取。记录第二测量并丢弃来自固相的第二容器。
在一些实施方案中,当产生并检测到信号(指示样品中分析物的存在)时,然后测量和量化信号。在具体的实施方案中,将每个容器中所测量的信号的量进行量化并作为单一值提供。本领域普通技术人员已知的用于组合多个测量以提供单一量化值的任何软件或方法可用于本方法的量化步骤,比如wo2011073741a1所述的那些。
在一个非限制性的实例中,对于定量测量,使用改良的四参数或五参数log-logistic软件程序来拟合校准曲线,例如orthoclinicaldiagnostics,assaydatadisk(在vitros®3600immunodiagnosticsystem、vitros®5600integratedsytem上)或磁卡(在vitros®eciq设备上)。在此,来自用于测量来自每个容器的可检测信号的装置中存在的校准器的信号水平将调整由程序提供的主曲线,并且软件通过将从每个孔获得的信号应用于校准曲线来确定每个孔中的分析物浓度。
在某些实施方案中,可提供单一值,其量化样品中存在的所有分析物的总量。例如,在其中本方法经配置以检测两种不同目标分析物的存在的情况下,将第一容器中检测到的第一分析物的量乘以第二容器中检测到的第二分析物的量,并然后将总数除以1000。因此,以下公式可用于获取样品中存在的第一和第二分析物的量的单一数值:值=([分析物1]x[分析物2])/1000。单位=(ng/ml)2/1000。
在其他实施方案中,在每个容器中测量的信号量与样品中存在的分析物的量相关。
在某些实施方案中,可将检测到的信号与在本方法中使用对照样品之后产生的信号相比较。这种比较可助于对样品中检测到的分析物的量进行量化。在一个实施方案中,由每个容器产生的信号量与样品中存在的该特定分析物的浓度成正比。就像“夹心测定”中的情况一样。
在另一个实施方案中,每个容器产生的信号量与样品中该特定目标分析物的浓度成反比。就像竞争性免疫测定中的情况一样。
在某些实施方案中,方法在免疫测定中实践。各种具体测定形式可用于本方法的实践中,并且包括免疫化学测定,比如酶免疫测定、夹心测定、竞争性结合测定、直接结合测定以及本领域众所周知的其他测定。
在某些实施方案中,比如图1-3所示,本方法包括“夹心测定”,其中目标分析物(例如样品中存在的抗原)至少与第一捕获抗体和第二检测抗体同时或连续复合。例如,在一个具体的实施方案中,捕获抗体被固定于固相的表面上。接下来,将样品提供给固相,使得对相同的目标分析物特异性的第二(检测)抗体与样品中的相应抗原结合,以形成捕获抗体-分析物-检测抗体复合物,即夹心结构。当夹心结构的抗体之一包含可检测标记(例如与过氧化物酶、荧光染料或放射性标记缀合)或者能够通过另外的特定结合反应(比如通过亲和素-生物素复合物)进行如此标记时,那么可确定样品中存在的抗原(分析物)的量。
其他实施方案包括竞争性结合测定,其中特定的目标分析物与分析物的检测抗体和分析物的另一配体竞争。例如,在竞争性免疫测定形式中,样品中的抗原可与提供给固相的分析物或抗原竞争结合作为测定试剂提供的具有标记抗原的检测抗体。
试剂盒
在本公开的某些方面,提供用于实施本文所述方法的试剂盒。合适的试剂盒包含足以实施本公开的方法的试剂以及用于实施所述方法的说明书。本文描述可作为测定试剂盒的一部分提供的另外任选元件。
在某些实施方案中,在试剂盒中提供用于实施本方法的试剂。试剂盒的试剂包括以下一种或多种:固相、抗体、缓冲溶液、发光底物、电子转移剂和用于实施本公开的方法的说明书。
在一些实施方案中,试剂盒包含具有多个包被有至少2种捕获抗体的容器的固相。在具体的实施方案中,试剂盒中提供的固相的每个容器具有其上固定的至少两种不同的捕获抗体,使得至少两种不同的捕获抗体的每一种识别不同的抗原或表位(分析物)。
如本文所述,取决于所检测的分析物的数量,固相可包含固定于固相的每个容器的两种或更多种捕获抗体。在某些实施方案中,固相的每个容器具有其上固定的至少2种、至少3种、至少4种、至少5种、至少6种或更多种不同的捕获抗体。在某些实施方案中,固相的每个容器具有其上固定的2、3、4、5、6、7、8、9、10或更多种不同的捕获抗体。
在某些实施方案中,固定于固相的每个容器的捕获抗体为对timp2和igfbp7特异性的小鼠单克隆抗体。在一个具体的实施方案中,对timp2特异性的捕获抗体为小鼠单克隆抗体6e2.1,和对igfbp7特异性的捕获抗体为小鼠单克隆抗体1d6。
在其他实施方案中,试剂盒包含具有固定于容器表面的至少两种捕获抗体的固相,所述抗体选自以下非限制性的抗体列表:特异性识别τ蛋白的任何单克隆或多克隆抗体(例如ht7和at270单克隆抗体;识别正常和异常磷酸化τ蛋白的抗体(例如alz50(ghanbarietal.,1990)、ht7(merckenetal.,1992)和at120(vandermeerenetal.,1993));识别psa或其结合伴侣的任何抗体(例如美国专利第5501983号所述的2e9、2h11和5a10,其全部内容通过参考结合至本文中);结合aβ或其一部分的任何抗体(比如美国专利第7700309号所述的那些,其全部内容通过参考结合至本文中);以及本领域普通技术人员已知的其他抗体(例如美国专利第9174097号公开的那些,其全部内容通过参考结合至本文中)。
在某些情况下,试剂盒包含固相,固相由作为吸管、套管、条带、板、载玻片等的一部分的多个容器组成。具体地讲,固相包含杯或孔的吸管或条带、多孔板、微孔板等,其可用于自动化免疫诊断装置。在一个实施方案中,试剂盒中提供的固相包含多个锥形容器,比如vitros®microwells。
在本方法的一些实施方案中,试剂盒中提供的固相包含至少2个容器、至少10个容器、至少15个容器、至少20个容器、至少25个容器或者更多。在一个实施方案中,提供包含至少两个vitros®microwells的吸管或套管的固相。在另一个实施方案中,提供包含至少20个vitros®microwells的吸管或套管的固相。在另一个实施方案中,提供包含至少25个vitros®microwells的吸管或套管的固相。
在某些实施方案中,试剂盒中提供的固相包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个容器。在一些实施方案中,固相包含2-100、2-75、2-50、2-25、2-15、2-10或2-5个容器。在一个实施方案中,固相包含25个锥形容器。在具体的实施方案中,固相包含吸管或套管中的25个容器。在一个具体的实施方案中,固相包含密封的吸管中的25个vitros®microwells。
在某些实施方案中,本公开的试剂盒包含多于一个固相。例如,试剂盒可包含至少2、3、4、5、6、7、8、9或10个固相,每个固相包括至少2个容器。在某些实施方案中,试剂盒包含2-10、2-9、2-8、2-7、2-6、2-5、2-4或2-3个包含至少2个容器的固相。在一个实施方案中,试剂盒包含3-6、3-5或3-4个固相,每个固相包含至少两个容器。在一个具体的实施方案中,试剂盒包含4个固相,每个固相包含至少两个容器。
在一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有至少10个锥形容器的吸管或套管。在另一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有至少20个锥形容器的吸管或套管。在仍然另一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有25个锥形容器的吸管或套管。在一个实施方案中,本公开的试剂盒包含4个固相,每个固相含有25个vitros®microwells的吸管或套管。
在一些实施方案中,试剂盒包含至少两种不同的检测抗体,其中至少两种不同的检测抗体的每一种识别不同的目标分析物。在一些实施方案中,至少两种不同的检测抗体的每一种包含相同的或产生相同的可检测信号的可检测标记。
在一些实施方案中,检测抗体为单克隆抗体、多克隆抗体、其片段或其任何组合。在具体的实施方案中,检测抗体均为单克隆抗体,其各自识别不同的目标分析物。在其他实施方案中,检测抗体均为多克隆抗体,其各自识别目标分析物。在仍然另一个实施方案中,提供的检测抗体包含单克隆抗体和多克隆抗体的组合,其各自对不同的目标分析物具有特异性。
在一些实施方案中,试剂盒包含对timp2和igfp7分析物特异性的抗体。在某些实施方案中,本公开的检测抗体为分别对timp2和igfbp7特异性的单克隆抗体。在具体的实施方案中,对timp2特异性的检测抗体为兔单克隆抗体40h2-40k3,和对igfbp7特异性的检测抗体为小鼠单克隆抗体6d2.1。
在具体的实施方案中,试剂盒包含至少两种不同的检测抗体,其各自识别不同的目标分析物并与酶(比如辣根过氧化物酶(hrp))缀合。在其他实施方案中,提供的检测抗体选自以下非限制性的检测抗体列表:特异性识别τ蛋白的任何单克隆或多克隆抗体(例如ht7和at270单克隆抗体;识别正常和异常磷酸化τ蛋白的抗体(例如alz50(ghanbarietal.,1990)、ht7(merckenetal.,1992)和at120(vandermeerenetal.,1993));识别psa或其结合伴侣的任何抗体(例如美国专利第5501983号所述的2e9、2h11和5a10,其全部内容通过参考结合至本文中);结合aβ或其一部分的任何抗体(比如美国专利第7700309号所述的那些,其全部内容通过参考结合至本文中);以及本领域普通技术人员已知的其他抗体(例如美国专利第9174097号公开的那些,其全部内容通过参考结合至本文中)。
在本公开的一些实施方案中,试剂盒包含发光底物。用于本方法和试剂盒的发光底物及其增强剂为本领域普通技术人员已知的。因此,酶、底物和增强剂的具体组合不旨在为限制性的。在某些实施方案中,试剂盒中提供的发光底物为鲁米诺或其衍生物和过酸盐。在一些实施方案中,试剂盒包含电子转移剂(增强剂),比如取代的乙酰苯胺,其能够放大由可检测标记产生的信号。
在一些实施方案中,本公开的试剂盒包含参考溶液(校准溶液),其包含已知量的特定目标分析物。在一个实施方案中,参考溶液可包含一个或多个已知量的至少2种目标分析物。在另一个实施方案中,可为由这种试剂盒检测的每种相应分析物提供参考溶液。如本文所述,参考溶液可用于形成校准曲线,以进一步量化样品中所测量的分析物的量。
在某些实施方案中,本公开的试剂盒包含一种或多种溶液或缓冲液。例如,试剂盒可含有以下一种或多种:磷酸盐缓冲液、检测抗体溶液(例如timp2检测抗体溶液、igfbp7检测抗体溶液)和水(例如去离子或无菌的)。
通常,本公开的试剂盒中提供的说明书将包括本公开的方法。本文所述的方法通常包括使含有或怀疑含有目标分析物的样品与固定于固相的特异性地与分析物结合的第一捕获抗体接触。样品还与包含检测剂的检测抗体接触,以形成固定于固相的捕获抗体-分析物-检测抗体复合物。然后由检测抗体产生信号,该信号指示通过样品中的分析物与捕获和检测抗体的结合形成的复合物的存在或量。然后测量信号。在某些非限制性的实例中,本公开的方法包括色谱、质谱和蛋白检测测定。在一个这种实例中,机器人仪器(即自动化免疫诊断装置),包括(但不限于)orthoclinicaldiagnosticseciq®、orthoclinicaldiagnosticsvitros®3600、orthoclinicaldiagnosticsvitros®5600、beckmanaccess®、abbottaxsym®、rocheelecsys®、dadebehringstratus®系统,属于能够与本方法结合使用的自动化免疫诊断装置。然而,可利用任何合适的自动化免疫诊断装置来测量可检测信号。
尽管阐述本公开的广泛范围的数值范围和参数为近似值,但是在具体实例中阐述的数值被尽可能精确地报告。然而,任何数值均固有地含有某些误差,这些误差必定是由其相应的测试测量中发现的标准偏差产生的。此外,本文公开的所有范围应理解为涵盖其中包含的任何和所有子范围。例如,规定的范围“1-10”应视为包括最小值1和最大值10之间(并且包括端值)的任何和所有子范围;也就是说,所有子范围均以最小值1或更大开头,例如1-6.1,并且以最大值10或更小结尾,例如5.5-10。
另外,任何称为“结合至本文中”的参考文献应理解为以其全部结合。
实施例
实施例1:材料和方法
容器形成。本公开的容器(例如孔)通过随后两天直接抗体包被方法产生。在包被之前,将容器(例如白色聚苯乙烯包被的孔)辐照至1mrad,以使孔间差异最小化。制备捕获抗体包被溶液,其含有由在150mmnacl缓冲液中的0.96mmk2hpo4加2.04mmkh2po4组成的30mm磷酸盐缓冲液、日落黄染料(7.5mg/kg溶液)(ph6.3±0.2)。timp2捕获mab6e2.1和igfbp7捕获mab1d6鼠抗体各自加入至最终浓度为3µg/ml。向每个孔加入200µl3µg/ml捕获抗体包被溶液。然后将容器在18-22℃下温育过夜(例如16-32小时)。与捕获抗体包被溶液一起温育过夜之后,将容器用含有0.1mtris/hcl(ph8.5)的tris洗涤缓冲液洗涤两次。抽吸洗涤缓冲液之后,将容器用tssb(0.1mtris/hcl(ph8.5),其含有5%蔗糖、0.45%氯化钠和0.1%bsa)包被。从每个容器抽吸所有溶液,并在最后抽吸之后干燥容器。洗涤、包被和最终抽吸步骤为在线过程,无需另外的温育步骤。含有包被的容器的板在18-22℃下储存于含有干燥剂的储存容器(例如塑料盒)中直至使用。容器作为密封于4个吸管中的100个包被的孔提供(每个吸管25个孔)。每个容器包被有timp2和igfbp7捕获抗体两者。
检测缀合物试剂的制备。使用本领域已知的标准缀合方法,由timp2检测mab40h2-40k3、igfbp7检测mab6d2.1和辣根过氧化物酶(hrp)制备timp2-hrp和igfbp7-hrp检测缀合物。timp2-hrp缀合试剂为110mm磷酸盐缓冲溶液(ph6.5),还含有铁氰化钾(0.001%)、tween®20(0.5%)、proclin™950(0.5%)、苯胺基萘-1-磺酸盐(ans)(0.04%)和牛血清白蛋白(bsa)(3.0%)和0.0005g/kgtimp2抗体缀合物。igfbp7-hrp缀合试剂为110mm磷酸盐缓冲液,含有100mmnacl溶液(ph6.5),还含有铁氰化钾(0.001%)、tween®20(0.5%)、proclin™950(0.5%)、苯胺基萘-1-磺酸盐(ans)(0.04%)和牛血清白蛋白(bsa)(3.0%)和0.002g/kgigfbp7-hrp缀合物。
分析物检测。为了获得样品中存在的示例性分析物的量,连续运行两次测定。从固相提供第一包被容器,并将患者样品分配至第一容器中,然后将包含与第一分析物结合的缀合于辣根过氧化物酶的第一检测抗体(例如timp2hrp缀合物)的检测抗体溶液试剂分配至含有患者样品的第一容器。接下来,从固相提供第二包被容器,并将患者样品分配至第二容器中,然后将包含与第二分析物结合的缀合于辣根过氧化物酶的第二检测抗体(例如igfbp7hrp缀合物)的检测抗体溶液分配至含有患者样品的第二容器。将第一孔和第二孔两者在37℃下温育8分钟,以助于固定于每个孔表面的捕获抗体-分析物-检测抗体复合物的形成。然后洗涤并抽吸每个容器以去除多余的检测抗体溶液。如美国专利第5846756号所述,将含有发光底物(鲁米诺衍生物和过酸盐)和含电子转移剂的溶液的信号试剂加入到每个孔中。与每种检测抗体缀合的检测剂(hrp),所结合的缀合物催化鲁米诺衍生物的氧化以产生光,该光从孔中发出。信号试剂中存在的电子转移剂(取代的乙酰苯胺)增加由鲁米诺衍生物产生的光水平并延长来自孔的光发射。测量每个孔的光发射。然后将每个容器置于接近光度计(vitros®3600immunodiagnosticsystem或vitros®5600integratedsystem),使得光度计可提供从每个容器发出的光量的读数。
由于本方法的效率,使用自动化免疫诊断装置(即vitros®3600immunodiagnosticsystem或vitros®5600integratedsystem)在16分钟内获得所测量的两种示例性分析物timp2和igfbp7的量,如表1所示。
表1:示例性方法条件和通过多个自动化免疫诊断装置获得首个检测结果的时间。
量化。由每个孔发出的光量与每个容器中的样品中存在的分析物浓度成正比。取决于特定的方法,可期望获得从两个测量信号得出的单一值。在该实施例中,为了获得单一数值,将第一孔中检测到的第一分析物的量乘以第二孔中检测到的第二分析物的量,并然后将总数除以1000。例如,以下公式可用于获取样品中存在的第一和第二分析物的量的单一数值。值=([分析物1]x[分析物2])/1000。单位=(ng/ml)2/1000。
实施例2.测定样品中两种单独分析物的量。
如图1-3所示,使用本公开的方法,使用免疫测定技术来检测尿液样品中存在的两种单独分析物(timp-2和igfbp-7)的存在。在此,提供一种固相,其包含具有固定于每个孔表面上的对分析物(timp2或igfbp7)特异性的小鼠单克隆抗体(捕获抗体)的孔。
将从受试者获得的35µl尿液(样品)与辣根过氧化物酶标记的抗timp2兔单克隆检测抗体缀合物一起分配至固相的第一孔中。在37℃下温育8分钟期间,样品中存在的分析物与timp2检测抗体结合,以在孔内形成分析物-检测抗体复合物。这些复合物被固定于孔表面上的小鼠单克隆抗timp2捕获抗体捕获。
将从受试者获得的20µl尿液与辣根过氧化物酶标记的抗igfbp7小鼠单克隆检测抗体缀合物一起分配至固相的另一孔中。将混合物在37℃下温育8分钟,以形成分析物-检测抗体复合物,该复合物被固定于孔表面上的小鼠单克隆抗igfbp7捕获抗体捕获。
温育之后,通过洗涤去除未结合的物质并抽吸每个孔中的剩余溶液。
通过发光检测来测量与每种检测抗体缀合的辣根过氧化物酶的结合量。如图3所示,向每个孔加入100µl含有发光底物(鲁米诺衍生物和过酸盐)和100µl含有电子转移剂(取代的乙酰苯胺)的增强剂溶液的信号试剂,并将孔温育4-5分钟。与每种检测抗体缀合的辣根过氧化物酶催化底物(鲁米诺衍生物)的氧化,在每个孔中产生可检测波长的光(发光)。另外,存在于信号试剂混合物中的电子转移剂增加由底物产生的光的水平并延长光发射。第一和第二孔的每一个发出具有相同波长的光信号,其由光度计连续测量。
通过将第一孔置于接近光度计,比如存在于自动化免疫诊断装置(例如vitros®3600immunodiagnosticsystem)内的光度计,来进行来自每个孔的发光信号的测量。然后,光度计读取第一孔的发光信号。然后将第二孔置于接近光度计,使得光度计然后可读取由第二孔发出的发光信号。在定性测定中,可通过光度计或自动化免疫诊断装置提供或不提供阳性或信号,来显示测试的样品中是否存在分析物。
实施例3:分析物的量化。对于定量测量,使用改良的四参数或五参数log-logistic程序,比如制造商提供的程序(orthoclinicaldiagnostics,assaydatadisk(在vitros®3600immunodiagnosticsystem、vitros®5600integratedsytem上)或磁卡(在vitros®eciq装置上),来拟合校准曲线。在此,来自校准器的信号水平调整由程序提供的主曲线,并且软件通过将从每个孔获得的发光信号应用于校准曲线来确定每个孔中的分析物浓度。
发出的光量与同样品中存在的抗原(分析物)结合的辣根过氧化物酶缀合的检测抗体的量成正比。因此,从每个孔测量的光量与每个样品中存在的分析物浓度(即每毫升尿液样品中分析物的纳克数)成比例。
所测量的每种分析物的量可计算为单一数值。在此,将第一孔中检测到的第一分析物的量乘以第二孔中检测到的第二分析物的量,并然后将总数除以1000。例如,以下公式可用于获取样品中存在的第一和第二分析物的量的单一数值。值=([timp-2]x[igfbp-7])/1000。单位=(ng/ml)2/1000。
- 还没有人留言评论。精彩留言会获得点赞!