水生动物组织中百菌清残留的检测分析方法与流程
本发明涉及检测技术领域,具体的说是一种水生动物组织中百菌清残留的检测分析方法。
背景技术:
百菌清(chlorothalonil)化学名称为四氯间苯二腈,是一种非内吸性、广谱、高效的保护性杀菌剂,对多种作物的真菌病害具有防治作用。其杀菌机理是与真菌细胞中的磷酸甘油醛脱氢酶发生作用,结合脱氢酶体中含有半胱氨酸的蛋白质,使脱氢酶丧失活性,破坏真菌细胞的新陈代谢,从而导致真菌的死亡。
百菌清从生产开始,至今在世界农业生产中的使用已经超过50年,由于广泛和长期使用,在农作物和自然生态环境中都检测到百菌清的残留,对环境和食品安全具有潜在威胁。百菌清对人和哺乳动物低毒,会引起皮肤炎症、眼睛不适和胃肠刺激等症状,对鱼、贝类等水生生物高毒,美国国家环境保护总署已经将其列为可能使人类致癌的物质之一。我国2012年修订的《生活饮用水卫生标准》首次将百菌清列入了监测范围。
201210338528.0公开了一种快速、灵敏的检测果蔬表面农药(其中包括百菌清)残留的方法,以离子迁移谱技术为基本检测技术,采用正、负离子模式,建立了离子迁移谱检测农药残留的快速定性、半定量分析方法。将含有不同农药样品的采样薄片,烘干溶剂送入到离子迁移谱热解析进样器内进行检测分析获得检测信号,通过样品峰迁移时间和信号强度进行定性和半定量分析。该方法为定性和半定量分析,不能准确分析百菌清的具体含量水平。
201210137297.7公开了一种检测牛组织中氟佐隆残留量的方法,该方法是将牛组织样品经过提取、净化后,以乙腈-水为流动相,高效液相色谱-紫外检测法检测;液相色谱条件为:色谱柱,agilentc18,5μm,150mm×4.6mmi.d.;流动相,体积比为68/32的乙腈-水;流速:1.2ml·min-1;检测波长:260nm;柱温:25℃;进样体积:20ml。该方法所测得牛组织中氟佐隆的lod为0.005mg·kg-1;loq脂肪为0.01mg·kg-1,其他组织为0.02mg·kg-1,能够满足关于动物性食品中氟佐隆药物残留分析的要求。但是其检出限仍然较高。
因此,目前亟需研究出适用于水生动物组织中百菌清残留的检测分析方法,为全面普查水生动物组织中百菌清的含量水平及分布特征提供可靠的分析手段。
技术实现要素:
本发明的目的在于提供一种水生动物组织中百菌清残留的检测分析方法,操作简单、方法可靠、回收率合理,其加标回收率为70~110%,rsd小于10%,并且检出限较低(检出限可以达到0.012μg/l),在水生生物分析检测领域具有广阔的应用前景。
本发明解决其技术问题所采取的技术方案是:
水生动物组织中百菌清残留的检测分析方法,包括以下步骤:
(1)水生动物组织中百菌清的提取
①取水生动物组织样品和蛋白酶置于离心管一中,超声,涡旋,静置;
②萃取:在步骤①静置完毕的离心管一中加入萃取溶剂,涡旋,加入ch3coona和无水mgso4,涡旋,振荡,离心,取出萃取液并冷冻;
③取离心管二加入n-丙基乙二胺、c18、无水mgso4,然后加入步骤②中经冷冻的萃取液,涡旋,离心,然后取上清液,氮吹近干后,加入稳定剂,用正己烷定容,过有机滤膜,得到待测样品;
n-丙基乙二胺(psa)与为nh2相似的吸附剂,psa有两个氨基pka值分别为10.1和10.9。有比氨基柱更强的离子交换能力。保留机理:弱阴离子交换(水溶液)或者极性作用(非极性有机溶剂),络合作用。psa的极性比nh2弱,psa可与金属离子产生鳌合作用,用于提取金属离子强亲合力和高容量可以有效去除脂肪酸,有机酸和一些极性色素及糖。广泛用于植物农残分析样品的处理。主要为正向萃取。
c18具有疏水作用,对非极性的组分有吸附作用,保留机理:强非极性作用。主要用于反相萃取,适合于非极性到中等极性的化合物,如抗菌素、巴比妥酸盐、酞嗪、咖啡因、药物、染料、芳香油、脂溶性维生素、杀真菌剂、除草剂、环境农药、pah和pcb残留、食品添加剂、碳水化合物、对羟基甲苯酸取代脂、苯酚、邻苯二甲酸酯、类固醇、表活化剂、茶碱、水溶性维生素等。
(2)检测
①绘制标准曲线,此处所述的绘制标准曲线的方法可以采用现有检测分析技术领域内常用的标准曲线绘制方法,其所选取的标准液的浓度也不做限定。
②将步骤(1)③得到的待测样品置于进样瓶中,用gc-ecd检测。
其中,所述水生动物组织为水产肉类、禽类肉类和畜类肉类水生动物组织;
优选地,所述水生动物组织为鱼肉,虾肉,蟹肉中的任意一种;
优选地,所述水生动物组织为鱼肉。
进一步地,步骤(1)①中的ph为7-8,例如7.1、7.2、7.3……8;温度为40-50℃,例如40℃、42℃、45℃、50℃等上述范围内的温度;超声功率为200-400w,可选择的为在此范围内的功率;进一步地,超声时间为2min-2h;进一步地,超声时间为10min-40min;进一步地,超声时间为30min;
进一步地,步骤(1)①中的ph为7.5,温度为45℃,超声功率为300w。
进一步地,
步骤(1)②、(1)③中离心管为聚丙烯离心管;
进一步地,步骤(1)②中冷冻时间为1-8h,可选的为1h、2h、3h、5h、8h等该范围内的任意时间。进一步地,步骤(1)②中冷冻时间为3-6h,3h、5h、6h等该范围内的任意时间;进一步地,步骤(1)②中冷冻时间为4h;
进一步地,步骤(1)②中所述萃取溶剂为100%甲醇或者酸性乙腈溶液;
进一步地,所述酸性乙腈溶液为甲酸/乙腈混合溶液或者乙酸/乙腈混合溶液;
进一步地,所述甲酸/乙腈混合溶液为甲酸体积分数为0.5-2%的乙腈溶液;
所述乙酸/乙腈混合溶液为乙酸体积分数为0.5-2%的乙腈溶液;
进一步地,所述甲酸/乙腈混合溶液为甲酸体积分数为1%的乙腈溶液;
所述乙酸/乙腈混合溶液为乙酸体积分数为1%的乙腈溶液;
进一步地,所述酸性乙腈溶液为乙酸/乙腈混合溶液。
进一步地,步骤(1)②中萃取条件为:萃取温度70℃,预热时间5min,稳定萃取时间5min;
进一步地,此萃取步骤循环1-5次,此处所说的萃取步骤为:在步骤①静置完毕的离心管一中加入萃取溶剂,涡旋,加入ch3coona和无水mgso4,涡旋,振荡,离心,取出萃取液,循环的步骤为:取出萃取液后,再次再离心管一中加入萃取溶剂,涡旋,振荡,离心,取出萃取液;若需再次循环,则取出萃取液后,再次再离心管一中加入萃取溶剂,涡旋,振荡,离心,取出萃取液;依此循环。
进一步地,此萃取步骤循环3次。萃取步骤循环操作得到的萃取液需合并。
进一步地,步骤(1)②中的ch3coona和无水mgso4的质量比为1:(0.2-10);
进一步地,步骤(1)②中的ch3coona和无水mgso4的质量比为1:4;
进一步地,无水mgso4需进行预处理,所述预处理步骤为:在380-520℃下灼烧2-8h,冷却后装入磨口玻璃瓶中,置于干燥器中保存。
进一步地,步骤(1)③中所述稳定剂为甲酸。
进一步地,步骤(2)①绘制标准曲线的方法为:配制百菌清浓度为20ppb、50ppb、100ppb、200ppb、400ppb、500ppb的标准溶液,用gc-ecd检测,绘制标准曲线;
进一步地,所述步骤(2)中,gc-ecd检测时,
检测仪器为agilent7890a型气相色谱仪,
检测器为μ-ecd,
色谱柱类型为hp-5石英毛细管柱(30m×0.32mm×0.25μm),
氮气流量为1ml/min,
进样量为1μl,
进样口温度为250℃。
进一步地,所述水生动物组织中百菌清经超声蛋白质酶解后,其加标回收率为70~110%,rsd小于10%,检出限为0.012μg/l。
进一步的技术方案为,一种水生动物组织中百菌清残留的检测分析方法,包括以下步骤:
(1)水生动物组织中百菌清的提取
①5.0g鱼肉样品和10ml蛋白酶,置于聚丙烯离心管一中,调节ph为7.5,300w超声,涡旋,静置;
②萃取:在步骤①静置完毕的聚丙烯离心管一中加入10ml醋酸体积分数为1%的乙腈溶液,涡旋,加入ch3coona和无水mgso4,涡旋,振荡,离心,取出萃取液并冷冻4h;
此步骤②中,萃取温度70℃,预热时间5min,稳定萃取时间5min;此萃取步骤循环3次,合并三次萃取液;
即:萃取:在步骤①静置完毕的聚丙烯离心管一中加入10ml醋酸体积分数为1%的乙腈溶液,萃取温度70℃,预热时间5min,稳定萃取时间5min;然后涡旋,加入ch3coona和无水mgso4,涡旋,振荡,离心,取出萃取液并冷冻4h;
③取4ml离心管二加入50mgn-丙基乙二胺,100mgc18,300mg无水mgso4,然后加入步骤②中经冷冻的萃取液,涡旋,离心,然后取上清液,氮吹近干后,加入稳定剂,用正己烷定容,过有机滤膜,得到待测样品;
此步骤③中的无水mgso4使用前先经以下预处理:在450℃下灼烧4h,冷却后装入磨口玻璃瓶中,置于干燥器中保存。
(2)检测
将步骤(1)得到的待测样品置于进样瓶中,用gc-ecd检测,检测仪器为agilent7890a型气相色谱仪,
检测器为μ-ecd,
色谱柱类型为hp-5石英毛细管柱(30m×0.32mm×0.25μm),
氮气流量为1ml/min,
进样量为1μl,
进样口温度为250℃。
本发明的有益效果是:
1、本发明的水生动物组织中百菌清残留的检测分析方法,适合于生物组织内的百菌清,能够浓缩富集被测的百菌清,降低检测限,并改善方法的灵敏度,而高效灵敏、适应性高的分析仪器保证了地表水及鱼肉中百菌清检测结果的精确性。
2、水生动物组织中百菌清残留的检测分析方法的重复利用性、稳定性和回收率都得到显著提高,可对水生动物组织中百菌清进行提取。
3、水生动物组织中百菌清残留的检测分析方法操作简单,方法可靠,可批量处理;节约溶剂;可完成水生动物组织中百菌清提取与富集,并且提取和富集比较充分,从而提高检测灵敏度和准确度。
4、水生动物组织中百菌清残留的检测分析方法通过优化色谱、质谱条件和减少基质效应等来提高分离能力和灵敏度。
附图说明
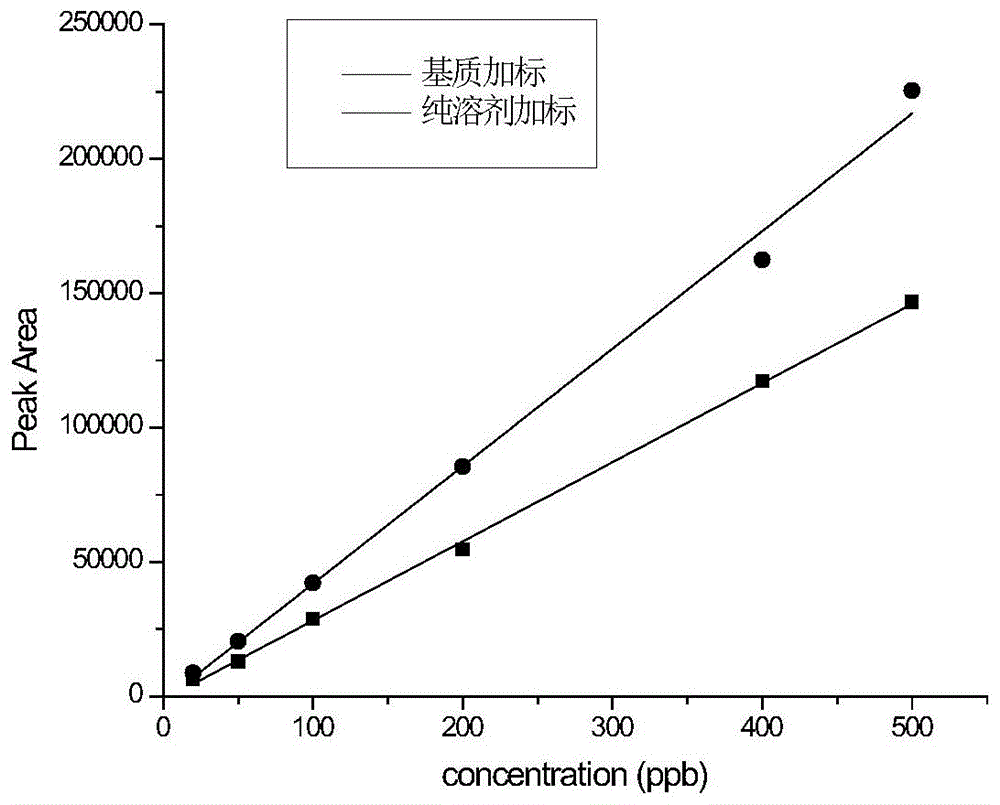
图1标准校正曲线和基质匹配校正标准。
具体实施方式
下面通过具体的实施例对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
1、仪器与样品
1.1、仪器:
检测仪器为agilent7890a型气相色谱仪,安捷伦科技(中国)有限公司
检测器为μ-ecd,安捷伦科技(中国)有限公司
色谱柱类型为hp-5石英毛细管柱(30m×0.32mm×0.25μm),
氮吹仪:dc12h系列氮气吹扫仪,上海安谱实验科技股份有限公司
1.2、样品:从以下采样区域捕获的鲤鱼,取其鱼肉组织。
2、试验方法与结果
绘制标准曲线:配制百菌清浓度为20ppb、50ppb、100ppb、200ppb、400ppb、500ppb的标准溶液,用gc-ecd检测,用内标法定量,方法检出限(mdl)和方法定量限(mql)分别采用3倍和1倍信噪比进行计算,信噪比采用masshunter软件(agilent)对添加较低浓度百菌清的样品进行计算,以20ppb、50ppb、100ppb、200ppb、400ppb、500ppb为横坐标,相对应的峰面积为纵坐标,分别建立标准校正曲线和基质匹配校正曲线,如附图1所示。
实施例1:鱼肉组织
从采样水域捕获的鱼(本实施例中选取的为鲤鱼),取其鱼肉组织,称量5.0g的鱼肉样品和10ml的蛋白酶加入聚丙烯离心管一中,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
往50ml离心管中加入10ml醋酸体积分数为1%乙腈溶液,预热时间5min,保持萃取温度70℃,稳定萃取5min;涡旋1min,加入0.5gnaac,2g无水mgso4,涡旋1min,摇床振荡15min,5000rpm离心5min,注射器取出大部分的萃取液,取出萃取液后,再次再离心管一中加入醋酸体积分数为1%乙腈溶液,预热时间5min,保持萃取温度70℃,稳定萃取5min;涡旋1min,振荡15min,5000rpm离心5min,取出萃取液;则取出萃取液后,再次再离心管一中加入萃取溶剂,涡旋,振荡,离心,取出萃取液;依此循环3次,合并三次萃取液,放置于-18℃冰箱中冷冻4h。
取出1ml经过冷冻的萃取液于4ml聚丙烯离心管二中,离心管二中事先加入50mgn-丙基乙二胺,100mgc18,300mg无水mgso4(无水mgso4使用前先经以下预处理:在450℃下灼烧4h,冷却后再加入离心管二中),涡旋1min,8000rpm离心5min。取500μl上清液,氮吹近干后,加入10μl甲酸作为稳定剂,用正己烷定容至500μl,过0.22μm有机滤膜,得到待测样品。
将上述步骤得到的待测样品置于进样瓶中,用gc-ecd检测,检测仪器为agilent7890a型气相色谱仪,检测条件如下:
检测器为μ-ecd,
色谱柱类型为hp-5石英毛细管柱(30m×0.32mm×0.25μm),
氮气流量为1ml/min,
进样量为1μl,
进样口温度为250℃。
本实施例中,检出限为0.012μg/l。
实施例2-6
与实施例1相比,区别之处仅在于,10ml醋酸体积分数为1%乙腈溶液依次替换为醋酸体积分数为0%乙腈溶液、醋酸体积分数为2%乙腈溶液、醋酸体积分数为3%乙腈溶液、醋酸体积分数为4%乙腈溶液、醋酸体积分数为5%乙腈溶液。
实施例2-6的检出限为0.012μg/l。
实施例7
与实施例1相比,区别之处仅在于,将“0.5gnaac,2g无水mgso4”替换为“1gnaac,1.5g无水mgso4”。
本实施例中,检出限为0.012μg/l。
实施例8(萃取溶剂为甲醇)
从采样水域捕获的鱼(本实施例中选取的为鲤鱼),取其鱼肉组织,称量5.0g的鱼肉样品和10ml的蛋白酶加入聚丙烯离心管一中,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
往50ml离心管中加入10ml甲醇,预热时间5min,保持萃取温度70℃,稳定萃取5min;涡旋1min,加入0.5gnaac,2g无水mgso4,涡旋1min,摇床振荡15min,5000rpm离心5min,注射器取出大部分的萃取液,取出萃取液后,再次再离心管一中加入甲醇,预热时间5min,保持萃取温度70℃,稳定萃取5min;涡旋1min,振荡15min,5000rpm离心5min,取出萃取液;则取出萃取液后,再次再离心管一中加入萃取溶剂,涡旋,振荡,离心,取出萃取液;依此循环3次,合并三次萃取液,放置于-18℃冰箱中冷冻4h。
取出1ml经过冷冻的萃取液于4ml聚丙烯离心管二中,离心管二中事先加入50mgn-丙基乙二胺,100mgc18,300mg无水mgso4(无水mgso4使用前先经以下预处理:在450℃下灼烧4h,冷却后再加入离心管二中),涡旋1min,8000rpm离心5min。取500μl上清液,氮吹近干后,加入10μl甲酸作为稳定剂,用正己烷定容至500μl,过0.22μm有机滤膜,得到待测样品。
将上述步骤得到的待测样品置于进样瓶中,用gc-ecd检测,检测仪器为agilent7890a型气相色谱仪,检测条件如下:
检测器为μ-ecd,
色谱柱类型为hp-5石英毛细管柱(30m×0.32mm×0.25μm),
氮气流量为1ml/min,
进样量为1μl,
进样口温度为250℃。
本实施例中,检出限为0.012μg/l。
采用实施例1的方法选取以下采样地点的鱼肉进行检测,选取的鱼类组织中百菌清的检测结果如下表1。
本发明在样品测试过程中,每10个样品设定一组程序空白,控制样品加标平行和样品平行。控制样品是采用干净的基质,程序空白考察提取过程中是否引入污染,控制样品加标平行和样品平行考察方法的准确性和重现性。
测定其加标回收率:
从采样水域捕获的鱼(本实施例中选取的为鲤鱼),取其鱼肉组织,称量5.0g的鱼肉样品和10ml的蛋白酶加入聚丙烯离心管一中,添加百菌清的标准工作溶液,使其浓度为0.2μg/kg,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
其他操作同实施例1。检测并计算其加标回收率,结果见下表1。
表1鱼肉中百菌清检测浓度
取湖南省湘潭雨湖区尚涟村渔场的虾,取虾肉组织(取3个样,b-1、b-2、b-3),采用实施例1的方法对所取虾肉组织进行检测,选取的虾类组织中百菌清的检测结果如下表2。
取样地点及检测结果如下表2:
测定其加标回收率:
从采样水域捕获的虾(本实施例中选取的为虾),取其虾肉组织,称量5.0g的虾肉样品和10ml的蛋白酶加入聚丙烯离心管一中,添加百菌清的标准工作溶液,使其浓度为0.2μg/kg,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
其他操作同实施例1。检测并计算其加标回收率,结果见下表2。
表2虾肉中百菌清检测浓度
取湖南省湘潭雨湖区尚涟村渔场的蟹,取蟹肉组织(取3个样,c-1、c-2、c-3),采用实施例1的方法对所取蟹肉组织进行检测,选取的蟹类组织中百菌清的检测结果如下表3。
取样地点及检测结果如下表3:
测定其加标回收率:
从采样水域捕获的蟹(本实施例中选取的为蟹),取其蟹肉组织,称量5.0g的蟹肉样品和10ml的蛋白酶加入聚丙烯离心管一中,添加百菌清的标准工作溶液,使其浓度为0.2μg/kg,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
其他操作同实施例1。检测并计算其加标回收率,结果见下表3。
表3蟹肉中百菌清检测浓度
分别采用实施例2-8的方法选取以下采样地点的鱼肉进行检测,选取的鱼类组织中百菌清的检测结果如下表4。
测定其加标回收率:
从采样水域捕获的鱼(本实施例中选取的为湖南省衡阳市衡东县大浦镇芳村的鲤鱼),取其鱼肉组织,称量5.0g的鱼肉样品和10ml的蛋白酶加入聚丙烯离心管一中,添加百菌清的标准工作溶液,使其浓度为0.2μg/kg,调节ph为7.5,以300w功率超声30min后,涡旋1min,静置30min。
其他操作同实施例2-8。检测并计算其加标回收率,结果见下表4。
表4鱼肉中百菌清检测浓度
对于其他的水生动物组织,如其他鱼类等,检测方法均可按照上述实施例中的方法进行分析检测。
上述仅为本发明优选的实施例,并不限制于本发明。对于所属领域的技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施例来举例说明。而由此方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!