一种葡萄糖脱氢酶酶活力准确定性定量的方法与流程
本发明涉及酶活力检测技术领域,具体涉及一种葡萄糖脱氢酶酶活力准确定性定量的方法。
背景技术:
葡萄糖脱氢酶(glucosedehydrogenase,e.c.1.1.1.47,简称gdh)主要存在于动物的肝脏及弱氧化醋杆菌中,能催化β-d-葡萄糖,生成葡萄糖酸(d-葡萄糖酸-δ-内酯),同时伴随着还原性辅酶nadph的生成。早在1975年,banauch等人将葡萄糖脱氢酶作为临床血糖测定的诊断用酶,以测定人体体液中的葡萄糖的浓度。目前,葡萄糖脱氢酶主要用于临床上血糖监测传感器和由nadp依赖的葡萄糖脱氢酶介导的nadph再生。
目前,葡萄糖脱氢酶活力主要的检测方法有分光光度法,离子色谱法、连续监测法等。分光光度法的原理是nadp+为氢受体时,葡萄糖脱氢酶能催化β-d-葡萄糖,生成葡萄糖酸(d-葡萄糖酸-δ-内酯),同时伴随着还原性辅酶nadph的生成,通过分光光度计可对其产生的nadph进行定量,从而计算出葡萄糖脱氢酶的活性。此方法虽然简单易行,成本低,但是该方法易受到不溶性颗粒及样品中相关杂质的影响,从而导致结果出现较大的误差。离子色谱法的原理是葡萄糖脱氢酶能催化β-d-葡萄糖,生成葡萄糖酸,通过检测葡萄糖酸钾的量能测定出葡萄糖脱氢酶的酶活。这种方法需要用到离子色谱,而该仪器普及性差,无法满足广泛使用的需求。连续监测法主要采用自动生化仪监测反应产物nadph随时间的变化过程,从而测定出葡萄糖脱氢酶的活性。该方法需要用到自动生化分析仪,普及性差,且对仪器各项参数、反应条件等需要考察,无法满足常规检测的要求。
中国专利cn104388373a所提及的葡萄糖脱氢酶酶活力测定方法,采用分光光度法检测样品中葡萄糖脱氢酶酶促反应的产物nadph吸光度值来测定葡萄糖脱氢酶的活力,此法易受到不溶性颗粒及样品中相关杂质的影响,导致结果误差大。中国专利cn108132318a所提及的nadph的hplc检测方法,采用c18柱以及梯度洗脱的方式,时间长,程序复杂。因此,建立快速、简便、直观、准确的gdh酶活力检测方法是急需解决的基础问题。本发明正是基于这样的目的进行了研究并提供了一种葡萄糖脱氢酶酶活力快速准确的测定方法。
技术实现要素:
本发明要解决葡萄糖脱氢酶酶活力准确定性定量的问题,首先需解决葡萄糖脱氢酶酶促反应的产物nadph的检测问题。为了克服现有技术中的缺点与不足,本发明首先提供一种nadph的hplc检测方法,进而提供一种葡萄糖脱氢酶酶活力准确定性定量的方法。本发明的方法能够快速、简便、直观、准确的检测出nadph的量并计算出葡萄糖脱氢酶酶活力,且不易受到复杂样品中不溶性颗粒及一些色素的影响。
本发明的目的通过下述技术方案实现:本发明提供一种测定nadph的hplc方法,所述方法采用以硅烷键合相作为固定相的反相色谱柱,流动相由缓冲盐和有机溶剂组成,紫外检测波长为330~350nm,流速为0.8~1.2ml/min。
在本发明的一些实施方式中,hplc方法使用的色谱柱是c30柱。
在本发明的一些实施方式中,hplc方法使用的缓冲盐选自磷酸氢二钠、乙酸钠、和磷酸钠中的一种或几种;有机溶剂选自甲醇、乙醇、异丙醇和乙腈中的一种或几种;在一些实施方式中,hplc方法使用的缓冲盐是乙酸钠,有机溶剂是甲醇。
在本发明的一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的ph为5.0~6.0;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的ph为5.0;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的ph为5.5;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的ph为6.0。
在本发明的一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的浓度为43~129mm;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的浓度为43mm;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的浓度为86mm;在一些实施方式中,hplc方法使用的缓冲盐乙酸钠溶液的浓度为129mm。
在本发明的一些实施方式中,hplc方法使用的有机溶剂占流动相总体积的百分比为8~12%;在一些实施方式中,hplc方法使用的有机溶剂占流动相总体积的百分比为8%;在一些实施方式中,有机溶剂占流动相总体积的百分比为10%;在一些实施方式中,有机溶剂占流动相总体积的百分比为12%。
在本发明的一些实施方式中,hplc方法使用的紫外检测波长为330~350nm;在一些实施方式中,hplc方法使用的紫外检测波长为340nm;在一些实施方式中,hplc方法使用的紫外检测波长为340nm;在一些实施方式中,hplc方法使用的紫外检测波长为350nm。
在本发明的一些实施方式中,hplc方法使用的流速为0.8~1.2ml/min;在一些实施方式中,hplc方法使用的流速为0.8ml/min;在一些实施方式中,hplc方法使用的流速为1.0ml/min;在一些实施方式中,hplc方法使用的流速为1.2ml/min。
在本发明的一些实施方式中,hplc方法使用的柱温为23~33℃;在一些实施方式中,hplc方法使用的柱温为23℃;在一些实施方式中,hplc方法使用的柱温为28℃;在一些实施方式中,hplc方法使用的柱温为33℃。
本发明还提供一种葡萄糖脱氢酶酶活力准确定性定量的方法,所述的方法采用hplc法检测葡萄糖脱氢酶酶促反应的产物nadph,进而计算出样品中葡萄糖脱氢酶的酶活力,具体包括如下步骤:
(1)绘制nadph峰面积—nadph浓度的标准曲线;
(2)葡萄糖脱氢酶介导的酶促反应的发生;
将ph8.0tris-hcl缓冲液、葡萄糖溶液和nadp+溶液混合均匀后,加入tris-hcl缓冲液稀释过的葡萄糖脱氢酶样品,室温反应后,加热煮沸并冷却至室温;
(3)hplc法检测酶促反应的产物nadph的生成量;
(4)已知nadph的生成量计算出葡萄糖脱氢酶的酶活力。
在本发明的一些实施方式中,步骤(2)中所述的酶促反应进行前样品需先采用tris-hcl缓冲溶液稀释至葡萄糖脱氢酶的酶活力在0.01~1.25u/ml范围内。步骤(2)中所述的室温反应时间是4min。
在本发明的一些实施方式中,步骤(3)中所述的hplc色谱条件为:
色谱柱:c30柱(4.6*250mm);
检测波长:340nm;
柱温:28℃;
流速:1.0ml/min;
运行时间:15min;
流动相:乙酸钠溶液(ph=5.5)和甲醇,甲醇占流动相总体积的百分比为10%。
在本发明的一些实施方式中,步骤(4)中所述的酶活力定义为在温度为25℃和ph8.0条件下,每分钟催化葡萄糖生成1μmol的nadph的酶量定义为一个国际单位(iu)。计算公式为:
式中:a:待测液峰面积;k:标准曲线的斜率;
c:标准曲线的截距;n:酶的稀释倍数;
m:称取的待测酶粉重量;t:室温反应时间;
u固体:固体样品的酶活;u液体:液体样品的酶活;
v总体积:反应总体积;v样品体积:样品反应体积。
在本发明的一些实施方式中,所述的室温反应时间t为4min。
本发明所述的“葡萄糖脱氢酶酶活力”是指在温度为25℃和ph8.0条件下,每分钟催化葡萄糖生成1μmol的nadph的酶量定义为一个国际单位(iu)。
本发明所述的“nadph”还原型辅酶ⅱ,学名还原型烟酰胺腺嘌呤二核苷酸磷酸,它参与多种合成代谢反应,如脂类、脂肪酸和核苷酸的合成,在暗反应还可为二氧化碳的固定供能。这些反应中需要nadph作为还原剂、氢负离子的供体,nadph是nadp+的还原形式。
本发明所述的“nadp+”是烟酰胺腺嘌呤二核苷磷酸,是还原型辅酶ii(nadph)的氧化形式,表示失去了一个电子而带上一个正电荷。主要作为脱氢酶的辅酶,在酶促反应中起递氢体的作用,为单递氢体。
本发明所述的“tris-hcl”是盐酸三羟甲基氨基甲烷,不仅被广泛用作核酸和蛋白质的溶剂,还可作为缓冲体系用于稳定ph值。
本发明所述的“固定相”是在色谱分离中固定不动、对样品产生保留的一相。
本发明所述的“流动相”是色谱过程中携带待测组分向前移动的物质称为流动相。与固定相处于平衡状态、带动样品向前移动的另一相。
与现有技术相比,本发明取得的有益效果为:
1、本发明所建立的hplc测定的方法具有直观准确的特点,能直观反映出反应产物nadph的峰面积,以实现对其准确定性定量,且反应时间较短,产物稳定性好,能同时进行大量样品的检测分析。
2、在本发明中,反应条件温和,采用hplc测定酶促反应产物nadph不受不溶性颗粒及有关色素的影响,准确性强,方法稳定性好,易于标准化操作,适用范围广。同时,检测中用到的试剂及标品量少,成本较低。
3、本发明hplc方法中用到的c30色谱柱对产物峰的分析相比其它色谱柱具有更好的保留值和分离度。
附图说明
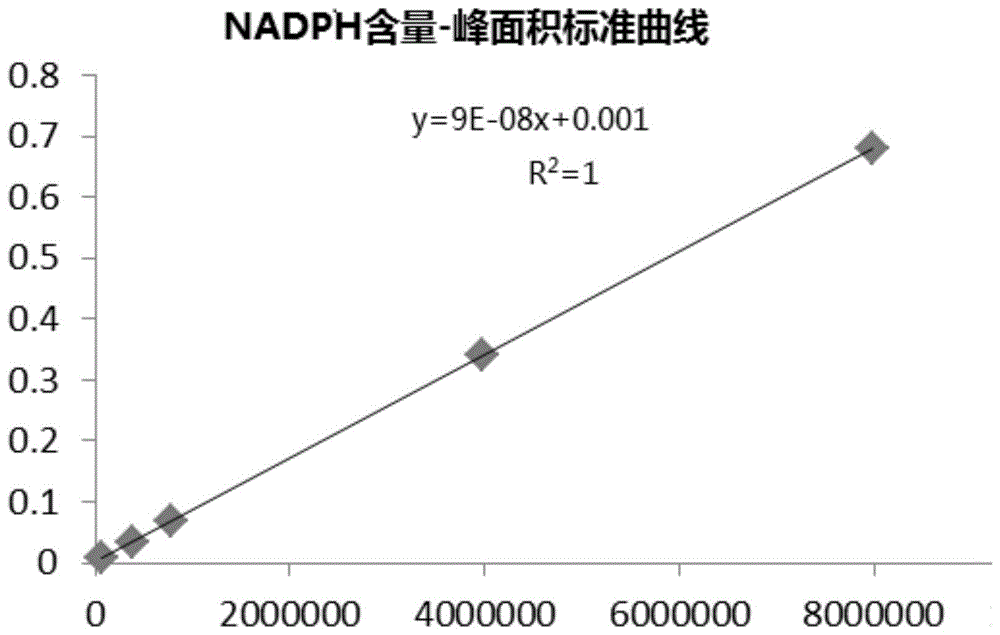
图1是实施例1nadph浓度—nadph峰面积标准曲线;
图2是实施例1hplc法测定nadph的色谱图;
图3是对比例1吸光度-nadph标准曲线;
图4是对比例2hplc法测定nadph的色谱图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1葡萄糖脱氢酶酶活力测定步骤
(1)nadph浓度—nadph峰面积标准曲线的绘制
称取nadph标准品(邦泰生物)约25mg于25ml容量瓶中,采用tris-hcl缓冲液(100mmol/l,ph8.0)溶解并定容至刻度,依次稀释成0.0068μmol/ml、0.03402μmol/ml、0.06804μmol/ml、0.3402μmol/ml、0.6804μmol/ml的标准品系列溶液,在500μl离心管中依次加入320μltris-hcl缓冲液(100mmol/l,ph8.0)、20μl葡萄糖溶液(0.754mmol/ml)和20μlnadp+(10mg/ml)溶液混合均匀后,分别加入上述不同浓度的nadph标准溶液5μl,混合后立即投入沸水中加热煮沸30s,立即冷却,平衡至室温,过0.45μm滤膜,在340nm处测定nadph的峰面积。以nadph的峰面积为横坐标,nadph的浓度为纵坐标绘制标准曲线,见图1。
(2)样品预处理
固体样品精密称取100mg于25ml容量瓶中,采用tris-hcl缓冲液(100mmol/l,ph8.0)溶解并定容至刻度,临用时采用tris-hcl缓冲液(100mmol/l,ph8.0)稀释至适当倍数;液体样品直接采用tris-hcl缓冲液(100mmol/l,ph8.0)稀释至适当倍数。稀释后的样品中葡萄糖脱氢酶的活力控制在0.01~1.25u/ml之间。
(3)葡萄糖脱氢酶酶促反应
在500μl离心管中依次加入320μltris-hcl(100mmol/l,ph8.0)缓冲液、20μl葡萄糖溶液(0.754mmol/ml)和20μlnadp+(10mg/ml)溶液,混合均匀后,加入待测溶液5μl,室温反应4min后,立即投入沸水中加热煮沸30s,立即冷却,平衡至室温。
(4)hplc检测酶促反应产物nadph
将酶促反应后的样品用0.45μm滤膜过滤后,采用hplc测定nadph的含量,色谱图见图2。
hplc检测条件:
色谱柱:welch-c30(4.6*250mm);
波长:340nm;
柱温:28℃;
流速:1.0ml/min;
运行时间:15min;
洗脱条件:乙酸钠溶液(ph=5.5):纯甲醇=90:10
(5)葡萄糖脱氢酶酶活力计算
根据样品反应过程中产生的nadph的含量,计算出相应待测液的酶活。酶活计算公式为:
式中:a:待测液峰面积;k:标准曲线的斜率;c:标准曲线的截距;n:酶的稀释倍数;m:称取的待测酶粉重量;u固体:固体样品的酶活;u液体:液体样品的酶活;t:室温反应时间,4min;v总体积:反应总体积;v样品体积:样品反应体积。酶活测定结果见表1。
表1hplc法酶活测定结果
实施例2hplc检测方法的耐用性考察
hplc正常条件:
色谱柱:welch-c30(4.6*250mm);波长:340nm;
柱温:28℃;流速:1.0ml/min;运行时间:15min;
洗脱条件:乙酸钠溶液(ph=5.5):纯甲醇=90:10。
样品信息:gdh-bo009。
在适当改变柱温、流速、检测波长、乙酸钠溶液浓度、流动相比例、乙酸钠溶液ph的情况下,评价单因素色谱条件的改变对检测结果的影响,每个条件下nadph标品溶液、酶与底物的反应液、空白溶液各进1针,记录色谱图,报告主峰面积,并计算酶活。
酶活检测结果见表2。
表2hplc方法耐用性考察结果
结果表明,在保证其他色谱条件相同的情况下,改变以上一种色谱条件后,酶活测定值与正常条件偏差小于5%。即该hplc方法在柱温28±5℃、流动相流速为1.0±0.2ml/min、乙酸钠溶液浓度为86±43mm、检测波长为340±10nm、ph为5.5±0.5范围内是耐用的。
在以下对比例实验中,发明人简要描述了葡萄糖脱氢酶酶活力测定方法开发过程中的部分对比实验数据。
对比例1uv法检测nadph
发明人采用与实施例1中相同的样品预处理和葡萄糖脱氢酶酶促反应操作步骤,不同之处在于采用uv方法对酶促反应后的样品中的nadph的含量进行测定:
用1cm比色皿,在波长340nm处,以不加酶液的反应液作参比,空白调零后,加入0.05ml待测样品液并迅速计时,反应4min后,记录最终吸光度值a。
以nadph的吸光度(abs)为横坐标,nadph的浓度(μmol/ml)为纵坐标,制作标准曲线,见图3。将待测液反应后的峰面积代入标准曲线,即可求得反应过程中产生的nadph的含量,从而计算出相应待测液的酶活。酶活测定公式为:
式中:a:待测液吸光度;k:标准曲线的斜率;c:标准曲线的截距;n:酶的稀释倍数;m:称取的待测酶粉重量;u固体:固体样品的酶活;u液体:液体样品的酶活;t:室温反应时间,4min;v总体积:反应总体积;v样品体积:样品反应体积。酶活测定结果见表3。
表3uv法酶活测定结果
对比例2采用hplc检测nadph(c18柱)
发明人采用与实施例1中相同的样品预处理和酶促反应操作步骤,然后采用hplc方法对样品中nadph含量进行测定,不同之处在于使用的是两种c18色谱柱(agilent-sbc18,waters-xbc18)。采用c30柱和两种c18柱检测nadph的对比色谱图见图4。产物nadph在不同色谱柱中的保留时间与空白溶剂分离度见表4。
表4nadph在不同色谱柱中的保留时间与空白溶剂分离度
在其余色谱条件相同的情况下,就分离度与保留时间而言,welch-xbc30的分离效果明显好于其余两款色谱柱。在welch-xbc30的分离下,产物峰nadph不仅与溶剂峰有较好的分离度,还有较强的保留。
结论:与uv法相比,采用hplc测定产物不受不溶性颗粒及有关色素的影响,适用范围广;与hplc(c18柱)测定nadph含量相比,hplc(c30柱)对产物nadph峰的分析具有更好的保留值和分离度。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!