利用超高效液相色谱-质谱联用检测白芍饮片中黄曲霉毒素G2,G1,B2,B1的方法与流程
本发明属于化学分析及检测领域,具体涉及一种利用超高效液相色谱-质谱联用技术检测白芍饮片中黄曲霉毒素g2,g1,b2,b1的方法。
背景技术:
黄曲霉毒素是真菌产生的有毒次生代谢产物,种类繁多,广泛污染农作物、食品及饲料等,严重威胁着人类健康,是一类毒性极强的剧毒物质,主要包括黄曲霉毒素b1、黄曲霉毒素b2、黄曲霉毒素g1和黄曲霉毒素g2,其中以黄曲霉毒素b1的毒性最强。1993年,黄曲霉毒素被世界卫生组织(who)的癌症研究机构划定为1类致癌物。黄曲霉毒素的危害性在于对人及动物肝脏组织有破坏作用,严重时可导致肝癌甚至死亡。
中药及其相关产品在生产、加工、运输、贮存过程中,很容易发生霉变而污染各种真菌,产生对人体有害的真菌毒素,中药真菌毒素污染问题也引起了业内人士的重视。为加强中药材的质量控制,国家食品药品监督管理局增加了中药材的安全性指标控制项目,尤其是加强对中药材中重金属及有害元素、黄曲霉毒素、农药残留量的控制。《中国药典》对部分中药材的规定限度为黄曲霉毒素b1不得过5μg/kg;黄曲霉毒素b1、黄曲霉毒素g2、黄曲霉毒素g1、黄曲霉毒素b2总量不得过10μg/kg;但对白芍饮片并未提及是否需要测试黄曲霉毒素。
无论从保障白芍饮片产品的安全性方面,还是从中药材的质量控制日益严格的趋势方面,均有必要建立一个针对白芍饮片中黄曲霉毒素进行检测的方法,以进一步完善白芍饮片产品的质量管理规范。
技术实现要素:
本发明所要解决的问题在于,为白芍饮片提供一种同时检测黄曲霉毒素g2,g1,b2,b1的检测方法,该方法具有线性拟合度高、灵敏度高、准确度和精密度高的优点。
为解决上述技术问题,本发明提供的技术方案为:
一种利用超高效液相色谱-质谱联用技术检测白芍中黄曲霉毒素g2,g1,b2,b1的方法,包括下列步骤:
(1)供试品溶液的制备:取白芍饮片粉碎后的粉末适量,经提取、免疫亲合柱洗脱纯化、稀释并定容,得供试品溶液;以粉末质量计,所述供试品溶液浓度为0.01~1g/ml;
混合对照品储备溶液的制备:分别取黄曲霉毒素g2、g1、b2、b1四种对照品适量,配置成含有黄曲霉毒素g2、g1、b2、b1的混合照品储备溶液;所述混合对照品储备溶液中,黄曲霉毒素g2、g1、b2、b1的浓度分别独立的为0.01~10μg/ml;
基质标准曲线溶液的制备:取适量白芍饮片粉碎后的粉末至少五份,按一定梯度分别加入不同体积的混合对照品储备溶液,然后按照所述供试品溶液的制备相同的方法,配制得到具有一定浓度梯度的至少五个基质标准曲线溶液;
(2)上机分析,按以下色谱条件和质谱条件进行检测;
色谱条件为:色谱柱为poroshell120ecc181.9μm2.1×100mm;流动相包括流动相a和流动相b;流动相a为体积比1:(0.9~1.1)的乙腈-甲醇的混合溶液;流动相b为0.005~0.02mol/l乙酸铵水溶液;采用梯度洗脱:流动相a+流动相b=100%;0-4.0min,流动相a保持体积百分比为40%;4.0-4.1min,流动相a体积百分比由40%递增至90%;4.1-7.0min,流动相a保持体积百分比为90%;
质谱条件:采用质谱检测器,esi离子源,正离子模式,进行多反应监测,选择黄曲霉毒素g2:m/z331.1--313.1;黄曲霉毒素g1:m/z329.1--243.1;黄曲霉毒素b2:m/z315.1--259.1;黄曲霉毒素b1:m/z313.1--241.1作为检测离子对;
(3)数据分析
将所述至少五个基质标准曲线溶液以及供试品溶液按所述色谱条件和质谱条件依次进样,记录图谱数据;根据至少五个基质标准曲线溶液的峰响应强度数据和浓度数据分别绘制出黄曲霉毒素g2、g1、b2、b1的基质标准曲线;根据基质标准曲线分别代入供试品溶液的峰响应强度数据分别计算并得出供试品溶液中黄曲霉毒素g2、g1、b2、b1的浓度。
具体的,色谱条件中,流速为0.2~0.4ml/min;柱温为35~45℃;进样量为0.1~5μl。
优选的,色谱条件为:流速为0.3ml/min;柱温为40℃;进样量为2μl。
优选的,流动相a为体积比1:1的乙腈-甲醇的混合溶液;流动相b为0.01mol/l乙酸铵水溶液。
具体的,所述质谱条件还包括:干燥气温度:325℃、干燥气流量10l/min、喷雾压力:50psi、鞘气温度:350℃、鞘气流速:11l/min、毛细管电压:4000v、喷嘴电压:500v。
具体的,所述基质标准曲线溶液中,黄曲霉毒素g2浓度梯度范围为:0~1.344ng/ml;黄曲霉毒素g1浓度梯度范围为:0~3.5712ng/ml;黄曲霉毒素b2浓度梯度范围为:0~1.152ng/ml;黄曲霉毒素b1浓度梯度范围为:0~3.5712ng/ml。上述基质标准曲线溶液可用于黄曲霉毒素g2、g1、b2、b1的标准曲线绘制和线性检测。
具体的,所述基质标准曲线溶液配制五份,配制时分别添加0.1,0.2,0.4,0.6,0.8ml的对照品储备溶液。
具体的,所述基质标准曲线溶液中,黄曲霉毒素g2浓度梯度范围为:0~1.344ng/ml;黄曲霉毒素g1浓度梯度范围为:0~3.5712ng/ml;黄曲霉毒素b2浓度梯度范围为:0~1.152ng/ml;黄曲霉毒素b1浓度梯度范围为:0~3.5712ng/ml。
具体的,用于重复性检测时,在步骤(1)中,白芍饮片重复性溶液浓度为:0.2g/ml。
具体的,用于定量限检测时,在步骤(1)中配制,白芍饮片中黄曲霉毒素g2定量限溶液浓度为:0.168ng/ml;黄曲霉毒素g1定量限溶液浓度为:0.1116ng/ml;黄曲霉毒素b2定量限溶液浓度为:0.036ng/ml;黄曲霉毒素b1定量限溶液浓度为:0.1116ng/ml。
具体的,供试品溶液的制备方法:取白芍饮片粉碎后的粉末适量,按粉末质量计,将粉末与0.5~1.5倍质量的氯化钠、10~20倍体积的70%甲醇溶液混合;搅拌,离心,取2~4倍体积的上清液,用水稀释至6~12倍体积,然后用微孔滤膜过滤;取3~5倍体积滤液采用免疫亲合柱依次用水和甲醇洗脱,收集甲醇洗脱液,用甲醇定容,得供试品溶液。
在一种具体的实施方式中,所述步骤(1)中,供试品溶液的制备:取白芍饮片粉碎后过二号筛的粉末5~6g,精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml混合;搅拌2分钟,离心5分钟,精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过;精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
具体的,混合对照品储备溶液的制备方法:分别取黄曲霉毒素g2、g1、b2、b1四种对照品适量,混合,或取黄曲霉毒素g2、g1、b2、b1混合对照品适量,用甲醇稀释,定容,得混合对照品储备溶液。
在一种具体的实施方式中,所述步骤(1)中,对照品储备溶液的制备:精密移取黄曲霉毒素g2,g1,b2,b1混合对照品溶液1.2ml置10ml容量瓶中,加甲醇稀释置刻度,混匀,作对照品储备溶液;所述混合对照品溶液中,黄曲霉毒素g2浓度为0.35μg/ml,黄曲霉毒素g1浓度为0.93μg/ml,黄曲霉毒素b2浓度为0.30μg/ml,黄曲霉毒素g1浓度为0.93μg/ml)。
具体的,基质标准曲线溶液的制备方法:按照供试品溶液的制备相同的步骤配制至少五份溶液,但所述至少五份溶液的配制过程中,在将粉末与氯化钠、70%甲醇溶液混合时,分别添加呈一定梯度的不同体积的混合对照品储备溶液进行混合,得到含黄曲霉毒素g2、g1、b2、b1四种对照品均呈一定浓度梯度的至少五份基质标准曲线溶液。
在一种具体的实施方式中,所述步骤(1)中,基质标准曲线溶液的制备:供试品溶液的制备:取白芍饮片粉碎后过二号筛的粉末5~6g,精密称定五份,分别置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml混合,同时分别添加0.1,0.2,0.4,0.6,0.8ml的对照品储备溶液;搅拌2分钟,离心5分钟,精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过;精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
在步骤(2)中,以基质标准曲线溶液中黄曲霉毒素g2,g1,b2,b1的浓度为横坐标,以相应的响应值为纵坐标,分别绘制黄曲霉毒素g2,g1,b2,b1的标准曲线进行定量。
本发明提供的检测白芍中黄曲霉毒素g2,g1,b2,b1的方法具有下列优点:(1)定性精准(2)灵敏度高(3)精密度高(4)线性拟合度高,适合于白芍饮片中黄曲霉毒素g2,g1,b2,b1的分析检测。
本发明的方法经一次进样可同时检测白芍中黄曲霉毒素g2,g1,b2,b1,定量限低,检测灵敏度高。
本发明的方法检测白芍中黄曲霉毒素g2,g1,b2,b1的线性关系好,相关系数r2均大于0.99,定量检测的准确度更高。
附图说明
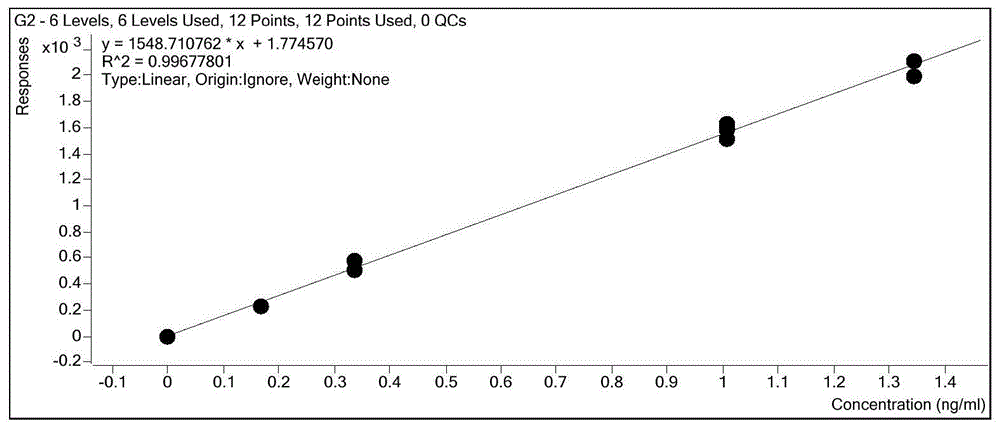
图1为本发明方法实施例1的黄曲霉毒素g2线性方程标准曲线。
图2为本发明方法实施例1的黄曲霉毒素g1线性方程标准曲线。
图3为本发明方法实施例1的黄曲霉毒素b2线性方程标准曲线。
图4为本发明方法实施例1的黄曲霉毒素b1线性方程标准曲线。
图5为本发明方法实施例2的重复性代表质谱图。
图6为本发明方法实施例3的黄曲霉毒素g2定量限质谱图。
图7为本发明方法实施例3的黄曲霉毒素g1,b2,b1定量限质谱图。
具体实施方式
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
色谱条件:agilent1290-6460;色谱柱:poroshell120ecc181.9μm2.1×100mm,s.n:usjsb01053;以乙腈:甲醇(1:1)为流动相a,以0.01mol/l乙酸铵水溶液为流动相b进行梯度洗脱,0~4~4.1~7min:40%~40%~90%~90%a;流速:0.3ml/min;柱温:40℃;进样量:2μl;采用质谱检测器,电喷雾模式(esi),正离子模式;干燥气温度:325℃、干燥气流量10l/min、喷雾压力:50psi、鞘气温度:350℃、鞘气流速:11l/min、毛细管电压:4000v、喷嘴电压:500v;进行多反应监测,选择各离子对及相关参数见下表:
供试品溶液的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml,高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
对照品储备溶液的制备:精密移取黄曲霉毒素g2,g1,b2,b1混合对照品(来源:中检院,批号:610001-201804,标示浓度:黄曲霉毒素g2:0.35μg/ml;黄曲霉毒素g1:0.93μg/ml;黄曲霉毒素b2:0.30μg/ml;黄曲霉毒素g1:0.93μg/ml)1.2ml置10ml容量瓶中,加甲醇稀释置刻度,混匀,作对照品储备溶液;
基质标曲的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml(分别加入对照品储备液0,0.1,0.2,0.4,0.6,0.8ml),高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
检测结果:取样量、响应值及相关结果见下表
表1:基质曲线
本发明的方法同时检测白芍中黄曲霉毒素g2,g1,b2,b1,四种物质的标准曲线的线性关系均良好,相关系数r2高,定量检测的准确度高。
实施例2:
色谱条件:agilent1290-6460;色谱柱:poroshell120ecc181.9μm2.1×100mm,s.n:usjsb01053;以乙腈:甲醇(1:1)为流动相a,以0.01mol/l乙酸铵水溶液为流动相b进行梯度洗脱,0~4~4.1~7min:40%~40%~90%~90%a;流速:0.3ml/min;柱温:40℃;进样量:2μl;采用质谱检测器,电喷雾模式(esi),正离子模式;干燥气温度:325℃、干燥气流量10l/min、喷雾压力:50psi、鞘气温度:350℃、鞘气流速:11l/min、毛细管电压:4000v、喷嘴电压:500v;进行多反应监测,选择各离子对及相关参数见下表:
供试品溶液的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml,高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
对照品储备溶液的制备:精密移取黄曲霉毒素g2,g1,b2,b1混合对照品(来源:中检院,批号:610001-201804,标示浓度:黄曲霉毒素g2:0.35μg/ml;黄曲霉毒素g1:0.93μg/ml;黄曲霉毒素b2:0.30μg/ml;黄曲霉毒素g1:0.93μg/ml)1.2ml置10ml容量瓶中,加甲醇稀释置刻度,混匀,作对照品储备溶液;
基质标曲的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml(分别加入对照品储备液0,0.1,0.2,0.4,0.6,0.8ml),高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
检测结果:取样量、响应值及相关结果见下表
表2:准确度和精密度
本发明的方法同时检测白芍中黄曲霉毒素g2,g1,b2,b1,四种物质的准确度与精密度良好,定量检测的准确度高。
实施例3,对白芍饮片未知样品进行黄曲霉毒素g2,g1,b2,b1的定量测定
色谱条件:agilent1290-6460;色谱柱:poroshell120ecc181.9μm2.1×100mm,s.n:usjsb01053;以乙腈:甲醇(1:1)为流动相a,以0.01mol/l乙酸铵水溶液为流动相b进行梯度洗脱,0~4~4.1~7min:40%~40%~90%~90%a;流速:0.3ml/min;柱温:40℃;进样量:2μl;采用质谱检测器,电喷雾模式(esi),正离子模式;干燥气温度:325℃、干燥气流量10l/min、喷雾压力:50psi、鞘气温度:350℃、鞘气流速:11l/min、毛细管电压:4000v、喷嘴电压:500v;进行多反应监测,选择各离子对及相关参数见下表:
供试品溶液的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml,高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
对照品储备溶液的制备:精密移取黄曲霉毒素g2,g1,b2,b1混合对照品(来源:中检院,批号:610001-201804,标示浓度:黄曲霉毒素g2:0.35μg/ml;黄曲霉毒素g1:0.93μg/ml;黄曲霉毒素b2:0.30μg/ml;黄曲霉毒素g1:0.93μg/ml)1.2ml置10ml容量瓶中,加甲醇稀释置刻度,混匀,作对照品储备溶液;
基质标曲的制备:取白芍饮片粉末约5g(过二号筛),精密称定,置于均质瓶中,加入氯化钠5~6g,精密加入70%甲醇溶液75ml(分别加入对照品储备液0,0.1,0.2,0.4,0.6,0.8ml),高速搅拌2分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度3900转/分钟),精密量取上清液15ml,置50ml量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,精密量取续滤液20.0ml,通过免疫亲合柱,流速每分钟3ml,用水20ml洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml量瓶中,并用甲醇稀释至刻度,摇匀,即得。
检测结果:取样量、响应值及相关结果见下表
表4:测定结果
该批次白芍饮片样品中黄曲霉毒素b1含量为:1.23μg/kg;四种黄曲霉总量为:1.23μg/kg。
本发明的方法同时检测白芍中黄曲霉毒素g2,g1,b2,b1,四种物质测试平行性良好,定量检测的准确度高。
综上所述,上述实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!