评估CAR功能性的方法与流程
评估car功能性的方法
技术领域
1.本发明涉及免疫学、细胞生物学和分子生物学领域。在某些方面,本发明的领域涉及免疫疗法。更具体地,本发明涉及用于确定嵌合抗原受体(car)特征例如特异性、功能性和灵敏性的方法。
背景技术:
2.多年来,癌症治疗的基础是手术、化学疗法和放射疗法。但是,在过去的几年中,免疫疗法已成为癌症治疗的有效工具。
3.基因工程的进步导致了合成的肿瘤靶向受体(称为嵌合抗原受体(car))的设计,该受体可以被引入到人免疫细胞(例如t细胞)中,以重定向抗原特异性并增强效应免疫细胞的功能。car最早是在1980年代中期开发的,此后人们对这些受体的兴趣不断增长。它们首先被产生以通过独立于hla
‑
肽复合物提供特异性抗原识别而绕过表达t细胞的固有的tcr特异性。eshhar及其同事在1993年的一项研究中首次描述了原型单链car,其中t细胞的特异性活化和靶向分别是通过由靶抗原特异性抗体结构域和fcε受体或t细胞受体cd3复合物的γ或ζ信号传导亚基组成的分子介导的(eshhar等人,1993,proc natl acad sci.,90,720
‑
4)。从那时起,许多研究小组设计出了具有单一肿瘤定向特异性和增强的信号传导胞内结构域的car分子。如今,car的结合结构域通常由单链抗体(scfv)的抗原结合结构域或选自文库并包含通过柔性接头连接的单克隆抗体(mab)的轻链和重链可变片段的抗体结合片段(fab)组成。scfv保留与衍生其的完整抗体相同的特异性和相似的亲和力,并且能够特异性结合至感兴趣的靶标。因此,car在单个融合分子中结合了抗原特异性和t细胞活化特性。实际上,scfv连接至包含cd3ζ的细胞内信号传导模块,以在抗原结合后诱导t细胞活化。模块结构已从仅具有cd3ζ信号传导结构域的第一代car扩展到将诸如cd28、4
‑
1bb或ox40的信号传导胞内结构域连接至cd3ζ的第二代和第三代car,以试图模拟共刺激。
4.car允许将t细胞以mhc非依赖性机制针对癌症进行靶向。car的配体结合与tcr对肽/mhc(pmhc)的结合在受体亲和力、抗原密度和空间特性上不同;并且设计针对特定靶分子的最佳car的实验方法依赖于体外或人肿瘤异种移植模型中转导的t细胞的功能测定。正如通过tcr/pmhc识别观察到的那样,由于car不太可能连续地与靶分子结合并聚集在有组织的突触中,因此可以认为,与tcr相比,car识别需要更高的配体密度。除了亲和力和特异性之外,这些受体的最佳构型和应用还依赖于构建体设计、信号传导结构域、载体递送系统、受体免疫细胞群和制造。
5.特别地,car有效性部分取决于car本身的亲和力,而另一部分则取决于胞外结构域(ectodomain)的组分。scfv中柔性接头序列的存在以及胞外结构域与胞内结构域之间的连接类型(铰链和跨膜区域)可以通过修饰(i)所得car的长度和柔性、(ii)其细胞表面密度、(iii)其通过振奋性信号转导自聚集并产生t细胞耗竭的趋势以及(iv)其与预期的靶抗原以外的分子的潜在结合来显著改变car功能。
6.因此,car特异性和功能可能受其结构(car长度和表位距离,间隔子,跨膜和胞内
结构域区域)及其灵敏性(抗体亲和力,抗原密度/亲和力,信号阈值)的影响。然而,存在旨在解决该问题的很少的有限研究和测定法,并且仍然没有证明最佳抗体或car构建体的选择,这通常导致对car功能的部分评估,而这些特性对于改善基于car的疗法是非常令人感兴趣的。
7.测试car识别靶细胞的能力和抗原特异性的方法是本领域已知的,例如通过测量细胞因子的释放(clay等人,j.immunol.,163:507
‑
513(1999))或通过测量细胞的细胞毒性(zhao等人,j.immunol.,174:4415
‑
4423(2005))。但是,这些方法可能很耗时且难以实施。因此,需要开发一种简单、快速且有效的方法来评估car表达细胞的功能性。
技术实现要素:
8.为了克服这个问题,发明人开发了一种用于评估car表达细胞功能性的方法。该方法基于胞啃作用(trogocytosis),其涉及抗原表达靶细胞和car表达细胞之间的膜转移。该测定允许以创新快速的方式评估car效应细胞活化,这取决于重组car结构的结构和灵敏性。
9.本发明涉及一种用于评估嵌合抗原受体(car)表达细胞的功能性的体外方法,其包括:
10.‑
用不同的标记物标记靶抗原表达细胞和car表达细胞,其中所述靶抗原表达细胞和所述car表达细胞是从同一细胞系制备的;
11.‑
共孵育标记的靶细胞和标记的car表达细胞,
12.‑
分析所述细胞以评估所述car表达细胞从所述靶抗原表达细胞的膜获取,所述膜获取指示所述car表达细胞对所述靶抗原的结合和/或活化能力,从而评估所述car表达细胞的功能性,
13.优选其中所述car表达细胞是免疫细胞。
14.优选地,共孵育进行至少1小时,优选1至5小时,甚至更优选1至3小时。特别地,以1:0.5至1:10的靶抗原表达细胞与car表达细胞的比例进行共孵育。
15.细胞分析通过细胞分选分析,优选流式细胞术分析进行。
16.优选地,用于评估嵌合抗原受体(car)表达细胞的功能性的体外方法还包括以下步骤:在共孵育标记的靶抗原细胞和标记的car表达细胞之前,将靶抗原表达细胞与识别与car衍生自的抗体相比相同或重叠的表位的抗体孵育。这样的抗体优选是单克隆抗体,优选包含car衍生自的单克隆抗体的cdr的单克隆抗体。
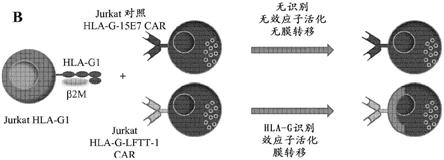
17.优选地,用于评估嵌合抗原受体(car)表达细胞的功能性的体外方法还包括测试不表达靶抗原的对照细胞。这样的方法可以进一步包括测试不识别靶抗原的对照car表达细胞。这样的方法还可以进一步包括功能性car表达细胞和/或car构建体的选择。
18.所述标记是膜标记物,优选亲脂性示踪剂或染料,甚至更优选选自mini26、pkh26
‑
pcl、pkh67、mini67、pkh67
‑
pcl、pkh26、pkh26
‑
pcl、vybrant cm
‑
dii、dii和dio。
19.优选地,细胞是免疫细胞,优选地选自t淋巴细胞、b淋巴细胞、自然杀伤细胞、自然杀伤t细胞、单核细胞和抗原呈递细胞。
20.本发明还涉及一种用于选择用于过继细胞疗法的功能性car表达细胞的体外方法,所述方法包括:
21.(i)用编码car的核酸序列转导免疫细胞群,优选其中所述免疫细胞群已从来自待治疗的受试者的生物样品中分离,
22.(ii)选择表达所述car的所述分离的细胞的亚群,和
23.(iii)通过根据前述权利要求中任一项所述的方法评估其功能,优选针对表达已针对其产生car的抗原的靶抗原表达细胞
24.(v)任选地从经历了从所述抗原表达细胞的膜获取的car表达细胞中选择功能性car表达细胞和/或car核酸构建体。
25.优选地,所述抗原是hla
‑
g,甚至更优选hla
‑
g1。
26.本发明还涉及包含通过本文公开的任何体外方法选择的功能性car构建体的细胞,优选免疫细胞。
27.附图简要说明
28.图1:使用pkh67染料将靶细胞、jurkat和hla
‑
g1/b2m表达细胞系的膜标记为绿色。使用pkh26染料将效应细胞、jurkat hla
‑
g
‑
15e7和hla
‑
lftt
‑
1car细胞的膜标记为红色。然后将细胞以1:1的比例共孵育,并在共孵育0、1和3小时后收集,然后通过流式细胞术进行分析。
29.图2:通过hla
‑
g car细胞(以红色标记)从肿瘤细胞(以绿色标记)的膜获取:(a)与hla
‑
g阴性肿瘤细胞共孵育后,未预期通过hla
‑
g car细胞的膜获取,而(b)与表达hla
‑
g1/b2m的肿瘤细胞共孵育后,只有抗hla
‑
g1/b2m car细胞应获取膜片。
30.图3:通过流式细胞术研究了通过hla
‑
g car细胞从jurkat或hla
‑
g1/b2m jurkat肿瘤细胞的膜获取。与jurkat或hla
‑
g1/b2m jurkat细胞共孵育1小时和3小时后,hla
‑
g
‑
15e7 car细胞(左图)未显示pkh67。hla
‑
g
‑
lftt
‑
1car细胞(右图)仅在与hla
‑
g1/b2m jurkat细胞共孵育后才在其表面上显示pkh67,其程度会随着时间的推移而增加。3个独立实验的代表。
31.图4:通过hla
‑
g
‑
15e7或hla
‑
g
‑
lftt
‑
1car细胞从jurkat或hla
‑
g1/b2m jurkat肿瘤细胞的膜获取的动力学(n=3)。
32.图5:通过将肿瘤细胞与lftt
‑
1单克隆抗体进行预孵育,防止通过hla
‑
g
‑
lftt
‑
1car细胞从hla
‑
g1/b2m jurkat肿瘤细胞的膜获取。
33.图6:(a)在抗hla
‑
g lftt
‑
1单克隆抗体的存在下评估hla
‑
g
‑
lftt
‑
1car特异性(3个独立实验的代表)。(b)hla
‑
g
‑
lftt
‑
1car特异性与用于其产生的单克隆抗体lftt
‑
1互补位相关(n=3)。
34.图7:(a)在抗hla
‑
g lftt
‑
1单克隆抗体的存在下评估jurkat、jurkat hla
‑
g1和hla
‑
g
‑
lftt
‑
1car细胞缀合物(4个独立实验的代表)。(b)通过lftt
‑
1单克隆抗体阻止jurkat hla
‑
g1和hla
‑
g
‑
lftt
‑
1car缀合物(n=4)。
35.图8:hla
‑
g阴性(红色的jurkat细胞)、hla
‑
g阳性(绿色的jurkat hla
‑
g1细胞)靶细胞和效应细胞(蓝色的hla
‑
g
‑
lftt
‑
1car细胞)之间的膜转移测定的示意图。
36.图9:(a)表达hla
‑
g肿瘤的jurkat细胞和hla
‑
g car效应细胞之间的膜获取的代表性图(b)通过hla
‑
g car效应子的膜获取仅从表达hla
‑
g的肿瘤细胞转移而不从周围的hla
‑
g阴性肿瘤细胞转移,表明hla
‑
g cr活化仅由表达hla
‑
g的肿瘤细胞驱动,而不由周围的hla
‑
g阴性肿瘤细胞驱动,
37.图10:通过效应car细胞从hla
‑
g1靶细胞的膜获取不取决于所用的膜染料。
38.图11:在hla
‑
g阴性、hla
‑
g阳性靶细胞和效应car细胞之间的差异膜转移测定的示意图。
39.发明详述
40.引言
41.发明人开发了一种用于确定car特性例如特异性、功能和灵敏性的新颖、创新、简便和快速的方法。该方法基于胞啃作用过程,该过程涉及抗原表达靶细胞和抗原特异性免疫细胞之间的膜转移。通过使用可以在实验室中轻松执行的步骤,该方法允许在不到一天的时间内确定这些特性。该方法的有效性和简便性的一个重要方面是使用同一细胞系用于制备car表达细胞和靶抗原表达细胞。
42.因此,本发明涉及用于评估嵌合抗原受体(car)表达细胞的功能性的体外方法,其包括用不同的标记物标记靶抗原表达细胞和car表达细胞,所述靶抗原表达细胞和car表达细胞属于同一细胞系;将标记的靶细胞和标记的car表达细胞共孵育并分析细胞,以评估通过car表达细胞从靶抗原表达细胞的膜获取,该膜获取指示了car表达细胞对靶抗原的结合和/或活化能力。
43.缩略语
[0044][0045]
定义
[0046]
为了促进对本发明的理解,下面定义了许多术语。
[0047]
如本文所用,术语“嵌合抗原受体”(car)、“工程改造的细胞受体”、“嵌合细胞受体”或“嵌合免疫受体”(icr)是指将抗原结合特异性嫁接到免疫细胞(例如t细胞或nk细胞)上的工程改造的受体,由此将抗原结合结构域的抗原结合特性与免疫细胞的免疫原性活性(例如t细胞的裂解能力和自我更新)结合在一起。特别地,car是指包含能够结合抗原的细胞外结构域、跨膜结构域、任选地铰链结构域和至少一个细胞内结构域的融合蛋白。术语“能够结合抗原的细胞外结构域”、“外部结构域”、“胞外结构域”和“抗原结合结构域”在本文中可互换使用,是指可以结合靶抗原的任何寡肽或多肽。特别地,本文所用的术语“抗原结合结构域”或“抗原特异性靶向结构域”是指靶向并结合特定抗原的car的区域。当car在宿主细胞中表达时,该结构域形成受体的细胞外结构域(胞外结构域)。car的抗原结合结构域通常来源于抗体,并且可以由单链抗体(scfv)或抗原结合片段(fab)的抗原结合结构域
组成。术语“细胞内结构域”、“内部结构域”、“胞质结构域”和“细胞内信号传导结构域”在本文中可互换使用,是指任何已知用作传递引起细胞中生物过程的活化或抑制的信号的结构域的寡肽或多肽。细胞内信号传导结构域可产生信号,该信号促进用包含car的核酸序列转导的细胞的免疫效应功能,例如细胞溶解活性和辅助活性,包括细胞因子的分泌。术语“跨膜结构域”是指任何已知跨细胞膜并可起到连接细胞外结构域和信号传导结构域的作用的寡肽或多肽。这可以是单个α螺旋、跨膜β桶、短杆菌肽a的β螺旋或任何其他结构。通常,跨膜结构域表示跨膜蛋白(也称为整合蛋白)的单个跨膜α螺旋。
[0048]
嵌合抗原受体可以任选地包含“铰链结构域”,其充当细胞外结构域和跨膜结构域之间的接头。如本文所用,术语“铰链”、“间隔子”或“接头”是指通常在多肽构建体的两个或更多个结构域之间编码的可变长度的氨基酸序列,以赋予例如柔性、改善的空间组织和/或邻近度。在scfv的上下文中使用的术语“接头”是指单独或组合使用以将可变的重链和可变的轻链区连接在一起的由氨基酸(例如甘氨酸和/或丝氨酸残基)组成的肽接头。嵌合抗原受体可以任选地包含信号肽。术语“信号肽”、“靶向信号”、“定位信号”、“转运肽”或“前导序列”是指存在于大多数新合成的旨在朝向分泌途径的蛋白质的n末端的短肽。信号肽的核心可能包含一长段疏水性氨基酸。信号肽可以从或可以不从成熟多肽上裂解下来。
[0049]
如本文所用,术语“抗体”是指单克隆抗体,多克隆抗体,多特异性抗体,人抗体,人源化抗体,骆驼抗体,嵌合抗体,单链可变片段(scfv),单链抗体,单结构域抗体,抗原结合片段(fab),f(ab')片段,二硫键连接的可变片段(sdfv),胞内抗体,纳米抗体和上述任何一种的表位结合片段。特别地,抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即包含抗原结合位点的分子。免疫球蛋白分子可以是任何类型(例如igg,ige,igm,igd,iga和igy)、类别(例如iggi,igg2,igg3,igg4,igai和iga2)或亚类。除非另有特别说明,否则术语“抗体”包括在基本上排除与其他分子的结合的情况下特异性结合感兴趣的抗原的完整的免疫球蛋白和“抗体片段”或“抗原结合片段”。术语“抗体”还包括基因工程改造的形式,例如嵌合抗体(例如人源化鼠抗体),异源缀合物抗体(例如双特异性抗体)。优选地,术语抗体是指单克隆抗体,甚至更优选地是指衍生自单克隆抗体的scfv。
[0050]
就结构而言,抗体可具有通过二硫键相互连接的重(h)链和轻(l)链。轻链有两种类型,即lambda(λ)和kappa(κ)。每条重链和轻链均包含恒定区和可变区(或“结构域”)。轻链和重链可变区包含被三个高变区(也称为“互补决定区”或“cdr”)打断的“框架”区。已经定义了框架区和cdr的范围(参见kabat等人,sequences of proteins of immunological interest,u.s.department of health and human services,1991,其通过引用并入本文)。框架区起到形成支架的作用,该支架通过链间非共价相互作用将cdr定位在正确的方向上。cdr主要负责与抗原表位的结合。每条链的cdr通常称为cdr1、cdr2和cdr3,其从n末端开始依次编号。根据本发明的抗体的vl和vh结构域可以包含四个框架区或“fr”,其在本领域中并且在本文中分别被称为“框架区1”或“fr1”;“框架区2”或“fr2”;“框架区3”或“fr3”;和“框架区4”或“fr4”。这些框架区被三个互补决定区或“cdr”打断,其在本领域中分别被称为“互补决定区1”或“cdr1”;“互补决定区2”或“cdr2”;和“互补决定区3”或“cdr3”。这些框架区和互补决定区优选按以下顺序可操作地连接:fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4(从氨基末端到羧基末端)。
[0051]
如本文所用,“抗体重链”是指存在于抗体构象中的两种类型的多肽链中的较大
者。
[0052]
如本文所用,“抗体轻链”是指存在于抗体构象中的两种类型的多肽链中的较小者,κ和λ轻链是指两种主要的抗体轻链同种型。
[0053]
术语“scfv”是指包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段的蛋白质,其中所述轻链可变区和重链可变区是连续连接的(例如,经由合成接头,例如短的柔性多肽接头),并且能够被表达为单链多肽,并且其中scfv保留了其衍生自的完整抗体的特异性。除非另有说明,否则如本文所用,scfv可具有任意顺序的vl和vh可变区,例如相对于多肽的n
‑
末端和c
‑
末端,scfv可包含vl
‑
接头
‑
vh或可包含vh
‑
接头
‑
vl。接头可包含框架序列的部分。
[0054]
如本文所用,术语“衍生自”或“来源于”是指具有衍生自亲本化合物或蛋白质的结构的结构的化合物或蛋白质,并且其结构与本文公开的那些充分相似并且基于该相似性而由本领域技术人员预期表现出与要求保护的化合物相同或相似的性质、活性和用途。例如,衍生自单克隆抗体的scfv是指与所述单克隆抗体具有相同特性的抗体片段,例如具有相同或相似的vh和vl或cdr和/或识别相同的表位。
[0055]
在细胞的上下文中,如本文所用,术语“衍生自”或“来源于”是指例如通过基因工程改造例如感染或转化从同一细胞系的细胞制备的一种或几种细胞。特别地,可以通过将编码待表达的抗原的核酸引入细胞系的细胞中来制备靶抗原表达细胞。类似地,可以通过将编码car的核酸引入细胞系的细胞中来制备表达car的细胞。
[0056]
如本文所用,术语“竞争性抗体”是指识别被另一种抗体识别的相同或重叠表位的抗体。当与car相关时,竞争性抗体可以是car所衍生自的抗体或抗体片段或识别与car识别的相同或重叠表位的任何抗体。
[0057]
如本文所用,术语“抗原”或“靶抗原”是指可以被特定体液或细胞免疫产物例如抗体分子、t细胞受体或car特异性结合的化合物、组合物或物质。很明显的是,本发明包括完整的抗原及其抗原片段。抗原可以合成产生或可以来源于生物学样品。这样的生物样品可以包括但不限于组织样品、肿瘤样品、细胞或生物流体。
[0058]
如本文所用,术语“hla
‑
g”和“人白细胞抗原g”是指与此名称相关的特定分子,包括但不限于其几种同种型中的任何一种,包括但不限于膜结合同种型(例如hla
‑
g1,hla
‑
g2,hla
‑
g3,hla
‑
g4),可溶性同种型(例如hla
‑
g5,hla
‑
g6,hla
‑
g7)和通过膜结合同种型的蛋白水解裂解而生成的可溶性形式(例如shla
‑
g1)。
[0059]
如本文所用,“结合”或“绑定”是指识别并接触抗原的肽、多肽、蛋白质、融合蛋白和抗体(包括抗体片段)。优选地,它是指抗原
‑
抗体类型的相互作用。“特异性结合”或“免疫特异性结合”是指抗体识别特定抗原,但基本上不识别或结合样品中的其他分子。在一些情况下,术语“特异性结合”或“特异性绑定”可用于指抗体、蛋白质或肽与第二化学物种的相互作用,以表示相互作用取决于特定结构(例如,抗原决定簇或表位)的存在。如本文所用,术语“特异性结合”是指具有至少10
‑6m的结合亲和力的抗体与抗原之间的接触。
[0060]
抗体的亲和力可以是其在单个抗原
‑
抗体位点上与特定抗原的结合的度量,并且实质上是抗体的抗原结合位点与特定表位之间的相互作用中存在的所有吸引力和排斥力的总和。抗体对特定抗原的亲和力可以通过平衡常数k表示,该常数由方程k=[ag ab]/[ag][ab]定义,其是抗体结合位点的亲和力,其中[ag]是游离抗原的浓度,[ab]是游离抗体
的浓度,[ag ab]是抗原
‑
抗体复合物的浓度。当抗原和抗体在一起强烈反应时,几乎没有游离抗原或游离抗体,因此抗体的平衡常数或亲和力将很高。特别地,高亲和力是至少10
‑6m的结合亲和力。结合亲和力可以通过本领域技术人员可用的任何方法特别是通过表面等离子体共振(spr)来测量。
[0061]
如本文所用,“刺激性配体”是指当存在于抗原呈递细胞(例如,apc,树突状细胞,b细胞等)上时可以与t细胞上的同源结合伴侣(在本文中称为“刺激分子”)特异性结合的配体,从而介导t细胞的初次反应,包括但不限于活化、免疫反应的起始、增殖等。
[0062]
如本文所用,术语“共刺激配体”包括抗原呈递细胞(例如,apc,树突状细胞,b细胞等)上的特异性结合t细胞上的同源结合伴侣(在本文中称为“刺激分子”)的分子,从而提供信号,除了由例如tcr/cd3复合物与载有肽的mhc分子的结合提供的主要信号外,该信号介导t细胞反应,包括但不限于增殖、活化、分化等。
[0063]
如本文所用,“共刺激分子”是指由免疫细胞(例如,t细胞,nk细胞,b细胞)表达的分子,其提供一种或多种对于免疫细胞信号传导途径的至少一些方面以刺激方式调节免疫细胞的活化的胞质信号传导序列。一方面,信号是主要信号,其例如通过tcr/cd3复合物与载有肽的mhc分子的结合而起始并导致t细胞反应(包括但不限于,增殖,活化,分化等)的介导。以刺激方式起作用的主要胞质信号传导序列(也称为“主要信号传导结构域”)可以包含被称为免疫受体酪氨酸活化基序或itam的信号传导基序。特别地,该术语是指与抗原呈递细胞上存在的共刺激配体特异性结合的t细胞上的同源结合伴侣,从而介导t细胞的共刺激反应,例如但不限于增殖活化、分化等。
[0064]
如本文所用,“刺激分子”是指与存在于抗原呈递细胞上的同源刺激性配体特异性结合的t细胞上的分子。
[0065]
如本文所用,“共刺激信号”是指这样的信号,其与主要信号(例如tcr/cd3连接)组合地导致t细胞增殖活化、分化等,和/或关键分子的上调或下调。
[0066]
术语“刺激”或“刺激性”是指通过刺激分子(例如,tcr/cd3复合物)与其同源配体的结合诱导从而介导信号转导事件例如但不限于经由tcr/cd3复合物的信号转导的主要反应。刺激可以介导某些分子的改变的表达,例如tgf
‑
β的下调和/或细胞骨架结构的重组等。
[0067]
如本文所用,“免疫细胞”是指参与先天性和适应性免疫的细胞,例如白血球(白细胞),其来源于骨髓中产生的造血干细胞(hsc),淋巴细胞(t细胞,b细胞,自然杀伤(nk)细胞)和骨髓来源的细胞(嗜中性粒细胞,嗜酸性粒细胞,嗜碱性粒细胞,单核细胞,巨噬细胞,树突状细胞)。特别地,免疫细胞可以选自包含b细胞、t细胞特别是cd4
+
t细胞和cd8
+
t细胞、nk细胞、nkt细胞、apc细胞、树突状细胞和单核细胞的非穷举性列表。
[0068]
术语“car表达细胞”或“car细胞”是指经过基因工程改造以在其表面上产生car的细胞,特别是免疫细胞(例如t细胞)。car细胞通常被产生以靶向在癌细胞上表达的特定抗原。在通过car抗原结合识别肿瘤细胞后,car细胞被活化以杀死癌细胞。
[0069]
如本文所用,术语“靶抗原表达细胞”或“抗原表达细胞”是指在其表面上呈现感兴趣的抗原,特别是鉴定为例如在肿瘤细胞上表达的抗原的细胞,特别是免疫细胞(例如t细胞)。可以对这些细胞进行基因工程改造以产生抗原或可替代地在其表面上天然产生抗原。
[0070]
术语“对照细胞”是指可以用作对照的细胞,优选免疫细胞(例如t细胞),因为它们不表达car(以下称为“对照car细胞”)或感兴趣的抗原(以下称为“对照细胞”)。优选地,它
们属于与用于car表达细胞和/或靶抗原表达细胞的细胞系相同的细胞系或由该相同的细胞系制备/衍生。
[0071]
如本文所用,术语“细胞系”是指具有相同遗传特性的同质细胞群。
[0072]
术语“标记”或“标记物”是指细胞,特别是免疫细胞中的任何可检测的标记,包括放射性标记和非放射性标记。非放射性标记包括光学可检测的标记,例如荧光、发光或磷光染料标记或染料。标记包括直接可检测和间接可检测的标签。如本文所用,术语“荧光标记”是指通过标记的荧光发射例如通过荧光光谱法可检测的任何标记。标记或标记物是标记细胞膜的染料,例如脂质染料。
[0073]
术语“细胞分选”是指用于根据细胞的类型和/或特征分离细胞的方法。最通常地取决于细胞大小、形状(形态)和/或表面蛋白或标记物表达的差异分离细胞。该方法可以导致获得同质细胞群。细胞分选可以依赖于本领域技术人员已知的不同策略,例如单细胞分选、荧光细胞分选、磁性细胞分选或浮力活化细胞分选。优选地,该术语是指荧光活化细胞分选或facs,其利用流式细胞术来提供细胞内和细胞外特性(例如荧光标记的表达)的快速、客观和定量的测量以用于分选细胞群。
[0074]
如本文所用,术语“car表达细胞的功能性”是指细胞,优选免疫细胞(例如t细胞)履行其生物学功能的能力。当涉及car细胞时,功能性是指通过结合抗原(即已针对其生成car细胞的抗原)识别靶细胞的能力,以及car表达细胞的活化能力,(例如活化信号传导途径(其导致杀死表达抗原的靶细胞(例如通过溶细胞活性和辅助活性,包括细胞因子的分泌))的能力)。因此,如本文所用,术语“功能性car细胞”是指能够结合靶向抗原(其后可以有效地诱导信号传导途径的活化)的car表达细胞。
[0075]
如本文所用,术语“共孵育”是指孵育至少两种分子或细胞,优选免疫细胞的行为或过程。在本发明的上下文中,细胞的共孵育可以导致细胞,特别是两个或更多个细胞群(例如car细胞和抗原表达细胞以及任选地对照细胞)的接触。
[0076]
术语“转染”或“转化”或“转导”在本文可互换使用,并用于嵌合抗原受体细胞的产生,并且特别是指将外来的或外源的核苷酸序列引入细胞的过程。外源核酸可以稳定地或瞬时地引入宿主细胞中。“转染”或“转化”或“转导”的细胞是已经用外源核酸转染、转化或转导的细胞。在一些实施方案中,该转导通过载体,优选慢病毒载体进行。
[0077]
如本文所用,术语“过继细胞疗法”或“过继t细胞疗法”或“act”是指将细胞转移至患者体内,其中在转移至受试者中之前将细胞工程改造或以其他方式改变。act的一个示例是从受试者的血液或肿瘤中收获免疫细胞,例如t细胞。然后将这些免疫细胞离体刺激、培养并扩增。然后用允许细胞表达新分子(例如car)的一种或多种核酸构建体转导细胞,从而为工程改造的免疫细胞提供抵抗疾病(例如癌症)的新机制。在一些情况下,car包含特异性识别由肿瘤或癌症表达的抗原(例如hla
‑
g)的抗原结合结构域。act程序中使用的典型免疫细胞包括肿瘤浸润淋巴细胞(til)或t细胞。act中使用的免疫细胞可以来源于患者/受试者本身,或来源于通用供体。act也可以伴随着可以与输送回受试者中的重组细胞竞争的受试者自身的淋巴细胞的淋巴细胞删除的可选步骤。
[0078]
如本文所用,术语“受试者”、“宿主”、“个体”或“患者”是指人和兽医受试者,特别是动物,优选哺乳动物,甚至更优选人,包括成人和儿童。然而,术语“受试者”还涵盖非人动物,尤其是哺乳动物,例如狗、猫、马、牛、猪、羊和非人灵长类动物。
[0079]
术语“治疗”是指旨在改善患者健康状况的任何行为,例如治疗、阻止、预防和延迟疾病或疾病症状。它表示疾病的治愈性治疗和/或预防性治疗。治愈性治疗定义为导致治愈的治疗或减轻、改善和/或消除、减轻和/或稳定疾病或疾病症状或其直接或间接引起的痛苦的治疗。预防性治疗包括导致疾病的预防的治疗和减少和/或延迟疾病的进展和/或发病率或其发生的风险的治疗。在某些实施方案中,这样的术语是指疾病、病症、感染或与其相关的症状的改善或根除。在其他实施方案中,该术语是指使癌症的扩散或恶化最小化。根据本发明的治疗不一定意味着100%或完全治疗。而是,存在不同程度的治疗,其中本领域普通技术人员认为其具有潜在的益处或治疗效果。
[0080]
如本文所用,术语“核酸构建体”、“质粒”和“载体”是等同的,并且是指用于将过客核酸序列例如dna或rna转移到宿主细胞中的核酸分子。载体可包含复制起点、可选择的标记物和任选地用于插入序列或基因的合适位点。载体可以是自我复制的染色体外载体,或整合入宿主基因组的载体。它也可以包含表达元件包括例如启动子、正确的翻译起始序列例如核糖体结合位点和起始密码子、终止密码子和转录终止序列。核酸构建体还可包含其他调节区,例如增强子、沉默子和边界元件/绝缘子,以指导给定基因的转录水平。能够指导与其可操作地连接的基因和/或核酸序列的表达的载体在本文中也可以被称为“表达载体”。有几种常见类型的载体,包括核酸构建体、细菌病毒基因组、噬菌粒、病毒基因组、黏粒和人工染色体。核酸构建体可以是用于稳定或瞬时表达基因或序列的载体。核酸构建体可以包括复制起始(ori)核酸构建体。特别地,核酸构建体可以被设计用于在不同宿主之间的遗传转移,包括但不限于质粒、病毒、黏粒、噬菌体、bac、yac。优选地,核酸构建体编码car。
[0081]
用于评估car表达细胞的功能性的方法
[0082]
本发明涉及用于评估嵌合抗原受体(car)表达细胞的功能性的体外方法,其包括(i)用不同标记物标记靶抗原表达细胞和car表达细胞,其中靶抗原表达细胞和car表达细胞从同一细胞系制备(ii)将标记的靶细胞和标记的car表达细胞共孵育(iii)分析细胞,以评估通过car表达细胞从靶抗原表达细胞的膜获取的能力,膜获取指示car表达细胞与靶抗原的结合能力,从而评估car表达细胞的功能性,和(iv)任选地,选择功能性car表达细胞和/或功能性car构建体。这些步骤将在下文中更具体地描述。
[0083]
细胞
[0084]
根据本发明的细胞是真核细胞,例如哺乳动物细胞,并且通常是人、猫或犬细胞,更通常是人细胞,优选原代人细胞。甚至更优选地,细胞是免疫细胞。细胞可获自受试者或可商购获得的培养物。细胞可以是自体细胞、同基因细胞、同种异体细胞和甚至在一些情况下是异种细胞。
[0085]
在一个实施方案中,细胞可以选自t细胞,包括cd4
+
t细胞和cd8
+
t细胞,b细胞,nk细胞,nkt细胞,单核细胞,粒细胞,例如髓样细胞,巨噬细胞,嗜中性粒细胞,树突状细胞,肥大细胞,嗜酸性粒细胞,嗜碱性粒细胞和树突状细胞,优选地细胞是t淋巴细胞、b淋巴细胞、自然杀伤细胞、单核细胞和抗原呈递细胞,例如树突状细胞。在一些实施方案中,细胞包括t细胞或其他细胞类型的一个或多个子集,例如完整t细胞群、cd4+细胞、cd8+细胞及其亚群,例如由功能、活化状态、成熟度、分化、扩增、再循环、定位和/或持久能力的潜能、抗原特异性、抗原受体的类型、在特定器官或区室中的存在、标记物或细胞因子分泌概况和/或分化程度限定的那些。优选地,细胞是选自t淋巴细胞、b淋巴细胞、自然杀伤细胞、单核细胞和抗原呈
递细胞的免疫细胞。
[0086]
在某些实施方案中,免疫细胞是t细胞,例如动物t细胞,哺乳动物t细胞,特别是人t细胞。t细胞和/或cd4+和/或cd8+t细胞的亚型和亚群包括幼稚t(tn)细胞,效应t细胞(teff),记忆t细胞及其亚型,例如干细胞记忆t(tscm),中央记忆t(tcm),效应记忆t(tem)或终末分化的效应记忆t细胞,肿瘤浸润淋巴细胞(til),未成熟t细胞,成熟t细胞,辅助t细胞,细胞毒性t细胞,粘膜相关性不变t(mait)细胞,天然存在的和适应性调节性t(treg)细胞,辅助t细胞,例如th1细胞、th2细胞、th3细胞、th17细胞、th9细胞、th22细胞、卵泡辅助t细胞、α/βt细胞和δ/γt细胞。可商购获得的t细胞系的非限制性实例包括细胞系bcl2(aaa)jurkat(crl
‑
2902
tm
)、bcl2(s70a)jurkat(crl
‑
2900
tm
)、bcl2(s87a)jurkat(crl
‑
2901
tm
)、bcl2 jurkat(crl
‑
2899
tm
)、neo jurkat(crl
‑
2898
tm
)、tall
‑
104细胞毒性人t细胞系(atcc#crl
‑
11386)。其他实例包括但不限于成熟的t细胞系,例如诸如deglis、ebt
‑
8、hpb
‑
mlp
‑
w、hut 78、hut 102、karpas 384、ki 225、my
‑
la、se
‑
ax、skw
‑
3、smz
‑
1和t34;和未成熟的t细胞系,例如all
‑
sil、be13、ccrf
‑
cem、cml
‑
t1、dnd
‑
41、du.528、eu
‑
9、hd
‑
mar、hpb
‑
all、h
‑
sb2、ht
‑
1、jk
‑
t1、jurkat、karpas 45、ke
‑
37、kopt
‑
k1、k
‑
t1、l
‑
kaw、loucy、mat、molt
‑
1、molt 3、molt
‑
4、molt 13、molt
‑
16、mt
‑
1、mt
‑
all、p12/ichikawa、peer、per0117、per
‑
255、pf
‑
382、pfi
‑
285、rpmi
‑
8402、st
‑
4、sup
‑
t1至t14、tall
‑
1、tall
‑
101、tall
‑
103/2、tall
‑
104、tall
‑
105、tall
‑
106、tall
‑
107、tall
‑
197、tk
‑
6、tlbr
‑
1、
‑
2、
‑
3和
‑
4、ccrf
‑
hsb
‑
2(ccl
‑
120.1)、j.rt3
‑
t3.5(atcc tib
‑
153)、j45.01(atcc crl
‑
1990)、j.cam1.6(atcc crl
‑
2063)、rs4;11(atcc crl
‑
1873)、ccrf
‑
cem(atcc crm
‑
ccl
‑
119);和皮肤t细胞淋巴瘤细胞系,例如hut78(atcc crm
‑
tib
‑
161)、mj[g11](atcc crl
‑
8294)、hut102(atcc tib
‑
162)。
[0087]
例如,可用于本发明的合适的免疫细胞包括自体t淋巴细胞、同种异体t细胞、异种t细胞、前述任何一种的祖细胞、转化的肿瘤或异种免疫效应细胞、肿瘤浸润淋巴细胞(til)、细胞毒性淋巴细胞或活化时能够杀死靶细胞的其他细胞。
[0088]
在一些其他实施方案中,细胞是自然杀伤(nk)细胞,自然杀伤t(nkt)细胞,细胞因子诱导的杀伤(cik)细胞,肿瘤浸润淋巴细胞(til),淋巴因子活化的杀伤(lak)细胞等。nk细胞可以从商购可得的来源分离或获得。商业性nk细胞系的非限制性实例包括细胞系nk
‑
92(crl
‑
2407
tm
),nk
‑
92mi(crl
‑
2408
tm
)。其他实例包括但不限于nk细胞系hank1,khyg
‑
1,nkl,nk
‑
ys,noi
‑
90和yt。
[0089]
此类商购可得的细胞系的非限制性示例性来源还包括美国典型培养物保藏中心或atcc(http://www.atcc.org/)和德国微生物和细胞培养物保藏中心(https://www.dsmz.de/)。
[0090]
特别地,在根据本发明的方法中使用的细胞是:
[0091]
‑
在其表面表达感兴趣的抗原的靶抗原表达细胞,
[0092]
‑
表达car(优选已被产生以特异性结合感兴趣的抗原的car)的car表达细胞,
[0093]
‑
任选地,对照细胞不表达感兴趣的抗原或不表达被产生以结合该抗原的car或两者。
[0094]
特别地,从同一细胞系制备靶抗原表达细胞和car表达细胞。
[0095]
在一个实施方案中,该方法进一步包括不表达靶抗原的对照细胞。特别地,对照细胞是不表达由car表达细胞识别的感兴趣的抗原或表达不被car表达细胞识别的抗原的细胞。该对照细胞是阴性对照。
[0096]
在另一个实施方案中,该方法进一步包括不识别靶抗原的对照car细胞。特别地,对照car细胞是表达不识别靶抗原的car的细胞。该对照car细胞是阴性对照。
[0097]
特别地,对照细胞和/或对照car细胞是从与car表达细胞和靶抗原表达细胞相同的细胞系制备的。
[0098]
在一个实施方案中,由靶抗原表达细胞表达的抗原是hla
‑
g。“hla
‑
g”表示包括至少七种同种型的人白细胞抗原g。优选地,由靶抗原表达细胞表达的抗原是选自hla
‑
g1、hla
‑
g2、hla
‑
g3、hla
‑
g4、hla
‑
g5、hla
‑
g6和hla
‑
g7的hla
‑
g同种型。
[0099]
hla
‑
g的初级转录物是可变剪接的,导致表达7种同种型,其中4种是膜结合的(hla
‑
g1,hla
‑
g2,hla
‑
g3和hla
‑
g4),和3种是可溶的(hla
‑
g5,hla
‑
g6和hla
‑
g7)。hla
‑
g1和hla
‑
g5是最丰富的同种型,并且它们代表了经典的i类hla分子的典型结构:由非共价结合至β2
‑
微球蛋白(β2m)的三个球形结构域和肽构成的重链,而其他同种型较短,缺乏重链的一个或两个结构域,并且不应与β2m结合。hla
‑
g1同种型是具有与β2
‑
微球蛋白缔合的α1、α2和α3结构域的完整同种型。hla
‑
g2同种型没有α2结构域,而hla
‑
g3没有α2和α3结构域,以及hla
‑
g4没有α3结构域。同种型hla
‑
g2、hla
‑
g3和hla
‑
g4均不结合β2m。可溶性hla
‑
g5和hla
‑
g6同种型包含分别与hla
‑
g1和hla
‑
g2相同的额外球状结构域。hla
‑
g7同种型仅具有与内含子2编码的两个氨基酸相连的α1结构域。hla
‑
g5同种型与β2m结合,而同种型hla
‑
g6和hla
‑
g7不与β2m结合。
[0100]
在一个特定的实施方案中,由靶抗原表达细胞表达的感兴趣的抗原是无β2m的hla
‑
g同种型。
[0101]
在一个实施方案中,由car表达细胞表达的car是特异性结合一些hla
‑
g同种型(优选2至5种,更优选选自hla
‑
g1、hla
‑
g2、hla
‑
g5和hla
‑
g6)的car。优选地,由car表达细胞表达的car是特异性结合hla
‑
g1和hla
‑
g5或特异性结合hla
‑
g2和hla
‑
g6的car。可替代地,由car表达细胞表达的car是特异性结合hla
‑
g2和hla
‑
g6的car。任选地,由car表达细胞表达的car是特异性结合无β2m的hla
‑
g或与β2m缔合的hla
‑
g的car。
[0102]
细胞标记
[0103]
根据本发明的方法,靶抗原表达细胞和car表达细胞用不同的标记物标记。尽管在该方法中只能使用一种标记,但是将不同的标记用于靶抗原表达细胞和car表达细胞为该方法提供了更高的效率。
[0104]
然后,优选地,用可以与用于标记car表达细胞和/或对照car细胞的标记物区分开的标记物标记靶抗原表达细胞和/或对照细胞。
[0105]
根据本发明,标记物的量足以标记细胞以使其可检测和/或可追踪。这样的量对于本领域技术人员而言是已知的,并且取决于合适的检测系统的选择以及标记物的合适量的选择,这在本领域技术人员的技术范围内。
[0106]
优选地,标记是无毒的和/或非诱变的,并且可以在活细胞中被检测到。然而,本发明的优点在于,由于标记是在体外进行的,因此还可以使用诱变和/或轻微毒性的标记物。根据本发明可以使用的标记包括放射性标记和非放射性标记。非放射性标记包括可光学检
测的标记,例如诸如荧光、发光和磷光标记或染料,优选荧光标记。标记包括可直接检测和可间接检测的标记。在一个实施方案中,标记是荧光标记,优选地适合于流式细胞术分析的标记。
[0107]
特别地,本发明的标记是可以掺入细胞膜的膜标记物,例如脂质标记物或染料。被选择掺入细胞膜的优选荧光分子是mini26、pkh26
‑
pcl、pkh67、mini67、pkh67
‑
pcl、pkh26、pkh26
‑
pcl、vybrant cm
‑
dii、dii和dio。在一个实施方案中,用于标记细胞的标记物选自pkh67和pkh26。
[0108]
当使用对照细胞时,不表达靶抗原的对照细胞可以用与靶抗原表达细胞相同的标记物标记或用不同的标记物标记。类似地,当使用对照car细胞时,不识别靶抗原的对照car细胞可以用与car表达细胞相同的标记物标记或用不同的标记物标记。
[0109]
在一个实施方案中,用pkh67标记抗原表达细胞和/或对照细胞,并且用pkh26标记car表达细胞和/或对照car细胞,反之亦然。
[0110]
细胞的标记允许研究car表达细胞的功能性,并任选地允许分离功能性car表达细胞(例如,通过荧光活化细胞分选,facs)。
[0111]
可以使用本领域技术人员已知的任何方法来标记细胞,特别是可以使用本领域已知的任何方法来标记细胞膜。
[0112]
特别地,用不同的标记物标记靶抗原表达细胞和car表达细胞和/或对照细胞包括:
[0113]
a)提供细胞或细胞培养物,特别是靶抗原表达细胞培养物和/或car表达细胞培养物和/或对照细胞和/或对照car细胞,
[0114]
b)使培养物或细胞与标记,特别是膜标记物(优选选自mini26、pkh26
‑
pcl、pkh67、mini67、pkh67
‑
pcl、pkh26和pkh26
‑
pcl)接触,
[0115]
c)任选地,洗涤培养物以去除多余的标记,
[0116]
d)任选地,重复步骤b)和c),
[0117]
e)任选地进一步培养细胞或培养物,优选培养至少1天,至少2天,更优选至少4天,甚至更优选至少1周或至少2周
[0118]
g)任选地选择和/或收集标记的细胞。
[0119]
因此,在一些实施方案中,可以在共孵育之前将细胞群在培养组合物中孵育。
[0120]
共孵育
[0121]
标记后,将靶抗原表达细胞、car表达细胞以及任选地对照细胞共孵育。
[0122]
在一个实施方案中,将car表达细胞与抗原表达细胞和/或与对照细胞共孵育。当共孵育分别包含car表达细胞与抗原表达细胞或car表达细胞与对照细胞时,可以用相同的标记物标记对照细胞和抗原表达细胞。当共孵育包含car表达细胞与抗原表达细胞和对照细胞时,这三个群体中的每一个都用不同的标记物标记。
[0123]
在另一个实施方案中,将抗原表达细胞与car表达细胞和/或与对照car细胞共孵育。当共孵育分别包含抗原表达细胞与car表达细胞或抗原表达细胞与对照car细胞时,对照car细胞和car表达细胞可以用相同的标记物标记。当共孵育包含抗原表达细胞与car表达细胞和对照car细胞时,这三个群体中的每一个都用不同的标记物标记。
[0124]
当共孵育包含car表达细胞、对照car细胞、抗原表达细胞和对照细胞时,这四个群
体中的每一个都用不同的标记物标记。
[0125]
可以通过本领域技术人员已知的任何方法来孵育细胞,这取决于本发明的细胞所需的特定条件。条件可以包括以下一种或多种:特定的培养基、温度、氧含量、二氧化碳含量、时间、试剂、例如营养素、氨基酸、抗生素和/或离子。
[0126]
在一些实施方案中,孵育条件包括适合于人免疫细胞(例如t细胞)的生长的温度,例如至少约25℃,通常至少约30℃,并且通常在或约37℃。
[0127]
孵育可以在培养容器(例如单元、腔室、孔、柱、管、管组、阀、小瓶、培养皿、袋或用于培养物或培养细胞的其他容器)中进行。
[0128]
优选地,共孵育进行至少1小时,至少2小时,至少3小时,至少4小时或至少5小时,优选1
‑
5小时,甚至更优选1
‑
3小时。
[0129]
在一个实施方案中,以1:0.5至1:10的靶抗原表达细胞与car表达细胞的比例,优选以1:1至1:10的靶抗原表达细胞与car表达细胞的比例进行共孵育。优选地,孵育之前的细胞浓度为至少104个细胞/ml,至少105个细胞/ml或至少106个细胞/ml,优选至少106个细胞/ml,甚至更优选2x106个细胞/ml。
[0130]
在本发明的上下文中,细胞的共孵育导致细胞,特别是细胞(例如car
‑
细胞和抗原表达细胞)的两个或更多个群体在存在或不存在对照细胞和/或对照car细胞的情况下的接触。
[0131]
在一个特定方面,该方法进一步包括以下步骤:在共孵育靶抗原表达细胞和car表达细胞之前,将靶抗原表达细胞与抗体,优选识别与car衍生自的抗体相比相同或重叠的表位的抗体孵育。优选地,抗体是单克隆抗体,其包含car衍生自的单克隆抗体的cdr中的至少一个,优选car衍生自的单克隆抗体的2、3、4、5或6个cdr。该特定方面允许测试car特异性,即,cat活化是否通过car表达细胞的car对靶抗原细胞的抗原的结合来进行。实际上,如果在抗体存在的情况下抑制或降低了car活化(以及随后膜转移),那么可以得出结论,即该作用是特异的car对抗原的作用以及car表达细胞对靶抗原具有特异性。可以通过进行相同的测试但使用不能结合抗原的抗体来添加阴性对照。
[0132]
膜获取分析和细胞分选
[0133]
胞啃作用涉及质膜和锚定蛋白从apc或肿瘤细胞转移到效应免疫细胞(例如car表达细胞)。胞啃作用依赖于细胞间接触。实际上,胞啃作用是一个活跃的过程,其广泛反映了效应细胞的抗原特异性活化。在此缀合过程中,膜转移取决于获取细胞的活化状态:胞啃作用需要在带有它们特异性识别的抗原的细胞的存在下的car表达细胞活化。因此,胞啃作用的程度与功能性免疫细胞(例如b、αβt、γδt和nk效应细胞)的活化有关,由t和b细胞上的抗原受体信号传导、nk细胞上的杀伤抑制和杀伤活化受体触发。但是,膜转移不仅与活化状态有关,而且与功能有关,因为进行胞啃作用的t细胞还在其表面暴露了其细胞毒性功能的标志物:cd107a。因此,一种基于胞啃作用的方法可以使膜转移成为研究效应细胞的特异性和功能的一种创新且快捷的方法,特别是应用于car表达细胞时。
[0134]
根据本发明的方法包括分析细胞以评估通过car表达细胞从靶抗原表达细胞的膜获取的步骤,该膜获取指示car表达细胞与靶抗原的结合和/或活化能力,从而评估car表达细胞的功能性。
[0135]
得益于已通过本领域技术人员已知的任何方法(根据用于细胞标记的标记物)预
macsquant
tm
等。
[0142]
在一个实施方案中,根据pkh67和pkh26标记的使用,通过流式细胞术分析来监测膜转移。
[0143]
在其中用pkh67标记抗原表达细胞并且用pkh26标记car表达细胞(或反之亦然)的实施方案中,通过facs进行膜转移分析。在该实施方案中,预期发生膜转移,使得可以将细胞分为至少三类:(i)仅表达pkh67的细胞,(ii)仅表达pkh26的细胞,(iii)表达pkh67和pkh26的细胞,以及(iv)最终既不表达pkh26也不表达pkh67的细胞。因此,可以建立同时表达pkh26和pkh67标记的细胞的百分比,以监测从抗原表达细胞有效获取细胞膜的car表达细胞的百分比,从而监测抗原
‑
car相互作用和car表达细胞的功能性。
[0144]
在其中方法进一步包括对照细胞或对照car细胞的实施方案中,可以通过流式细胞术经由标记物pkh67、pkh26、dii、vybrant cm
‑
dii、dio或其他亲脂性染料或可商购获得的亲脂性染料来分选对照细胞或对照car细胞。
[0145]
特别地,在包括对照细胞的实施方案中,其中对照细胞用pkh67标记,和car表达细胞用pkh26标记,或反之亦然,通过facs进行膜转移分析。在该实施方案中,预期不会发生膜转移,使得可以将细胞分为至少两类:(i)仅表达pkh67的细胞,(ii)仅表达pkh26的细胞,(iii)最终既不表达pkh26也不表达pkh67的细胞。
[0146]
在包含对照car细胞的实施方案中,其中对照car细胞用pkh67标记,和抗原表达细胞用pkh26标记,或反之亦然,通过facs进行膜转移分析。在该实施方案中,预期不会发生膜转移,使得可以将细胞分为至少两类:(i)仅表达pkh67的细胞,(ii)仅表达pkh26的细胞,(iii)最终既不表达pkh26也不表达pkh67的细胞。
[0147]
在一个特定的实施方案中,该方法进一步包括选择功能性car表达细胞和/或功能性car构建体。实际上,这种方法允许选择表达经测试对感兴趣的抗原具有功能性的特定car构建体的细胞。通过数据分析,例如发生膜转移的百分比的分析,该方法允许选择针对感兴趣的抗原的最合适的car表达细胞和/或car构建体。因此,该方法还允许选择已知影响car表达细胞功能性的最合适的car组分(例如跨膜结构域,铰链,细胞内结构域)。功能性car表达细胞和/或功能性car构建体的这种特定选择对于改善基于car的疗法具有重要意义。
[0148]
用于制备用于过继细胞疗法的功能性car表达细胞的方法
[0149]
将基因引入细胞并在细胞中表达基因的方法是本领域已知的。
[0150]
特别地,用于产生包含载体和/或外源核酸的细胞的方法是本领域众所周知的。参见,例如,sambrook等人(2001,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)。在表达载体的情况下,可以通过本领域的任何方法将载体容易地引入宿主细胞,例如哺乳动物、细菌、酵母或昆虫细胞。例如,表达载体可以通过物理、化学或生物学手段转移到宿主细胞中,这将在下文中更详细地描述。
[0151]
在一些实施方案中,如本文所述,所述方法包括从受试者分离细胞,制备、加工、培养和/或工程改造它们,并在冷冻保存之前或之后将它们重新引入同一患者。
[0152]
这里特别提供了产生car表达细胞的方法,所述方法包括以下步骤,或可替代地基本上由以下步骤组成,或者进一步由以下步骤组成:(i)用编码car的核酸序列转导分离的细胞的群体;和(ii)选择已成功用步骤(i)的所述核酸序列转导的所述分离的细胞的亚群,
从而产生car表达细胞。一方面,分离的细胞选自t细胞和nk细胞。
[0153]
这里甚至更特别地提供了一种产生car表达细胞的方法,所述方法包括以下步骤,或可替代地基本上由以下步骤组成,或者进一步由以下步骤组成:
[0154]
(i)用编码car的核酸序列转导免疫细胞群,优选其中所述免疫细胞群已从来自待治疗的受试者的生物样品中分离,
[0155]
(ii)选择表达所述car的所述分离的细胞的亚群,和
[0156]
(iii)通过根据前述权利要求中任一项所述的方法评估其功能,优选针对表达已针对其产生car的抗原的靶抗原表达细胞
[0157]
(v)任选地从经历了从所述抗原表达细胞的膜获取的car表达细胞中选择功能性car表达细胞和/或car核酸构建体。
[0158]
在一个特定的实施方案中,所述方法还包括在用编码car的核酸序列转导免疫细胞群之前:
[0159]
(i)提供免疫细胞群,优选来自待治疗受试者的生物样品(例如血细胞),
[0160]
(ii)分离特定的免疫细胞群(例如t细胞,b淋巴细胞,单核细胞和抗原呈递细胞和/或nk细胞)。
[0161]
在另一个实施方案中,该方法进一步包括从经历了从抗原表达细胞的膜获取的car表达细胞中选择car表达细胞和/或car构建体。随后,对应于经历了从抗原表达细胞的膜获取的car表达细胞的经转导的免疫细胞构建体可以被进一步重新引入或施用至受试者。该方法允许在将这样的工程改造的细胞引入有此需要的受试者之前,通过评估其功能性来选择最合适的car表达细胞以靶向感兴趣的抗原。
[0162]
为了促进施用,可以将根据本发明的转导的细胞与药学上可接受的承载体或稀释剂通过本领域已知的任何方法制成药物组合物或制成适于体内施用的植入物,以适合用于施用至受试者。
[0163]
一旦将从根据本发明的方法选择的表达car构建体的细胞施用至受试者,就可以通过许多已知方法中的任何一种来测量工程改造的细胞群和/或在一些方面抗体的生物学活性。在某些实施方案中,工程改造的细胞破坏靶细胞的能力可以使用本领域已知的任何合适方法来测量,例如在kochenderfer等人,j.immunotherapy,32(7):689
‑
702(2009),和herman等人,j.immunological methods,285(1):25
‑
40(2004)中描述的细胞毒性测定。在某些实施方案中,还可以通过测定某些细胞因子例如gm
‑
csf、il
‑
3、mip
‑
la、tnf
‑
a、il
‑
10、il
‑
13、ifn
‑
γ或il
‑
2的表达和/或分泌来测量细胞的生物学活性。
[0164]
在某些方面,通过评估临床结果(例如无进展生存或总体生存、肿瘤负荷或载荷的降低、肿瘤的稳定)来测量生物学活性。
实施例
[0165]
‑
结果
[0166]
通过car/hla
‑
g1相互作用进行膜获取
[0167]
先前已证明免疫细胞从靶细胞例如apc或肿瘤细胞抗原呈递细胞获取细胞表面膜片(caumartin等人,embo j,2007.26(5):p.1423
‑
33)。通过效应细胞从靶细胞进行膜获取(i)需要细胞间接触,(ii)是快速的,并且(iii)是依赖于获取细胞的活化状态的活跃过程,
其(iv)反映了效应细胞的抗原特异性活化。因此,膜转移与功能成熟的免疫细胞的活化有关。
[0168]
研究了在car接合后效应细胞是否可以被活化,并然后从靶细胞获取膜片。为了这个目的,使用jurkat t细胞系作为效应细胞以及靶细胞来建立实验,以避免除hla
‑
g/car相互作用之外的任何其他旁观者蛋白质
‑
蛋白质相互作用。这意味着细胞间接触只能由car
‑
抗原相互作用介导/驱动。
[0169]
如图1所示,使用pkh67荧光染料将jurkat靶细胞的膜标记为绿色,而使用pkh26荧光染料将jurkat效应子car细胞膜标记为红色。为了确定膜转移是否与car
‑
hla
‑
g相互作用有关,我们首先比较了表达hla
‑
g的靶细胞和car效应细胞之间膜转移的程度。为此,取决于它们与hla
‑
g1同种型的结合,产生了两种不同的hla
‑
g car构建体:基于lftt
‑
1抗体互补位的hla
‑
g car对与β2m缔合的hla
‑
g1同种型具有特异性,而基于15e7抗体互补位的“对照hla
‑
g car”仅对不与β2m缔合的hla
‑
g1同种型具有特异性。jurkat hla
‑
g1细胞系仅表达与β2m同种型缔合的hla
‑
g1,其仅被lftt
‑
1抗体而非15e7识别。如图2a所示,在靶细胞上不存在hla
‑
g表达的情况下,效应car细胞预期不会从靶细胞获取膜。然而,在图2b中,在存在表达hla
‑
g的靶细胞的情况下,表达特定hla
‑
g
‑
lftt
‑
1car的jurkat细胞应从hla
‑
g1/缔合β2m的靶细胞获取膜片,而表达对照hla
‑
g
‑
15e7 car的jurkat细胞不应如此。
[0170]
将靶细胞和效应细胞共孵育1至3小时,然后通过流式细胞术分析膜转移。如图3a和3b所示,在共孵育之前,car效应细胞没有从表达或不表达hla
‑
g的肿瘤靶细胞获取膜。共孵育1小时后,非特异于hla
‑
g1/β2m蛋白的car效应细胞既未从转导hla
‑
g1的肿瘤细胞也未从hla
‑
g1阴性的肿瘤细胞中获取膜片。但是,已经有15.9%的hla
‑
g1/β2m特异性car细胞从hla
‑
g1肿瘤细胞而非其hla
‑
g1阴性对应物中获取了膜片。
[0171]
总之,在表达hla
‑
g1/β2m的肿瘤细胞与特异于hla
‑
g1/β2m抗原的car效应细胞之间证实了膜转移。
[0172]
膜获取是一个快速的过程
[0173]
共孵育3小时后,确认了hla
‑
g1/β2m肿瘤细胞与hla
‑
g car效应细胞之间的膜转移,其中几乎22%的lftt
‑
1car效应细胞能够进行胞啃作用。然而,即使在3小时的共孵育后,15e7 car细胞也不能够从hla
‑
g1/β2m靶细胞获取膜。如图4所示,膜获取的动力学是快速的,因为在1h共孵育后,膜转移影响了+/
‑
32%的hla
‑
g
‑
lftt
‑
1car效应细胞,并且共孵育3小时将能够进行胞啃作用的效应细胞的比例略微增加到+/
‑
40%。
[0174]
这些结果表明,膜转移是快速的,并且仅与抗原/car特异性相互作用有关,因为hla
‑
g
‑
lftt
‑
1car效应细胞仅从hla
‑
g1/β2m阳性肿瘤细胞获取膜片段,而hla
‑
g
‑
15e7 car效应细胞不从hla
‑
g1/β2m阳性肿瘤细胞获取膜片。
[0175]
膜获取取决于car特异性
[0176]
然后,评估了胞啃作用与car特异性之间的关系。为此,如图5所示,在胞啃作用实验之前,将hla
‑
g1转导的肿瘤细胞与lftt
‑
1抗体(其互补位用于产生hla
‑
g
‑
lftt
‑
1car构建体)或与其同种型对照抗体孵育。然后将hla
‑
g1 car效应细胞与这些肿瘤细胞孵育1小时,并通过流式细胞术研究膜获取(图6a)。与同种型对照抗体的预孵育不阻止hla
‑
g1 car效应细胞进行胞啃作用(图6b)。但是,lftt
‑
1预孵育几乎完全消除了胞啃作用过程。
[0177]
胞啃作用依赖于靶细胞与效应细胞之间通过抗原
‑
car相互作用介导的细胞间接
触。为此目的,研究了与lftt
‑
1抗体的预孵育是否可以抑制hla
‑
g1肿瘤细胞和hla
‑
g
‑
lftt
‑
1car细胞之间的缀合物形成(图7a)。已确定,由于与lftt
‑
1抗体的预孵育阻断靶细胞与car效应细胞之间的相互作用,从而抑制胞啃作用。实际上,hla
‑
g1 car效应细胞不再能够建立与hla
‑
g1肿瘤细胞的细胞间接触,并且不再能够获取膜(图7b)。
[0178]
总而言之,由于膜转移是(i)特异的、(ii)由car/抗原相互作用介导的、细胞间接触依赖性和(iv)快速的,因此,胞啃作用是一种确定car特征的有效方法。仅通过hla
‑
g
‑
lftt
‑
1而不是通过hla
‑
g
‑
15e7 car效应细胞从表达hla
‑
g1/β2m的靶细胞的胞啃作用表明,胞啃作用与确定car特异性特别相关。
[0179]
膜转移特异于car相互作用细胞
[0180]
在car刺激后,进一步研究了car活化的效应细胞是否仅与抗原特异性表达肿瘤细胞相互作用,或者它们是否可能具有旁观者效应。为此,将红色标记的hla
‑
g1阴性肿瘤细胞与绿色标记的hla
‑
g1阳性肿瘤细胞和蓝色标记的hla
‑
g
‑
lftt
‑
1car效应细胞(图8)共孵育1小时。然后通过流式细胞术分析通过car效应细胞的膜获取。如图9所示,共孵育后,hla
‑
g
‑
lftt
‑
1car效应细胞仅获取绿色膜片,这表明活化的hla
‑
g
‑
lftt
‑
1car效应细胞仅与表达hla
‑
g1的肿瘤细胞而不与旁观者细胞相互作用。
[0181]
观察到的膜转移不受用于鉴定靶细胞的染料的影响。如图10、11a和11b所示,hla
‑
g
‑
lftt
‑
1car效应细胞从表达hla
‑
g1的肿瘤细胞中获得了相同程度的红色或绿色膜染料,表明胞啃作用并不取决于所用的膜染料。
[0182]
材料与方法
[0183]
细胞系
[0184]
jurkat细胞系是购自atcc(美国典型培养物保藏中心tib
‑
152)的人cd4+t细胞。分别用hla
‑
g1、hla
‑
g
‑
lftt
‑
1或hla
‑
g
‑
15e7 car慢病毒转导jurkat细胞系。在补充了2mm l
‑
谷氨酰胺、1mg/ml青霉素和链霉素(x)以及10%热灭活的fcs(invitrogen)的rpmi 1640(invitrogen)中培养jurkat wt和jurkat转导的细胞系。
[0185]
jeg
‑
3细胞系是购自atcc(美国典型培养物保藏中心htb
‑
36)的人绒毛癌细胞。将它们在补充有1mg/ml青霉素和链霉素(x)和10%热灭活的fcs(invitrogen)的mem(x)中培养。
[0186]
car
‑
hla
‑
g jurkat细胞
[0187]
hla
‑
g
‑
lftt
‑
1和hla
‑
g
‑
15e7 car构建体如先前所述[7]生成。简而言之,抗hla
‑
g识别结构域是衍生自hla
‑
g1/缔合β2m特异性抗体lftt1(参考专利car hla
‑
g)或衍生自hla
‑
g1/无β2m特异性抗体15e7(参考专利)的单链可变片段(scfv)。使用衍生自igg1铰链区的短间隔子将该scfv连接至跨膜结构域。hla
‑
g car胞内结构域由cd28、ox40和cd3z活化分子的融合构成。在cmv立即早期启动子下,用特异性引物通过pcr提取后,通过消化/连接将car构建体克隆到ptrip质粒载体中。
[0188]
hla
‑
g jurkat细胞
[0189]
通过转导产生表达hla
‑
g的稳定jurkat细胞系,并如下产生慢病毒颗粒:将根据longmei zhao等人[38]的对应于天然hla
‑
g1 cdna(nm_002127.5)修饰的k334a和k335a的特异性序列在cmv立即早期启动子下用特异性引物通过pcr提取后通过消化/连接分别克隆到ptrip质粒载体中。
[0190]
慢病毒载体
[0191]
通过用重组质粒ptrip、编码来自vsv的糖蛋白、血清型印第安纳州糖蛋白的包膜表达质粒和p8.74衣壳化质粒磷酸钙共转染hek
‑
293t细胞(atcc)来产生hiv
‑
1衍生的载体颗粒。通过实时pcr对来自转导的hek
‑
293t细胞的细胞裂解物滴定病毒原液,并表示为每毫升转导单位(tu)。
[0192]
为了生成jurkat hla
‑
g
‑
lftt
‑
1、hla
‑
g
‑
15e7 car细胞和jurkat hla
‑
g,将1x105个jurkat细胞接种在具有500μl的crpmi培养基和分别106tu(293t)的trip cmv
‑
car
‑
hla
‑
g
‑
lftt
‑
1、trip cmv
‑
car
‑
hla
‑
g
‑
15e7或trip cmv
‑
hla
‑
g载体的12孔板中。将细胞在37℃下孵育1小时,然后在37℃ 1200g下离心1小时。之后,加入1ml的crpmi培养基并在37℃下孵育。两周后,使用抗hla
‑
g抗体通过流式细胞术对阳性细胞进行分选。在jurkat hla
‑
g
‑
car活化测定之前,通过流式细胞术评估hla
‑
g的表达。
[0193]
胞啃作用实验
[0194]
根据制造商的说明书,分别用pkh26和pkh67荧光染料(sigma)标记jurkat hla
‑
g car效应细胞和jurkat或jurkat hla
‑
g1肿瘤细胞。
[0195]
对于胞啃作用测定,将jurkat hla
‑
g
‑
lftt
‑
1或hla
‑
g
‑
15e7 car(“获得”细胞)与jurkat或jurkat hla
‑
g1细胞(“供体”细胞)以1:1的效应
‑
肿瘤比例以2x106个细胞/ml的总浓度和在37℃下在5%co2湿润培养箱中共培养1h(lemaoult等人,2007 blood j;caumartin等人,2007 embo j)。共孵育结束时,将细胞置于冰上,并且所有其他步骤均在低于4℃的温度下进行。通过流式细胞术研究了car效应细胞对肿瘤细胞膜的获取。当指示时,在facs采集之前,通过涡旋振荡使缀合的细胞解离。
[0196]
流式细胞术分析
[0197]
使用配备有diva软件的bd lsr fortessa(bd bioscience)在以下实验条件下进行分析:悬浮在ph 7.4的pbs等渗缓冲液中的细胞,其渗透压为320
‑
330mosmol/kg,分析的细胞数为10,000。
[0198]
car阻断程序
[0199]
为了阻断hla
‑
g/car相互作用,先将jurkat hla
‑
g肿瘤细胞与5μg/ml阻断性lftt
‑
1抗体或其igg1同种型对照预孵育,然后进行与jurkat hla
‑
g
‑
lftt
‑
1car效应细胞的共孵育实验。
[0200]
统计分析
[0201]
数据表示为平均值+/
‑
标准偏差(sd)。使用student t检验,p值小于.05被认为是显著的。对于显示代表性实验的图,误差线代表一式三份的sd。
[0202]
结论
[0203]
在此报道了一种基于靶细胞和活化的效应细胞之间的膜转移来确定car功能性的新方法。此外,膜获取程度与效应细胞的活化状态直接相关。
[0204]
基于胞啃作用参数,该方法是一种快速测定和评估car特异性、功能性和灵敏性的创新的测定法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1