一种检测新型冠状病毒SARS-CoV-2抗体的试剂盒及方法与流程
本发明涉及生物医学检测领域,特别涉及一种检测新型冠状病毒sars-cov-2抗体的试剂盒及方法。
背景技术:
新型冠状病毒(sars-cov-2)直接攻击患者呼吸系统和消化系统,造成患者免疫系统紊乱,严重者产生炎症风暴导致死亡。
新型冠状病毒危害性巨大的一个主要原因,是患者发病具有3-14天甚至更长的潜伏期。早期病人没有任何症状,即使采用广为接受的金标准荧光定量pcr技术,发病初期阳性检出率也只有30~50%,使得诊断极其困难。医疗机构不得不采用ct和临床症状作为核酸检测的补充手段,不仅花费大、耗时长、造成大量患者无法及时确诊,还存在很大诊断上的不准确性,造成误诊和医疗资源的浪费。
日前,国家卫健委临检中心提议补充新型冠状病毒特异抗体检测,以明确患者是否“近期或既往感染过新型冠状病毒”,有助于核酸检测阴性但临床上疑似患者的确诊。但临检中心推荐的检测流程相当繁琐复杂,且一般的抗体检测方法易受到血液标本中的一些物质(如类风湿因子、非特异igm/igg(如受其它类型的冠状病毒、流感病毒、腺病毒等感染产生的抗体)等)的干扰而出现“假阳性”结果,导致难以区分是近期新型冠状病毒(sars-cov-2)还是其它病毒造成的感染。
因此,有必要提供一种能简单、快速、特异性检测新型冠状病毒的技术,以提高检测效率和准确度。
技术实现要素:
有鉴于此,本发明提供了一种检测新型冠状病毒sars-cov-2抗体的试剂盒及检测方法,以简单、快速、特异性检测出人体是否受到新型冠状病毒的感染,提高检测速度和准确度。
具体地,第一方面,本发明提供了一种检测新型冠状病毒sars-cov-2抗体的试剂盒,包括包被sars-cov-2抗原的磁微粒、化学发光标记物标记的抗人igm/igg二抗、非新型冠状病毒抗原。
其中,所述包被sars-cov-2抗原的磁微粒、化学发光标记物标记的抗人igm/igg二抗、非新型冠状病毒抗原可以单独保存或以混合态保存,但所述包被sars-cov-2抗原的磁微粒不与所述化学发光标记物标记的抗人igm/igg二抗相混合。例如,所述非新型冠状病毒抗原可以与所述化学发光标记物标记的抗人igm/igg抗体二抗在一起保存,也可以与所述包被sars-cov-2抗原的磁微粒混合保存。在使用所述试剂盒时,注意使待测样本先与所述非新型冠状病毒抗原所在的体系混合,以使待测样本中的非sars-cov-2特异性抗体在溶液中被结合封闭。
其中,所述化学发光标记物标记的抗人igm/igg二抗可以为化学发光标记物标记的igm二抗、化学发光标记物标记的igg二抗,或者为化学发光标记物标记的igm二抗与化学发光标记物标记的igg二抗的混合物。
可选地,所述化学发光标记物为酶(如碱性磷酸酶、辣根过氧化物酶等)、吖啶酯、三联吡啶钌等中的一种或多种。在本发明一实施方式中,所述化学发光标记物为吖啶酯。
可选地,所述化学发光标记物标记的抗人igm/igg二抗中,所述抗人igm/igg二抗与所述化学发光标记物的摩尔比为1:(2-50)。优选为1:(2-10)。
可选地,所述sars-cov-2抗原包括但不限于刺突蛋白(spikeprotein,s蛋白)s1、刺突蛋白s-rbd、核衣壳蛋白(nucleocapsidprotein,n蛋白)、包膜蛋白(envelopeprotein,e蛋白)等任何与新型冠状病毒sars-cov-2有关或类似结构的抗原。进一步可选地,磁微粒可通过其表面的活性基团(如羧基、胺基、巯基、对甲苯磺酰基等等)经过活化或直接与sars-cov-2抗原共价偶联,或将磁微粒先与链霉亲和素偶联,同时采用生物素标记sars-cov-2抗原,最终得到包被sars-cov-2抗原的磁微粒。其中,所述磁微粒的内核为四氧化三铁或三氧化二铁。
其中,所述包被sars-cov-2抗原的磁微粒上的sars-cov-2抗原可以为上述列举的一种或多种。优选为上述刺突蛋白s1、刺突蛋白s-rbd、核衣壳蛋白和包膜蛋白的混合。当sars-cov-2抗原为多种时,其可以是多个抗原混合包被的磁微粒,或者某一抗原包被的磁微粒与不同抗原包被的磁微粒的混合。
进一步可选地,在所述包被sars-cov-2抗原的磁微粒中,所述sars-cov-2抗原与磁微粒的包被质量比为0.5%-5%。
可选地,所述非新型冠状病毒抗原包括但不限于hku1冠状病毒、oc43冠状病毒、nl63冠状病毒、229e冠状病毒、sars冠状病毒、mers冠状病毒、流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒、腺病毒、人间质肺病毒、人偏肺病毒等的抗原中的至少一种。其中,所述流感病毒包括乙型流感病毒yamagata、victoria,及甲型流感病毒h1n1、h3n2、h5n1、h7n9、h7n1、h7n2、h7n3、h7n7、h7n9、h9n2等;所述副流感病毒包括副流感病毒1、2、3型等;所述呼吸道合胞病毒包括呼吸道合胞病毒a、b型等;所述鼻病毒包括鼻病毒a、b、c组等;所述腺病毒包括腺病毒1、2、3、4、5、7、55型等。
可选地,所述试剂盒还包括缓冲液和化学发光体系溶液。
其中,所述缓冲液可以包括tris-hcl缓冲液(如ph在7.5-10.0,优选为7.5-9.0)、ph在6.8-8.2的hepes缓冲液、磷酸盐(pbs)缓冲液(如ph=6.0-9.5,优选为7.2-8.0)、mes缓冲液(如ph=5.0-7.5)、硼酸钠缓冲液(如ph=7.6-9.5)、柠檬酸缓冲溶液(如ph=6.0-8.0)等。所述缓冲液可以用于清洗、样品稀释,以及包被sars-cov-2抗原的磁微粒、化学发光标记物标记的抗人igm/igg二抗等溶液的浓度调配。
其中,在所述化学发光标记物为辣根过氧化物酶时,所述化学发光体系溶液含有底物鲁米诺;在所述化学发光标记物为碱性磷酸酶时,所述化学发光体系溶液含有底物amppd;在所述化学发光标记物为三联吡啶钌时,所述化学发光体系溶液含有三丙胺。在所述化学发光标记物为吖啶酯时,所述化学发光体系溶液包括预激发液a(例如h2o2和hno3的混合液)和激发液b(例如tritonx-100和naoh的混合液)。预激发液a和激发液b在进行检测时,先后加入,两者加入时间的间隔从0.001s至10min不等。可选地,预激发液a的加入体积为1.0μl至10.0ml;激发液b的加入体积为1.0μl至10.0ml。
在本发明一实施方式中,所述试剂盒分为r1试剂、r2试剂,其中,所述r1试剂包括包被sars-cov-2抗原的磁微粒,所述r2试剂包括化学发光标记物标记的抗人igm/igg二抗和非新型冠状病毒抗原。所述r1试剂与r2试剂分开储存,在使用时再按比例与待测样本混合。
进一步可选地,所述r1试剂、所述r2试剂可以独立地含有缓冲液、表面活性剂、稳定剂和防腐剂。其中,所述表面活性剂可以独立地选自吐温、triton、sds等;所述稳定剂和防腐剂可以独立地选自牛血清白蛋白(bsa)、人血清白蛋白、人γ球蛋白、鼠抗、叠氮钠、proclin300等中的一种或多种。
可选地,所述包被sars-cov-2抗原的磁微粒在所述r1试剂中的浓度在0.01mg/ml至1000mg/ml的范围。优选为在0.1-10mg/ml的范围。进一步优选为在1-10mg/ml的范围。
进一步地,所述r1试剂的ph在3.0-10.5的范围。例如为6.0、6.5、7.0、8.0、8.8等。优选为6.0-9.0。
可选地,所述化学发光标记物标记的抗人igm/igg二抗在所述r2试剂中的浓度在0.01ng/ml至10000ng/ml的范围。优选为在100-900ng/ml的范围。更优选为在500-800ng/ml的范围。
进一步地,所述r2试剂的ph在3.0-10.5的范围。例如为6.0、6.5、7.0、8.0、8.8等。优选为6.0-9.0。
可选地,所述非新型冠状病毒抗原在所述r2试剂中的最终浓度为0.001ng/ml-10mg/ml,优选为1ng/ml-100μg/ml,更优选为50-2500ng/ml。
进一步可选地,所述试剂盒还包括阳性对照品和/或阴性对照品。其中,所述阳性对照品可以为经过病毒灭活的含弱阳性抗igm或igg抗体的人体血清。阴性对照品可以为经过病毒灭活的不含抗igm或igg抗体的正常人血清。
本发明中所述试剂盒采用的检测原理是免疫竞争法,具体如下:当使用所述试剂盒进行检测时,注意先将待测样本与所述非新型冠状病毒抗原所在的体系混合,再与其他组分混合;这样可阻止病人样本中感染产生的非sars-cov-2特异性抗体结合到连接于磁微粒的sars-cov-2抗原上,确保只有sars-cov-2感染产生的相应特异性igm/igg抗体能与包被的磁微粒上的sars-cov-2抗原结合,并与化学发光标记物标记的抗人igm/igg二抗结合形成复合物,经清洗、磁分离后,只有化学发光标记物标记的抗人igm/igg二抗-人体sars-cov-2特异性抗体-sars-cov-2抗原这三者的复合物保留在磁微粒上,最后加入化学发光体系,利用其与化学发光体系反应产生光子以检测出sars-cov-2特异性igm/igg抗体。
可选地,所述试剂盒可以与全自动化学发光仪(如麦科田immuf6、雅培i2000、i1000;科斯迈smart6500、500s等)配合使用。这样可降低人为操作对测试结果的影响,使检测结果更可靠、准确、快速,保证可重复性。
本发明第一方面提供的所述试剂盒为竞争型化学发光免疫分析试剂盒,能够特异性地检测出病人样本是否含有因新型冠状病毒sars-cov-2感染所产生的特异性igm/igg抗体,且不与普通的冠状病毒、流感病毒等产生交叉反应,具有灵敏度高、特异性强、检测速度快、重复性好、使用便捷等诸多优点,为临床诊断/治疗等提供了一种更特异、稳定、快速、可靠的检测手段。
第二方面,本发明还提供了一种检测新型冠状病毒sars-cov-2抗体的方法,包括:
按以下(a)-(c)任一方式执行步骤(1):
(a).先将非新型冠状病毒抗原和化学发光标记物标记的抗人igm/igg二抗的混合制剂与待测样本进行混合孵育,再向其中加入包被sars-cov-2抗原的磁微粒进行孵育;
(b).先将非新型冠状病毒抗原和包被sars-cov-2抗原的磁微粒的混合制剂与待测样本进行混合孵育,再向其中加入化学发光标记物标记的抗人igm/igg二抗;
(c).先将待测样本与非新型冠状病毒抗原进行混合孵育,再向其中分别加入包被sars-cov-2抗原的磁微粒、化学发光标记物标记的抗人igm/igg二抗;
(2)对步骤(1)所得的混合溶液进行磁分离,收集得到的磁微粒复合物,并向其中加入化学发光体系溶液,检测其相对发光强度(rlu,relativelightunit)。
可选地,若检测到化学发光的强度达到设置的阈值,则判定所述待测样本含有新型冠状病毒sars-cov-2的特异性igm/igg抗体,进而判定待测样本为sars-cov-2阳性。此外,上述判定条件可在全自动化学发光仪中预先设定,减少所述检测方法对操作人员的依赖。
所述阈值范围为10rlu到100,000rlu。所述阈值可以采用上述阳性对照品在化学发光仪上进行测试得到。
其中,在检测所述磁微粒复合物与化学发光体系溶液构成的混合体系的相对发光强度时,是利用光电倍增管采集所产生的光子个数。光电倍增管采集信号的窗口时间从0.001s至100s不等。
其中,上述方式(a)-(c)中的混合制剂可以为缓冲液形式。
可选地,方式(c)中,所述包被sars-cov-2抗原的磁微粒与所述化学发光标记物标记的抗人igm/igg二抗的加入顺序不限,可以前者先加,也可以后者先加,只要二者不同时加入即可。
其中,(a)-(c)任一方式中,所述混合孵育的温度为18-37℃。可选地,所述混合孵育的时间不少于4min。例如10-40min。每加入一种组分,最好均进行孵育。
其中,所述待测样本可以为全血(加入柠檬酸抗凝)、血浆(加入edta稳定)、或者血清等。
本发明第二方面提供的检测新型冠状病毒sars-cov-2抗体的检测方法,操作简单,相较于核酸检测降低了对操作人员的技术要求,能经济有效地识别出待测样本是否受新型冠状病毒sars-cov-2感染。此外,该检测方法具有检测速度快、特异性强、灵敏度高、准确性好、便于批量检测等特点,填补了国内外化学发光检测新型冠状病毒sars-cov-2的空白,为临床诊断和治疗提供一种快速筛选和准确判断的方法。
附图说明
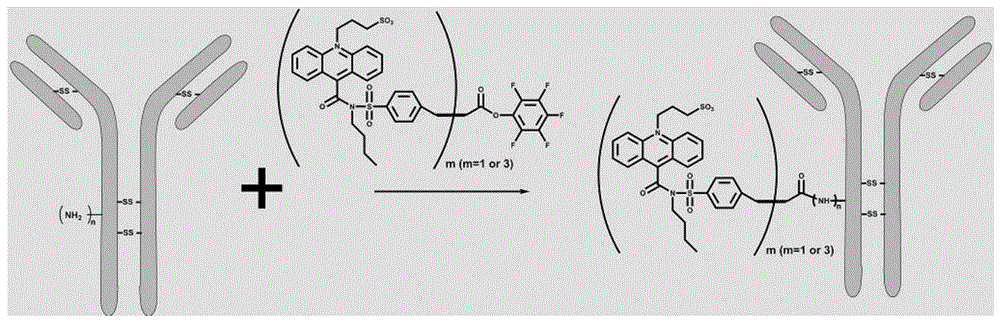
图1为吖啶酯标记抗人igm/igg二抗的过程示意;
图2为检测临床待测血清样本和阳性对照品、阴性对照品中有无新型冠状病毒sars-cov-2抗体的化学发光曲线图。
具体实施方式
以下所述是本发明的示例性实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
若无特别说明,以下描述所涉及到的化学试剂均为市售试剂。
磁珠包被sars-cov-2抗原
将特异性抗原通过共价偶联的方式连接到磁珠上的过程称为磁珠包被,包被后的产物可成为磁微粒包被物。包被的基本原理如下:磁珠表面的化学基团(羧基、胺基、对甲苯磺酰基等)与抗原表面的胺基或羧基等发生化学反应,形成抗原—磁微粒的共价结合物,该共价结合物经过洗涤和封闭,去除了未反应的抗原及封闭掉非特异性结合的位点,最终制得磁微粒包被物。其中,在磁珠表面带羧基基团时,需要先加入化学交联剂(如edc等)活化以实现其与抗原的酰胺化共价偶联,在磁珠表面带胺基基团时,需要先对抗原进行预先活化(如edc等),以实现两者的酰胺化共价偶联。
一个典型的例子如下:将商业化的tosyl-activated(对甲苯磺酰基活化的)磁珠的水悬液于室温下放置平衡,然后放置于混匀仪上,缓慢混匀5~20分钟,直到其完全分散;吸取一定量混匀后的磁珠分散液至离心管中,将该离心管置于磁力架上,静置至少1分钟直至磁珠被完全吸附,将磁珠上清液移除;之后向离心管中加入一定量的磁珠重悬液(如ph=7.2-9.5的pbs缓冲液),再加入待包被的sars-cov-2抗原,使该抗原与磁珠tosyl基团的摩尔比为1:20,充分混匀。
盖上离心管,置于37℃恒温恒湿箱中的旋转混匀仪上,于转速15~20rpm下旋转孵育24h左右,再将该离心管置于磁力架上静置至少1分钟,确保磁珠被完全吸附后,将磁珠上清液移除;加入一定量的磁珠封闭液(牛血清白蛋白的pbs缓冲液,ph=7.2-9.5),充分混匀,盖上离心管,置于37℃恒温恒湿箱中的旋转混匀仪上,于转速15~20rpm下旋转孵育24h左右,以封闭掉磁珠上未结合sars-cov-2抗原的活性位点。之后将该离心管从恒温恒湿箱中取出,置于磁力架上静置至少1分钟,将磁珠上清移除,加入一定量的磁珠缓冲液(具体为ph=7.0-9.5的tris-hcl缓冲液),即制得包被有sars-cov-2抗原的磁微粒母液。
吖啶酯标记人二抗
取一定量的吖啶酯标记缓冲液(如ph=5.0-7.5的mes缓冲液)于离心管中,再向其中加入待标记的抗人igm/igg二抗,配制得到3.0mg/ml的二抗溶液。向配制好的二抗溶液中加入一定量的活化吖啶酯母液(5.0mg/ml,活化吖啶酯(如nsp-dmae-nhs)溶解于dmf有机溶剂),震荡混匀约5s,用锡箔纸包住离心管,避光孵育至少1小时,得到吖啶酯标记的抗人igm/igg二抗溶液,其标记过程可参见图1。
取一个新的透析管,将上述吖啶酯标记的抗人igm/igg二抗溶液转移到洗净的透析管中,拧紧透析管盖子;放入装有4l吖啶酯标记缓冲液(ph=5.0-7.5的mes缓冲液)的5l烧杯中,搅拌下透析约6-8小时;更换4l吖啶酯标记缓冲液,再透析约6-8小时;最后换成4l新鲜吖啶酯标记缓冲液,透析至少6-8小时,得到透析纯化后的吖啶酯标记的抗人igm/igg二抗。取出纯化后的标记二抗,使用紫外可见分光光度计,用吖啶酯标记缓冲液(ph=5.0-7.5的mes缓冲液)作空白基准,测试蛋白吸收峰值a280和吖啶酯吸收峰值a370,计算吖啶酯/二抗的交联比例(ir)和二抗浓度。
本发明一实施方式中,ir值在2.0-10.0的范围,二抗浓度在2-4mg/ml的范围。在一具体实施例中,ir值为8.0,二抗浓度为3.0mg/ml。
试剂盒制备
取上述包被有sars-cov-2抗原的磁微粒母液,用缓冲液(具体为ph=7.0-9.5的tris-hcl缓冲液)稀释配制成磁微粒浓度为2.5mg/ml的磁微粒工作液,即,得到r1试剂。
取上述透析纯化后的吖啶酯标记的抗人igm/igg二抗(以下简称为“二抗标记物”),用吖啶酯标记物缓冲液(如ph=5.0-7.5的mes缓冲液)配制成3-5个不同浓度(0.001ng/ml至10mg/ml)的二抗标记物系列溶液。然后搭配固定浓度(2.5mg/ml)的磁微粒工作液、吖啶酯的化学发光体系,对弱阳性对照样本(如经过病毒灭活的含抗人igm或igg的弱阳性人体血清样本)进行测试,根据测得的相对发光值(rlu,relativelightunit)强度选定二抗标记物的合适浓度,由此确定稀释比例,进而配制二抗标记物工作液。本发明中可将浓度确定的二抗标记物的溶液称为“二抗标记物工作液”。
向上述二抗标记物工作液中加入一定浓度的非新型冠状病毒抗原(sars、h1n1等病毒的抗原)溶液,得到r2试剂。其中,非新型冠状病毒抗原在r2试剂的最终浓度在0.001ng/ml~10mg/ml的范围。
上述r1试剂和上述r2试剂共同构成了成品试剂盒的主要组份。当然,r1试剂和上述r2试剂也可分别含有其他成分,如稳定剂。在一个具体的例子中,上述二抗标记物在r2试剂中的浓度为800ng/ml,非新型冠状病毒抗原在r2试剂的最终浓度为1200ng/ml。
当然,在其他实施方式中,也可以将二抗标记物工作液作为r2试剂,非新型冠状病毒抗原的溶液作为r3试剂。还可以将含包被有sars-cov-2抗原的磁微粒和非新型冠状病毒抗原的混合溶液作为r1试剂,二抗标记物工作液作为r2试剂。只需注意在检测时,先使待测样本与非新型冠状病毒抗原所在的体系进行混合即可。
采样及样本处理
按照业内标准操作程序和采血管厂家使用说明,采用柠檬酸抗凝管、edta抗凝管或sst采血管,抽取一定量的病人血液样本(注意穿防护服、戴手套、和口罩,避免感染)。将采血管中的血液样本在2000rpm的转速下高速离心10分钟以上;小心吸取上层血清或血浆,加入到样本杯进行测试,或者直接将采血管放置于仪器样本架上进行测试,或用一定量的缓冲液稀释后,得到待测试的样本溶液。
样本的检测
在调试完自动化学发光仪后,将磁微粒工作液和吖啶酯标记的二抗标记物工作液分别放置于全自动化学发光仪的指定位置,将待测样本和阳性对照品、阴性对照品放置于样本架上;首先启动质控测试:仪器自动吸取一定量的阳性对照品溶液(100μl),将其与一定量的二抗标记物工作液(含非新型冠状病毒抗原,100μl)混合10分钟左右后,再吸取一定量的磁微粒工作液(50μl)加入其中,孵育反应持续10分钟后,用磁铁吸取磁微粒,用清洗液(ph=7.0-8.0的pbs缓冲液,300μl)清洗后,经磁分离弃去上清液。加入吖啶酯的化学发光酸性预触发液(100μl),再加入化学发光碱性触发液(100μl),测试相对发光强度,确定发光阈值(cut-off)。其中,阴性对照品的检测流程也同上,其检测主要用于检验化学发光仪的运行是否正常。
之后启动待测病人样本的测试,流程同上,只是把阳性对照品溶液替换为样本溶液。软件根据待测样本的发光强度值和设置的发光阈值(cut-off),判断样本测试结果的阴阳性。若待测样本的发光值高于cut-off,则为阳性样本;若其发光值低于cut-off,则待测样本为阴性样本。
图2为为检测一临床待测样本和阳性对照品(cut-off样本)、阴性对照品中有无新型冠状病毒sars-cov-2抗体的化学发光曲线图。该待测病人样本的化学发光值高于阳性对照品,则判定该待测病人样本为含有新型冠状病毒sars-cov-2抗体的阳性样本。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!