一种基于超声的流式细胞磁标记微装置的制作方法
本发明涉及医疗器械技术领域,尤其涉及一种基于超声的流式细胞磁标记微装置。
背景技术:
细胞疗法是精准治疗肿瘤的一种有前途的策略,但由于输注细胞的体内分布、迁移和靶向机制尚不清楚,并且输注细胞的有效性和安全性难以直接验证,因此在临床应用中仍然面临困难。为了解决上述问题,研究人员提出了磁性纳米颗粒(mns)标记细胞的方法,以便使用磁共振成像(mri)追踪磁标记的细胞。因此,细胞磁标记技术是用于细胞治疗和细胞示踪等领域的重要技术。但是,由于细胞膜对磁性纳米颗粒的非渗透性,将磁性纳米颗粒快速、安全和高效地加载到细胞中仍然是一个重大挑战。
目前细胞磁标记的方法可分为三种:孵化法、电穿孔法和声穿孔法。其中,孵化法是装载磁性纳米颗粒的常规策略,将细胞与磁性纳米颗粒一起孵育,同时需要添加带正电的转染剂以促进磁性纳米颗粒跨细胞膜的转运。孵育方法很简单易行,但是非常耗时。此外,所使用的转染剂通常对细胞有毒因而不被建议使用。电穿孔法是一种施加高电场以瞬时增加细胞膜通透性,然后增加磁性纳米颗粒跨细胞膜进入细胞的方法。与孵育方法相比,电穿孔法的标记速度更快,因此可以在更短的时间内获得更好的磁性标记结果。声穿孔法是一种基于超声空化效应的方法,可以短暂、可逆地增加细胞膜的通透性,从而提高细胞对基因、药物和磁性纳米颗粒的摄取效率。与电穿孔法相比,声穿孔法不仅同样具有细胞标记时间短和细胞标记效率高的优点,而且对细胞损伤和死亡的范围通常小于电穿孔。因此,声穿孔可以实现相对更高的细胞活性。
在目前的声穿孔法中,大多是将超声直接应用于试管中细胞与磁性纳米颗粒的混合物。因此,细胞不能被连续、批量地标记。近年来,微流体技术得到了快速发展,不仅可以通过精确地操作微细胞样品实现将物质装载到细胞中,而且可以连续、快速和高效地处理细胞样品。虽然基于超声的微流体技术在药物释放方面得到很大发展,但由于磁性纳米颗粒相对较大的尺寸和潜在的毒性,到目前为止,尚未有报道微流体技术应用于细胞磁标记的技术。
因此,如何能够连续、快速、安全地将磁性纳米颗粒装载进细胞,是本领域技术人员目前需要解决的技术问题。
技术实现要素:
有鉴于此,本发明的目的在于提供一种基于超声的流式细胞磁标记微装置,可用于连续、快速、安全和高效地进行细胞磁标记,也可拓展用于细胞与药物或基因的装载用途。
为了实现上述目的,本发明提供了如下技术方案:
一种基于超声的流式细胞磁标记微装置,包括:
微流体芯片,所述微流体芯片内部设有流体通道,所述流体通道包括第一通道、第二通道、混合通道和标记通道,所述第一通道用于注入细胞悬浮液,所述第二通道用于注入磁性纳米颗粒溶液,所述第一通道在所述微流体芯片的表面开设有细胞悬浮液注入口,所述第二通道在所述微流体芯片的表面开设有磁性纳米颗粒溶液注入口,所述第一通道的流出端和所述第二通道的流出端均连接于所述混合通道的流入端,所述混合通道的流出端连接于所述标记通道的流入端,所述标记通道的流出端在所述微流体芯片的表面开设有混合液出口,所述混合通道的通流面积小于所述标记通道的通流面积;
超声装置,所述超声装置包括用于容纳所述微流体芯片和连接耦合剂的容器以及设置于所述容器底部的超声换能器,所述超声换能器连接有匹配电路。
优选地,所述混合通道为特斯拉混合器结构。
优选地,所述标记通道包括多段并列布置且首尾连通的直线通道。
优选地,所述微流体芯片包括芯片本体和覆盖片,所述芯片本体的一侧表面设有凹陷的沟槽结构,所述覆盖片固定覆盖所述沟槽结构以形成所述流体通道,所述芯片本体的另一侧表面或所述覆盖片上开设有与所述流体通道连通的所述细胞悬浮液注入口、所述磁性纳米颗粒溶液注入口和所述混合液出口。
优选地,所述芯片本体的材质为聚二甲基硅氧烷或有机玻璃,所述覆盖片为玻璃片。
优选地,所述混合通道的最大通流面积为0.5mm×0.5mm,所述标记通道的最大通流面积为1.5mm×1.5mm。
优选地,所述容器为开口式器皿,所述容器的底部开设有换能器安装孔,所述超声换能器密封连接于所述换能器安装孔中。
优选地,所述开口式器皿为塑料皿。
优选地,所述第一通道的数量为一条,所述第二通道的数量为两条。
优选地,所述超声换能器的中心频率为1mhz。
本发明的提供的一种基于超声的流式细胞磁标记微装置中,细胞悬浮液在微流体芯片上实现流式细胞,与磁性纳米颗粒溶液在微流体芯片汇合并在混合通道实现快速、均匀地混合,在标记区域与超声装置实现细胞磁标记。
本发明具有以下有益效果:
1)本方案结合超声技术和微流体技术,流式细胞的设计允许快速、有效地标记细胞,在两分钟内实现对流式细胞的磁标记,可以连续批量地对细胞进行足量的磁标记,并且实现较高的细胞平均载磁量;
2)在线混合的设计可以安全地标记细胞,并使得芯片集成化程度提高,大大降低对细胞的活性和增殖功能影响,简化了细胞磁标记的操作,具有操作简便、效率高、安全性高的优点;
3)此外,本发明微装置还可以拓展用于细胞与药物或基因的装载用途。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
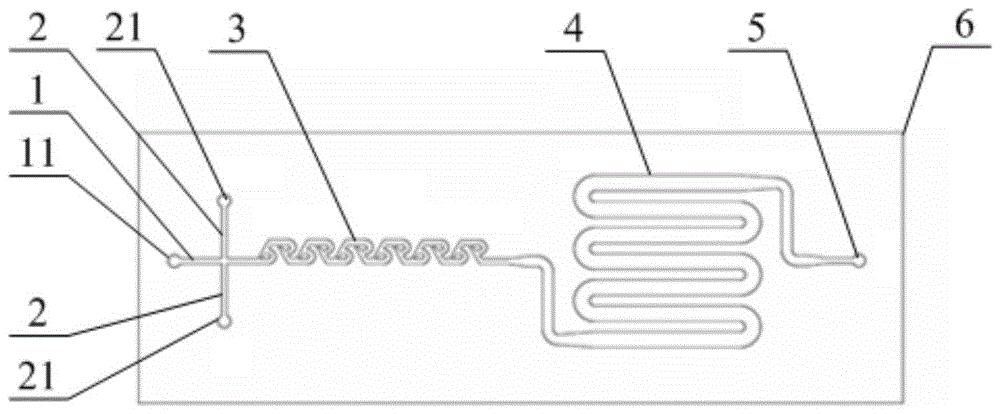
图1为本发明具体实施例中的微流体芯片的通道结构示意图;
图2为本发明具体实施例中的超声装置的结构示意图;
图3为本发明具体实施例中的超声装置的纵向剖视图;
图4为本发明具体实施例中的基于超声的流式细胞磁标记微装置的总体结构示意图;
图5为本发明具体实施例中的基于超声的流式细胞磁标记微装置的纵向剖视图。
图1至图5中:
1-第一通道、11-细胞悬浮液注入口、2-第二通道、21-磁性纳米颗粒溶液注入口、3-混合通道、4-标记通道、5-混合液出口、6-微流体芯片、7-容器、8-超声换能器、9-连接耦合剂。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参照图1至图5,图1为本发明具体实施例中的微流体芯片的通道结构示意图;图2和图3分别为本发明具体实施例中的超声装置的结构示意图和纵向剖视图;图4为本发明具体实施例中的基于超声的流式细胞磁标记微装置的总体结构示意图;图5为本发明具体实施例中的基于超声的流式细胞磁标记微装置的纵向剖视图。
本发明提供了一种基于超声的流式细胞磁标记微装置,包括:微流体芯片6和超声装置,其中,微流体芯片6内部设有流体通道,流体通道包括第一通道1、第二通道2、混合通道3和标记通道4,第一通道1用于注入细胞悬浮液,第二通道2用于注入磁性纳米颗粒溶液,第一通道1在微流体芯片6的表面开设有细胞悬浮液注入口11,第二通道2在微流体芯片6的表面开设有磁性纳米颗粒溶液注入口21,第一通道1的流出端和第二通道2的流出端均连接于混合通道3的流入端,混合通道3的流出端连接于标记通道4的流入端,标记通道4的流出端在微流体芯片6的表面开设有混合液出口5,混合通道3的通流面积小于标记通道4的通流面积;超声装置包括用于容纳微流体芯片6和连接耦合剂9的容器7以及设置于容器7底部的超声换能器8,超声换能器8连接有匹配电路。使用时,微流体芯片6位于超声装置的上方,且微流体芯片6的标记区域位于超声换能器8的上方,微流体芯片6的标记通道4和超声换能器8共同构成超声标记区域,连接耦合剂9盛放在容器7中并且覆没微流体芯片6的标记通道4,即,微流体芯片6和超声装置之间的连接由容器7中的连接耦合剂9完成。其中,连接耦合剂9优选冰水,还可以为水或其他耦合剂。
需要说明的是,本方案对微流体芯片6的形状、材料没有特殊的限制,满足实际操作条件即可,具体的,微流体芯片6可以设计为长方体、方形盘、圆形盘等形状,微流体芯片6的材料可以选用聚二甲基硅氧烷(pdms)、或有机玻璃(pmma)、或玻璃等。优选地,微流体芯片6的形状为长方体,材料为聚二甲基硅氧烷,长宽高优选为2.5cm×7.5cm×0.5cm。本方案可通过改变流体通道深度和宽度来调节微流体芯片6的尺寸大小,微流体芯片6的面积可以为15~25cm2,厚度可以为4~8mm。
需要说明的是,微流体芯片6内部设有流体通道,通道深度小于芯片厚度,本方案可以通过多种加工方式或结构设计来实现在微流体芯片6内部开设流体通道,例如,通过注塑方式在一个整体的芯片板中成型出流体通道结构,或者通过在一块板材表面加工沟槽结构,再在该板材沟槽表面覆盖另一层板,利用两层板之间的沟槽形成流体通道结构,等等。优选地,本方案中微流体芯片6包括芯片本体和覆盖片,芯片本体的一侧表面设有凹陷的沟槽结构,覆盖片固定覆盖沟槽结构以形成流体通道,芯片本体的另一侧表面或覆盖片上开设有与流体通道连通的细胞悬浮液注入口11、磁性纳米颗粒溶液注入口21和混合液出口5。使用时,可以将芯片本体设有沟槽结构的一面朝下放置。覆盖片与芯片本体可以通过胶粘、热压或键合的方式固定为一体,从而形成一个整体的芯片结构。进一步优选地,芯片本体的材质为聚二甲基硅氧烷或有机玻璃,覆盖片为玻璃片。
微流体芯片6主要提供以下三个功能:功能之一是实现流式细胞,细胞悬浮液被连续地注入微流体芯片6中,使细胞在微流体通道中流动起来,形成流式细胞,从而有利于连续批量地对细胞进行操作和处理。在本方案中,通过在微流体芯片6上刻画通道,通过外部驱动细胞悬浮液在通道中流动。功能之二是实现片上混合操作,细胞悬浮液和磁性纳米颗粒溶液以一定的流量比在混合通道3中充分、均匀地混合,以便实现片上在线混合,减少高浓度磁性纳米颗粒与细胞长时间孵育而造成对细胞的毒性伤害,为下一步的标记做准备。在本方案中,混合通道3优选采用特斯拉混合器结构,具体为改进的特斯拉混合器,其宽度范围在0.2mm~0.5mm,深度为0.5mm,具体结构示意图如图1所示。功能之三是实现片上超声标记,细胞与磁性纳米颗粒的混合液在通过标记通道4时接收来自超声装置发出的超声波而引发空化效应,使得细胞短暂可逆地开孔让磁性纳米颗粒进入细胞内,从而实现对细胞的磁标记。在本方案中,标记区域采用迂回直线通道设计,即,微流体芯片6中设置的标记通道4为迂回的直线通道,标记通道4包括多段并列布置且首尾连通的直线通道,如此设置的目的是为了延长细胞与磁性纳米颗粒混合液在标记通道4中的存留时间,其宽度为1.5mm,深度为1.5mm,具体结构示意图如图1所示。
其中,微流体芯片6中混合通道3和标记通道4的截面大小不同,即两者通流面积不同,混合通道3最大通流面积为0.5mm×0.5mm,标记通道4的最大通流面积为1.5mm×1.5mm。在注入流量一定时,由于混合通道3的通流面积小于标记通道4的通流面积,因此,液体在混合通道3中可得到相对较高的流速,从而有利于细胞悬浮液和磁性纳米颗粒溶液的在混合通道3的混合;标记通道4的截面大于混合通道3,从而可得到相对较低的流速,使得细胞和磁性纳米颗粒混合液在标记区域的存留时间加长,即加长了超声波对细胞和磁性纳米颗粒混合液的处理时间,以便于大尺寸的磁性纳米颗粒进入细胞内。在其他实施例中,混合通道3和标记通道4的实现方式可变,宽度和深度可变。例如,混合通道3也可以采用迂回的直线通道首尾相连的结构,标记通道4可以采用螺旋通道结构等。
需要说明的是,本方案可以根据具体的混合需求来设计以通道1和第二通道2的具体数量,优选地,如图1所示,本方案中的第一通道1的数量为一条,第二通道2的数量为两条,相应的,细胞悬浮液注入口11有一个,磁性纳米颗粒溶液注入口21有两个。
本发明提供的基于超声的流式细胞磁标记微装置包括带有匹配电路的超声装置。如图2所示,超声装置包括超声换能器8、容器7和匹配电路。其中,容器7用于盛放微流体芯片6和连接耦合剂9,容器7优选设计为开口式器皿,超声换能器8可以通过连接件固定、粘接固定等方式固定于容器7的底部。容器7的材质可以选用塑料、玻璃、有机玻璃等,其来源无特殊要求,优选地,本方案中的开口式器皿为塑料皿。另外,为了减少超声波透过容器7底面而带来的超声损耗,优选地,本方案在容器7的底部开设有换能器安装孔,超声换能器8密封连接于换能器安装孔中。在本方案中,塑料皿的直径为8.5cm,高度为1.5cm,当然,本方案还可以根据芯片和超声换能器的尺寸将塑料皿设计为其他尺寸规格。超声换能器8的作用是将电能转化为超声波,为微流体芯片6的标记通道4提供超声波来源。在本方案中,超声换能器8采用压电陶瓷换能器,其中心频率为1mhz,直径为2.2cm。在其他实施例中,除了超声换能器8的中心频率为1mhz、输出功率符合要求外,其类型和来源没有特殊的限制,由市场购买获得即可。匹配电路的作用是通过对超声换能器8和接口设备进行谐振匹配和阻抗匹配,使超声换能器8的超声波输出最大化。在本方案中,匹配电路是根据超声换能器8的中心频率和负载阻抗的实际情况由电容、电感和电阻设计而成。在其他实施例中,匹配电路应根据超声换能器的频率、静态电容和实际负载阻抗等参数进行设计,本文不再赘述。
本发明提供的基于超声的流式细胞磁标记微装置包括设置在超声装置和微流体芯片6之间的冰水(即连接耦合剂9)。冰水盛放在塑料皿中,并覆没微流体芯片6的标记通道4部分。塑料皿中的冰水主要有两个作用,一是作为超声换能器8与微流体芯片6之间的连接耦合剂,使得由超声换能器8产生的超声波可以直接作用于微流体芯片6的标记通道4,使得两者共同组成超声标记区;二是利用水良好的比热容作为超声换能器8的热抑制剂,防止超声换能器8的发热对细胞活性造成影响。本发明中的冰水通过去离子水加入冰块制成,来源没有特殊的限制。
本发明提供的基于超声的流式细胞磁标记微装置包括微流体芯片6和超声装置,如图4和图5所示。在本发明中,微流体芯片6放置在超声装置上方,其中微流体芯片6有通道的一面朝向下方,超声装置的塑料皿开口朝向上方。微流体芯片6被设置为倾斜约5゜插入超声装置的塑料皿中,如图5所示,其中微流体芯片6的设有混合液出口5的一端伸入水中,这样可以有效地抑制驻波效应,从而有利于超声波能量传输的最大化。微流体芯片6的标记区域放置在超声装置的超声换能器8的正上方,共同组成超声标记区域。当细胞和磁性纳米颗粒的混合液通过标记区域时,接受由超声装置发出的超声波处理,从而达到磁标记的目的。在其他实施例中,微流体芯片6和超声换能器8的放置应能够使得超声波有效作用于微流体芯片6的标记区域。
在本发明中,微流体芯片6的入口由一个细胞悬浮液注入口11和两个磁性纳米颗粒溶液注入口21组成。其中,使用时,两个磁性纳米颗粒溶液注入口21的注入速度被设置为相等的,并且其流量为细胞悬浮液流量的一半。超声装置的激励信号主要由信号发生器和功率放大器提供,其中信号发生器可以提供正弦信号或者脉冲信号,经过功率放大器放大后,经过匹配电路驱动超声换能器8。通过连续不断地注入的细胞悬浮液和磁性纳米颗粒溶液,二者在微流体芯片6中汇合,然后通过混合通道3进行充分混合使得磁性纳米颗粒均匀分布在细胞周围,再通过标记通道4在超声波诱导的空化作用下细胞膜短暂开孔使得磁性纳米颗粒进入,从而完成细胞磁标记,最后从混合液出口5处收集到包含磁标记细胞的混合溶液,经过离心和洗涤处理可得到磁标记细胞,这样便实现了连续、快速、安全和高效地对细胞进行磁标记。
本发明提供的基于超声的流式细胞磁标记微装置不仅可以连续、批量地进行细胞磁标记,还可以拓展用于细胞与药物或基因的装载用途。
在一种实施例中,微装置的制备方法如下。微流体芯片6的制作:首先通过绘制软件绘制微流体通道的三维模型,接着使用pmma材料通过精密数控机床来加工凸起的通道图案,得到pmma模具,然后在pmma模具上浇铸pdms预聚物,经过固化、分离、打孔、切割等操作后,最后将pdms有图案的一面与玻璃使用等离子体键合法进行键合,得到微流体芯片6。在其他实施例中,常用的微流体制作方法均可用。超声装置的制作:首先通过放置微流体芯片6确定与微流体芯片6的标记通道4对应的塑料皿底位置进行钻孔,钻孔孔径与超声换能器8的直径一致;然后,将超声换能器8与上述塑料皿底的钻孔进行组合,其中超声换能器8的表面与塑料皿底的高度一致,使用胶水进行密封;接着通过阻抗分析仪测量超声换能器8的中心频率、静态电容和实际负载阻抗参数,通过这些参数使用电感、电容等电子元件制作匹配电路;最后将塑料皿加入适量的水,然后将微流体芯片6设有混合液出口5的一端向下倾斜约5゜放置在塑料皿中。在其他实施例中,可以通过胶水固定将微流体芯片6和超声装置紧固连接。
实施例1
具有附图1至5所示结构的一种基于超声的流式细胞磁标记微装置的微流体芯片、超声装置和总体结构示意图,包括:
微流体芯片6的长宽高为2.5cm×7.5cm×0.5㎝的长方体芯片;微流体芯片6的材质为聚二甲基硅氧烷(pdms)和玻璃。微流体芯片6包括第一通道1(细胞悬浮液通道)、第二通道2(磁性纳米颗粒溶液通道)、混合通道3和标记通道4,其中混合通道3是由改进的特斯拉结构组成(宽度范围为0.2mm~0.5mm,深度为0.5mm),标记区域是由迂回的直线通道构成(直线通道宽度为0.5mm,深度为0.5mm),标记区域整体长度为2cm,宽度为2cm。设置一个细胞悬浮液注入口11,设置两个磁性纳米颗粒溶液注入口21,还有一个混合液出口5。
超声装置包括超声换能器8、塑料皿和匹配电路。塑料皿通过打孔(孔径与超声换能器8直径一致)与超声换能器8进行组合。超声换能器8与匹配电路相连接来进行谐振匹配和阻抗匹配。匹配电路根据超声换能器8的中心频率和实际负载阻抗等参数进行设计后,由电容、电感和电阻等构成。
将微流体芯片6与超声装置上下放置,其中微流体芯片6含有玻璃的一面朝下,超声装置中的塑料皿的开口朝上。微流体芯片6含有混合液出口5的一端被设置为向下倾斜5゜放置在超声装置的塑料皿中。微流体芯片6的标记通道4被设为放置在超声装置的超声换能器8的正上方,共同组成超声标记区域。通过在塑料皿中加入冰水覆盖微流体芯片6的标记区域来连接微流体芯片6和超声装置。微流体芯片6和超声装置通过胶水紧固。
实施例2
采用实施例1提供的一种基于超声的流式细胞磁标记微装置进行dc2.4细胞的超顺磁性氧化铁纳米颗粒(spions)标记,具体过程为:
通过信号发生器和功率放大器为实施例1所述的超声装置提供中心频率为1mhz、信号强度为6w的正弦波激励,使得超声装置以一定强度发出中心频率为1mhz的超声波。
将密度为106cell/ml的dc2.4细胞悬浮液以75μl/min的流量从实施例1提供的细胞悬浮液注入口11注入,将浓度为800μg/ml的spions溶液以37.5μl/min的流量从实施例1提供的两个磁性纳米颗粒溶液注入口21注入。
注入的细胞悬浮液和spions溶液在微流体芯片6中的通道中汇合,然后以一定的流量共同经过混合通道3进行充分混合,使得spions颗粒均匀分布在细胞的周围,得到细胞与spions的混合液。
混合液以一定的流量经过迂回的直线标记通道4。在标记通道4内混合液接收超声波的处理,超声诱导的空化效应使得细胞膜能够短暂、可逆地开孔,细胞周围的spions得以进入细胞内,从而完成细胞的spions标记。其中,对塑料皿中的水温持续监测,通过加入冰块的方式使水温维持在10℃以下,为细胞存活提供了安全的微环境。
在将细胞悬浮液和spions溶液在本发明实施例1提供的基于超声的流式细胞磁标记的微装置中运行稳定后,在混合液出口5处用离心管收集样品,用细胞离心机离心得到细胞沉淀,再用磷酸盐缓冲液(pbs)洗涤三次,得到磁标记的细胞。分别测试并计算磁标记细胞的平均载磁量、细胞的活性以及细胞的增殖特性。测试结果为,采用本发明实施例1提供的基于超声的流式细胞磁标记的微装置进行dc2.4细胞的spions标记,在2min内可完成细胞磁标记,细胞的平均载磁量在19pg/cell以上,细胞存活率为94%以上,细胞的正常增殖特性维持在92%以上。这个结果表明,本方案提供的基于超声的流式细胞磁标记的微装置在不影响细胞活性和基本功能的条件下,可以连续、快速、安全和高效地对细胞进行磁标记。
以上实施例仅为说明本发明的基本原理和较佳实施例而已,但本发明并不受上述实施例的限制。在不脱离本发明精神和范围下所做的任何替换、变化和改进等,均应包含在本发明的保护范围之内。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!