SARS-CoV-2检测试剂盒的制作方法
sars-cov-2检测试剂盒
技术领域
1.本发明涉及病毒检测技术领域,具体而言,涉及一种sars-cov-2检测试剂盒。
背景技术:
2.新型冠状病毒(sars-cov-2,亦被称为2019-ncov、hcov-19)属于β属的冠状病毒,颗粒呈圆形或椭圆形直径60nm~140nm,基因特征与sars具有明显的区别,且相比于sars具有更高的感染能力。基于流行病学调查,covid-19 的潜伏期为1~14天,多为3~7天,症状以发热、干咳、乏力为主,重症患者多在发病一周后出现呼吸困难和/或低氧血症,严重者可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出现凝血功能障碍及多器官功能衰竭等。因此,如何快速确诊疑似病例,以及如何有效监控疾病进程,将为治疗covid-19,打好疫情攻坚战的重点。
3.据《新型冠状病毒肺炎诊疗方案(试行第六版)》中规定,目前确诊covid-19 的方法为使用实时荧光rt-pcr检测新型冠状病毒核酸阳性,或病毒基因测序与已知的新型冠状病毒高度同源。但疫情发展至今,核酸检测试剂的漏检问题一再暴露,阳性检出率只有30%~50%,主要是由于检测方式的局限性造成的。核酸检测,一般是通过收集鼻咽拭子、疑似患者的痰、血液、粪便,提取其中的 rna片段进行荧光rt-pcr,采样过程中会混入大量人体细胞、细菌,进而造成待测rna丰度低,检测系统无法检测,最终导致假阴性的产生。同时,除抽血外,其余采样方式均会造成采样人员暴露于可能含有病原体的环境中,有潜在的感染风险。而且核酸检测样品的制备过程,需要步骤多、操作时间长,对检测人员的技术水平要求高。
技术实现要素:
4.本发明涉及一种sars-cov-2检测试剂盒,其包括a)与固相支持物偶联的 rbd特异性配体,b)偶联有吖啶类荧光团的标记物的rbd重组蛋白,以及:
5.用于溶解a组分的第一缓冲液,ph=5.5~6.5;
6.用于溶解b组分的第二缓冲液,ph=5.5~8.5;
7.用于裂解样本以释放病毒中的rbd抗原的第三缓冲液,ph=3.0~4.5。
8.本发明所提供的试剂盒采用rbd重组蛋白与样本中的rbd蛋白竞争与固相支持物偶联的rbd特异性配体,再检测rbd重组蛋白上的吖啶类荧光团即可进行定量分析。
9.本试剂第一缓冲液ph略偏酸性,能够将经过第三缓冲液处理的样品中ph 调整至抗原与包被于固相支持物上的rbd特异性配体结合的合适ph条件,适合于吖啶类荧光团的发光检测,提高检出率和准确性。在检测过程中,无需对样品进行rna提取操作,检测步骤较少,操作时间缩短,可避免因rna丰度低导致的假阴性结果。而且可配合使用自动的化学发光测定仪,减少了人员与可能携带病原体样本的接触,最大程度上降低感染几率。同时,化学发光技术本身检测灵敏,检测速度快,远远优于核酸检测。
附图说明
10.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
11.图1为本发明一个实施例中转染后的细胞样品wb图。
具体实施方式
12.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
13.因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
14.本发明涉及一种sars-cov-2检测试剂盒,其包括a)与固相支持物偶联的 rbd配体,b)偶联有吖啶类荧光团的标记物的rbd重组蛋白,以及:
15.用于溶解a组分的第一缓冲液,ph=5.5~6.5;还可以选择5.7、5.9、6.0、6.1、 6.3;
16.用于溶解b组分的第二缓冲液,ph=5.5~8.5;还可以选择6.0、6.5、7.0、7.5、 8.0;
17.用于裂解样本以释放病毒中的rbd抗原的第三缓冲液,ph=3.0~4.5,还可以选择3.5、3.8、4.0、4.2。
18.第三缓冲液是通过研究证实的,在保证抗原活性的情况下,将其从样本中分离出来最优条件。
19.如本文使用的术语“缓冲液”指水溶液或组合物,当酸或碱加入该溶液或组合物中时,所述水溶液或组合物抵抗ph中的变化。这种对ph变化的抗性是由于此类溶液的缓冲性质。因此,显示出缓冲活性的溶液或组合物被称为缓冲液或缓冲溶液。缓冲液一般不具有无限的维持溶液或组合物的ph的能力。相反,它们一般能够维持在特定范围内的ph,例如ph 3~ph 9。一般地,缓冲液能够维持在其pka上和下一个对数内的ph(参见例如,mohan,buffers,a guide for thepreparation and use of buffers in biological systems,calbiochem,1999)。缓冲液和缓冲溶液一般由缓冲盐或优选非离子缓冲液组分如tris和hepes制备。可以在本发明的方法中使用的缓冲液优选选自磷酸盐缓冲液(pb)、磷酸盐缓冲盐水缓冲液(pbs)、2-氨基-2羟甲基-1,3-丙二醇(tris)缓冲液、2-(n-吗啉代) 乙磺酸(mes)、tris缓冲盐水溶液(tbs)和tris/edta(te)。
20.在一些实施方式中,所述第一缓冲液中的缓冲组分主要为mes,浓度为20 mm~100mm,还可以选择40mm、60mm、80mm。
21.在一些实施方式中,所述第二缓冲液中的缓冲组分主要是pbs,浓度为10 mm~
50mm,还可以选择20mm、30mm、40mm。
22.在一些实施方式中,所述b组分溶解于所述第二缓冲液中,且浓度为1ug/ml ~400ug/ml。
23.在本发明中,若无特别强调,则浓度一般为工作浓度。
24.在一些实施方式中,所述第三缓冲液中的缓冲组分主要是柠檬酸盐与有机酸的混合组分;有机酸可以更好的提供缓冲效果。
25.在一些实施方式中,所述有机酸选自乙酸、乙二酸、苹果酸和水杨酸中的至少一种;
26.在一些实施方式中,所述第三缓冲液中的缓冲组分主要是柠檬酸盐10mm ~50mm,还可以为20mm、30mm、40mm;乙酸0.5mm~2mm,还可以为1mm 或1.5mm。
27.在一些实施方式中,所述第三缓冲液中的用于裂解的成分选自tween和/或 triton;
28.在一些实施方式中,所述tween选自tween-20和/或tween-80;
29.在一些实施方式中,所述tween的浓度为0.1%~2%,例如0.5%、1%、1.5%。
30.本发明试剂盒可处理的样本类型可以包括例如:
31.咽拭子、鼻拭子、鼻炎抽取物、深咳痰液、呼吸道抽取物、支气管灌洗液、肺泡灌洗液、血液、血清、血浆。
32.在一些实施方式中,所述第一缓冲液、所述第二缓冲液和所述第三缓冲液中的至少一种中还含有防腐剂。
33.在一些实施方式中,所述防腐剂选自nan3、proclin-300、proclean-150。
34.在一些实施方式中,所述第一缓冲液和/或所述第二缓冲液中还含有封闭剂;
35.在一些实施方式中,所述封闭剂选自bsa、抗人igg抗体、血清和igg中的至少一种。
36.抗人igg抗体能够通过吸附样本中的igg抗体使与人igg结合的rf抗体发生聚沉,避免样本中的rf抗体通过非特异结合,结合到捕获抗体上干扰测试结果,从而提高检测的特异性。bsa、血清、igg也可以起到封闭的作用。
37.在一些实施方式中,所述固相支持物为磁珠。
38.所述磁性微球的粒径可以为0.2μm~5μm;
39.磁性微球的粒径还可以选择0.5μm、1μm、2μm、3μm、4μm。
40.所述磁珠可选为γfe2o3或fe3o4磁性纳米粒子。
41.可选的,所述磁珠溶解于所述第一缓冲液中,且浓度为0.05mg/ml~0.5mg/ml,可以选择0.10mg/ml、0.15mg/ml、0.20mg/ml、0.25mg/ml、0.30mg/ml、0.35mg/ml、 0.40mg/ml、0.45mg/ml。
42.在一些实施方式中,所述rbd重组蛋白其从n端到c端依次具有信号肽序列、seq id no:1所示的rbd蛋白序列、seq id no:2所示的跨膜结构域序列以及seq id no:3所示的标签序列。
43.棘突蛋白(spike protein)是冠状病毒最重要的表面膜蛋白,含有两个亚基 (subunit),s1和s2。其中s1主要包含有受体结合区(receptorbinding domain, rbd),负责识别细胞的受体。spike蛋白承担病毒与宿主细胞膜受体结合及膜融合功能,是宿主中和抗体的重要作用位点以及疫苗设计的关键靶点。 sars-cov-2的spike蛋白与人ace2互作来感
染人的呼吸道上皮细胞。
44.seq id no:1所示的rbd蛋白序列为sars-cov-2保守序列,有利于提高检出率以及检测灵敏度和特异性。跨膜结构域以及标签肽段连接在rbd蛋白的c端,一方面跨膜结构域将重组蛋白留在细胞膜上,有利于蛋白的稳定,同时方便通过离心收集细胞富集蛋白;另一方面,rbd蛋白的c端胞内标签肽段,可以使用相应的标签抗体捕获,省去了纯化蛋白的步骤。信号肽将rbd蛋白引导分泌至胞外,产生翻译后修饰,有利于形成正确的空间结构。因此在rbd蛋白c端融合跨膜结构域和c端标签肽段有利于重组蛋白的稳定,配合所述标签序列特异性的配体的使用,还能进一步提高检测的灵敏度和特异性。
45.在一些实施方式中,所述信号肽序列的序列如seq id no:4所示。
46.在一些实施方式中,所述rbd重组蛋白的制备方法,包括:
47.a)在适宜的条件下培养转染有能够表达所述重组rbd蛋白的宿主细胞,收集所述宿主细胞;
48.b)将所述宿主细胞与膜蛋白解离试剂共孵育;
49.c)将孵育液固液分离,收集上清中的rbd蛋白。
50.在本发明中,所述rbd特异性配体是能够与内源性rbd蛋白及所述的rbd 重组蛋白特异性结合的物质,例如,凝集素、受体、核酸适配体或抗体及抗体片段。本领域技术人员将理解,使用术语“特异性”表示,样品中存在的其它生物分子不与rbd蛋白发生显著的结合。特异性的配体对所述标签序列具有例如至少106l/mol,优选对其靶分子具有107l/mol、108l/mol、或更优选109l/mol的亲和力。在一些实施方式中,所述rbd特异性配体是ace2;其可以是天然提取也可以是重组表达的。
51.在一些实施方式中,所述吖啶类荧光团选自吖啶酯、吖啶酯磺酰胺、吖啶酯甲苯磺酰胺、吖啶酯对甲基磺酰胺、吖啶酯三氟甲基磺酰胺中的一种或多种。固相可以为近似球状的颗粒物。
52.下面将结合实施例对本发明的实施方案进行详细描述。
53.实施例1新冠病毒刺突蛋白的rbd蛋白的制备
54.选择新冠病毒刺突蛋白的rbd蛋白,氨基酸序列为:
55.nitnlcpfgevfnatrfasvyawnrkrisncvadysvlynsasfstfkcygvs ptklndlcftnvyadsfvirgdevrqiapgqtgkiadynyklpddftgcvia wnsnnldskvggnynylyrlfrksnlkpferdisteiyqagstpcngvegfn cyfplqsygfqptngvgyqpyrvvvlsfellhapatvcgpkkst(seq id no: 1);
56.信号肽,氨基酸序列为:
57.mfvflvllplvssqcv(seq id no:4);
58.跨膜结构域,氨基酸序列为:
59.elwlvlvavgagllllgliilll(seq id no:2);
60.标签肽段,氨基酸序列为:
61.wgqggthgqwnkpskp(seq id no:3)。
62.将信号肽、rbd蛋白、跨膜结构域、标签肽段依次连接,融合成rbd重组抗原,完整融合蛋白的dna序列为:
63.atgtttgtttttcttgttttattgccactagtctctagtcagtgtgttaatat tacaaacttgtgcccttttggtgaagtttttaacgccaccagatttgcatct gtttatgcttggaacaggaagagaatcagcaactgtg
ttgctgattattct gtcctatataattccgcatcattttccacttttaagtgttatggagtgtctcc tactaaattaaatgatctctgctttactaatgtctatgcagattcatttgtaa ttagaggtgatgaagtcagacaaatcgctccagggcaaactggaaagatt gctgattataattataaattaccagatgattttacaggctgcgttatagcttg gaattctaacaatcttgattctaaggttggtggtaattataattacctgtata gattgtttaggaagtctaatctcaaaccttttgagagagatatttcaactg aaatctatcaggccggtagcacaccttgtaatggtgttgaaggttttaatt gttactttcctttacaatcatatggtttccaacccactaatggtgttggtta ccaaccatacagagtagtagtactttcttttgaacttctacatgcaccagc aactgtttgtggacctaaaaagtctactgagctgtggctggtgctggtgg ccgtgggcgctggactgctgctgctgggactgatcatcctgctgctgtggg gtcaaggcggtacacatggtcaatggaacaagccttcgaagccgtga (seq id no:5)。
64.rbd重组蛋白的dna通过基因合成(通用生物系统(安徽)有限公司)获得。该rbd重组抗原的dna上游带有hind iii位点和kozak序列,下游带有ecor i位点。该dna经过相应的限制性内切酶酶切,连接到用hind iii和ecor i酶切后的穿梭表达载体pcdna3.1(+),得到重组质粒pcdna3.1(+)-rbd。
65.将该重组质粒转入大肠杆菌克隆菌株top 10,挑取单克隆菌落接种至100 ml含有100μg/ml氨苄青霉素的lb培养基中,37℃、200rpm培养过夜,用于提取重组质粒。重组质粒使用无内毒素质粒提取试剂盒(天根生化科技(北京)有限公司,dp120)提取。293t细胞铺皿培养至汇合度约85%时,转染重组质粒pcdna3.1(+)-rbd。
66.一皿细胞转染10μg质粒dna,质粒dna与pei质量比为1:5。将质粒 dna和pei各自与250μl pbs混匀后,将两种混合物涡旋混匀1min,室温静置15min后,均匀滴加于细胞培养皿中,混匀后置于培养箱培养48h。将转染后的细胞刮下,pbs重悬清洗细胞两次后,一皿细胞使用1ml 10mm na2hpo4/50mm nacl/1%triton x-100,ph7.4缓冲液(缓冲液a)重悬,并置于4℃环境中提取30min;16000g离心15min,上清即为提取的重组rbd抗原,-20℃保存备用。
67.经过以上提取步骤得到的目的蛋白通过wb检测确认有表达,检测目的蛋白有表达。因为rbd蛋白有糖基化位点,wb图显示的相对分子量比理论相对分子量大。电泳结果如图1所示。
68.实施例2试剂盒的制备
69.在本实施例中,试剂盒主要分为校准品和检测试剂,其中,检测试剂由3 部分组成:
70.r1磁珠组分:由包被了ace2的顺磁性磁珠和磁珠稀释液。其中ace2可以是天然提取也可以是重组表达的,磁珠浓度0.3mg/ml磁珠稀释液为常用的含有20mm mes、5%bsa、0.1%山羊抗人igg血清、防腐剂等成分的稀释液, ph在5.5。
71.r2吖啶组分:由标记了吖啶酯磺酰胺的重组rbd蛋白和吖啶稀释液组成,重组rbd蛋白浓度为100ug/ml,吖啶稀释液为含有10mm pbs、0.1%bsa、 mouse igg、防腐剂等成分的稀释液,ph在5.5。
72.r3抗原释放组分:由10mm柠檬酸盐、0.5mm苹果酸、0.5%tween-20、 0.1%防腐剂等组成,ph=3。
73.实施例3试剂盒的制备
74.在本实施例中,试剂盒主要分为校准品和检测试剂,其中,检测试剂由3 部分组成:
75.r1磁珠组分:由包被了ace2的顺磁性磁珠和磁珠稀释液。其中ace2可以是天然提取也可以是重组表达的,磁珠浓度0.5mg/ml磁珠稀释液为常用的含有100mm mes、0.1%bsa、10%山羊抗人igg血清、防腐剂等成分的稀释液,ph在6.5。
76.r2吖啶组分:由标记了吖啶酯三氟甲基磺酰胺的重组rbd蛋白和吖啶稀释液组成,重组rbd蛋白浓度为400ug/ml,吖啶稀释液为含有50mm pbs、 5%bsa、mouse igg、防腐剂等成分的稀释液,ph在8.5。
77.r3抗原释放组分:由50mm柠檬酸盐、2mm乙二酸、2%tween-80、0.5%防腐剂等组成,ph=4.5。
78.实施例4试剂盒的制备
79.在本实施例中,试剂盒主要分为校准品和检测试剂,其中,检测试剂由3 部分组成:
80.r1磁珠组分:由包被了ace2的顺磁性磁珠和磁珠稀释液。其中ace2可以是天然提取也可以是重组表达的,磁珠浓度0.15mg/ml磁珠稀释液为常用的含有60mm mes、3%bsa、5%山羊抗人igg血清、防腐剂等成分的稀释液, ph在6.0。
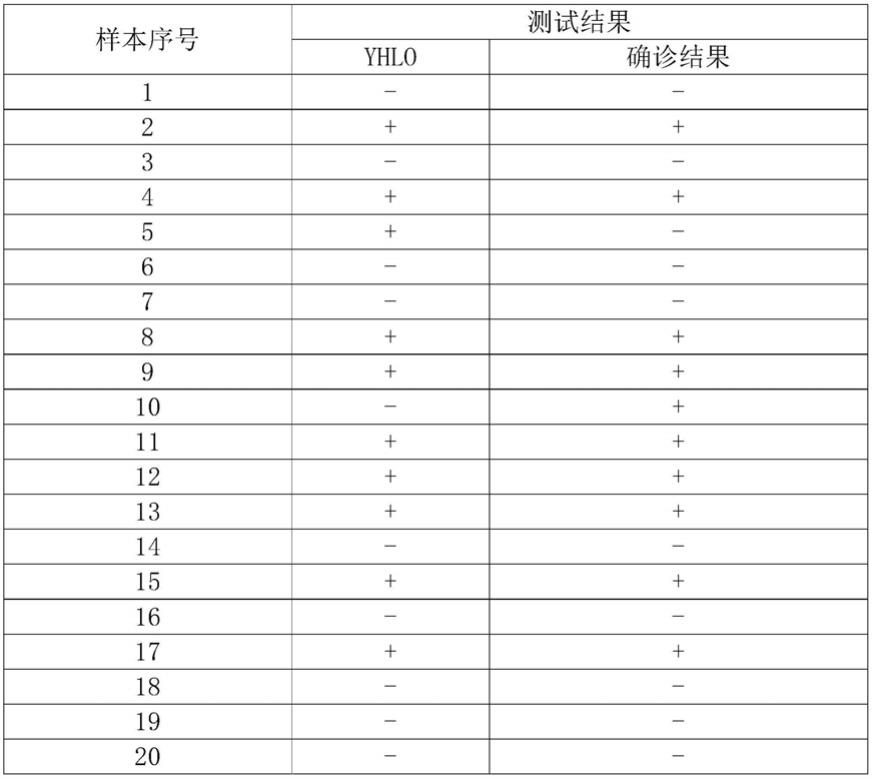
81.r2吖啶组分:由标记了吖啶酯的重组rbd蛋白和吖啶稀释液组成,重组 rbd蛋白浓度为200ug/ml,吖啶稀释液为含有30mm pbs、3%bsa、mouse igg、防腐剂等成分的稀释液,ph在6。
82.r3抗原释放组分:由25mm柠檬酸盐、1mm乙酸、1%tween-80、0.3%防腐剂等组成,ph 3.5。
83.实施例5试剂盒的使用
84.在本实施例中,试剂盒需与化学发光测定仪配套使用,其中清洗液、预激发液、激发液以及相应的清洗和发光读数步骤为测定仪的默认设定,其余步骤由人工设定程序,由测定仪处理完成。
85.第一步样本处理:设定程序,吸取20ul样本于反应杯中,并加入试剂100 ul r3组分,于37℃孵育5min,使可能与抗原结合的抗体充分释放。
86.第二步添加磁珠:向反应杯中添加50ul上述r1试剂组分,于37℃孵育 5min,样本中的抗原与包被于磁珠上的ace2结合,随后执行清洗程序,吸取未结合和吸附的样品;
87.第三步添加标记了吖啶的重组rbd蛋白:向反应杯中添加100ul上述r2 组分,并于37℃孵育5min,使带有发光标记物的spike蛋白s1亚基受体结合域与磁珠上未被结合的ace2充分反应,磁珠上的ace2-抗原复合物充分结合,随后执行清洗程序,洗去未结合的组分;
88.第四步测定待测物浓度:根据仪器预先设定好的发光程序,激发通过一系列反应结合在磁珠上的化学发光标记物,并由化学发光测定仪读取发光值;
89.第五步产生报告:根据校准曲线和参考区间,报告病人血样中新型冠状病毒抗原的含量,以辅助临床判断病情。
90.以实施例4试剂盒按照实施例5方法进行检测,检出结果如下表所示。
91.92.93.[0094][0095]
上表中共计做了100例样本,其中阴性符合率为96%,阳性符合率为90%;
[0096]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0097]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1