用于检测精子DNA碎片率的方法和试剂盒与流程
本申请属于体外诊断试剂领域,具体涉及用于检测精子dna碎片率的方法和试剂盒。
背景技术:
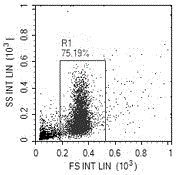
:dna是一种长链聚合物,组成单位为四种脱氧核苷酸,即:腺嘌呤脱氧核苷酸(damp)、胸腺嘧啶脱氧核苷酸(dtmp)、胞嘧啶脱氧核苷酸(dcmp)、鸟嘌呤脱氧核苷酸(dgmp)。脱氧核糖(五碳糖)与磷酸分子借由酯键相连,组成dna长链骨架,排列在外侧,四种碱基排列在内侧,遵循碱基互补配对原则。每个糖分子都与四种碱基中的一种相连,这些碱基沿着dna长链所排列而成的序列,可组成遗传密码,指导蛋白质的合成。精子的主要功能是保留并传递父辈的遗传信息。每个正常精子中含有23条染色体,其中dna含量为3.32pg/精子,而rna含量为0.2-0.3pg/精子,rna含量达到精子dna含量的6.02-9.04%。dna存在于精子内,被鱼精蛋白包裹呈致密的结构。由于dna存储着生物体赖以生存和繁衍的遗传信息,维护dna分子的完整性对细胞至关紧要。外界环境和生物体内部的因素都经常会导致dna分子的损伤或改变,而且与rna及蛋白质可以在细胞内大量合成不同,一般在一个原核细胞中只有一份dna,在真核二倍体细胞中相同的dna也只有一对,如果dna的损伤或遗传信息的改变不能更正,对体细胞就可能影响其功能或生存,对生殖细胞则可能影响到其后代。正常状态下,dna分子是完整的双链结构,而在体内由于多种原因会导致dna损伤,而损伤的dna会对生物个体的繁衍产生重大影响,因此,精子dna的碎片程度反映了精子遗传物质的完整性,对精子dna完整性检测是意义非凡的。精子dna完整性检测常用方法有:(1)精子染色质结构分析法(spermchromatinstructureanalysis,scsa):此方法可进行定量检测,敏感性高,操作方便,检测时间短,能在几秒钟的时间内快速检测5000-10000个精子细胞,直接、客观;目前已有标准化的诊断标准来衡量dna断裂程度。(2)精子染色质扩散法(spermchromatindispersion,scd):是流式细胞术发明之前检测dfi的标准方法,操作过程复杂,时间长,依赖主观判断。(3)彗星试验:定量检测,每次通过人工观察计数200-500个精子,检测时间长,方法复杂,主观性强,标准化困难。(4)末端标记法(tunel):可检测凋亡精子,因其灵敏可靠被广泛用于细胞凋亡的研究。但是tunel试验有待于建立标准化方法,尚难用于临床精子常规检测。(5)8-羟基脱氧鸟苷(8-ohdg)酶联免疫分析法:具有较高的灵敏度,需样品量小,是非损伤性的,快速而且选择性好。该方法存在一些缺点,如dna的不完全酶解,可导致检测值比真实值偏高。(6)荧光原位标记法:直接、客观、高效快速,但应用较窄,多用于染色体整倍体检测。以上各类技术的优缺点比较如下表:序号产品/技术名称原理特点1精子染色质结构分析法(scsa)吖啶橙与不同dna结合后发不同荧光,经流式细胞仪统计计数。简便、高效、快速、客观、稳定、易标准化,是目前能为临床提供的最佳技术。2精子染色质扩散法(scd)精子dna在酸处理后去除核蛋白,经dapi等染色后用显微镜观察。通过肉眼观察到核的扩散状况,速度慢,费时费力;检测结果依赖人的主观判断。3彗星试验(comet)单细胞凝胶电泳灵敏度高,但难以建立标准化方法,难以应用于临床。4末端标记法(tunel)外源性核苷酸在酶的催化下与凋亡细胞中的单链或双链相结合。可检测凋亡精子,灵敏可靠;但难以建立标准化方法,难以应用于临床。58-羟基脱氧鸟苷(8-ohdg)酶联免疫分析法液相色谱分析,即将dna酶水解样品用hplc分离后定量测定8-ohdg。较高的灵敏度;但存在dna的不完全酶解,导致检测值比真实值偏高;成本高、准确性低。6荧光原位杂交技术(fish)探针杂交。可检测染色体非整倍体,难以用于dna碎片检测。可见,与其他精子dna完整性检测方法相比较,基于流式细胞术的scsa方法的优势在于它是一种定量检测,敏感性高,操作方法简单,流式细胞仪快速检测能力大大缩短了检测时间,并能非常直接、客观、准确地分析数据,目前已经成为精子dna完整性检测的首选方法。该方法检测精子dna碎片率是基于吖啶橙检测法,吖啶橙与单链或双链dna结合不同的荧光,通过识别荧光颜色以及计数来计算精子dna碎片率值。但是,在传统流式细胞术检测精子dna时,精子中的rna也会成单链状态,同样与吖啶橙结合,发射的荧光与吖啶橙/单链dna结合发射的荧光一样,从而造成dna检测信号中包含了rna检测信号,这样的检测结果不能全面、准确、真实地反映精子dna本身状况。因此,亟需改进精子dna碎片率的检测方法并开发相关产品。技术实现要素:为了解决上述问题,一方面,本申请提供了基于流式细胞术检测精子dna碎片率的方法,其包括利用核糖核酸酶对精子试样进行消化处理的步骤。在具体实施方案中,所述核糖核酸酶为不含dna酶的核糖核酸酶a(rnasea)。在具体实施方案中,所述核糖核酸酶的浓度为0.01-1mg/ml。在另一具体实施方案中,所述核糖核酸酶的浓度为0.1mg/ml。在具体实施方案中,所述消化处理的温度为15-70℃。在另一具体实施方案中,所述消化处理的温度为37℃。在具体实施方案中,所述消化处理的时间为3-10分钟。在另一具体实施方案中,所述消化处理的时间为5分钟。在具体实施方案中,本申请提供的方法还包括在消化处理之前利用稀释缓冲液将精子试样稀释至1~2×106个/ml的步骤。在具体实施方案中,所述稀释缓冲液为以下的混合物:0.01mol/ltris-hcl(三羟甲基氨基甲烷盐酸盐),0.15mol/lnacl(氯化钠),1mmol/ledta(乙二胺四乙酸)和0.1%triton-x100(聚乙二醇辛基苯基醚);ph值为7.4。在具体实施方案中,本申请提供的方法还包括在消化处理之后利用酸化缓冲液处理精子试样,再加入吖啶橙染色液进行染色的步骤。在具体实施方案中,所述酸化缓冲液为以下的混合物:0.08mol/lhcl(盐酸),0.15mol/lnacl(氯化钠)和0.1%(聚乙二醇辛基苯基醚);ph值为1.2。在具体实施方案中,所述吖啶橙染色液为以下的混合物:0.1mol/l柠檬酸,0.2mol/lna2hpo4(磷酸氢二钠),1mmol/ledta,0.15mol/lnacl和6μg/ml吖啶橙。在具体实施方案中,本申请提供的方法还包括利用流式细胞仪对染色后的精子试样进行检测的步骤。在具体实施方案中,所述流式细胞仪检测时至少记录试样主群5000个细胞。另一方面,本申请提供了基于流式细胞术检测精子dna碎片率的试剂盒,其包括:稀释缓冲液,其为以下的混合物:0.01mol/ltris-hcl,0.15mol/l氯化钠,1mmol/l乙二胺四乙酸钠和0.1%triton-x100,ph值为7.4;核糖核酸酶a,其浓度为10-100mg/ml,于-20℃保存于50mmol/ltris-hcl(ph7.4)和50%(v/v)甘油的缓冲液中;酸化缓冲液,其为以下的混合物:0.08mol/l盐酸、0.15mol/l氯化钠和0.1%聚乙二醇辛基苯基醚,ph值为1.2;以及吖啶橙染色液,其为以下的混合物:0.1mol/l柠檬酸、0.2mol/l磷酸氢二钠、1mmol/l乙二胺四乙酸、0.15mol/l氯化钠和6μg/ml吖啶橙。在具体实施方案中,所述核糖核酸酶a不含dna酶。在具体实施方案中,所述核糖核酸酶a的使用终浓度为0.01-1mg/ml,优选0.1mg/ml。在具体实施方案中,所述核糖核酸酶a的使用温度为15-70℃,优选37℃。在具体实施方案中,所述核糖核酸酶a的使用时间为3-10分钟,优选5分钟。又一方面,还提供了本申请的试剂盒在检测精子dna碎片率中的应用。可见,本申请通过消除精子中rna后检测精子dna碎片率(dfi),检测结果更为准确,更能真实反映精子dna本身的情况,且不影响检测方法的快速、简便、高效、高通量、重复性强等特点。附图说明图1为精子细胞群图,其中用门圈中区域即为精子细胞主群。图2为精子细胞群荧光表达图,其中分为三群细胞,靠近fitc(纵轴)的细胞群即为dna完整性好的细胞群,靠近percp(横轴)的细胞群即为dna完整性差的细胞群,位于二者之间的细胞群为dna完整性较差的细胞群。具体实施方案为了能够更准确地测定精子dna碎片率,本申请发明人通过深入研究发现,消除精子中rna结合吖啶橙后发射荧光信号的负面影响,可显著提高检测结果的准确性,由此建立了一种消除rna后的精子dna碎片率检测方法。具体地,本申请提供的消除rna后的精子dna碎片检测方法包括以下步骤:(1)将液化的精液用37℃稀释缓冲液稀释精子至1~2×106个/ml;(2)将500μl稀释过的精子加入到流式细胞仪上样管中;(3)加入rna酶5μl,消化5分钟;(4)加入酸化处理缓冲液(酸化处理缓冲液主要成分为盐酸,目的是使紧密的dna变得结构较为松散,以便于后续染色步骤进行),30秒后加入吖啶橙染色液,染色1分钟后上机检测;(5)设定流式细胞仪的校准,将检测管上机,每管样本至少连续测定两次,每管样本至少记录样本主群5000个细胞并使用精子dna碎片率流式软件统计分析;(6)染色后的精子细胞悬液通过流式细胞仪收集精子的红绿荧光信号(即fitc与percp荧光信号),通过收集到的红色荧光精子占收集精子总数的比例,判定样本的dna碎片化程度;结果判断依据于建立的图像收集模板,主要是对荧光强度的要求(依据不同仪器的收集条件不同建立对应的模板,具体包括,以calibur仪器为例,fitc荧光强度中位数处于收集范围的中部为400~600,percp荧光强度中位数为50~100;(7)测定后,分别用漂白剂、进样管清洁剂和除菌的双蒸水彻底清除残留于流式细胞仪进样线中的细胞碎片和荧光染料。步骤(1)中所述的稀释缓冲液为0.01mol/ltris-hcl,0.15mol/lnacl(氯化钠),1mmol/ledta(乙二胺四乙酸),0.1%triton-x100的混合物,ph值为7.4。步骤(3)中所述的rna酶为一种不含dna酶的rna酶a,浓度为10-100mg/ml,-20℃保存于50mmol/ltris-hcl(ph7.4)和50%(v/v)甘油中,其用于消化精子中的rna,避免单链rna染色后发红色荧光,影响dna检测结果的准确性。步骤(4)中所述的酸化处理缓冲液为0.08mol/l盐酸,0.15mol/lnacl和0.1%triton-x100。步骤(4)中所述的吖啶橙染色液为0.1mol/l柠檬酸,0.2mol/lna2hpo4(磷酸氢二钠),1mmol/ledta,0.15mol/lnacl和6μg/ml吖啶橙。在酸化处理后利用吖啶橙染料与双链dna结合发绿色或黄色荧光,与单链dna结合发红色荧光的特性,确定精子dna碎片化程度。可见,本申请提供的精子dna碎片率检测方法,通过对精子样本进行处理、染色,消化精子中的rna,再通过荧光标记、流式上机检测精子dna碎片率,从而真实评估精子的dna损伤程度,为不育症检查、辅助生殖治疗方案的选择提供帮助。该方法避免了精子中rna结合吖啶橙发射荧光带来的信号,检测结果更准确,实现了精子dna碎片率检测的简单、快速、准确、高通量检测目的。在此基础上,本申请还提供了相应的用于精子dna碎片率检测的试剂盒及其应用。为了更好地理解本申请的内容,下面将结合具体实施例和附图作进一步说明。应当理解的是,这些实施例仅用于对本申请进一步说明而非限制本申请的范围。此外,在阅读了本申请所述的内容后,本领域技术人员对本申请所作出的一些非实质性的改动或调整,仍落入本申请的保护范围。下列实施例中的试剂、材料和方法,如无特殊说明,均为本领域的常规试剂、材料和方法。实施例1本实施例提供了利用本发明的方法检测精子dna碎片率,其中rnase酶消化效果检测包括以下步骤:1.1物品的准备:准备无菌、一次性塑料制品(离心管、tip头),trizol试剂、氯仿、异丙醇、75%乙醇、无rnase水、rnasea、核酸定量检测仪。1.2精子细胞总rna的提取及分离:1.2.1精子细胞的裂解(细胞量5×108个)将液化的精液于室温下,以800g的离心速度离心10分钟,彻底弃上清。加入1mltrizol,立即用移液器抽吸5次混匀。1.2.2室温静置5分钟。再加入0.25ml氯仿,用力颠倒离心管以混匀。静置5分钟后,室温下,以12000g的离心速度离心10分钟。1.2.3将上层水相小心地移至另一离心管中,再加入0.7倍体积的异丙醇,振荡混匀。室温放置10分钟。1.2.4室温下,以12000g的离心速度离心10分钟。小心地弃上清。1.2.5在离心管中加入500μl75%乙醇,振荡片刻后,离心5分钟。小心地弃上清。1.2.6室温静置15分钟使rna沉淀恰好干燥。1.2.7加入120μl水溶解rna。1.2.8混匀后取2μl,利用核酸定量检测仪测定a260值计算rna含量(见下表)。1.2.9将剩下的rna分成3份(分别为22、22、55μl):分别用于检测不同温度、不同消化时间、不同rnase浓度下rna的消化效果。1.2.9.1第一份rna中加入3μl10mg/ml的rnase,混匀后室温下分别消化1、2、3、4、5、6、7、8、9、10分钟后,从中取出2μl利用核酸定量检测仪测定rna含量(见下表)。1.2.9.2第二份rna中加入3μl10mg/ml的rnase,混匀后37℃下分别消化1、2、3、4、5、6、7、8、9、10分钟后,从中取出2μl利用核酸定量检测仪测定rna含量(见下表)。1.2.9.3第三份rna进一步分成10份(各5.4μl),分别加入0.6μl0.01mg/ml、0.05mg/ml、0.1mg/ml、0.25mg/ml、0.5mg/ml、0.75mg/ml、1.0mg/ml2.5mg/ml、5mg/ml、7.5mg/ml、10mg/ml的rnase,混匀后37℃下消化5分钟后,从中取出2μl利用核酸定量检测仪测定rna含量(见下表)。1.2.10根据下表rna含量检测结果,当rna含量基本检测不到(浓度<0.001μg/ml)时,优选的rnase终浓度为0.1mg/ml,优选的消化时间为5分钟,37℃消化温度效果优于室温。1.2.11核酸定量检测仪测定rna含量见下表:实施例2本实施例提供了利用不同的方法检测精子dna碎片率。具体地,包括以下步骤:2.样品的制备2.1将20份自然液化的精液(各样本体积为1.5-5.5ml,精子浓度为1500-20000万/ml)分成3份,分别采用以下3种方法检测精子dfi:方法a:消化rna的流式细胞术检测dfi;方法b:未消化rna后的流式细胞术检测dfi;方法c:精子染色质扩散法检测dfi;2.2方法a检测dfi:2.2.1用37℃缓冲液稀释精子至1~2×106个/ml;其中缓冲液为0.15mol/lnacl(氯化钠),1mmol/ledta(乙二胺四乙酸)混合物,ph值为7.4;2.2.2将500μl稀释过的精子加入到流式细胞仪上样管中,加入5μl10mg/mlrnasea(购自sigma公司),37℃消化5分钟;2.2.3之后,加入400μl酸化处理缓冲液0.08mol/l盐酸,剂置于冰盒中的冰上,30秒后再加入染色液(0.1mol/l柠檬酸,0.2mol/lna2hpo4(磷酸氢二钠),1mmol/ledta,0.15mol/lnacl,6μg/ml吖啶橙的混合物);2.2.4设定bdfacscalibur流式细胞仪的参数,开启488nm的氩离子激光器,调节好下面4个通道的电压并收集信号:ssc、fsc、fl1(波长515-545nm)、fl3(荧光光谱峰值落在深红色范围,波长>650nm);2.2.5将上样管上机,使染色后的精子细胞悬液通过流式细胞仪,设定样品流速为med(35μl/min);收集精子的ssc、fsc及红绿荧光信号(即fitc与percp荧光信号),收取模式为x和y轴参数预设为fsc-h1024、ssc-h1024、fl1-h1024、fl3-h1024;2.2.6每管样本至少连续测定两次,每管样本至少记录样本主群5000个细胞,使用facscalibur流式软件统计分析结果;通过流式细胞仪收集到的红色荧光精子占收集精子总数的比例来判定样本的dna碎片化程度。结果判断依据于建立的图像收集模板,主要是对荧光强度的要求,依据不同仪器的收集条件不同建立对应的模板,bdfacscalibur仪器的fitc荧光强度中位数处于收集范围的中部,为400~600;percp荧光强度中位数为50~100;2.2.7精子细胞群如图1所示,其中用门圈中区域即为精子细胞主群。精子细胞群荧光表达图如图2所示,其中分为三群细胞,靠近fitc(纵轴)的细胞群即为dna完整性好的细胞群,靠近percp(横轴)的细胞群即为dna完整性差的细胞群,位于二者之间的细胞群是完整性较差的细胞群;2.2.8测定后,分别用漂白剂、进样管清洁剂和除菌的双蒸水彻底清除残留于流式细胞仪进样线中的细胞碎片和荧光染料。2.3方法b检测dfi:2.3.1用37℃缓冲液稀释精子至1~2×106个/ml;其中缓冲液为0.15mol/lnacl(氯化钠),1mmol/ledta(乙二胺四乙酸)混合物,ph值为7.4;2.3.2后面的检测步骤同1.2.3-1.2.8。2.4方法c检测dfi:(该方法是将精子混合在琼脂糖中经过变性和裂解去掉核蛋白处理后,精子染色质穿过核膜和质膜围绕到精子周围,在精子周边形成棉絮或晕环样结构,再经瑞士-姬姆萨染液染色处理后,dna完整的精子会出现大晕环或中晕环,而存在dna碎片的精子则为小晕环或无晕环。判断标准:光晕与精子头直径比列>2/3为大光晕;光晕与精子头直径比例>1/4,而≤2/3为中光晕;光晕与精子头部直径比例≤1/4为小光晕。2.4.1按照下表配置和准备相关溶液:避光2-8℃存放。组成装量成分溶液120ml0.01mol/ltris-hcl(三羟甲基氨基甲烷-盐酸)、0.15mol/lnacl(氯化钠)、1mmol/ledta(乙二胺四乙酸)溶液2700μl1.0%低熔点琼脂糖溶液320ml0.08mol/l盐酸溶液420ml0.2mol/ldtt(二硫苏糖醇)、1mmol/ledta.2na(乙二胺四乙酸二钠)、2.5mol/lnacl(氯化钠)、0.2mol/ltris(三羟甲基氨基甲烷)、1%tritonx-100、0.05%tween-20溶液520ml2.0g/l瑞氏染料、2.0g/l姬姆萨染料、0.1g/l美蓝、20ml/l甘油于甲醇中溶液620ml0.3g/lkh2p04(磷酸二氢钾)、0.2g/lna2hpo4(磷酸氢二钠)载玻片10片包被0.65%琼脂糖2.4.2准备仪器和耗材:操作过程中用到设备,包括:普通光学显微镜、80℃恒温水浴箱、2~8℃与-20℃冰箱、恒温加热器、掌上离心机等;其他需要的材料,包括:22×22mm盖玻片、精液采样装置、一次性使用手套、1μl~5μl可调移液枪和一次性吸头、20μl~200μl可调移液枪和一次性吸头、1.5mlep管、3~5ml吸管、摄子、染色板、纯化水、70%/90%/100%乙醇溶液等。2.4.3检测前将室温调整至20~24℃左右;2.4.4使用溶液1调节精子浓度至5~10×106/ml;2.4.5将含溶液2的离心管置于80℃孵育5分钟,待完全融化后,用掌上离心机离心后置于金属恒温加热器上37℃待用(从80℃转移至37℃至少平衡5min后方可使用);2.4.6取精子浓度为5~10×106/ml处理好的样本30μl,加入溶液2中(注意在金属恒温加热器上37℃持续保温),充分混匀,37℃孵育待用;2.4.7迅速于载玻片包被区域加入上一步骤制备的精子悬液30μl。迅速盖上2~8℃冰箱预冷5min的盖玻片(勿对盖玻片施压),尽量避免产生气泡;37℃静置2min,置2~8℃冰箱5min,使其凝固;2.4.8从冰箱中取出载玻片,小心平移移去盖玻片(在移动盖玻片的过程中,盖玻片始终紧贴于载玻片平面滑动,切不可将盖玻片向上抬离凝胶平面)。2.4.9溶液4提前预热至25℃;吸取1ml溶液3滴加在载玻片上,孵育7min;沥干,ddh2o洗涤1次2.4.10吸取1ml溶液4滴加在载玻片上,孵育25min;沥干,ddh2o洗涤10min×两次2.4.11沥干,滴加70%酒精,2min;沥干,滴加90%酒精,2min;沥干,滴加100%酒精;2min;沥干,空气中自然干燥;2.4.12滴加溶液5(约0.5ml~0.8ml)于载玻片上,染色1min;2.4.13再将溶液6上面(滴加量是溶液1的2~3倍),以洗耳球吹出微风是两液充分混合,染色3~10分钟。2.4.14快速自来水温和冲洗(冲洗时不能先倒掉染液,应以流水冲去,以防止有沉渣沉淀在标本上),干燥。2.4.15镜检,取多个视野,计数200个以上的精子,计算精子dna碎片率。2.5三种方法检测dfi结果如下表:2.6采用两两均数配对t检验,发现:方法a与方法b比较有统计学差异(p=0.005<0.05);方法a与方法c比较没有统计学差异(p=0.546>0.05);方法b与方法c比较有统计学差异(p<0.05);统计学结果表明,方法a经过rna酶消化以后,检测到的dfi与方法c的结果一致;同时方法a的dfi结果比方法b偏小,推测其中rna的存在是造成dfi结果偏高的原因。上述说明并非对本申请的限制,本申请也并不限于上述举例。本
技术领域:
的普通技术人员在本申请的实质范围内,做出的变化、改型、添加或替换,也应属于本申请的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1