一种检测肾癌患者外周血循环肿瘤细胞PD-L1基因突变的试剂盒及检测方法与流程
本发明属于分子生物学技术领域,尤其涉及一种检测肾癌患者外周血循环肿瘤细胞pd-l1基因突变的试剂盒及检测方法。
背景技术:
肾细胞癌(renalcellcarcinoma,rcc)是泌尿系统最常见的恶性肿瘤之一,发病率和死亡率约占全身恶性肿瘤的2-3%,近几十年其发病呈上升趋势。根治性手术是治疗肾癌的有效手段,但约有20%~30%的肾癌患者就诊时已出现远处转移。即使经历肾癌根治手术,仍有20%~40%的患者会出现复发、转移。随着靶向药物的临床应用,晚期肾癌患者的生存期已经大大延长,但对高危转移性肾癌患者,单纯靶向治疗效果仍不理想,5年生存率不足10%。近年来,以pd-1/pd-l1为靶点的免疫疗法为肾细胞癌治疗带来了新的曙光。
研究发现,免疫抑制及免疫逃逸与肿瘤细胞pd-l1的过表达密切相关,肿瘤细胞可通过其表面的pd-l1与免疫细胞t细胞表面的pd-1结合,传导抑制性信号,使得t细胞不能识别、攻击肿瘤细胞,导致肿瘤细胞发生免疫逃逸。基于此理论提出假设,自原发灶脱落进入循环系统的循环肿瘤细胞(ctc)发生凋亡、免疫清除或存活、转移结局与其pd-l1表达水平密切相关。既往研究结果证实,pd-1或pd-l1免疫制剂的疗效多与肿瘤组织中pd-l1的表达水平有关,提示pd-l1可能是预测免疫治疗疗效的生物标志物,此外,还有研究表明肾细胞癌组织中pd-l1的高表达与肿瘤侵袭性呈正相关。因此,检测循环肿瘤细胞(ctc)pd-l1表达情况对肾细胞癌预后判断及免疫治疗疗效评估具有重要价值。
目前,山东省第一医科大学、山东省药物研究院联合山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司等单位,对于循环肿瘤细胞检测鉴定关键技术进行产业化推广的研究,本项目为山东省重大科技创新工程项目,本项目将以山东第一医科大学济南校区的山东省药物研究院为核心,落实注册人制度,依托循环肿瘤细胞检测鉴定核心诊断技术,进一步注册鉴定诊断试剂盒,以包括pd1、pd-l1、er、pr、her-2、gpc-3、vegf、p53、vimentin、tki-egfr、ras、ck、alk-d5f3、cd20、alk/eml4、beta-catenin、e-cadherin、ep-cam、hpv、idh-1、psa、psma、vegf、gfap、细胞角蛋白、ae1/ae3、雌激素受体、孕激素受体、bca-225、ca125、cea、ema、ercc1、hpv、ki-67、p53、top2a等作为ctcs表达的示踪剂,注册超灵敏、超快速、高覆盖、低成本、准确特异的鉴定诊断试剂盒,通过与在济南注册的山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司合作进行产业化推广。
技术实现要素:
为了克服晚期或复发肾癌患者无法实时或反复穿刺获取组织标本、进而不能评估患者pd-l1状态的不足,本发明提供了一种肾癌患者外周血循环肿瘤细胞pd-l1基因突变非诊断目的的检测方法:利用膜过滤装置分离获得无法获取组织标本的晚期或复发非肾癌患者外周血中的ctc,进一步运用免疫组化技术检测ctc的pd-l1表达情况。
本发明采用的技术方案如下:
一种检测肾癌患者外周血循环肿瘤细胞pd-l1基因突变的试剂盒,包括稀释液50ml、脱色液1ml、染色液a0.5ml、染色液b1ml、pd-l1(人)一抗100μl、山羊抗人igg/hrp100μl、0.1%tritonx-100100μl、0.3%h2o2100μl、6×pbs缓冲液60ml。
进一步地,所述稀释液是由1mmol/ledta+0.1%bsa+0.1%海藻糖+0.2%月桂醇聚氧乙烯醚组成。
进一步地,所述脱色液是由95%酒精与100%二甲苯按容积比1:1组成。
进一步地,所述染色液a为dab染色液;所述染色液b为苏木素染色液。
一种上述的试剂盒非诊断目的检测肾癌患者外周血循环肿瘤细胞pd-l1基因突变的方法,包括以下步骤:
(1)利用膜过滤装置分离获取无法获得组织标本的晚期或复发肾癌患者外周血中的ctc:采集无法获取组织标本的晚期或复发肾癌患外周血:肘正中静脉外周血5ml;
(2)外周血样预处理:将采集的外周血样采用稀释液进行10倍稀释,稀释后加多聚甲醛固定外周血样10分钟,固定终浓度为0.25%;
(3)利用膜过滤分离肿瘤细胞装置过滤外周血样,分离获得外周血ctc:将预处理的外周血样加入到膜过滤分离肿瘤细胞装置的血样容器中,使其依靠重力自然过滤;
(4)过滤结束后,从膜过滤分离肿瘤细胞装置中取下滤器,将循环肿瘤细胞染色液a液0.5ml加入到滤器中,染色3min,pbs缓冲液冲洗干净;滤液过滤完全后加入染色液b液1ml,染色2min,纯水1ml冲洗2次,取下滤膜,放置在载玻片上,干燥后在显微镜下观察,确定是否存在ctc;
(5)运用免疫组化技术检测ctc的pd-l1表达情况。
本发明检测ctc的pd-l1表达的具体方法如下:
(1)脱色:将带有ctc的滤膜从载玻片上取下,置于脱色液中浸泡4-6小时,脱去ctc染色液;
(2)滴加100μl0.1%tritonx-100,室温孵育15min,di水洗2min×3次;
(3)滴加100μl0.3%h2o2,室温孵育10min,pbs洗2min×3次;(4)滴加100μlpd-l1(人)一抗,室温孵育2h或4℃过夜,pbs洗2min×3次;
(5)滴加100μl山羊抗人igg/hrp,18~26℃温度下孵育20min,pbs洗2min×3次;
(6)滴加100μldab显色液,18~26℃孵育并随时在显微镜下观察显色情况,观察时间为3~10min;
(7)显色完成后,弃掉dab显色液,流水冲洗5min,苏木素染色5min;
(8)盐酸酒精分化8秒,自来水返蓝5min;
(9)将返蓝后的ctc采用75%乙醇(1min),95%乙醇(1min),100%乙醇(1min)梯度乙醇脱水,然后加入0.5ml试剂a,振荡均匀后,加入1ml试剂b,摇动混合均匀后,离心沉淀,将沉淀物采用中性树脂封固;
(10)光学显微镜下镜检。
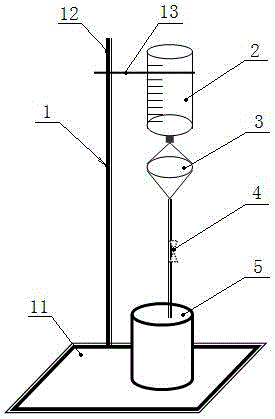
本发明所使用的膜过滤分离肿瘤细胞装置,包括滤器、血样容器、废液缸和铁架台,所述铁架台设有底座、立架和支架,所述血样容器通过支架设置于铁架台上部,血样容器的下方为滤器,滤器通过输液器联通至废液缸,废液缸设置于底座上。
所述滤器包括滤器上口、滤膜、载滤膜平台和滤器下口,滤膜置于载滤膜平台上;滤器上口接血样容器,滤器下口通过输液器接废液缸。
所述滤膜为疏水材料制成,其上均匀布满口径为8微米的滤孔。
本发明的有益效果是:
(1)本发明提供的检测方法,不用穿刺活检获取组织标本即可检测到晚期或复发肾癌患者pd-l1表达情况。该技术属于微创,并能够实时检测。
(2)本发明提供的方法,能够避免染色过程中可能产生的边缘效应导致的假阳性结果,稳定性好,降低细胞的损失,提高检测的准确性。
附图说明
图1为本发明的膜过滤装置结构示意图;
图2为本发明膜过滤装置的滤器的结构示意剖视图;
图3为本发明膜过滤装置的滤器滤膜的结构示意图;
图4为肾癌患者外周血分离获取的循环肿瘤细胞影像图;
图中:1铁架台、2血样容器、3滤器、4输液器、5废液缸、6滤器上口、7滤膜、8载滤膜平台、9滤器下口、10滤孔、11底座、12立架、13支架。
具体实施方式
下面结合附图和实施例对本发明阐述如下。
本发明所使用的试剂盒具体规格如表1所示:
表1
运用此技术方法分离获取并鉴定10例肾癌患者(同时检测10例正常人样本做阴性对照)外周血循环肿瘤细胞的实施例。
实施例1
一、利用膜过滤装置分离获取无法获得组织标本的晚期或复发肾癌患者外周血中的ctc,确定ctc是否存在:
自肘正中静脉采集空腹8-12小时的空腹血5ml,用45ml稀释液(成分:1mmol/ledta+0.1%bsa+0.1%海藻糖+0.2%月桂醇聚氧乙烯醚)稀释外周血,然后加入3ml的4%多聚甲醛固定稀释后的血样10分钟;
在固定的间期,组装膜过滤装置:如附图1、图2、图3所示,该过滤装置由滤器3、滤膜7、血样容器2、废液缸5、铁架台1构成;
用10mlpbs润湿滤器3,然后将固定好的外周血样加入到膜过滤装置的血样容器2中,使其依靠重力自然过滤,ctc被截留在滤膜7上;
肿瘤细胞直径一般大于15微米,而血细胞(包括红细胞、白细胞)直径一般小于8微米,因此当含有ctc的外周血经过滤后,血细胞因直径小于滤孔10能够被滤过,而ctc因直径大于滤孔10被截留在滤膜7上。
过滤结束后,从过滤装置中取下滤器3,打开并移走滤器上口6,将将循环肿瘤细胞染色液a液0.5ml加入到滤器中,染色3min,pbs缓冲液冲洗干净;滤液过滤完全后加入b液,1ml,染色2min,纯水1ml,pbs缓冲液将滤器3冲洗干净,用眼科镊子取下滤膜7,细胞面朝上,放置在载玻片上;
将滤膜干燥后在显微镜下观察,确定是否存在ctc。
通过观察,10例健康志愿者均未查到ctc;除1例晚期肾癌患者和1例复发肾癌患者未检测到ctc外,其余8例均检测到ctc(表1),本次检测阳性率为80%,值得注意的是,当稀释液不添加0.1%海藻糖或者不添加0.2%月桂醇聚氧乙烯醚时,单一的采用0.3%海藻糖或者0.3%月桂醇聚氧乙烯醚,制备的血样稳定性差,部分血样还会形成分层,血液细胞容易发生聚集和粘连,影响最终的检测效果。
表1实施例ctc检测结果
二、运用免疫组化技术检测ctc的pd-l1表达情况:
将载玻片上载有ctc的滤膜7从载玻片上取下,置于95%酒精与100%二甲苯按容积比1:1混匀的脱色液中浸泡4-6小时,脱去ctc染色液;滴加100μl0.1%tritonx-100,室温孵育15min,di水洗2min×3次;滴加100μl0.3%h2o2,室温孵育10min,pbs洗2min×3次;滴加100μlpd-l1(人)一抗,室温孵育2h(或4℃过夜),pbs洗2min×3次;滴加100μl山羊抗人igg/hrp,室温(18~26℃)孵育20min,pbs洗2min×3次;滴加100μldab显色液,室温(18~26℃)孵育并随时在显微镜下观察显色情况(一般为3~10min,时间不能超过10min);显色完成后,弃掉dab显色液,流水冲洗5min,苏木素染色5min;盐酸酒精分化8秒,自来水返蓝5min;75%乙醇(1min),95%乙醇(1min),100%乙醇(1min)梯度乙醇脱水,将沉淀物晾干,中性树脂封固;光学显微镜下镜检,细胞病理学专家阅片,根据细胞膜和细胞浆着色程度判定pd-l1表达情况。
图4为肾癌患者外周血分离获取的循环肿瘤细胞影像图,其中ctc细胞细胞核异型性,核质比大于0.8,细胞直径(长端)大于15μm,核深染(由于癌细胞染色质增多,颗粒变粗,核深染)其细胞核较大,细胞核形状不规则;高核质比。
所检测的循环肿瘤细胞应用免疫组化证实pd-l1的表达并与肾癌大体标本pd-l1结果对比,观察其差异,主要针对大体标本pd-l1表达阴性而循环肿瘤细胞表达阳性的患者,指导肾癌的靶向治疗,为肾癌靶向治疗提供新的思路。
- 还没有人留言评论。精彩留言会获得点赞!