光电流电极及光电免疫感测装置的制作方法
1.本发明涉及一种电极,特别是涉及一种光电流电极。
背景技术:
2.中国台湾专利公开第201528529号揭示一种金属纳米粒子修饰二氧化钛纳米线基板的方法,且包含下列步骤:(1)以水热法于一可透光导电玻璃基板上形成二氧化钛层,其中,该可透光导电玻璃基板例如表面具有氧化铟锡导电层的玻璃基板或表面具有氟掺杂氧化锡导电层的玻璃基板,该二氧化钛层包括长度为100~1000nm且宽度为5~50nm的二氧化钛纳米线;(2)于步骤(1)的二氧化钛层的二氧化钛纳米线的表面溅镀一层包括金属颗粒的第一金属层,获得一积层体,其中,该金属是选自金、银、铜,或上述任意组合;及(3)将步骤(2)的积层体以300~800℃的温度进行锻烧处理,以使该第一金属层转变成一第二金属层,其中,该第二金属层包括直径约5~50nm的金属纳米粒子。
3.该金属纳米粒子修饰二氧化钛纳米线基板具有局域性表面电浆共振(localized surface plasmon resonance,简称lspr)特性,而能够提高可见光的吸收度,因此,当应用于太阳能电池中,能够提高电池的发电效率。然而,虽该金属纳米粒子修饰二氧化钛纳米线基板能够提高可见光的吸收度,但提高幅度仍不佳。
技术实现要素:
4.本发明的一目的在于提供一种具有优异可见光吸收效益的光电流电极。
5.本发明光电流电极用于与可见光搭配使用以产生光电流。该光电流电极包含载板、第一纳米颗粒层、受该可见光激发而能够产生表面电浆共振的第二纳米颗粒层及半导体层。该第一纳米颗粒层包括多个间隔地且固定地结合在该载板的上表面的第一贵金属纳米颗粒。该第二纳米颗粒层设置在该第一纳米颗粒层上,且包括多个第二贵金属纳米颗粒。两相邻的第二贵金属纳米颗粒经由对应的第一贵金属纳米颗粒而形成电连接。所述第二贵金属纳米颗粒的平均粒径大于所述第一贵金属纳米颗粒的平均粒径。该半导体层设置在该第二纳米颗粒层上,且包括具有生物相容性的半导体纳米材料。
6.本发明的光电流电极中,所述第一贵金属纳米颗粒的平均粒径范围为1nm至20nm,而所述第二贵金属纳米颗粒的平均粒径范围为为50nm至200nm。
7.本发明的光电流电极中,每一第一贵金属纳米颗粒的材质选自于铜、金、银,或上述任意的组合。
8.本发明的光电流电极中,每一第二贵金属纳米颗粒为金纳米颗粒。
9.本发明的光电流电极中,该半导体层具有大于60%的孔隙率。
10.本发明的光电流电极中,该具有生物相容性的半导体纳米材料为纳米线半导体材料。
11.本发明的光电流电极中,该具有生物相容性的半导体纳米材料选自于氧化钛、氧化锌、氧化钨,或上述任意的组合。
12.本发明的光电流电极中,该载板的材质选自于玻璃、陶瓷、硅、碳化硅、氮化硅,或上述任意的组合。
13.本发明的另一目的在于提供一种光电免疫感测装置。
14.本发明光电免疫感测装置,包含:上述的光电流电极。
15.本发明的电免疫感测装置中,还包含设置在该光电流电极的半导体层上的分子探针。
16.本发明的有益效果在于:通过该第二纳米颗粒层产生的表面电浆共振效应(surface plasmon resonance,简称spr)及该半导体层与该第二纳米颗粒层在界面处形成作为电子吸收体的萧特基能障(schottky barrier)而促进电子与电洞的分离,有助于提高该光电流电极对可见光的吸收度,甚至是红外光的吸收,致使在太阳光或白光发光器的照射下该光电流电极具有优异的光电流密度。
附图说明
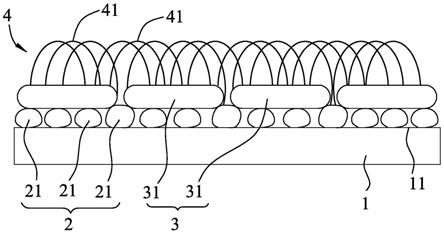
17.图1是本发明光电流电极的剖视示意图;
18.图2是一俯视图,说明本发明光电流电极的金属积层体;
19.图3是一俯视图,说明本发明光电流电极的金属积层体;
20.图4是一sem图,说明本发明光电流电极的金属积层体;
21.图5是一俯视图,说明本发明光电流电极的金属积层体及半导体层;
22.图6是一光吸收图谱,说明本发明光电流电极对可见光吸收的程度;
23.图7是一示意图,说明本发明光电免疫感测装置的第一实施例;
24.图8是一示意图,说明本发明光电免疫感测装置的第二实施例;
25.图9是一示意图,说明该第二实施例的光电免疫感测装置的光电流电极及安装单元。
具体实施方式
26.下面结合附图及实施例对本发明进行详细说明。
27.参阅图1,本发明光电流电极用于与可见光搭配使用以产生光电流。该光电流电极包含一片载板1、一层第一纳米颗粒层2、一层受该可见光激发而能够产生表面电浆共振的第二纳米颗粒层3,及一层半导体层4。
28.该载板1包括一个上表面11。该载板1例如光可穿透载板。该载板1的材质可单独一种使用或混合多种使用,且该载板1的材质例如但不限于玻璃、陶瓷、硅、碳化硅或氮化硅等。在本发明的一些实施态样中,该载板1的材质选自于玻璃、陶瓷、硅、碳化硅、氮化硅,或上述任意的组合。在本发明的具体例中,该载板1为玻璃载板。
29.该第一纳米颗粒层2包括多个间隔地且固定地结合在该载板1的上表面11的第一贵金属纳米颗粒21。在本发明的一些实施态样中,所述第一贵金属纳米颗粒21的平均粒径范围为1nm至20nm。每一第一贵金属纳米颗粒21的材质可单独一种使用或混合多种使用,且每一第一贵金属纳米颗粒21的材质例如铜、金或银等。在本发明的一些实施态样中,每一第一贵金属纳米颗粒21的材质选自于铜、金、银,或上述任意的组合。由于金纳米颗粒具有良好的导电率及良好的生物相容性,因此,在本发明的具体例中,每一第一贵金属纳米颗粒21
为金纳米颗粒。
30.该第二纳米颗粒层3设置在该第一纳米颗粒层2上,且包括多个间隔设置的第二贵金属纳米颗粒31。两相邻的第二贵金属纳米颗粒31经由对应的第一贵金属纳米颗粒21而形成电连接。所述第二贵金属纳米颗粒31的平均粒径大于所述第一贵金属纳米颗粒21的平均粒径。所述第二贵金属纳米颗粒31的平均粒径与所述第一贵金属纳米颗粒21的平均粒径的比值范围为5以上。在本发明的一些实施态样中,所述第二贵金属纳米颗粒31的平均粒径范围为50nm至200nm。每一个第二贵金属纳米颗粒31的材质可单独一种使用或混合多种使用,且每一个第二贵金属纳米颗粒31的材质例如金或银等。由于金纳米颗粒具有良好的导电率、良好的生物相容性及优异的表面电浆共振效应,因此,在本发明的具体例中,每一个第二贵金属纳米颗粒31为金纳米颗粒。
31.该半导体层4设置在该第二纳米颗粒层3上,且包括具有生物相容性的半导体纳米材料41。在本发明的一些实施态样中,该半导体层4的厚度范围为200nm至500nm。在本发明的一些实施态样中,该半导体层4具有大于60%的孔隙率。在本发明的一些实施态样中,该具有生物相容性的半导体纳米材料41为纳米线半导体材料。该具有生物相容性的半导体纳米材料41可单独一种使用或混合多种使用,且该具有生物相容性的半导体纳米材料41例如但不限于金属氧化物。该金属氧化物例如氧化钛、氧化锌,或氧化钨等。在本发明的一些实施态样中,该具有生物相容性的半导体纳米材料41选自于氧化钛、氧化锌、氧化钨,或上述任意的组合。由于二氧化钛具有优异的光催化效率、光化学稳定性、生物相容性、耐腐蚀性等优点,因此,在本发明的具体例中,该具有生物相容性的半导体纳米材料41为二氧化钛纳米线。
32.本发明光电流电极能够作为光触媒电极,且通过该第二纳米颗粒层3产生的表面电浆共振效应及该半导体层4与该第二纳米颗粒层3在界面处形成作为电子吸收体的萧特基能障而促进电子与电洞的分离,有助于该光触媒电极对可见光的吸收,致使在太阳光或白光发光器的照射下该光触媒电极具有优异的光催化效率。
33.《光电流电极的制备方法》
34.本发明上述光电流电极的制备方法,包含以下步骤:步骤(a),在一片载板的上表面沉积一层贵金属沉积膜;步骤(b),对该贵金属沉积膜施予微波电浆处理,而转变成一层第一纳米颗粒层,其中,该第一纳米颗粒层包括多个间隔地且固定地结合在该载板的上表面的第一贵金属纳米颗粒;步骤(c),在该第一纳米颗粒层的表面上形成胺基硅氧烷层,然后,将包含多个贵金属纳米颗粒的溶液施予在该胺基硅氧烷层的表面上;步骤(d),重复步骤(c),形成一个包括交替堆叠的多层胺基硅氧烷层及多层贵金属纳米颗粒层的积层体;步骤(e),对步骤(d)的积层体施予微波电浆处理,以至于所述胺基硅氧烷层被移除且所述贵金属纳米颗粒层的所述贵金属纳米颗粒在该第一纳米颗粒层的表面上形成多群间隔设置的贵金属纳米团簇;步骤(f),加热所述贵金属纳米团簇,以至于所述贵金属纳米团簇分别转变成多个第二贵金属纳米颗粒,而构成一层设置在该第一纳米颗粒层的表面的第二纳米颗粒层;及,步骤(g),在该第二纳米颗粒层的表面上形成一层半导体层,且该半导体层包括具有生物相容性的半导体纳米材料。
35.在本发明的一些实施态样中,该步骤(a)是采用溅镀来进行。该步骤(b)的第一纳米颗粒层如上所述,所以不再赘述。该步骤(c)是将包含胺基硅氧烷及溶剂的溶液施予在该
第一纳米颗粒层的表面上,然后,移除该溶剂,形成该胺基硅氧烷层。该胺基硅氧烷例如但不限于3-(胺基丙基)三甲氧基硅烷[(3-aminopropyl)trimethoxysilane,简称aptms]。在本发明的一些实施态样中,该步骤(g)是使半导体前驱材料沉积在该第二纳米颗粒层的表面上,然后,浸泡于碱溶液中,接着,进行热处理,形成该半导体层。该半导体前驱材料是依据上述半导体纳米材料来选择,举例来说,该半导体纳米材料为氧化钛,则该半导体前驱材料为钛。
[0036]
《光电免疫感测装置》
[0037]
参阅图7,本发明光电免疫感测装置的第一实施例,用来感测目标物10,且包含一个光电免疫传感器5、一个容置该光电免疫传感器5的安装单元6、一个光学单元7,及一个讯号处理器8。该目标物10例如甲型胎儿蛋白(alpha-fetoprotein,简称afp)、免疫蛋白、药物、抗原、抗体、致病因子、葡萄糖(glucose)、半胱氨酸(cysteine),或谷胱甘肽(glutathione)等。
[0038]
该光电免疫传感器5包括上述的光电流电极51,及与该光电流电极51间隔设置的一个参考电极52和一个辅助电极53。该参考电极52例如银/氯化银电极(ag/agcl electrode)。该辅助电极53例如碳电极(carbon electrode)。值得说明的是,依据应用需求,该参考电极52是可省略的。
[0039]
该安装单元6包括一个具有一个供该光电免疫传感器5及该目标物10设置的容置槽60的反应容器。
[0040]
该光学单元7用来提供照射该光电流电极51的光源。该光学单元7包括一个发光器71、一个位于该发光器71下游的单色仪72,及一个位于该单色仪72下游的斩波器73。该发光器71例如白光发光器。该白光发光器例如白光发光二极管(white light-emitting diode)。值得说明的是,依据应用需求,该单色仪72及该斩波器73是可省略的。
[0041]
在本发明光电免疫感测装置的第一实施例的变化态样中,该光电免疫传感器5还包含设置在该光电流电极51的半导体层上的具有专一性的分子探针。该分子探针能够与该目标物10专一性地结合。该分子探针例如但不限于免疫蛋白、酵素、核酸、抗体,或抗原等。该酵素例如葡萄糖氧化酶(gox)、乙酰胆碱酯酶(ache)、碱性磷酸酶(alp)、辣根过氧化物酶(hrp),或葡萄糖脱氢酶(gdh)等。该抗体例如甲型胎儿蛋白抗体(anti alpha-fetoprotein,简称anti-afp)。
[0042]
当该光学单元7照射该光电免疫传感器5的光电流电极51时,该光电流电极51能够产生表面电浆共振的第二纳米颗粒层与该半导体层间的电荷转移,从而产生氧化还原反应,并利用一台电连接该光电免疫传感器5的讯号处理器8(例如计算机),获得一个第一光电流密度讯号,而当该光电免疫感测装置与该目标物10接触时,能够获得一个第二光电流密度讯号,此时,依据该第一光电流密度讯号与该第二光电流密度讯号间的差异,能够对该目标物10进行定性或定量的分析。
[0043]
参阅图8及图9,本发明光电免疫感测装置的第二实施例与该第一实施例的不同主要在于:在该第二实施例中,该安装单元6为一个线路基板62,且该线路基板62具有三条导电线路621及三个分别电连接所述导电线路621的讯号输出端622,而该光电免疫传感器5的光电流电极51、该参考电极52及该辅助电极53设置在该线路基板62上并分别与所述导电线路621电连接。
[0044]
在本发明光电免疫感测装置的第二实施例的一个变化态样中,该光电免疫传感器5还包含设置在该光电流电极51的半导体层上的具有专一性的分子探针。该分子探针如上所述,所以不再赘述。
[0045]
本发明将就以下实施例来作进一步说明,但应了解的是,所述实施例仅为例示说明用,而不应被解释为本发明实施的限制。
[0046]
实施例1
[0047]
步骤(a),使一片玻璃载板经洗净处理及干燥处理,获得一片经处理的玻璃载板。将该经处理的玻璃载板及金靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的玻璃载板的上表面形成一层厚度为1.5nm的溅镀金膜。
[0048]
步骤(b),对该溅镀金膜施予微波电浆处理,使该溅镀金膜转变成一层厚度为10nm的第一纳米颗粒层,从而获得第一积层体,其中,该第一纳米颗粒层包括多个间隔地且固定地镶嵌在该经处理的玻璃载板的上表面的第一金纳米颗粒,且所述金纳米颗粒的平均粒径为10nm。将该第一积层体利用电浆进行10分钟表面处理,获得经电浆处理的第一积层体。
[0049]
步骤(c),将1毫升的氯金酸溶液[包括水及氯金酸(tetrachloroauric acid,haucl4)及79毫升的纯水混合,然后,加入1毫升的柠檬酸三钠溶液(包括水及柠檬酸三钠,其中,在该柠檬酸三钠溶液中该柠檬酸三钠的浓度为4wt%),接着,加入0.1毫升的单宁酸溶液[包括水及单宁酸(tannic acid),其中,在该单宁酸溶液中该单宁酸的浓度为1wt%],最后,加入0.05毫升的碳酸钾水溶液(包括去离子水及碳酸钾,其中,在该碳酸钾水溶液中该碳酸钾的浓度为50mm),获得一混合液。将该混合液于60℃搅拌1小时,接着,冷却至5℃,获得金纳米颗粒溶液,其中,该金纳米颗粒溶液包括多个粒径为10nm的金纳米颗粒。将步骤(b)的该经电浆处理的第一积层体浸泡于胺基硅氧烷溶液[购自aldrich;成分包含3-(胺基丙基)三甲氧基硅烷]中30分钟,而于该经电浆处理的第一积层体的第一纳米颗粒层上形成一层胺基硅氧烷层,接着,取出并以浸渍法浸泡于该金纳米颗粒溶液中,然后,取出并利用乙醇清洗,接着,利用氮气吹干,而于该胺基硅氧烷层上形成一层厚度为10nm且包括多个间隔设置的金纳米颗粒的金纳米粒子结构,从而获得第二积层体。
[0050]
步骤(d),将步骤(c)的第二积层体重复进行上述步骤(c),共重复五次,从而获得第三积层体,而该第三积层体包括该经处理的玻璃载板、形成在该经处理的玻璃载板上的该第一纳米颗粒层、六层胺基硅氧烷层,及六层与所述胺基硅氧烷层交替堆叠地设置的金纳米粒子结构。
[0051]
步骤(e),将该第三积层体置于真空度为10-7
torr的环境中,并导入压力为10-1
至10-5
torr的氩气,接着,对该第三积层体进行微波电浆处理,以使所述胺基硅氧烷层被移除及所述金纳米粒子结构的金纳米颗粒进行团簇(cluster),而在该第一纳米颗粒层的表面上形成多群间隔设置的金纳米团簇。
[0052]
步骤(f),于500℃加热步骤(e)的所述金纳米团簇,以使每一个金纳米团簇融合而转变成一个第二金纳米颗粒,致使获得一层厚度为60nm且包括由所述金纳米团簇分别转变成的所述第二金纳米颗粒的第二纳米颗粒层,从而获得第四积层体,其中,在该第二纳米颗粒层中所述第二金纳米颗粒的平均粒径为60nm。
[0053]
步骤(g),将该第四积层体经洗净处理及干燥处理,会得经处理的第四积层体。将该经处理的第四积层体及钛靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的第
四积层体的第二纳米颗粒层的上表面形成一层厚度为50nm的钛层,获得第五积层体。将该第五积层体置于一个高压釜(autoclave)中,并将13毫升的氢氧化钠水溶液(包括水及氢氧化钠,其中,在该氢氧化钠水溶液中该氢氧化钠的浓度为5m)加入至该高压釜内,接着,将该高压釜放入一台高温炉中,并于80℃进行1小时水热反应,致使该钛层转变成厚度为248.6nm且包括二氧化钛纳米线的二氧化钛层,从而获得第六积层体,其中,该二氧化钛层的孔隙率为83%。待该水热反应结束后,自该高温炉中取出该高压釜,并置于冷水浴中进行降温处理,然后,将该第六积层体自该高压釜中取出,并以硝酸水溶液(包括水及硝酸,其中,在该硝酸水溶液中该硝酸的浓度为0.1m)清除该第六积层体的表面上未反应完的氢氧化钠水溶液,然后,利用去离子水清洗,接着,浸泡于乙醇中约5秒,再以氮气枪吹干,最后,置于该高温炉中,并于500℃进行1小时锻烧处理,从而获得本发明光电流电极,其中,在该光电流电极中,该第一纳米颗粒层的厚度为10nm、该第二纳米颗粒层的厚度为90nm,及该二氧化钛层的厚度为227.3nm。
[0054]
实施例2
[0055]
该实施例2与该实施例1的方法类似,不同在于:不进行步骤(f)的锻烧处理。
[0056]
比较例1
[0057]
步骤(a),使一片表面具有氟掺杂氧化锡导电层的玻璃基板经洗净处理及干燥处理,获得一片经处理的玻璃载板。将该经处理的玻璃载板及金靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的玻璃载板的上表面形成一层厚度为10nm的溅镀金膜,接着,对该溅镀金膜施予微波电浆处理,使该溅镀金膜转变成一层厚度为10nm的第一纳米颗粒层,从而获得第一积层体,其中,该第一纳米颗粒层包括多个间隔地且固定地镶嵌在该经处理的玻璃载板的上表面的金纳米颗粒,且所述金纳米颗粒的平均粒径为10nm。将该第一积层体利用电浆进行10分钟表面处理,获得经电浆处理的第一积层体。
[0058]
步骤(b),将该经电浆处理的第一积层体经洗净处理及干燥处理,会得经处理的第一积层体。将该经处理的第一积层体及钛靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的第一积层体的第一纳米颗粒层的上表面形成一层厚度为50nm的钛层,从而获得第二积层体。将该第二积层体置于一个高压釜中,并将13毫升的氢氧化钠水溶液(包括水及氢氧化钠,其中,在该氢氧化钠水溶液中该氢氧化钠的浓度为5m)加入至该高压釜内,接着,将该高压釜放入一台高温炉中,并于80℃进行1小时水热反应,致使该钛层转变成厚度为248.6nm且包括二氧化钛纳米线的二氧化钛层,从而获得第三积层体。待该水热反应结束后,自该高温炉中取出该高压釜,并置于冷水浴中进行降温处理,然后,将该第三积层体自该高压釜中取出,并以硝酸水溶液(包括水及硝酸,其中,在该硝酸水溶液中该硝酸的浓度为0.1m)清除该第三积层体的表面上未反应完的氢氧化钠水溶液,然后,利用去离子水清洗,最后,浸泡于乙醇中约5秒,再以氮气枪吹干,形成第四积层体。
[0059]
步骤(c),于步骤(b)的第四积层体的二氧化钛层的二氧化钛纳米线的表面溅镀一层包括多个间隔设置且平均粒径为10nm的金颗粒的第一金层,接着,以500℃进行锻烧处理,以使该第一金层转变成一第二金层,从而获得光电流电极,其中,该第二金层包括平均粒径为10nm的金粒子。
[0060]
比较例2
[0061]
步骤(a),使一片表面具有氟掺杂氧化锡导电层的玻璃基板经洗净处理及干燥处
理,获得一片经处理的玻璃载板。将该经处理的玻璃载板及金靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的玻璃载板的上表面形成一层厚度为1nm的溅镀金膜,接着,对该溅镀金膜施予微波电浆处理,使该溅镀金膜转变成一层厚度为10nm的第一纳米颗粒层,从而获得第一积层体,其中,该第一纳米颗粒层包括多个间隔地且固定地镶嵌在该经处理的玻璃载板的上表面的金纳米颗粒,且所述金纳米颗粒的平均粒径为10nm。将该第一积层体利用电浆进行10分钟表面处理,获得经电浆处理的第一积层体。
[0062]
步骤(b),将该经电浆处理的第一积层体经洗净处理及干燥处理,会得经处理的第一积层体。将该经处理的第一积层体及钛靶材置于一台磁控溅镀机中进行溅镀处理,而于该经处理的第一积层体的第一纳米颗粒层的上表面形成一层厚度为50nm的钛层,从而获得第二积层体。将该第二积层体置于一个高压釜中,并将13毫升的氢氧化钠水溶液(包括水及氢氧化钠,其中,在该氢氧化钠水溶液中该氢氧化钠的浓度为5m)加入至该高压釜内,接着,将该高压釜放入一台高温炉中,并于80℃进行1小时水热反应,致使该钛层转变成厚度为248.6nm且包括二氧化钛纳米线的二氧化钛层,从而获得第三积层体。待该水热反应结束后,自该高温炉中取出该高压釜,并置于冷水浴中进行降温处理,然后,将该第三积层体自该高压釜中取出,并以硝酸水溶液(包括水及硝酸,其中,在该硝酸水溶液中该硝酸的浓度为0.1m)清除该第三积层体的表面上未反应完的氢氧化钠水溶液,然后,利用去离子水清洗,接着,浸泡于乙醇中约5秒,再以氮气枪吹干,最后,置于该高温炉中,并于500℃进行1小时锻烧处理,从而获得光电流电极,其中,在该光电流电极中,该第一纳米颗粒层的厚度为10nm,及该二氧化钛层的厚度为227.3nm。
[0063]
结构分析量测:利用一台场发射扫描式电子显微镜[厂牌:德国蔡司(zeiss);型号:ultra plus]及高分辨率穿透式电子显微镜[厂牌:日本电子株式会社(jeol ltd.);型号:jem-2010]对实施例1的光电流电极进行量测,其中,高分辨率穿透式电子显微镜的加速电压为8~200kv。量测结果如图2至图5所示。
[0064]
参阅图2,说明本发明实施例1的光电流电极的第二纳米颗粒层3的第二金纳米颗粒31的分布,由此可知,所述第二金纳米颗粒31彼此间具有一间隙。参阅图3,说明本发明实施例1的光电流电极的第一纳米颗粒层2的第一金纳米颗粒21与第二纳米颗粒层3的第二金纳米颗粒31的分布,且参阅圆框处,所述第二金纳米颗粒31间存在将相邻的第二金纳米颗粒31连接在一起的第一金纳米颗粒21。参阅图4,说明本发明实施例1的光电流电极的第一纳米颗粒层2的第一金纳米颗粒21与第二纳米颗粒层3的第二金纳米颗粒31的分布,且参阅圆框处,显示有第一金纳米颗粒21。参阅图5,说明本发明光电流电极的第二纳米颗粒层3的第二金属纳米颗粒31上存在二氧化钛纳米线41。
[0065]
光吸收强度量测:利用一台紫外线-可见光光谱仪(厂牌:perkin elmer;型号:lambda 900)对实施例1、比较例1及比较例2的光电流电极进行量测,且波长扫描范围设定在300nm~700nm。量测结果如图6所示。
[0066]
由图6的吸收强度可知,相较于比较例1及比较例2的光电流电极的吸收强度,实施例1的光电流电极具有优异的吸收强度,且对可见光至红外光皆有优异的吸收。
[0067]
催化效率量测:将实施例1、比较例1及比较例2的光电流电极浸泡在孔雀石绿溶液(包括水及孔雀石绿,其中,在该孔雀石绿溶液中,孔雀石绿的浓度为0.01m)中,并以白光发光二极管[美国cree xhp70.2系列,且光通量为248流明(lm)]照射,然后,利用一台拉曼光
谱仪对孔雀石绿溶液进行吸收强度量测,并依据吸收强度及公式(ln[a]=-kt+ln[a]0),计算出一级常数(k),其中,t为照射时间(单位:分钟)、[a]0为孔雀石绿的初始浓度、[a]为孔雀石绿经照射后的浓度。
[0068]
表1
[0069][0070]
由表1的实验数据可知,相较于比较例1及比较例2的光电流电极的一级常数,实施例1的光电流电极具有高一级常数,表示实施例1的光电流电极具有优异的催化效率。
[0071]
灵敏度量测:将20μl的甲型胎儿蛋白抗体溶液[包括磷酸盐缓冲液(购自merck,且包括水及磷酸盐)及甲型胎儿蛋白抗体(购自mybiosource,inc.且型号为mbs530361),其中,在该甲型胎儿蛋白抗体溶液中该甲型胎儿蛋白抗体的浓度为1000ng/ml]滴在本发明第二实施例的光电免疫感测装置的光电免疫传感器5的光电流电极51上,并在室温下反应1小时,接着,利用该磷酸盐缓冲液冲洗,然后,使用超纯水冲洗,接着,用氮气枪吹干,然后,将20μl的人类甲型胎儿蛋白溶液[包括磷酸盐缓冲液(购自merck,且包括水及磷酸盐)及人类甲型胎儿蛋白(购自mybiosource,inc.且型号为mbs537909),其中,在该人类甲型胎儿蛋白溶液中该人类甲型胎儿蛋白的浓度为1000ng/ml]滴在该光电免疫传感器5的光电流电极51的甲型胎儿蛋白抗体上,并在室温下反应1小时,接着,利用该磷酸盐缓冲液冲洗,然后,使用超纯水冲洗,接着,用氮气枪吹干,然后,利用该磷酸盐缓冲液覆盖该光电免疫传感器5,接着,启动该光学单元7(其中,该发光器71为美国cree xhp70.2系列,且光通量为858流明)及该讯号处理器8(购自ch instrument(chi)且型号为chi611e),获得一个第一光电流密度讯号x1,经过一段时间的照射,关闭该光学单元7以停止照光,获得一个第二光电流密度讯号x2。计算出该第一光电流密度讯号x1与该第二光电流密度讯号x2的比值,作为灵敏度的判断。将该第二实施例的光电免疫传感器5的光电流电极51置换成比较例1的光电流电极及比较例2的光电流电极,并依照上述的方式进行量测。
[0072]
表2
[0073][0074]
由表2的实验数据可知,相较于比较例1及比较例2的光电流电极的灵敏度,实施例1的光电流电极具有优异的灵敏度。
[0075]
综上所述,本发明通过该第二纳米颗粒层3产生的表面电浆共振效应及该半导体层4与该第二纳米颗粒层3在界面处形成作为电子吸收体的萧特基能障而促进电子与电洞的分离,有助于该光电流电极对可见光的吸收,甚至是红外光的吸收,致使在太阳光或白光发光器的照射下,甚至是在低流明(例如1000流明以下)的光源照射下,本发明光电流电极具有优异的光电流密度,所以确实能达成本发明的目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1