细胞的筛选方法、核酸的制造方法、重组细胞的制造方法、目标物质的制造方法、药物组合物的制造方法及试剂与流程
1.本发明涉及细胞的筛选方法、核酸的制造方法、重组细胞的制造方法、目标物质的制造方法、药物组合物的制造方法及试剂。
背景技术:
2.周所周知,g蛋白偶联受体(gpcr)、转运蛋白、离子通道、细胞因子受体等的细胞膜蛋白质与各种疾病有关,它们正作为诊断药物、医疗用医药品的靶标分子而受到关注。细胞膜蛋白质是细胞外的物质,例如,通过与包含低分子化合物、肽、蛋白质等配体结合,其功能被活性化或抑制,由此而发挥细胞功能或药理功能。
3.此外,近年,与细胞膜蛋白质结合的特异抗体或抗体样分子(抗体片断、单链抗体、双特异性抗体或药剂结合抗体等)正在受到关注,将其用作诊断药或医疗用医药品的开发也正在开展。
4.在细胞膜蛋白质中,特别是针对多次跨膜蛋白质(例如,gpcr、转运蛋白、离子通道等)的特异性结合物质(例如,蛋白质配体、肽配体、特异抗体等)正在作为医药品而被开发。但是,已作为医药品而实用化的物质还很有限。
5.多次跨膜蛋白质与可溶性蛋白质(例如,细胞因子、激素、酶、核内受体)相比,包含很多的疏水性结构,因此分离纯化非常困难。此外,能够被证明保持有在自然界中存在的结构,并且保持多次跨膜蛋白质的功能的纯化例非常有限。一般而言,多次跨膜蛋白质以存在于细胞的脂质双分子膜中的状态而发挥其功能性。
6.作为探索针对细胞膜蛋白质的特异性结合物质的技术,例如,可以举出大量制造并纯化作为细胞膜蛋白质的一部分而暴露在细胞外的可溶性结构域或部分肽,并对其进行使用的方法。例如,可以举出将纯化的所述可溶性结构域或部分肽固相化在96孔板上,以elisa法等评价其与作为候补的特异性结合物质的结合性的方法。然而,就以这样的方法筛选物质而言,无法保证其能够以特异且高的亲和性与存在于活体内的靶标细胞膜蛋白质相结合。因此,在以诊断药或医疗用医药品的开发为目的而探索细胞膜蛋白质的有效特异性结合物质时,为了模拟活体内的细胞膜蛋白质的立体结构,使用在活细胞的细胞膜上表达有靶标细胞膜蛋白质的哺乳动物细胞是更为有效的。
7.另一方面,就肽配体、蛋白质配体、特异抗体等物质而言,可以通过培养来源于人类或非人类动物的细胞、应用了基因重组技术的重组细胞,而使它们分泌这些物质到培养上清中。此处,如果发现与靶标细胞膜蛋白质特异性结合的未知物质,则需要以生产不同的物质的数千~数万种的生产细胞集团(例如,抗体生产杂交瘤库)作为调查对象。但是近年来,为了探索新物质而需要调查的生产细胞数有不断增加的倾向,需要调查数万~数千万种的细胞。因此,在生产细胞的培养、维持所花费的成本、探索所花费的时间等方面,现有技术存在巨大的技术问题。
8.作为探索针对期望的细胞膜蛋白质的特异性抗体的现有技术,可以举出将杂交瘤
培养和流式细胞仪组合手法。例如,制备数千种的杂交瘤的培养上清,使其与在细胞表面表达有靶标细胞膜蛋白质的cho细胞接触,并且使用流式细胞仪评价结合性。然后,将判定为阳性的杂交瘤回收,以极限稀释法进行进一步的培养。然后,重复使用了流式细胞仪的结合性评价,花费2个月左右,能够鉴定出产生期望的特异性抗体的细胞(例如,专利文献1)。
9.但是,众所周知,对非人类动物以gpcr等的细胞膜蛋白质作为抗原进行免疫时,亲和性、特异性这两者均较高的抗体的出现频度极低。要筛选产生这样的出现频度低的特异抗体的目标细胞,以杂交瘤法,需要对数十万~数百万种的生产细胞进行培养和评价。因此,可以认为利用杂交瘤培养和流式细胞仪的现有方法已经接近了其能力的极限。
10.作为其他的技术,应用了单细胞解析技术的特异性抗体生产细胞的鉴定法正在被开发(非专利文献1)。例如,将1个抗体生产细胞和抗原蛋白质封入疏水性的微流控液滴中。然后,能够将从抗体生产细胞中分泌的抗体和抗原蛋白质的结合的有无可视化,并在具有微流路的分析机器中分离出包含产生特异性抗体的阳性细胞的微流控液滴。
11.在非专利文献2中,则记载有应用了微流控液滴和微流路的特异性抗体生产细胞的鉴定方法的原理。
12.然而,就该方法而言,存在以下的缺点:在将微流控液滴中的抗体和抗原蛋白质的结合的有无可视化的过程中,无法增加清洗步骤。因此,在以细胞膜表面上表达量极少的细胞膜蛋白质为靶标时,与背景的荧光信号相比,抗体和抗原蛋白质的结合所发出的荧光信号较弱,故难以确认是否存在所述结合(非专利文献1)。
13.另外,微流控液滴中的细胞的生存维持,特别是,来源于未进行不死化的骨髓组织、脾脏、淋巴组织、血液细胞的b淋巴球、浆细胞的生存维持非常困难,需要根据细胞种类而进行严密的控制。
14.此外,一般而言,在包含阳性细胞的微流控液滴中也包含多种阴性抗体生产细胞。因此,为了建立单克隆抗体,还需要实施多次的筛选操作。
15.此外,就用于使抗体和靶标细胞膜蛋白质的结合的有无可视化的方法而言,需要根据靶标细胞膜蛋白质进行优化,要进行通用的实用化还存有改良的余地。
16.在专利文献2中记载有:使表达靶标细胞膜蛋白质的细胞集团在载玻片上与候补的细胞集团接触,从候补的细胞集团中鉴定出产生针对靶标细胞膜蛋白质的抗体细胞的技术。但是,由于该方法也同样无法进行所述的清洗步骤,以在细胞膜表面上表达的量极少的细胞膜蛋白质为靶标时,难以确认抗体和细胞膜蛋白质是否结合。
17.在专利文献3中,公开了:向涂覆有纯化的可溶性细胞因子受体蛋白质的微孔中导入抗体生产细胞的候补,以细胞分泌的抗体和可溶性细胞因子受体蛋白质的结合性来筛选期望的抗体生产细胞的技术。但是如上所述,分离纯化的受体蛋白质不一定保持有能够在活体内发挥功能的结构。并且,要将难以纯化的多次跨膜蛋白质适用于该方法是非常困难的。
18.现有技术文献
19.专利文献
20.专利文献1:国际公开第2012/043634号
21.专利文献2:国际公开第2004/051268号
22.专利文献3:日本专利第4148367号公报
23.非专利文献
24.非专利文献1:fitzgerald v,leonard p.,"single cell screening approac hes for antibody discovery",methods,116:34
‑
42,2017
25.非专利文献2:shembekar et al.,"single
‑
cell droplet microfluidic scre ening for antibodies specifically binding to target cells",cell reports 22,2206
‑
2215,february 20,2018
技术实现要素:
26.本发明所要解决的技术问题
27.如上所述,能够更迅速且高效地筛选生产与细胞膜蛋白质特异性结合的目标物质的细胞的技术还不能算是完成了。此外,为了对应评价的细胞的母集团数的增加,需要尽量地减少细胞培养的操作。因此本发明以提供一种能够更迅速且高效地筛选生产与细胞膜蛋白质特异性结合的目标物质的细胞的技术,以及,使用以该技术筛选的细胞来制造抗体等目标物质的技术为目的。
28.解决技术问题的技术手段
29.本发明的发明人发现,通过在直径20~30μm的微孔内,使表达目标细胞膜蛋白质的细胞和生产与细胞膜蛋白质特异性结合的目标物质的目标细胞的候补共存,能够在非常短的时间内筛选出目标细胞。
30.本发明的1种形态是一种细胞的筛选方法,其是从第二细胞的集团中筛选目标细胞的细胞筛选方法,所述目标细胞生产与期望的细胞膜蛋白质特异性结合的目标物质,其包含下述步骤:
31.a)提供具有多个微孔的基板的步骤,
32.b)使细胞表面上表达所述细胞膜蛋白质的第一细胞附着于各个所述微孔的步骤,
33.c)在步骤b)之后,向各个所述微孔中,导入从所述集团中分离出的1或2个第二细胞,在所述微孔内使所述第一细胞和所述第二细胞共存的步骤,
34.d)在步骤c)之后,选定包含有结合有所述目标物质的第一细胞的微孔的步骤,
35.e)从步骤d)选定的微孔中,回收作为所述目标细胞的所述第二细胞的步骤。
36.优选所述步骤d)包含将所述目标物质与所述第一细胞的结合进行可视化的可视化步骤。
37.优选所述可视化步骤包含向所述微孔中添加待与所述目标物质特异性结合的标记物质的步骤。
38.优选所述标记物质为针对所述目标物质的标记抗体。
39.优选所述标记物质中的标记为荧光标记。
40.优选所述标记物质是以第一荧光物质进行了标记的抗体,所述步骤b)包含以第二荧光物质标记附着于所述微孔中的所述第一细胞的第一细胞标记步骤,第一荧光物质发出的荧光的荧光波长与第二荧光物质发出的荧光的荧光波长不同。
41.优选所述可视化步骤包含:将所述目标物质与所述第一细胞结合时所发生的,伴随所述细胞膜蛋白质的活性化的细胞内信息传递物质的变动进行可视化的步骤。
42.优选所述细胞膜蛋白质为多次跨膜蛋白质。
43.优选所述第一细胞为导入了表达所述细胞膜蛋白质的载体的细胞。
44.优选所述第一细胞为表达所述细胞膜蛋白质的肿瘤细胞。
45.优选所述第一细胞为表达所述细胞膜蛋白质的非肿瘤细胞。
46.优选所述目标物质为抗体。
47.优选所述第二细胞来源于以所述细胞膜蛋白质或编码它的核酸进行了免疫的,来源于非人类动物的骨髓、脾脏、淋巴组织或血液细胞。
48.优选所述第二细胞为不死化了的细胞。
49.优选所述第二细胞为杂交瘤。
50.优选所述第二细胞来源于人类的淋巴组织或血液。
51.优选所述第二细胞为通过爱泼斯坦
‑
巴尔病毒感染而进行了不死化的细胞。
52.优选所述第二细胞为具有外来性的抗体基因、表达该抗体的重组细胞。
53.优选所述抗体为完全抗体、功能性抗体片断、单链抗体,或多特异性抗体。
54.优选所述抗体为完全人类抗体、人源化抗体、或嵌合抗体。
55.优选所述抗体为猫源化抗体或狗源化抗体。
56.本发明的另一种形态是一种核酸的制造方法,其是从目标细胞中取得编码所述目标物质的核酸的方法,其中,所述目标细胞是通过所述的方法从第二细胞的集团中筛选出的目标细胞。
57.优选所述目标物质为抗体。
58.本发明的另一种形态是一种重组细胞的制造方法,其将通过所述的方法所制造的核酸导入至宿主细胞,以取得表达所述目标物质的重组细胞的方法。
59.本发明的另一种形态是一种目标物质的制造方法,其是培养通过所述的方法所制造的重组细胞,从其培养物中取得所述目标物质的方法。
60.本发明的另一种形态是一种目标物质的制造方法,其是培养以所述的方法从第二细胞的集团中筛选出的目标细胞,从其培养物中取得所述目标物质的方法。
61.优选所述目标物质为抗体。
62.本发明的另一种形态是一种药物组合物的制造方法,其是将以所述的方法所制造的核酸与药学上容许的载体或添加物组合,取得含有所述核酸作为有效成分的药物组合物的方法。
63.本发明的另一种形态是一种药物组合物的制造方法,其是将以所述方法所制造的目标物质与药学上容许的载体或添加物组合,取得含有所述目标物质作为有效成分的药物组合物的方法。
64.本发明的另一种形态是一种用于检测所述期望的细胞膜蛋白质的试剂,其包含通过所述方法所制造的目标物质。
65.发明的效果
66.根据本发明,能够更迅速且高效地筛选生产对细胞膜蛋白质进行特异性结合的目标物质的细胞。此外,能够容易地制造对细胞膜蛋白质进行特异性结合的目标物质,例如抗体。
附图说明
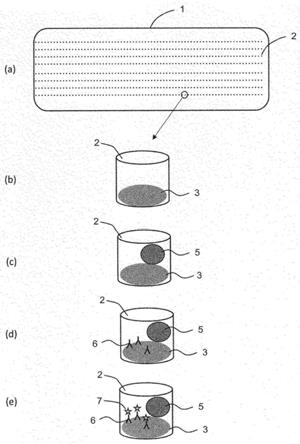
67.[图1]表示本发明的一种方式所涉及的细胞的筛选方法的概要的说明图,(a)~(e)表示各步骤。
[0068]
[图2]表示实施例4中的阳性微孔的图像的一个例子的照片,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0069]
[图3]表示实施例4中的阴性微孔的图像的一个例子的照片,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0070]
[图4]表示对来源于从实施例5中的阳性微孔中回收的杂交瘤的基因重组抗体进行流式细胞术的结果的图。
[0071]
[图5]表示对来源于从实施例5中的阴性微孔中回收的杂交瘤的基因重组抗体进行流式细胞术的结果的图。
[0072]
[图6]表示实施例6中的阳性微孔的图像的一个例子的照片,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0073]
[图7]表示实施例6中的阴性微孔的图像的一个例子的照片,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0074]
[图8]表示对来源于从实施例7中的阳性微孔中回收的淋巴球的基因重组抗体进行流式细胞术的结果的图。
[0075]
[图9]来源于来源于从实施例7中的阴性微孔中回收的淋巴球的基因重组抗体进行流式细胞术的结果的图。
[0076]
[图10]表示实施例9中的微孔的图像的一个例子的照片,(a)为观察透射光的结果,(b)为观察来源于alexa fluor 488的荧光的结果,(c)为观察来源于dylight 650的荧光的结果。
[0077]
本发明的具体实施方式
[0078]
本发明的细胞的筛选方法是从第二细胞的集团中筛选出生产与期望的细胞膜蛋白质特异性结合的目标物质的目标细胞的方法。以下,有时将所述目标细胞称为阳性细胞。此外,有时将所述期望的细胞膜蛋白质称为“靶标细胞膜蛋白质”。此外,有时将所述目标物质称为“针对细胞膜蛋白质的特异性结合物质”,或单称为“特异性结合物质”。此外在本发明中,有时也将“对细胞进行筛选”表达为“对细胞进行鉴定”。
[0079]
图1表示本发明的一种方式所涉及的细胞的筛选方法的概要。(a)表示具有多个微孔2的基板1。(b)表示第一细胞3附着在微孔2中的状态。(c)表示使第一细胞3在微孔2内与第二细胞5共存的状态。(d)表示第二细胞5所分泌的目标物质6结合到第一细胞3的表面的状态。(e)表示标记物质7结合到第一细胞3表面上的目标物质6上的状态。
[0080]
<基板和微孔>
[0081]
在本发明中,使用具有多个微孔的基板。微孔是指,能够放入1~3个左右的哺乳动物细胞或鸟类细胞的微小尺寸的孔(凹陷、凹部)。微孔是有底的微小的穴,例如其开口部的
内径为10μm~50μm左右,深度与开口部的内径相近。
[0082]
典型的微孔的形状为圆筒形。其它也可以是如四角柱、六角柱等多角柱状的由多个平面所构成的筒状;倒圆锥形、倒金字塔形等擂钵状。另外,也可以是将2个以上的这些形状组合连结而成的形状。形状为倒圆锥形、倒金字塔形时,可以将其设为锥的底面部分为微孔的开口部、顶点的一部分被切去的形状(即,圆锥台状或金字塔台状)。
[0083]
微孔为圆筒形时,其开口部的直径(内径)可以根据微孔中收纳的细胞的种类、个数而适宜决定。第一细胞为cho细胞,第二细胞为来源于非人类动物的b淋巴球或浆细胞时,直径优选为20μm~40μm左右。另外,微孔的深度优选为与开口部的直径相近。
[0084]
基板上的单位面积中的微孔数(密度)无特别限制,例如,可以根据1次要探索的第二细胞的总数和目标细胞的表达频度而适宜决定。例如,可以在每1cm
2中
20,000个~200,000个的范围内。
[0085]
基板上的微孔间的距离(间距)无特别限制,可以在不对相邻的微孔造成影响的范围内适宜设定。例如,微孔为圆筒型时,相邻的微孔的开口部中心间的距离优选为开口部直径的1.5~3倍左右。
[0086]
基板的材质无特别限制,进行后述的可视化步骤时,优选不具有自身荧光的透明材质。
[0087]
具有多个微孔的基板可以从市场获得。例如,as one公司售卖具有多个直径为10μm、20μm、或30μm的微孔的基板(微孔槽)。
[0088]
<靶标细胞膜蛋白质>
[0089]
本发明中的靶标细胞膜蛋白质无特别限制,以多次跨膜蛋白质为代表的所有细胞膜蛋白质都能够作为对象。例如,g蛋白偶联受体(gpcr)、离子通道、转运蛋白、cd抗原、细胞粘附分子、癌抗原、病毒抗原等均可以作为对象。此外细胞膜蛋白质的来源动物种无特别限制。此外,在本发明中,具有以下情形的蛋白质也能够作为对象:其是未确立纯化法的、难以大量纯化的、难以以保持天然存在的结构的形态分离纯化的等细胞膜蛋白质,且其是一部分从脂质双分子膜层暴露到细胞外的蛋白质。
[0090]
<第一细胞>
[0091]
在本发明中,将在细胞表面上表达期望的细胞膜蛋白质的第一细胞附着于微孔内而使用。
[0092]
作为第一细胞,只要是在细胞表面上表达期望的细胞膜蛋白质的细胞即可,无特别限制。作为一个实施方式,可以举出导入了表达靶标细胞膜蛋白质的载体的重组细胞。例如,将全长的靶标细胞膜蛋白质的基因插入至适当的表达载体(例如,pcdna、pef/frt/v5
‑
dest等)中。然后,将该载体导入cho细胞、cos细胞、hek293细胞、nih3t3细胞等细胞,以取得在细胞膜上暂时地或稳定地表达靶标细胞膜蛋白质的重组细胞。可以将该重组细胞作为第一细胞使用。此时,靶标细胞膜蛋白质在细胞膜上的表达量,与不具有表达载体的细胞相比,优选有5倍以上的增强度。
[0093]
作为其他的实施方式,可以将与正常细胞相比,过剩表达靶标细胞膜蛋白质的肿瘤细胞作为第一细胞使用。作为肿瘤细胞,例如,可以使用对手术取出的脏器进行单细胞化而得到的细胞。另外,肿瘤细胞也可以从atcc、细胞销售公司处获得。
[0094]
作为其他的实施方式,也可以将来源于表达靶标细胞膜蛋白质的正常组织(例如
非人类或人类组织)的各种细胞(非肿瘤细胞)作为第一细胞使用。例如,可以将血液细胞、神经细胞、血管内皮细胞、血管平滑肌细胞、免疫细胞、脂肪细胞、骨骼肌细胞、淋巴球细胞、皮肤细胞等作为第一细胞使用。另外,可以将血液细胞以公知的方法进行ips化后,使其分化为特定的组织细胞,并将该细胞作为第一细胞使用。
[0095]
<目标物质>
[0096]
在本发明中,是从第二细胞的集团中筛选生产与期望的细胞膜蛋白质特异性结合的目标物质的目标细胞。所述目标物质(特异性结合物质)包括:与特定的细胞膜蛋白质选择性结合的结构已知或未知的多肽、环状肽、蛋白质。更具体而言,包括包含肽激素、细胞因子、抗体、人工多肽、人工环状肽等的特异性结合物质。
[0097]
<第二细胞>
[0098]
在本发明中,在微孔内使第一细胞和第二细胞共存。以下,对第二细胞进行具体的说明。
[0099]
首先,对目标物质(特异性结合物质)为抗体以外的物质的情形,换言之,第二细胞为抗体生产细胞以外的细胞时的实施方式进行说明。
[0100]
作为第二细胞,只要是预测能够生产期望的目标物质的细胞即可,无特别限制。例如,可以将来源于非人类或人类组织的各种细胞,例如血液细胞、神经细胞、血管内皮细胞、血管平滑肌细胞、免疫细胞、脂肪细胞、骨骼肌细胞、淋巴球细胞、皮肤细胞等作为第二细胞使用。例如,可以将非人类动物的组织分离,在胶原酶处理等之后,以30~100μm的网孔过滤,将进行了单细胞化的细胞作为第二细胞使用。例如,可以将对人类的血液或手术取出的脏器进行单细胞化而得到的细胞作为第二细胞使用。此外,可以将肿瘤细胞作为第二细胞使用。就肿瘤细胞而言,例如,可以使用对手术取出的脏器进行单细胞化而得到的细胞。另外,肿瘤细胞可以从atcc、细胞贩卖公司处获得。
[0101]
可以将重组细胞作为第二细胞使用。例如,将包含编码目标物质的基因的cdna库导入至pcdna、pef/frt/v5
‑
dest、mammalian powerexpress system等的表达载体中。然后,将该载体暂时地导入cho细胞、cos细胞、hek293细胞、nso细胞等细胞中,得到重组细胞。可以将该重组细胞作为第二细胞使用。进一步而言,可以将所述重组细胞中的使用载体中所保持的药剂耐性基因而生存的恒定地进行基因表达的重组细胞作为第二细胞使用。另外,也可以向来源于腺病毒、慢病毒等的病毒载体中导入cdna库,使其感染cho细胞、hek293细胞、nih3t3细胞等,并将得到的细胞作为第二细胞使用。
[0102]
将重组细胞作为第二细胞使用时,优选向重组细胞中导入编码1种目标物质的基因。
[0103]
接下来,对目标物质(特异性结合物质)为抗体的情形,换言之,第二细胞为抗体生产细胞的实施方式进行说明。
[0104]
本发明中的“抗体”一词可以与“免疫球蛋白”置换。本发明中的抗体中包含其功能性片段。此处的“抗体的功能性片段”是指,抗体(即免疫球蛋白)的部分片段,且具有至少一种针对抗原的作用的片段。作为所述部分片段的例子,可以举出f(ab’)2、fab、fv、二硫键fv、单链抗体(scfv、vh
‑
vl)、vh、以及它们的聚合物、以及它们与重链ch3区域的融合体等。此外,本发明中的抗体可以是多特异性抗体。作为其例子,可以举出双特异性抗体中的一种,diabody(例如,国际公开第93/11161号)。本发明中的抗体的型(同种型)无特别限制。例
如,可以是igg、igm、iga、igd、ige等中的任一种型。此外,抗体的亚型也无特别限制。例如,如果是igg,可以是igg1、igg2、igg3、igg4等中的任一种亚型。此外抗体可以是完全人类抗体、人源化抗体、嵌合抗体中的任一种抗体。
[0105]
可以将来源于人类的淋巴组织或血液的b细胞或浆细胞等的抗体生产细胞作为第二细胞使用。例如,可以将从正常人、罹患癌的患者、罹患已知或未知的感染症的患者、罹患自体免疫疾病的患者、接种了疫苗的人等处采取的b细胞或浆细胞作为第二细胞使用。
[0106]
需要说明的是,为了更高效地鉴定针对靶标细胞膜蛋白质的抗体生产细胞,也可以进行细胞浓缩。例如,可以对活性化b细胞或浆细胞进行浓缩,将其作为第二细胞的集团使用,上述活性化b细胞或浆细胞由来源于以靶标细胞膜蛋白质进行了免疫的非人类动物的骨髓、脾脏、淋巴组织或血液细胞而获得。例如,可以将从来源于人类的淋巴组织或血液的细胞处获得的活性化b细胞或浆细胞浓缩,并将其作为第二细胞的集团使用。活性化b细胞或浆细胞的浓缩,例如,可以以细胞表面的cd抗原为指标进行。例如,可以使用针对选定的cd抗原的抗体磁珠。作为cd抗原的例子,可以举出:cd2、cd3、cd4、cd8、cd11b、cd11c、cd14、cd15、cd16、cd34、cd40、cd43、cd45r、cd49b、cd56、cd61、cd79a、cd90.2、cd138、cd235a。作为浓缩的程度,例如,可以举出将约10,000,000个的来源于淋巴组织的淋巴球细胞的集团,将b细胞或浆细胞浓缩至50倍以上的程度。
[0107]
关于以靶标细胞膜蛋白质对非人类动物进行免疫的方法,如hutchings cj,koglin m,olson wc,marshall fh,"opportunities for therapeutic antibo dies directed at g
‑
protein
‑
coupled receptors",nat rev drug discov.16(9),2017.所记载的,有各种方法。例如,可以举出:合成暴露在细胞表面上的部分肽或部分蛋白质,将其作为抗原进行免疫的方法。另外,还可以举出:以表面活性剂使靶标细胞膜蛋白质可溶化,而从细胞中提纯,将其作为抗原进行免疫的方法。另外,还可以举出:以高表达靶标细胞膜蛋白质的细胞自身进行直接免疫的方法。另外,还可以举出:将靶标细胞膜蛋白质配置到人工双分子脂膜或病毒样纳米粒子上,以此作为抗原进行免疫的方法。此外,还可以举出:将编码靶标细胞膜蛋白质的cdna序列插入蛋白质表达载体,以该载体进行免疫的方法(dna免疫)。其中,dna免疫由于存在能够取得特异性更高且亲和性更高的抗体的可能性,故而优选。
[0108]
可以将杂交瘤等进行了不死化了的细胞作为第二细胞使用。例如,从以靶标细胞膜蛋白质进行了免疫的非人类动物处采取免疫细胞,通过将其与骨髓瘤进行细胞融合而得到杂交瘤。可以将该杂交瘤作为第二细胞使用。关于细胞融合、杂交瘤的筛选、克隆,可以使用公知的方法。例如,细胞融合可以通过使用聚乙二醇的方法、对免疫细胞和骨髓瘤的混合液施加电压的方法进行。另外,杂交瘤的筛选,可以通过使用hat选择培养基进行培养而进行。
[0109]
除了杂交瘤法以外的方法也可以对细胞进行不死化。例如,如果是来源于人类的淋巴组织或血液的b细胞,以爱泼斯坦
‑
巴尔病毒(epstein
‑
barr virus)感染而进行了不死化的细胞也作为第二细胞使用。
[0110]
可以将导入了抗体基因的重组细胞作为第二细胞使用。例如,从来源于免疫动物的淋巴组织或血液细胞的b细胞或浆细胞中制作cdna库。从该cdna库中选择性扩增抗体或抗体片断的基因。对扩增的基因进行编辑,使其能够表达完全抗体、功能性抗体片断、单链
抗体或多特异性抗体等各种形态的抗体分子,以制作抗体基因库。将该基因库导入pcdna、pef/frt/v5
‑
dest、mammalian powerexpress system等的载体中。然后,将该载体暂时地导入cho细胞、cos细胞、hek293细胞、nso细胞等的细胞中,得到重组细胞。可以将该重组细胞作为第二细胞使用。进一步而言,可以将所述重组细胞中的,使用载体中所保持的药剂耐性基因而生存的,恒定地进行基因表达的重组细胞作为第二细胞使用。
[0111]
作为第二细胞的来源的动物种类无特别限制,可以优选使用哺乳动物细胞或鸟类细胞。作为哺乳动物,可以举出小鼠、大鼠、豚鼠、兔、猴、牛、马、狗、猫、山羊、绵羊、猪、骆驼、羊驼等。另外,作为鸟类的例子,可以举出鸡、鸭或火鸡。
[0112]
<第一细胞的附着>
[0113]
在本发明中,使所述的第一细胞附着于微孔。由此,能够使第一细胞在不损失其细胞功能的情况下被收纳至微孔内并固定化。就附着于微孔的第一细胞的个数而言,只要能够保证第二细胞进入的空间即可,没有特别限制,但优选1~2个。
[0114]
<第一细胞和第二细胞的共存>
[0115]
在本发明中,向第一细胞附着了的微孔中导入1或2个第二细胞,使第一细胞和第二细胞共存。由此,第二细胞所生产的(分泌的)目标物质与第一细胞的表面接触。优选微孔导入1个第二细胞。
[0116]
使第一细胞在微孔内和第二细胞共存后,优选以特定的条件进行孵育。孵育的条件,例如,可以根据第二细胞生产的目标物质的性质和第二细胞的生存时间来决定。例如,优选向磷酸缓冲液、hbss或细胞培养液(例如rpmi培养基、ham f
‑
12培养基等)中根据需要添加牛血清、成长因子、诱导特异性结合物质的产生的细胞因子(例如,il
‑
4、il
‑
5、il
‑
6、il
‑
13、il
‑
21、tnf、ifnγ、cd40配体等),在25~37℃下孵育15分钟~6小时。
[0117]
<阳性微孔的选定>
[0118]
使第一细胞在微孔内和第二细胞共存,根据需要进行孵育后,选定包含结合有目标物质的第一细胞的微孔(阳性微孔)。换言之,对各微孔中是否存在第一细胞的表面上表达的靶标细胞膜蛋白质和第二细胞所分泌的物质的结合进行检测。
[0119]
作为检测第一细胞和目标物质是否结合的方法,例如,可以优选使用可视化的方法。即,在优选的实施方式中,包含将所述特异性结合物质与所述第一细胞的结合可视化的可视化步骤。
[0120]
所述可视化的手法无特别限制。作为1个例子,可以举出将第一细胞的表面可视化的直接的手法。作为其他例子,可以举出将所述目标物质与所述第一细胞结合时发生的伴随所述细胞膜蛋白质的活性化的细胞内信息传递物质的变动可视化的间接的手法。
[0121]
作为所述直接的手法,可以举出使用与目标物质特异性结合的标记物质的方法。即,使所述标记物质与在微孔内与第二细胞共存的第一细胞接触。所述标记物质,例如可以是标记抗体。
[0122]
对具体的做法进行例示,首先,在制作所述的cdna库时,进行设计,使得对特异性结合物质赋于标记(例如,flag、v5)或抗体的fc部分。然后,将该cdna库导入cho细胞等而得到的重组细胞作为第二细胞使用。对于被赋于了标记的目标物质,可以使用针对该标记的标记抗体(例如,标记抗flag抗体、标记抗v5抗体)。对于被赋于了fc部分的目标物质,可以使用标记抗fc抗体(例如,标记抗igg抗体)。作为具体的操作,在使第一细胞在微孔内和第
二细胞共存后,根据需要,以特定的条件进行孵育,然后添加标记物质。
[0123]
作为所述标记,可以采用荧光物质(荧光复合体)、荧光蛋白质、酶等标记。
[0124]
作为所述荧光物质,可以举出:alexa fluor(注册商标)、aqua,texas red(注册商标)、荧光素(fluorescein)及其诱导体、罗丹明及其诱导体、cascade blue(注册商标)、藻红蛋白、dylight(注册商标)等。优选使用alexa fluor 488。
[0125]
作为荧光蛋白质,可以举出绿色荧光蛋白质(gfp)。
[0126]
作为所述酶,可以举出碱性磷酸酶、辣根过氧化物酶、荧光素酶等。
[0127]
以标记物质(例如,标记抗体)发出的强信号作为指标,能够检测结合有目标物质的第一细胞。并且,可以根据标记的特性,使用荧光显微镜、发光显微镜、倒置显微镜或包含它们的显微操作装置的机器,选定包含阳性信号的微孔(阳性微孔)。
[0128]
另一方面,间接的手法,例如,可以在特异性结合物质是促进细胞膜蛋白质的功能的物质(例如,内在性配体、被认为具有激动剂活性的多肽、环状肽、抗体、蛋白质等)的情形下适用。对具体的做法进行例示,向表达靶标细胞膜蛋白质的第一细胞中,预先导入能够将伴随靶标细胞膜蛋白质的活性化而发生的细胞内信息传递物质的变动可视化的报告基因。如上所述,在目标物质与靶标细胞膜蛋白质结合时,可以使报告基因的表达的变化可视化。其结果,可以以间接的方式使细胞膜蛋白质和目标物质的结合可视化。例如,通过使用promega公司制造的pgl4 signaling vector系列和作为发光基质的荧光素(luciferin),能够进行间接的可视化。并且,可以使用发光显微镜或包含发光显微镜的机器,来选定阳性微孔。
[0129]
作为可以适用间接的手法的其他的例子,可以举出将细胞内的camp的变动可视化的方法。例如,就细胞内的camp量的变动而言,可以通过以抗磷酸化抗体和荧光标记了的2次抗体来检测添加使细胞膜蛋白质活性化的物质时表现出的creb(camp response element binding protein)的特异性磷酸化。另外,作为其他的例子,可以举出将细胞内的ca的变动可视化的方法。细胞内的ca的变动可以通过细胞内荧光ca指示剂的荧光强度的变化而间接地可视化。
[0130]
通过在添加标记物质前,预先对第一细胞进行荧光标记,可以进一步简便且迅速地选定阳性微孔。例如,作为所述标记物质,采用以荧光物质(第一荧光物质)标记了的抗体,并以别的荧光物质(第二荧光物质)标记第一细胞。此处,作为第二荧光物质,采用其发出的荧光的荧光波长与第一荧光物质发出的荧光不同的物质。即,第一荧光物质发出的荧光的荧光波长与第二荧光物质发出的荧光的荧光波长不同。例如,作为第二荧光物质,使用calcein
‑
am、二乙酸荧光素(fluorescein diacetate(fda))、二乙酸羧基荧光素(carboxyf luorescein diacetate(cfda))、cytored、碘化丙啶(propidium iodide(pi))、e溴化乙锭(thidium bromide(eb))、吖啶橙(acridine orange(ao))、dapi、hoechst 33342或hoechst 33258。另一方面,作为第一荧光物质,使用alexa fluor 488。由此,通过发出的荧光的不同,能够轻易地区分结合有标记抗体的第一细胞和未与标记抗体结合的第一细胞。并且,可以使用荧光显微镜或包含荧光显微镜的机器来选定阳性微孔。
[0131]
抗体通常被分泌到细胞外,但已知存在不被分泌到细胞外的膜型抗体。因此,不被分泌的膜型抗体有时存在于第二细胞的表面。此时,如果添加标记抗igg抗体,其有可能不仅和结合有第一细胞的抗体结合,还和第二细胞上的膜型抗体结合。但是,如果是使用了所
述的第一荧光物质和第二荧光物质的实施方式,就能够特异性地仅检测出结合有第一细胞的抗体。
[0132]
在可视化步骤中,添加标记物质后,优选进行用于除去剩余的标记物质的清洗步骤。就清洗而言,只要是以能够将第一细胞和第二细胞保持在微孔内的条件(第一细胞和第二细胞不流失的条件)进行即可,无特别限制。例如,可以举出以磷酸缓冲液、hbss或细胞培养液温和地清洗微孔数次。通过包含清洗步骤,即使在靶标细胞膜蛋白质在第一细胞的细胞膜上的表达量极低的情况下,也可以以高灵敏度检测出目标物质与靶标细胞膜蛋白质结合的信号。
[0133]
<第二细胞的回收>
[0134]
选定阳性微孔后,将第二细胞作为目标细胞回收。从微孔中回收第二细胞时,例如,可以使用微型机械手进行回收。例如,可以将直径为数μm到50μm的毛细管插入阳性微孔中,在存活的状态下吸引第二细胞,进行回收。通过微型机械手进行操作可以是自动也可以是手动。例如,可以使用细胞拣选系统(as one公司)或cellcelector(automated lab solution公司)进行回收。
[0135]
就回收的第二细胞而言,优选回收至适当的细胞培养用的培养基中,或回收至用于迅速进行提取使mrna不分解的细胞溶解液(lysis缓冲液)中。
[0136]
需要说明的是,阳性微孔中导入有2个第二细胞时,例如,可以将2个第二细胞回收至细胞培养用的培养基中后,将两者分离,采用其中任一者作为目标细胞。或者,可以将2个第二细胞回收至lysis缓冲液中后,以下述的方法取得、分离编码2种目标物质的核酸,采用其中任一者的核酸作为目的核酸(目的基因)。
[0137]
<核酸、重组细胞、特异性结合物质的制造方法>
[0138]
本发明还包含:一种核酸的制造方法,其是从以所述的方法从第二细胞的集团中筛选出的目标细胞中,取得编码目标物质的核酸(基因)的制造方法。此外本发明还包含:一种重组细胞的制造方法,其是将该核酸导入宿主细胞,以取得表达目标物质的重组细胞的制造方法。此外本发明还包含:一种目标物质的制造方法,其是对该重组细胞进行培养,从其培养物中取得目标物质的制造方法。其中,优选所述目标物质为抗体。
[0139]
作为从第二细胞中取得编码目标物质的核酸的方法,可以使用公知的方法。例如,组合逆转录反应和pcr法来合成cdna。并从该cdna中,分离目的核酸。
[0140]
作为取得表达目标物质的重组细胞的方法,可以使用公知的方法。例如,可以将分离的目的核酸导入至适宜的载体中。将该载体导入大肠菌、酵母、哺乳动物细胞(例如cho细胞、hek293细胞或nso细胞)等的宿主细胞,以取得目的重组细胞。
[0141]
然后,可以对该重组细胞进行培养,从其培养物(例如,培养上清)中取得目标物质。
[0142]
对于目标物质是抗体的情形,进行进一步的说明。从第二细胞中分离抗体基因时,例如,可以通过国际公开第2009/091048号、国际公开第2009/110606号、以及国际公开第2011/027808号所述的方法的组合,或根据nobuyuki kurosawa,megumi yoshioka,rika fujimoto,fuminori yamagishi and masaharu isobe,"rapid production of antigen
‑
specific monoclonal antibodies from a variety of animals",bmc biology,10:80,2012所述的方法(magrahd法)来进行分离。
[0143]
可以对分离的抗体基因进行改变,以构建表达完全抗体、功能性抗体片断、单链抗体、或多特异性抗体的重组细胞。同样地,也可以构建表达完全人类抗体、人源化抗体、或嵌合抗体的重组细胞。同样地,也可以构建表达猫源化抗体或狗源化抗体的重组细胞。
[0144]
当第二细胞自身能够稳定培养时,可以对第二细胞自身进行培养,从其培养物中取得抗体等的目标物质。即本发明包含:一种目标物质的制造方法,其是通过对以所述的方法从第二细胞的集团中筛选出的目标细胞进行培养,并从其培养物中取得目标物质的制造方法。
[0145]
作为从培养物中纯化抗体等的目标物质的方法,可以使用公知的方法。例如,可以采用亲和、离子交换、凝胶过滤等的各种色谱法。作为亲和色谱法中的配体,可以举出:protein a、protein g、抗flag抗体、抗v5抗体等。
[0146]
<药物组合物的制造方法>
[0147]
本发明包含:一种药物组合物的制造方法,其是将通过所述的方法制造的核酸与药学上容许的载体或添加物组合,以取得含有所述核酸作为有效成分的药物组合物的制造方法。此外本发明还包含:一种药物组合物的制造方法,其是将通过所述的方法所制造的目标物质,与药学上容许的载体或添加物组合,以取得含有所述目标物质作为有效成分的药物组合物的制造方法。
[0148]
通过本发明而制造的目标物质,例如抗体,作为药物组合物(治疗剂)的有效成分是有用的。所述药物组合物可以包含:通过本发明而制造的抗体等的目标物质、药学上容许的载体或添加物。优选所述药物组合物是阻断或活性化靶标细胞膜蛋白质特异性的细胞内信息传递机制的组合物。
[0149]
所述药物组合物可以经口或非经口地,全身或局部地给药。作为给药的形态,可以举出注射剂型、经鼻给药剂型、经肺给药剂型、经皮给药型等。其为注射剂型时,例如,可以通过静脉内注射、肌肉内注射、腹腔内注射、皮下注射等,进行全身或局部的给药。另外,可以根据患者的年龄、症状等,适宜地选择给药方法。目标物质为抗体时,就抗体的给药量而言,例如,可以在每次平均体重1kg对应为0.0001mg到1000mg的范围内,或者,例如,可以在对应每名患者的抗体为0.001~100000mg/body的范围内选择给药量。但是,抗体的给药量不限于这些范围。
[0150]
所述药物组合物可以依照常规方法进行制剂化(例如,remington's pharm aceutical science,latest edition,mark publishing company,easton,u.s.a)。作为所述载体或添加物的例子,可以举出:表面活性剂(peg、tween等)、赋形剂、抗氧化剂(抗坏血酸等)、着色料、着香料、保存料、稳定剂、缓冲剂(磷酸、柠檬酸、其他的有机酸等)、螯合剂(edta等)、悬浮剂、等张化剂、结合剂、崩解剂、滑润剂、流动性促进剂、矫味剂等。具体而言,可以举出:轻质无水硅酸、乳糖、结晶纤维素、甘露醇、淀粉、羧甲基纤维素钙、羧甲基纤维素钠、羟基丙基纤维素、羟基丙基甲基纤维素、聚乙烯醇缩醛二乙氨基乙酸酯、聚乙烯吡咯烷酮、明胶、中链脂肪酸甘油三酯、聚氧乙烯氢化蓖麻油60、白糖、羧基甲基纤维素、玉米淀粉、无机盐类等。另外,可以包含:其它的低分子量的多肽;血清白蛋白,明胶,免疫球蛋白等的蛋白质;甘氨酸、谷氨酰胺、天冬酰胺、精氨酸、赖氨酸等的氨基酸。
[0151]
将所述药物组合物制为注射用的水溶液时,可以与例如包含生理食盐水、葡萄糖或其它的辅助剂的等张液,例如,可以举出:d
‑
山梨糖醇、d
‑
甘露糖、d
‑
甘露醇、氯化钠;适当
的溶解辅助剂,例如醇(乙醇等)、多元醇(丙二醇,peg等);非离子性表面活性剂(聚山梨醇酯80、hco
‑
50)等组合使用。另外,根据需要,可以将作为有效成分的抗体封入微胶囊(羟基甲基纤维素,明胶,聚[甲基丙烯酸甲酯]等的微胶囊)、或制成胶体型药物输送系统(脂质体、白蛋白微球、微乳、纳米粒子、纳米胶囊等)(参照"remingto's pharmaceutical science 16th edition",oslo ed.(1980)等)。
[0152]
此外,已知使抗体与其他的药剂直接融合,以提高治疗效果的技术,该技术也可以适用于所述药物组合物。
[0153]
此外,就本发明中得到的核酸(基因)而言,也可以考虑例如将抗体基因导入基因治疗用载体,以作为基因治疗药。作为该基因治疗药(重组载体)的给药方法,除了以naked质粒直接给药之外,可以举出:以脂质体等包装而给药的方法、导入逆转录病毒载体、腺病毒载体、牛痘病毒载体、痘病毒载体、腺相关病毒载体、hvj载体等各种病毒载体以给药的方法(adolph『病毒基因组法』、crc press、florid(1996)参照)、使其包覆在胶体金粒子等珠载体上(国际公开第93/17706号等)进行给药的方法等。
[0154]
即,就所述基因治疗药而言,只要在活体内作为有效成分的抗体被表达,其作用能够得到发挥即可,可以以任何方法进行给药。优选通过适当的非经口路径,以充分的量进行给药。作为非经口路径,可以举出:介由静脉内、腹腔内、皮下、皮内、脂肪组织内、乳腺组织内、吸入或肌肉内的路径的注射、注入或介由气体诱导性粒子冲击法(以电子枪等)、点鼻剂等粘膜路径的方法等。此外,所述基因治疗药也可以通过体外(ex vivo)下的脂质体转染、粒子冲击法(米国专利第4、945、050号)或利用病毒感染对细胞进行给药,并将该细胞再导入动物中的方法进行给药。
[0155]
<细胞膜蛋白质检测用试剂>
[0156]
本发明还包含:一种用于检测期望的细胞膜蛋白质的试剂,其包含以所述的方法所制造的目标物质。例如,可以使用包含以本发明的方法制造的抗体(目标物质)的试剂,使所述抗体与来源于人类或来源于非人类哺乳动物的血液细胞接触。然后,使包含荧光物质或色素的标记物质直接或间接地进行接触。接着,以流式细胞术或读板机检测期望的细胞膜蛋白质的表达。此外,也可以使用所述试剂,使所述抗体与来源于人类或来源于非人类哺乳动物的病理组织片接触,以检测期望的细胞膜蛋白质的表达。
[0157]
此外,可以构建包含所述试剂的细胞膜蛋白质检测用试剂盒。例如,可以将所述试剂与标记物质等组合,以构建细胞膜蛋白质检测用试剂盒。
[0158]
本发明还包含:使用通过所述的方法所制造的目标物质来检测所述期望的细胞膜蛋白质的方法。本发明还包含:通过所述的方法所制造的目标物质的用于检测所述期望的细胞膜蛋白质的使用。
实施例
[0159]
在以下的实施例1~8中,主要进行了产生针对作为人类gpcr中的1种的爱帕琳肽受体(以下,也略称为aplnr)的特异性结合抗体的细胞的筛选。此外,还从筛选的细胞中分离抗体基因,构建了表达抗体的重组细胞。此外进行了该重组细胞所表达的抗体的功能性评价。
[0160]
实施例1
[0161]
(1
‑
1)aplnr表达载体的制备
[0162]
将注册在基因库(genebank)上的人类aplnr基因序列(nm_005161.4)以小鼠的氨基酸密码子进行优化而制作了人工合成基因(序列编号1)。使用该人工合成基因,按照国际公开第2012/043533号(日本国专利第5315495号)所述的方法,构建了包含人类aplnr基因和groel基因的融合基因的载体pci
‑
aplnr
‑
groel。
[0163]
(1
‑
2)aplnr稳定表达细胞(第一细胞)的制备
[0164]
将所述人工合成基因(序列编号1)导入pef5/frt/v5
‑
dest载体(invitrogen公司),构建了pef
‑
frt
‑
aplnr。由pef
‑
frt
‑
aplnr所表达的人类aplnr,其c末端附加有v5和6
×
his标记。
[0165]
将flp
‑
in
‑
cho细胞(invitrogen公司),在包含10%胎牛血清、100单位/m l青霉素、100μg/ml链霉素的ham’s f
‑
12培养基(invitrogen公司)中培养。使用lipofectamin 2000,将pef
‑
frt
‑
aplnr和pog44质粒(invitrogen公司)同时导入该细胞。从导入的第二天开始,将培养基换为包含500μg/ml潮霉素(invitrogen公司)的ham’s f
‑
12培养基,每3天交换一次培养基,培养2周。以极限稀释法从形成的群落中,克隆出潮霉素耐性细胞。
[0166]
使用藻红蛋白(pe)标记抗小鼠igg抗体(beckman coulter公司)作为2次抗体,以流式细胞仪解析所得到的潮霉素耐性细胞与抗爱帕琳肽抗体(r&d社)或与抗v5标记抗体(invitrogen公司)的结合。其结果,得到的潮霉素耐性细胞显示pe阳性,人类aplnr的稳定表达得到了确认。以下,将该细胞记为人类aplnr稳定表达cho细胞株(第一细胞)。
[0167]
实施例2
[0168]
(2
‑
1)通过dna免疫法获得免疫动物
[0169]
按照国际公开第2012/043533号(日本国专利第5315495号)所述的方法,对于8周龄的小鼠icr(雌),分数次注射了载体pci
‑
aplnr
‑
groel(dna免疫)。
[0170]
(2
‑
2)来源于脾脏的包含抗体生产细胞的细胞集团(第二细胞)的制备
[0171]
从以(2
‑
1)进行了dna免疫的小鼠中取出脾脏,将其回收至装有冷藏hbss的6孔板中。除去附着的结缔组织、脂肪组织等后,在新的hbss中打散脾脏使淋巴球游离。将细胞回收,以10ml的hbss进行再悬浮。以细胞过滤器分离未破坏组织后,以2000rpm离心分离5分钟,将细胞回收。将回收了的细胞悬浮于1ml的溶血溶液中,在37℃下孵育5分钟,除去了赤血球。以1000rpm离心分离5分钟,将淋巴球细胞回收。
[0172]
使用easysep mouse biotin positive selection kit(stemcell technologies公司),从2.5
×
107个所述淋巴球细胞中,分离出包含期望的抗体生产细胞(目标细胞)的候补的约1.3
×
105个的细胞集团(第二细胞)。
[0173]
实施例3
[0174]
(3
‑
1)杂交瘤细胞(第二细胞)的制备
[0175]
将细胞融合中使用的骨髓瘤细胞(sp2/o)在细胞融合的5天前唤醒,在2天前进行一次传代后进行使用。
[0176]
将实施例2中取得的经过免疫的小鼠的冻结脾细胞解冻,以37℃的rpmi1640培养基(含有10%fbs)悬浮,对细胞数进行计数。将脾细胞和骨髓瘤细胞(sp2/o)以细胞数比1:1的比例进行混合。需要说明的是,骨髓瘤细胞是在细胞融合的5天前唤醒,在2天前进行一次传代后进行使用。将细胞混合物离心分离后,以ecf缓冲液清洗细胞。同样的清洗还进行了2
次。
[0177]
使用细胞融合装置ecfg21(nepagene公司),实施了脾细胞和骨髓瘤细胞的细胞融合。细胞融合后,加入细胞溶液的2倍量的rpmi1640培养基(含有fbs、不含抗生物质),在co2孵育器内静置1小时。进行离心分离回收细胞,以hat培养基(rpmi1640含10%fbs、2
‑
巯基甲醇(x500)、hfcs(x100)、hat(x50))悬浮。使用96孔板、24孔板以及10cm的培养皿,以常规方法进行了抗体产生杂交瘤细胞的克隆和培养。
[0178]
实施例4
[0179]
(4
‑
1)使用了微孔的特异性抗体产生杂交瘤的筛选
[0180]
准备了微孔槽asmc30
‑
20p(as one公司)。该微孔槽是在约1.5cm
×
约2.4cm的区域中以等间隔配置有640个直径为30μm的微孔84的基板。各微孔的深度等于微孔的直径。微孔间的间距为微孔的直径的2倍。在现有技术中,微孔一般收纳1个细胞进行使用。但是在本实施例中,微槽中收纳有第一细胞和第二细胞,即收纳有2个以上的细胞进行实验。以下进行说明。
[0181]
将人类aplnr稳定表达cho细胞(第一细胞)以f
‑
12培养基(10%fbs,含有青霉素/链霉素(penicillin/streptomycin))悬浮,制备3
×
105细胞/500μl的细胞悬浮液。将该细胞悬浮液充填至各微孔中。将微槽以300rpm、2分钟的条件,离心2次,以各微孔中收纳有1或2个第一细胞的方式进行了制备。以f
‑
12培养基清洗微槽后,加入了500μl的f
‑
12培养基。以co2孵育器在37℃下孵育1小时,使第一细胞以保持作为细胞的功能性的状态附着于微孔的底面。加入以f
‑
12培养基将浓度调整至10nm的cytored溶液,进一步在37℃下孵育1小时,对第一细胞进行了染色。以f
‑
12培养基清洗3次除去剩余的cytored后,用1ml的f
‑
12培养基充满微槽内部。
[0182]
对实施例3中制备的杂交瘤(第二细胞)的集团进行培养,制备了3
×
105细胞/500μl的细胞悬浮液。将该细胞悬浮液充填至各微孔中。将微槽以300rpm、2分钟的条件,离心2次,以各微孔内收纳有1或2个第二细胞的方式进行了制备。以培养基清洗微槽后,加入适量的培养基在37℃下孵育30分钟,使杂交瘤分泌抗体。清洗微孔除去上清后,上样以rpmi1640(含有10%fbs)稀释了500倍的alexa fluor 488标记抗小鼠igg抗体(2次抗体;标记物质),在37℃下孵育30分钟。以rpmi1640(不含酚红、含有1%fbs)清洗3次后,加入rpmi16401ml。将微槽设置到细胞拣选系统(as one公司)中,取得了全部微孔的透射光图像和2种荧光图像的信息。cytored的荧光检测是以激发波长543nm、荧光波长593nm的条件进行的。alexa fluor 488的荧光检测是以激发波长482nm、荧光波长536nm的条件进行的。
[0183]
图2(a)~(c)是,被判断为收纳有产生与第一细胞表面的aplnr进行特异性结合的抗体的杂交瘤,即收纳目标细胞的阳性的微孔的图像的一个例子。另一方面,图3(a)~(c)是,被判断为收纳有产生不与第一细胞表面的aplnr进行特异性结合的抗体的杂交瘤,即非目标细胞的阴性的微孔的图像的一个例子。在图2、3中,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0184]
如图2(c)所示,在目标细胞与aplnr表达cho细胞共存的微孔中,在与以cytored标记的cho细胞相同的位置观察到了alexa fluor 488的荧光。也就是说,与目标细胞共存的微孔内的cho细胞被alexa fluor 488和cyto red共染色。由此,确认了cho细胞的表面结合有alexa fluor 488标记抗igg抗体。
[0185]
另一方面,如图3(c)所示,在非目的的细胞与aplnr表达cho细胞共存的微孔中,alexa fluor 488的荧光并未在与以cytored标记的cho细胞相同的位置被观察到。即,cho细胞的表面上并未结合alexa fluor 488标记抗igg抗体,cho细胞并未被alexa fluor 488和cytored共染色。由此,确认了cho细胞的表面上并未结合alexa fluor 488标记抗igg抗体。
[0186]
最终,从84640个的微孔中,选定了16个包含目标细胞的阳性微孔。
[0187]
从阳性微孔中,挑选出只包含1个杂交瘤的微孔。从挑选出的微孔中,使用直径数μm~数十μm的毛细管吸引杂交瘤,将其回收至细胞溶解液中。最终筛选出至少3种独立的杂交瘤。
[0188]
根据本实施例的方法,能够将通常需要花费60天左右的杂交瘤的筛选,在7天以内完成。
[0189]
实施例5
[0190]
(5
‑
1)从筛选出的杂交瘤中分离抗体基因
[0191]
从实施例4中筛选出的1种杂交瘤中,通过magrahd法(nobuyuki kurosawa,megumi yoshioka,rika fujimoto,fuminori yamagishi and masaharu isobe,"rapid production of antigen
‑
specific monoclonal antibodies from a variety of animals",bmc biology,10:80,2012)取得了抗体基因。即,将实施例4中得到的细胞溶解液5μl和oligo dt磁珠5μg混合,将来源于细胞的mrna捕捉到oligo dt磁珠上。使用magrahd reactor tray和钕磁铁,以清洗溶液清洗oligo dt磁珠后,通过逆转录反应进行了cdna的合成。进一步清洗磁珠后,进行了5’末端翻译反应。使用合成了的所述cdna,以5’race pcr法,对抗体重链可变区域(vh区域)的基因和抗体轻链可变区域(vl区域)的基因进行了分离扩增。
[0192]
需要说明的是,为了提高扩增产物的特异性,进行了2次pcr。在第1次的pcr中,混合使用了以下引物:对vh区域和vl区域进行共通的扩增的第一正向引物(序列编号3)、对vh区域进行特异性扩增的第一反向引物(序列编号4)、对vl区域进行特异性扩增的第二反向引物(序列编号5)。在第2次的pcr中,以第1次的扩增产物作为模板,对于vh区域的扩增,使用了第二正向引物(序列编号6)和对vh区域进行特异性扩增的第三反向引物(序列编号7),对于vl区域的扩增,使用了第二正向引物(序列编号6)和对vl区域进行特异性扩增的第四反向引物(序列编号8)。
[0193]
对第2次pcr之后的样品进行琼脂糖凝胶电泳的结果,分别在750bp的位置确认到了对应vh区域的扩增产物,在550bp的位置确认到了对应vl区域的扩增产物。
[0194]
(5
‑
2)抗体表达单元的构建
[0195]
通过ts
‑
jpcr法(megumi yoshioka,nobuyuki kurosawa and masaharu isobe,"target
‑
selective joint polymerase chain reaction:a robust and rapid method for high
‑
throughput production of recombinant monoclonal antibodies from single cells",bmc biotechnol.2011jul 21;11:75)构建了抗体表达单元。即,以pcr将(5
‑
1)中扩增的vh区域的基因、抗体重链恒定区域的基因、基因表达所需要的启动子区域融合,构建了表达全长抗体重链的抗体表达单元。同样地,以pcr将(5
‑
1)中扩增的vl区域的基因、抗体轻链恒定区域的基因、基因表达所需要的启动子区域融合,构建了表达全长抗体轻
链的抗体表达单元。通过将这些抗体表达单元共导入哺乳动物细胞,能够得到暂时地表达期望的抗体(igg)的重组细胞。
[0196]
(5
‑
3)将抗体表达单元导入哺乳动物细胞
[0197]
通过所述文献(nobuyuki kurosawa et al.,bmc biology,10:80,2012)所述的方法,将所述2种的抗体表达单元共导入至hek293ft细胞中。即,将hek293ft细胞播种至胶原涂覆96孔板中,使浓度为1.5
×
104细胞/100μl/孔。使用lipofectamin 2000,将(5
‑
2)中构建的2种的抗体表达单元共导入至hek293ft细胞中。在导入第3天回收细胞上清,将其用于表达抗体的结合性评价。
[0198]
作为比较例,使用从阴性微孔中回收的非目的的杂交瘤,进行了与(5
‑
1)~(5
‑
3)相同的操作,并回收了细胞上清。
[0199]
(5
‑
4)使用了流式细胞术的aplnr和抗体的结合性评价
[0200]
将人类aplnr稳定表达cho细胞株,在直径10cm的培养皿内进行培养。以pbs清洗细胞3次后,加入细胞剥离用缓冲液1ml,在37℃下孵育15分钟。将剥离的细胞以facs缓冲液悬浮,以1000rpm离心5分钟后,以facs缓冲液再悬浮以使细胞浓度为1
×
107细胞/ml。以细胞悬浮液的1/500量加入fc block(becton
·
dickinson公司),在4℃下进行30分钟的封闭。封闭后,悬浮细胞,并使浓度为2
×
105细胞/50μl。在96孔板内,将该细胞悬浮液和(5
‑
3)中回收的细胞上清混合,在4℃下孵育1小时。孵育后,以100μl的facs缓冲液清洗细胞2次。将荧光标记抗igg抗体(2次抗体)的稀释液每孔添加50μl,在4℃下孵育1小时,使2次抗体与cho细胞表面上结合的抗体结合。以100μl的facs缓冲液清洗细胞2次后,使其在80μl的facs缓冲液中悬浮,以流式细胞术法测定了细胞表面的荧光强度。
[0201]
图4表示流式细胞术的结果。即,(5
‑
3)中得到的重组细胞所表达的抗体,具有针对人类aplnr表达cho细胞的结合性。需要说明的是,该抗体未表现出针对不表达aplnr的野生型的cho细胞的结合性。
[0202]
另一方面,如图5所示,在使用了从阴性微孔中回收的非目的的杂交瘤的比较例中,重组细胞表达的抗体不具有针对人类aplnr稳定表达cho细胞的结合性。
[0203]
以上的结果显示,通过本实施例得到的抗体具有针对人类aplnr表达cho细胞的特异结合性。
[0204]
实施例6
[0205]
(6
‑
1)使用了微孔的特异性抗体产生淋巴球细胞的筛选
[0206]
依照实施例4的方法,从实施例2中制备的未进行不死化的淋巴球细胞(第二细胞)的集团中,筛选出产生目的抗体的细胞。以下进行说明。
[0207]
以实施例4同样的方式,使人类aplnr稳定表达cho细胞(第一细胞)附着于微孔的底面。然后,以cytored对第一细胞进行染色,以1ml的f
‑
12培养基充满微槽内部。
[0208]
将实施例2中制备的淋巴球(第二细胞)的集团以rpmi1640悬浮,制备了3
×
105细胞/500μl的细胞悬浮液。将该细胞悬浮液充填至各微孔中。将微槽以300rpm、2分钟的条件,离心2次,以各微孔中收纳有1个或2个第二细胞的方式进行了制备。以rpmi1640清洗微槽后,添加1ml的rpmi1640,在37℃下孵育30分钟,促进淋巴球产生抗体。清洗微孔,除去上清后,施用以rpmi1640(含有10%fbs)稀释了500倍的alexa fluor 488标记抗小鼠igg抗体(2次抗体;标记物质),在37℃下孵育30分钟。以rpmi1640(不含酚红,含有1%fbs)清洗3次后,
加入rpmi1640 1ml。将微槽设置到细胞拣选系统(as one公司)中,取得全部的微孔的透射光图像和2种荧光图像的信息。
[0209]
图6(a)~(c)是,被判断为收纳有产生与第一细胞表面的aplnr进行特异性结合的抗体的淋巴球,即目标细胞的阳性的微孔的图像的一个例子。另一方面,图7(a)~(c)是,被判断为收纳有产生不与第一细胞表面的aplnr进行特异性结合的抗体的淋巴球,即非目的的细胞的阴性的微孔的图像的一个例子。在图6、7中,(a)为观察透射光的结果,(b)为观察来源于cytored的荧光的结果,(c)为观察来源于alexa fluor 488的荧光的结果。
[0210]
如图6(c)所示,在目标细胞和aplnr表达cho细胞共存的微孔中,在与以cytored标记的cho细胞相同的位置观察到了alexa fluor 488的荧光。即,与目标细胞共存的微孔内的cho细胞被alexa fluor 488和cytored共染色。特别是在离目标细胞(淋巴球)近的部分中观察到了更强的alexa fluor488的荧光。由此,确认了cho细胞的表面上结合有alexa fluor 488标记抗igg抗体。
[0211]
另一方面,图7(c)所示,在非目的的细胞与aplnr表达cho细胞共存的微孔中,alexa fluor 488的荧光并未在与以cytored标记的cho细胞相同的位置被观察到,而只在淋巴球的细胞膜表面被观察到。即,cho细胞的表面上并未结合alexa fluor 488标记抗igg抗体,cho细胞未被alexa fluor 488和cytored共染色。由此,确认了在cho细胞的表面上并未结合alexa fluor 488标记抗igg抗体。
[0212]
最终,从84640个的微孔中,选定了40个包含目标细胞的阳性微孔。
[0213]
从阳性微孔中,挑选出只包含1个淋巴球的微孔。从挑选出的微孔中,以直径数μm~数十μm的毛细管吸引淋巴球,将其回收至细胞溶解液中。最后,以流式细胞术确认了其针对目标物质的结合性,筛选出了至少14种的独立的抗体产生淋巴球。
[0214]
根据本实施例的方法,在不经过以往需要花费60天左右的杂交瘤法的情况下,仅用了1天就直接从淋巴组织中筛选出了期望的淋巴球。
[0215]
实施例7
[0216]
(7
‑
1)从筛选出的淋巴球中分离抗体基因
[0217]
进行与实施例5相同的操作,取得了实施例6中筛选出的一种淋巴球的抗体基因。
[0218]
(7
‑
2)抗体表达单元的构建
[0219]
进行与实施例5相同的操作,构建了以(7
‑
1)中得到的抗体基因表达全长抗体重链和全长抗体轻链的2种抗体表达单元。
[0220]
(7
‑
3)将抗体表达单元导入哺乳动物细胞
[0221]
进行与实施例5相同的操作,将(7
‑
2)中得到的抗体表达单元共导入至hek293ft细胞中。导入48小时后回收细胞上清,将其用于表达抗体的功能性评价。
[0222]
(7
‑
4)使用了流式细胞术的aplnr和抗体的结合性评价
[0223]
进行与实施例5相同的操作,进行了(7
‑
3)中得到的重组细胞所表达的抗体的结合性评价。
[0224]
图8表示流式细胞术的结果。即,(7
‑
3)中得到的重组细胞表达的抗体具有针对人类aplnr表达cho细胞的结合性。需要说明的是,该抗体并未表现出针对不表达aplnr的野生型的cho细胞的结合性。
[0225]
另一方面,如图9所示,在使用了从阴性微孔中回收的非目的的淋巴球的比较例
中,重组细胞表达的抗体不具有针对人类aplnr稳定表达cho细胞的结合性。
[0226]
对于实施例6中筛选出的其他的淋巴球(13种)也进行了同样的探讨。其结果,全部的抗体都具有针对人类aplnr表达cho细胞的结合性。此外,其中12种并未表现出针对不表达aplnr野生型的cho细胞的结合性。
[0227]
以上结果显示,通过本实施例得到的抗体具有针对人类aplnr表达cho细胞的特异结合性。
[0228]
实施例8
[0229]
为了确认本发明对于aplnr以外的靶标细胞膜蛋白质是否有效,对于以与aplnr的配体不同的生理活性脂质为配体的gpcr,进行了与实施例1~5相同的实验。对从预测包含阳性细胞的27个微孔中回收的细胞进行了解析。其结果,在18个微孔中,确认到了产生具有针对表达靶标细胞膜蛋白质的cho细胞的特异结合性的抗体的阳性细胞。
[0230]
通过所述的实施例显示了:无论是否进行不死化,通过本发明,都可以更迅速且高效地筛选出表达对难以纯化的细胞膜蛋白质进行特异性结合的目标物质的细胞。此外还显示了:通过本发明,能够容易地制造针对细胞膜蛋白质的特异性结合物质(例如,抗体)。
[0231]
实施例9
[0232]
本实施例表示:将第一细胞表面的细胞膜蛋白质与目标物质特异性结合时所引起的伴随细胞膜蛋白质的活性化的细胞内信息传递物质的变动可视化的间接的手法的一个例子。作为细胞膜蛋白质,使用了人类glp
‑
1(glucagon
‑
like peptide
‑
1)受体,作为目标物质,使用了它的特异性结合抗体。
[0233]
以与实施例1类似的方法进行了制备,将人类glp
‑
1受体稳定表达cho细胞(第一细胞)悬浮在f
‑
12培养基(10%fbs,含有青霉素/链霉素(penicillin/streptomycin))中,制备了3
×
105细胞/500μl的细胞悬浮液。将该细胞悬浮液充填至各微孔中。将微槽以300rpm、2分钟的条件,离心2次而制备,使各微孔收纳有1或2个第一细胞。
[0234]
以与实施例2同样的方法对大鼠进行免疫。以与实施例3同样的方法制作与小鼠骨髓瘤融合了的抗体产生杂交瘤,从培养基中纯化抗体。以f
‑
12培养基(含有青霉素/链霉素(penicillin/streptomycin))将纯化抗体稀释至500nm以制备溶液。向微孔中添加该溶液400μl。另一方面,将不含纯化抗体的溶液,以同样的形式,添加到别的微孔中。添加溶液后,在室温下静置30分钟,进行了第一细胞和抗体结合的反应。
[0235]
然后,添加以f
‑
12培养基(含有青霉素/链霉素(penicillin/streptomycin))调整至500pm的配体(glp
‑
1)400μl(glp
‑
1最终浓度250pm),在37℃下孵育1小时,使人类glp
‑
1受体活性化。以pbs清洗微孔后,添加4%多聚甲醛磷酸缓冲液(和光纯药工业株式会社)600μl,在室温下静置15分钟,进行了第一细胞的固定化。以pbs再次清洗微孔后,添加预先冰冷的90%甲醇600μl,在冰上静置15分钟,进行了第一细胞的细胞膜透射处理。以pbs清洗微孔后,以抗体稀释液(1x pbs,1%bsa,0.3%triton x
‑
100)进行了100倍稀释,添加了识别ser133的磷酸化的兔抗磷酸化
‑
creb(克隆87g3)抗体(cell signaling technology)500μl。在室温下静置1小时,进行了1次抗体反应。
[0236]
使用抗体稀释液,对作为检测兔抗磷酸化
‑
creb抗体的荧光标记2次抗体的alexa fluor 488标记抗兔子igg抗体、作为检测来源于大鼠的抗体的荧光标记2次抗体的dylight 650标记抗大鼠igg抗体进行调整,使其分别200倍稀释和500倍稀释,制备了2次抗体溶液
500μl。1次抗体反应结束后,以pbs清洗微孔,添加制备了的2次抗体溶液500μl。在室温下静置1小时,进行了各个抗体的可视化。以pbs清洗微孔后,加入pbs 1ml。将微槽设置到细胞拣选系统中,取得了透射光图像和2种荧光图像的信息。alexa fluor488的荧光检测是以激发波长482nm、荧光波长536nm的条件进行的。dylight 650的荧光检测是以激发波长628nm、荧光波长692nm的条件进行的。
[0237]
作为代表例,基于8个微孔(no.1~no.8)的荧光强度和2个微孔(no.1和no.5)的荧光图像,对结果和考察作以下记载。此处,来源于alexa fluor 488的荧光,是来自添加配体(glp
‑
1)引起的细胞内camp的上升所介导的磷酸化creb。也就是说,来源于alexa fluor 488的荧光反映细胞膜蛋白质(glp
‑
1受体)是否活性化。如果glp
‑
1受体活性化,来源于alexa fluor 488的荧光强度就会变高。另一方面,来源于dylight 650的荧光,是来自第一细胞表面上的抗体。即,来源于dylight 650的荧光,反映添加了的是否结合到抗体的第一细胞表面上。如果抗体与第一细胞表面结合,来源于dylight 650的荧光强度就会提高。
[0238]
表1汇总了8个微孔的来源于alexa fluor 488的荧光强度和来源于dylight 650的荧光强度。图10是表示2个微孔(no.1和no.5)的图像的照片,(a)为观察透射光的结果,(b)为观察来源于alexa fluor 488的荧光的结果,(c)为观察来源于dylight 650的荧光的结果。
[0239]
[表1]
[0240]
孔编号alexa fluor 488强度dylight 650强度184.1166.78295.7163.4395.98155.62494.29176.5852559.116251.129.957237.698.798233.669.15
[0241]
如图10(b)所示,就来源于alexa fluor 488的荧光而言,no.1微孔较弱。且如表1所示,no.1的来源于alexa fluor 488的荧光强度是no.5的1/3左右(84.1对255)。这表示:在no.1的微孔中glp
‑
1的功能(glp
‑
1受体的活性化)被抑制,另一方面,在no.5的微孔中glp
‑
1的功能未被抑制。
[0242]
如图10(c)所示,就来源于dylight 650的荧光而言,no.1的微孔较强。如表1所示,no.1的来源于dylight 650的荧光强度是no.5的约18倍(166.78对9.11)。这表示:在no.1的微孔中,添加的抗体牢固地与第一细胞表面结合。此外,在no.5的微孔中,抗体并未与第一细胞表面结合。
[0243]
此外,如表1所示,在来源于alexa fluor 488的荧光强度强的微孔中,dylight 650的荧光强度就低(参照no.5~no.8)。根据所述的结果,与磷酸化creb的量相对应的荧光强度的相对降低表示,人类glp
‑
1受体活性化所引起的细胞内camp的上升受到抑制。
[0244]
通过本实施例的方法,能够鉴定出包含与第一细胞表面的人类glp
‑
1受体进行特异性结合,抑制受体的功能的抗体的微孔。此外,根据同样的原理,也能够鉴定出包含促进
受体功能的抗体的微孔。另外,代替纯化抗体,也可以将如杂交瘤(例如,实施例4)、抗体产生淋巴球细胞(例如,实施例6)这样的第二细胞放入微孔中,以鉴定出包含生产功能性抗体(目标物质)的目标细胞的微孔。此外,也可以从鉴定出的微孔中,将目标细胞以单细胞的形式进行分离。所述功能性抗体包含抑制受体的功能的抗体和促进受体的功能的抗体这两者。
[0245]
符号的说明
[0246]
1 基板
[0247]
2 微孔
[0248]
3 第一细胞
[0249]
5 第二细胞
[0250]
6 目标物质
[0251]
7 标记物质
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1